Масса тела и качество спермы у трутней медоносных пчел (Apis mellifera linnaeus, 1758) породного типа приокский среднерусской породы под влиянием акарицидов
Автор: Брандорф А.З., Шестакова А.И., Ларькина Е.О., Лапынина Е.П.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Проблемы репродукции
Статья в выпуске: 2 т.58, 2023 года.
Бесплатный доступ
В современном пчеловодстве отмечается массовая гибель пчелиных семей, одной из причин которой становится заболевание варроозом. Для снижения негативного воздействия варрооза на жизнедеятельность пчелиной семьи массово применяют акарициды. При этом акарицидные препараты негативно влияют на репродуктивные показатели трутней. По данным различных источников, отмечается их неоднозначное действие на развитие особей пчелиной семьи, в том числе трутней, а следовательно, и на хозяйственно полезные признаки (медовую и восковую продуктивность, яйценоскость маток, устойчивость к заболеваниям). В представленной работе мы впервые получили данные о том, что акарицидные препараты, в состав которых входят амитраз, флувалинат и тимол со щавелевой кислотой, оказывают негативный эффект на репродуктивные показатели трутней медоносных пчел среднерусской породы и вызывают ухудшение качества спермы. Целью работы была оценка влияния акарицидных препаратов на фертильность, деформацию и концентрацию сперматозоидов у трутней медоносных пчел породного типа Приокский среднерусской породы, а также на массу их тела. Работа проводилась на опытной пасеке ФГБНУ ФНЦ пчеловодства (Рязанская обл., г. Рыбное) в весенне-летний период 2021 года. Из пчел ( Apis mellifera Linnaeus, 1758) породного типа Приокский среднерусской породы сформировали 4 группы по три пчелиных семьи в каждой, I группа (контрольная) не подвергалась обработкам, II-IV были опытными. Степень пораженности клещом Varroa destructor составляла во всех группах 1-2 %. После появления в семьях 1-суточного трутневого расплода каждую опытную группу обрабатывали одним из трех акарицидных препаратов для борьбы с варроозом: на II опытной группе применяли препарат с действующим веществом амитраз («Sichuan Wangshi Animal Health Co., Ltd.», Китай) (3-й класс опасности, СанПин 1.2.25.84-10), на III опытной группе - препарат с действующим веществом флувалинат («Shanxi Zhenxing Fish & Bees Medicine Industry Co., Ltd.», Китай) (3-й класс опасности, СанПин 1.2.25.84-10), на IV опытной группе - препарат на основе щавелевой кислоты («Shandong Deshang Chemical Co., Ltd.», Китай) и тимола («Hunan Insen Biotech Co., Ltd.», Китай) (4-й класс опасности, СанПин 1.2.25.84-10). Два препарата (амитраз и тимол + щавелевая кислота) разбрызгивали из пульверизатора на трутневый расплод в 2-кратной повторности через 7 сут. Препарат с флувалинатом применяли в виде полосок, которые располагали по обе стороны рамки с трутневым расплодом. Воздействие противоварроозных препаратов оценивали по показателям качества спермы и массы тела трутней в возрасте 26-30 сут. Сперму отбирали методом искусственной стимуляции выворачивания эндофаллоса у половозрелых трутней в возрасте 26-30 сут. Определяли концентрацию сперматозоидов, подвижность, жизнеспособность, морфологию (дефекты, аномалии). При оценке жизнеспособности сперматозоидов методом флуоресцентной микроскопии применяли флуорохром Hoechst 33258 («Пан-Эко», Россия) и PI («Химмед», Россия). Исследования проводили на биологическом люминесцентном светодиодном микроскопе МИКРОМЕД 3ЛЮМ LED (ООО «Наблюдательные приборы», Россия) при увеличении ½400. Для определения деформации головок сперматозоидов использовали метод быстрого дифференцированного окрашивания набором реагентов Диахим-Дифф-Квик (ООО «НПФ «АБРИС+», Россия). Установлено, что обработка акарицидами влияет на массу трутней в пчелиной семье. Существенное снижение массы тела отмечали при использовании препаратов с флувалинатом и щавелевой кислоты с тимолом - максимальная масса трутней оказалась меньше на 10-20 мг (р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Apis mellifera, медоносная пчела, трутень, качество спермы, жизнеспособность сперматозоидов, морфология сперматозоидов, акарицидные препараты, амитраз, флувалинат, тимол, щавелевая кислота
Короткий адрес: https://sciup.org/142238885
IDR: 142238885 | УДК: 638.12:57.017.53:612.616.2 | DOI: 10.15389/agrobiology.2023.2.345rus
Текст научной статьи Масса тела и качество спермы у трутней медоносных пчел (Apis mellifera linnaeus, 1758) породного типа приокский среднерусской породы под влиянием акарицидов
Пчеловодство — важный элемент агропромышленного комплекса.
На долю медоносных пчел как опылителей приходится около 80 % энтомофильных растений. Разведение пчел важно для увеличения биоразнообразия опылителей в экосистеме, повышения урожайности энтомофильных сельскохозяйственных культур, получения диетических продуктов питания, лечебных препаратов для апитерапии, различного сырья для переработки (1, 2). При апимониторинге, на основании которого осуществляется оценка состояния и контроль загрязнения окружающей среды, в качестве биоиндикатора используют медоносных пчел и их продукты (3, 4).
В России, как и во всем мире, наблюдается массовая гибель пчелиных семей, известная как коллапс семей — распад пчелиных колоний (КПС) (57). В качестве причин КПС выделяют следующие: массовое применение пестицидов, в том числе неоникотиноидов; бесконтрольное разведение пчел, которое приводит к массовой гибридизации; варрооз, вызываемый эктопаразитом Varroa destructor , который служит в том числе переносчиком вирусных заболеваний (8, 9).
Серьезным фактором, наносящим ущерб пчеловодству, становится массовое использование пестицидов, которое вызывает гибель пчелиных семей, а остатки вредных веществ обнаруживают в ульях, в продуктах пчеловодства, а также у взрослых пчел и пчелиного расплода (10, 11). Накопление остаточных веществ пестицидов в гнездах пчелиных семей может привести к ухудшению их здоровья и развития (12). Медоносные пчелы, подвергшиеся воздействию пестицидов, становятся восприимчивыми к заражению микроспоридиями Nosema ceranae и другим заболеваниям (13, 14). Показано, что обработка фипронилом пчелиной семьи, зараженной Nosema cer-anae , отрицательно действует на фертильность трутней (15).
Варрооз носит массовый характер по всему миру. Последствиями высокой степени инвазии в пчелиной семье может быть сокращение численности трутней, задержка в их развитии, снижение массы. При высокой степени инвазии у трутней возникают патологии в виде недоразвитых крыльев или их полного отсутствия, сокращается продолжительность жизни — большинство трутней не доживают до половой зрелости (16). Главным методом борьбы с вароозом и его профилактики служит применение органических веществ природного происхождения (муравьиная кислота, щавелевая кислота, тимол), синтетических соединений (акарициды на основе амитраза, флувалината, кумафоса и др.), а также сырья лекарственных растений (17, 18).
Установлено, что в случае высокой инвазированности при обработке семей препаратом с действующим веществом флувалинат (концентрация 10 %, в полосках) выход трутней значительно сокращается (19-21). Также показана высокая смертность при обработке препаратами с флувалинатом (20,4 мг/100 мл ацетона) у трутней в возрасте от 12 до 18 сут (гибель составила 66,9 %). У выживших трутней после обработки этим препаратом наблюдали снижение массы тела примерно на 5-10 %, а также уменьшение длины и ширины правого переднего крыла (21). Установлено, что концентрация сперматозоидов у трутней, обработанных препаратами, в состав которых входят действующие вещества флувалинат и амитраз, по сравнению с необработанными трутнями уменьшается (22).
При обработке 30 % муравьиной кислотой пчелы удаляют трутневый расплод, задерживается развитие и снижается выживаемость трутней, но при этом негативного влияния на массу семенных пузырьков и слизистой железы органическая кислота не оказывает. Была выдвинута гипотеза о том, что лечение тимолом может привести к снижению летной активности трутней (23).
Применение кумафоса оказывает негативное воздействие на пчелиные семьи: высокие концентрации ухудшают память, влияют на передвижение, а также на поведение пчел-кормилиц и снижают трофаллаксию медоносных пчел. Было доказано, что кумафос (2-5 мкг) отрицательно влияет и на развитие матки, в том числе приводит к уменьшению массы тела (2426). Кумафос вызывал снижение жизнеспособности и концентрации сперматозоидов в сперме сразу после отбора, а также в образцах, хранящихся до 6 нед (21). Установлено снижение митохондриальной активности сперматозоидов у трутней и, соответственно, их жизнеспособности под воздействием имидаклоприда (200 мкг) (27). Сублетальные дозы фипронила в период половой зрелости приводили к снижению концентрации сперматозоидов, их жизнеспособности и увеличению скорости метаболизма (28, 29).
Перечисленные выше пестициды наиболее эффективны в борьбе с клещем Varroa destructor , но все они оказывают негативное воздействие на жизнедеятельность пчелиной семьи. Любые подобные последствия обработки одним из акарицидов могут повлиять на репродуктивную функцию матки и трутней. Воздействие акарицидов в период развития трутней снижает их жизнеспособность, уменьшает массу тела, включая массу репродуктивных желез и концентрацию сперматозоидов (30). Важно отметить, что трутни, оплодотворяя пчелиную матку, принимают участие в передаче генетического материала следующему поколению. Снижение жизнеспособности сперматозоидов в результате обработки противоворроозными препаратами может негативно сказаться на общем развитии пчелиной семьи.
В настоящее время недостаточно данных о влиянии акарицидов на физиологическое состояние пчел, а тем более пчелиных маток и трутней, в том числе на их репродуктивные функции (31).
В представленной работе мы впервые получили данные о том, что акарицидные препараты, в состав которых входят амитраз, флувалинат и тимол со щавелевой кислотой, негативно влияют на репродуктивные показатели трутней медоносных пчел среднерусской породы и вызывают ухудшение качества спермы.
Целью работы было изучение влияния акарицидных препаратов на фертильность, деформацию и концентрацию сперматозоидов трутней медоносных пчел породного типа Приокский среднерусской породы, а также на массу их тела.
Методика . Работа проводилась на опытной пасеке ФГБНУ ФНЦ пчеловодства (Рязанская обл., г. Рыбное) в весенне-летний период 2021 года. Из пчел ( Apis mellifera Linnaeus, 1758) породного типа Приокский среднерусской породы сформировали 4 группы пчелиных семьей, одинаковых по хозяйственно полезным признакам: I группа — контрольная (не подвергалась обработкам), II-IV — опытные. В каждой группе было по три пчелиные семьи (8 улочек, 3-5 рамок с расплодом, 10 кг меда, 2 кг перги на семью). Степень пораженности клещом Varroa destructor составляла 1-2 %. После появления в семьях 1-суточного трутневого расплода каждую опытную группу обрабатывали одним из трех акарицидных препаратов для борьбы с варроозом: на II опытной группе применяли препарат с действующим веществом амитраз («Sichuan Wangshi Animal Health Co., Ltd.», Китай) (3-й класс опасности, СанПин 1.2.25.84-10), на III опытной группе — препарат с действующим веществом флувалинат («Shanxi Zhenxing Fish & Bees Medicine Industry Co., Ltd.», Китай) (3-й класс опасности, СанПин 1.2.25.84-10), на IV опытной группе — препарат со щавелевой кислотой («Shandong Deshang Chemical Co., Ltd.», Китай) и тимолом («Hunan Insen Biotech Co., Ltd.», Китай) (4-й класс опасности, СанПин 1.2.25.84-10).
Препараты, содержащие действующие вещества амитраз и тимол со щавелевой кислотой, разбрызгивали из пульверизатора на трутневый расплод в 2-кратной повторности через 7 сут. Препарат на основе флувалината применяли в виде полосок, которые располагали по обе стороны рамки трутневым расплодом. Во всех группах рамки с трутневым расплодом за 2-3 сут до выхода трутней помещали в изоляторы, после выхода трутней каждого метили перманентными маркерами разных цветов в зависимости от группы.
Определяли концентрацию (32) и подвижность сперматозоидов (33) с помощью камеры Горяева («МиниМед», Россия), жизнеспособность — по целостности мембран (34) методом флуоресцентной микроскопии, а также изучали морфологию сперматозоидов (дефекты, аномалии) (35). При оценке жизнеспособности сперматозоидов методом флуоресцентной микроскопии применяли флуорохром Hoechst 33258 («Пан-Эко», Россия) и PI («Химмед», Россия). Рабочие растворы флуорохромов готовили в Трис-буфере (рН 8,8); конечная концентрация Hoechst 33258 — 5 мкг/мл, PI — 10 мкг/мл. Суспензию из образца спермы готовили в Трис-буфере (рН 8,8) в соотношении 1:400. Исследования проводили на биологическом люминесцентном светодиодном микроскопе МИКРОМЕД 3 ЛЮМ LED (ООО «Наблюдательные приборы», Россия) при увеличении ½400. Всего подсчитывали 200 сперматозоидов. Для определения деформации головок сперматозоидов использовали метод быстрого дифференцированного окрашивания набором реагентов Диахим-Дифф-Квик (ООО «НПФ «АБРИС+», Россия).
Полученные результаты обрабатывали с помощью программного обеспечения Statistica для Windows версия 13 («StatSoft Russia», Россия) и Microsoft Excel 2010 с учетом стандартных методик вариационной статистики, включая вычисление t -критерия Стьюдента для оценки достоверности различий. Для каждой серии данных рассчитывали среднее арифметическое значение ( М ) и стандартное отклонение (±SD), а также коэффициенты вариации ( Cv ). Различия между показателями считали статистически значимыми при р < 0,05.
Результаты . У медоносных пчел масса тела — важный физиологический показатель, от которого зависят многие характеристики, в том числе способность к длительной зимовке и максимальный принос нектара в гнездо. У пчелиной матки масса тела характеризует ее способность к высокой яйценоскости, у трутней это показатель жизнеспособности и оплодотворяющей способности.
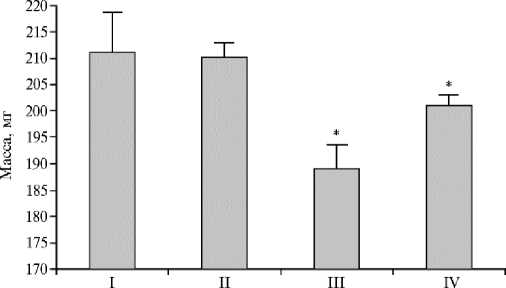
В исследуемых группах пчел масса тела трутней существенно различалась (рис. 1): в опытных группах она была на 1-22 мг меньше, чем в контроле. Статистически значимые различия на 5-10 % (р < 0,05) установили для трутней из III и IV групп. Следовательно, негативного воздействия амитраза на массу трутней, в отличие от флувалината и щавелевой кислоты с тимолом, не наблюдалось.
Для получения свежеотобранной спермы и определения показателей ее качества в садки отбирали по 100 трутней и определяли соотношение половозрелых трутней к их общему числу (рис. 2). Наибольшая доля половозрелых трутней была в контрольной группе. В опытных группах этот
показатель снижался. Самое заметное уменьшение происходило в III группе — на 10 % относительно контроля.
Группа
Рис. 1. Масса тела трутней породного типа Приокский среднерусской породы ( Apis mel-lifera Linnaeus, 1758) при обработке трутневого расплода акарицидными препаратами ( N = 3, n = 30, М ±SD; г. Рыбное, Рязанская обл., 2021 год) . Описание групп см. в разделе «Методика».
* Различия с контролем статистически значимы при р < 0,05.
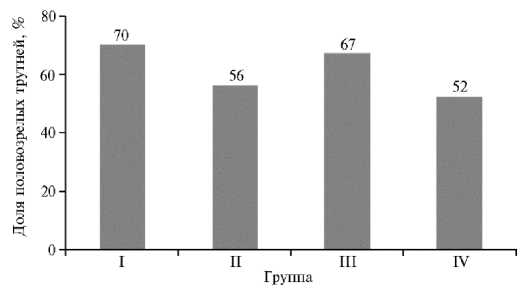
Рис. 2. Доля половозрелых трутней породного типа Приокский среднерусской породы ( Apis mel-lifera Linnaeus, 1758) относительно их общего количества при обработке трутневого расплода акарицидными препаратами ( n = 100; г. Рыбное, Рязанская обл., 2021 год) . Описание групп см. в разделе «Методика».
Показатели качества свежеотобранной спермы трутней породного типа Приокский среднерусской породы ( Apis mellifera Linnaeus, 1758) при обработке трутневого расплода акарицидными препаратами ( N = 3, n = 200, M ±SD; г. Рыбное, Рязанская обл., 2021 год)
|
Показатель |
Группа |
|
|
I контрольная II опытная III опытная |
IV опытная |
|
|
Жизнеспособность, % |
M ±SD |
99,1±0,52 |
97,9±0,94 |
99,4±0,19 |
97,6±0,48 |
|
Lim |
98,3-100,0 |
96,8-99,7 |
99,2-99,7 |
96,7-98,2 |
|
|
Сv , % |
0,9 |
1,6 |
0,3 |
0,8 |
|
|
Деформация головок |
M ±SD |
52,0±0,63 |
72,9±2,86 |
52,3±12,64 |
68,7±0,88 |
|
сперматозоидов, % |
Lim |
51,0-53,1 |
69,5-78,7 |
28,8-71,7 |
67,1-70,2 |
|
Сv , % |
2,0 |
6,8 |
41,6 |
2,4 |
|
|
td |
7,06* |
0,02 |
15,5* |
||
|
Концентрация, млн/мкл |
M ±SD |
1,9±0,12 |
1,1±0,21 |
1,8±0,63 |
0,7±0,05 |
|
Lim |
1,7-2,1 |
0,7-1,5 |
0,6-2,8 |
0,6-0,8 |
|
|
Сv , % |
11,2 |
38,7 |
61,7 |
13,6 |
|
|
td |
3,7* |
0,2 |
9,2* |
Пр им еч ан и е. Описание групп см. в разделе «Методика».
* Изменения статистически значимы относительно контрольной группы при р < 0,05.
Качественные показатели спермы, которыми обусловлена ее оплодотворяющая способность, изменяются в зависимости от внешних факто- ров. Важные критерии в оценке качества спермы трутней — жизнеспособность, концентрация, а также морфологическое строение головки сперматозоидов (табл.).
Показатель жизнеспособности сперматозоидов в сперме трутней не имел статистически значимых различий между опытом и контролем. Незначительное снижение жизнеспособности сперматозоидов на 1,2-1,5 % выявили во II и IV группах, где также были отмечены минимальные значения этого показателя.
Во II и IV группах мы выявили статистически значимое увеличение доли поврежденных сперматозоидов с деформацией головок — в 1,4-1,3 раза (р < 0,05) по сравнению с контрольной группой. Следует отметить, что минимальное число поврежденных сперматозоидов в сперме трутней зарегистрировали в I группе (контроль), что достоверно (р < 0,05) меньше, чем в опытных группах, и подтверждается невысоким значением коэффициента изменчивости признака.
А
Б
В
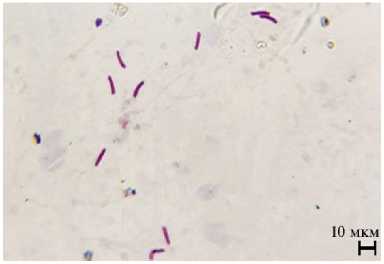
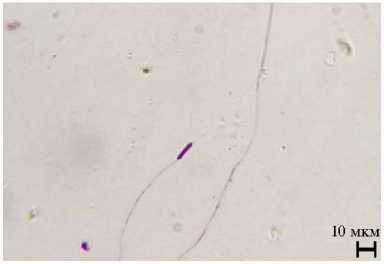
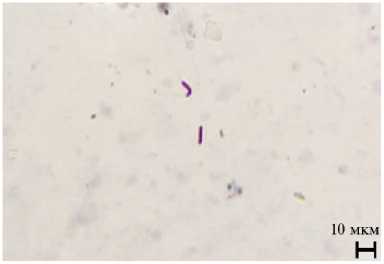
Рис. 3. Деформированные головки сперматозоидов трутней породного типа Приокский среднерусской породы ( Apis mellifera Linnaeus, 1758) при обработке трутневого расплода акарицидными препаратами: А — нормальная головка сперматозоида без деформации (контроль), Б, В — патологии головок сперматозоидов во II группе, Г — деформации головок сперматозоидов в III группе (быстрое дифференцированное окрашивание набором реагентов Диахим-Дифф-Квик, ООО «НПФ «АБРИС+», Россия; микроскоп МИКРОМЕД 3 ЛЮМ LED, ООО «Наблюдательные приборы», Россия, увеличение ½400; г. Рыбное, Рязанская обл., 2021 год). Описание групп см. в разделе «Методика».
Г
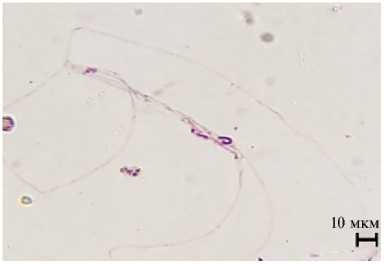
При быстром дифференцированном окрашивании набором реагентов Диахим-Дифф-Квик мы обнаружили различные аномалии головок сперматозоидов у трутней (рис. 3).
Во II и IV группах наблюдалось статистически значимое (р < 0,05) снижение концентрации сперматозоидов соответственно в 1,8 и 2,7 раза относительно контроля, что значительно снижало показатели качества спермы. Следует отметить, что меньшие концентрации сперматозоидов от- мечали во всех опытных группах и по сравнению с I группой этот показатель был в среднем ниже в 2,7 раза, что подтверждает негативное воздействие акарицидов на качественный показатель спермы трутней.
До сих пор влияние противоварроозных препаратов на трутней медоносных пчел не исследовано в полном объеме. Хотя среди пчеловодов подробные препараты нашли довольно широкое применение, сведения об их действии на качество и репродуктивные свойства трутней крайне ограничены (31). В опытах F.B. Abdelkader с соавт. (36) установлено, что в случае препарата с действующим веществом амитраз Rulamit-VA («TEKNOVET İLAÇ SANAYİ VE TİCARET ANONİM ŞİRKETİ», Турция), применяемого согласно инструкции производителя, наблюдалась высокая смертность сперматозоидов и высокий процент сперматозоидов с нарушенной целостностью мембраны и дефектами акросомы. При обработке щавелевой кислотой (опрыскивание 5 мл на пространство рамки) отмечено снижение концентрации и подвижности сперматозоидов, а также нарушение целостности ак-росом. В обзорной статье J. Rangel и A. Fisher (30) приводятся сведения о влиянии акарицидов на параметры сперматозоидов трутней. Так, у трутней из пчелиных семей, подвергшихся воздействию флувалината (20,4 мг/100 мл ацетона), тимола (в концентрациях ниже LD 10 , норма для рабочих пчел) и амитраза (4,3 мг/100 мл ацетона), концентрация сперматозоидов была ниже, чем в других опытных группах и в контроле. Смертность трутней в пчелиных семьях, обработанных флувалинатом, была выше (66,9 %) по сравнению с необработанными пчелиными семьями (62,5 %).
В своей работе мы также проследили влияние акарицидных препаратов на фертильность трутней, однако, в отличии от зарубежных авторов, применяли обработку опрыскиванием 1-суточных личинок трутней. Это позволило оценить действие препаратов на стадии личиночного развития.
Таким образом, показано негативное влияние акарицидных препаратов, в состав которых входят амитраз, флувалинат и тимол со щавелевой кислотой, на развитие трутней медоносных пчел среднерусской породы и качество их спермы. Существенное снижение массы тела трутней (на 1020 мг) отмечено при использовании препаратов с флувалинатом и щавелевой кислоты с тимолом. В результате применения акарицидов показатели жизнеспособности сперматозоидов снижались в среднем на 1,3 %, концентрации спермы — в среднем в 2,2 раза, а также в сперматеке увеличивалось количество сперматозоидов с деформированными головками в среднем в 1,3 раза. Все испытанные вещества оказали равноценно негативное влияния на трутней. В связи с этим рекомендуется применять акарициды только в лечебных целях при подтверждении заклещеванности. Кратность применения препаратов должна зависеть от степени инвазии. Чтобы снизить негативное влияние препаратов на репродуктивную функцию трутней, не следует превышать указанные в инструкции дозы.
Список литературы Масса тела и качество спермы у трутней медоносных пчел (Apis mellifera linnaeus, 1758) породного типа приокский среднерусской породы под влиянием акарицидов
- Abrol D.P. Honeybee and crop pollination. In: Pollination biology: biodiversity conservation and agricultural production. Springer Science, Business Media, 2012: 85-110.
- Афанасьев В.И. Российское пчеловодство: состояние, перспективы развития и влияние на урожайность сельскохозяйственных культур. Экономика, труд, управление в сельском хозяйстве, 2018, 2: 76-81.
- Kayode L., Lizette D., Johnson R.M., Siegfried B.D., Ellis M.D. Effect of amitraz on queen honey bee egg and brood development. Mellifera, 2014, 14: 33-40.
- Ларькина Е.О., Свищук Д.В., Лапынина Е.П. Влияние антропогенных и биотических факторов на популяцию пчелиных семей Рязанской области. Вестник РГАТУ, 2021, 13(1): 23-30 (doi: 10.36508/rsatu.2021.49.1.004).
- Rosenkranz P., Aumeier P., Ziegelmann B. Biology and control of Varroa destructor. Journal of Invertebrate Pathology, 2010, 103: 96-119 (doi: 10.1016/j.jip.2009.07.016).
- Cameron S.A., Sadd B.M. Global trends in bumble bee healt. Annual Review of Entomology, 2020, 65: 209-232 (doi: 10.1146/annurev-ento-011118-111847).
- Zattara E.E. Aizen M.A. Worldwide occurrence records suggest a global decline in bee species richness. One Earth, 2021, 4(1): 114-123 (doi: 10.1016/j.oneear.2020.12.005).
- Evans J.D., Schwarz R.S. Bees brought to their knees: microbes affecting honey bee health. Trends in Microbiology, 2011, 19(12): 614-620 (doi: 10.1016/j.tim.2011.09.003).
- Messan K., Rodriguez Messan M., Chen J., DeGrandi-Hoffman G., Kang Y. Population dy-namics of Varroa mite and honeybee: effects of parasitism with age structure and seasonality. Ecological Modelling, 2021, 440: 109359 (doi: 10.1016/j.ecolmodel.2020.109359).
- Smodiš Škerl M.I., Kmecl V., Gregorc A. Exposure to pesticides at sublethal level and their distribution within a honey bee (Apis mellifera) colony. Bull. Environ. Contam. Toxicol., 2010, 85(2): 125-128 (doi: 10.1007/s00128-010-0069-y).
- Гранкин Н.Н., Гусева Ю.Ю. Влияние пестицидов на пчелиные семьи. Наука-2020, 2018, 9(25): 53-57.
- Al-Waili N., Salom K., Al-Ghamdi A., Ansari M.J. Antibiotic, pesticide, and microbial contam-inants of honey: human health hazards. Scientific World Journal, 2012: 930849 (doi: 10.1100/2012/930849).
- Aufauvre J., Biron D.G., Vidau C., Fontbonne R., Roudel M., Diogon M., Viguès B., Belzunces L.P., Delbac F., Blot N. Parasite-insecticide interactions: a case study of Nosema cer-anae and fipronil synergy on honeybee. Scientific Reports, 2012, 2: 326 (doi: 10.1038/srep00326).
- Pettis J.S., vanEngelsdorp D., Johnson J., Dively G. Pesticide exposure in honey bees results in increased levels of the gut pathogen Nosema. Naturwissenschaften, 2012, 99(2): 153-158 (doi: 10.1007/s00114-011-0881-1).
- Kairo G., Biron D.G., Abdelkader F.B., Bonnet M., Tchamitchian S., Cousin M., Dussaubat C., Benoit B., Kretzschmar A., Belzunces L.P., Brunet J.-L. Nosema ceranae, fipronil and their com-bination compromise honey bee reproduction via changes in male physiology. Sci. Rep., 2017, 7: 8556 (doi: 10.1038/s41598-017-08380-5).
- Теребова С.В., Колтун Г.Г., Подвалова В.В. Эпизоотическая ситуация по варроатозу пчел в Приморском крае. Аграрный вестник Приморья, 2021, 1(21): 37-43.
- Sammataro D. Global status of honey bee mites. In: Honey bee colony health, challenges and sustainable solutions /D. Sammataro, J.A. Yoder (eds). Boca Raton, CRC Press, 2012: 37-54.
- Исаев Ю.Г. Варрооз пчел и возможность оздоровления пасеки. Российский журнал проблемы ветеринарной санитарии, гигиены и экологии, 2020, 4(36): 507-510 (doi: 10.36871/vet.san.hyg.ecol.202004015).
- Burley L.M., Fell R.D., Saacke R.G. Survival of honey bee (Hymenoptera: Apidae) spermatozoa incubated at room temperature from drones exposed to miticides. Journal of Economic Entomology, 2008, 101(4): 1081-1087 (doi: 10.1603/0022-0493(2008)101[1081:sohbha]2.0.co;2).
- Fell R.D., Tignor K. Miticide effects on the reproductive physiology of queens and drones. Amer-ican Bee Journal, 2001, 141: 888-889.
- Ben Abdelkader F. Impact of pesticides on honeybee (Apis mellifera L.) drones. Uludag Bee Jour-nal, 2019, 19(2): 188-194 (doi: 10.31467/uluaricilik.626929).
- Shoukry R., Khattaby A., El-Sheakh A., Abo-Ghalia A., Elbanna S. Effect of some materials for controlling varroa mite on the honeybee drones (Apis mellifera L.). Egyptian Journal of Agricultural Research, 2013, 91(3): 825-834.
- Tihelka E. Effects of synthetic and organic acaricides on honey bee health: a review. Slov. Vet. Res., 2018, 55(2): 119-40 (doi: 10.26873/SVR-422-2017).
- Bevk D., Kralj J., Čokl A. Coumaphos affects food transfer between workers of honeybee Apis mellifera. Apidologie, 2011, 43: 465-470 (doi: 10.1007/s13592-011-0113-x).
- Williamson S.M., Baker D.D., Wright G.A. Acute exposure to a sublethal dose of imidacloprid and coumaphos enhances olfactory learning and memory in the honeybee. Apis mellifera. Inver-tebrate Neuroscience, 2013, 13: 63-70 (doi: 10.1007/s10158-012-0144-7).
- Chaimanee V., Evans J.D., Chen Y., Jackson C., Pettis J.S. Sperm viability and gene expression in honey bee queens (Apis mellifera) following exposure to the neonicotinoid insecticide imidaclo-prid and the organophosphate acaricide coumaphos. Journal of Insect Physiology, 2016, 89: 1-8 (doi: 10.1016/j.jinsphys.2016.03.004).
- Ciereszko A., Wilde J., Dietrich G.J., Siuda M., Bąk B., Judycka S., Karol H. Sperm parameters of honeybee drones exposed to imidacloprid. Apidologie, 2017, 48(2): 211-222 (doi: 10.1007/s13592-016-0466-2).
- Kairo G., Provost B., Tchamitchian S., Ben Abdelkader F., Bonnet M., Cousin M., Sénéchal J., Benet P., Kretzschmar A., Belzunces L.P., Brunet J.L. Drone exposure to the systemic insecticide Fipronil indirectly impairs queen reproductive potential. Scientific Reports, 2016, 6: 31904 (doi: 10.1038/srep31904).
- Kairo G., Poquet Y., Haji H., Tchamitchian S., Cousin M., Bonnet M., Pelissier M., Kretzsch-mar A., Belzunces L.P., Brunet J.-L. Assessment of the toxic effects of pesticides on honey bee drone fertility using laboratory and semifield approaches: a case study of fipronil. Environ. Toxicol. Chem., 2017, 36(9): 2345-2351 (doi: 10.1002/etc.3773).
- Rangel J., Fisher II A. Factors affecting the reproductive health of honey bee (Apis mellifera) drones — a review. Apidologie, 2019, 50: 759-778 (doi: 10.1007/s13592-019-00684-x).
- Ilyasov R.A., Lim S., Lee M.L., Kwon H.W., Nikolenko A.G. Effect of miticides amitraz and fluvalinate on reproduction and productivity of honey bee Apis mellifera. Uludag Bee Journal (Uludağ Arıcılık Dergisi), 2021, 21(1): 21-30 (doi: 10.31467/uluaricilik.883775).
- Лазарева Л.Н. Влияние биодобавок на хранение спермы трутней при положительных тем-пературах. В сб.: Сборник НИИР по пчеловодству. Киров, 2014.
- Rhodes J.W. Semen production in drone honey bees. RIRDC Pub., 2008.
- Locke S.J., Peng Y.-S., Cross N.L. A supravital staining technique for honey bee spermatozoa. Physiological Entomology, 1990, 15(2): 187-192.
- Smith C.C. Opposing effects of sperm viability and velocity on the outcome of sperm competition. Behavioral Ecology, 2012, 23(4): 820-826 (doi: 10.1093/beheco/ars036).
- Abdelkader F.B., Çakmak I., Çakmak S.S., Nur Z., Incebiyik E., Aktar A., Erdost H. Toxicity assessment of chronic exposure to common insecticides andbee medications on colony develop-ment and drones spermparameters. Ecotoxicology, 2021, 30(1): 806-817 (doi: 10.1007/s10646-021-02416-3).


