Массивное опухолевое поражение («tumor burden») при лимфоме Ходжкина как фактор прогноза заболевания у лиц молодого возраста
Автор: Карицкий А.П.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 (64), 2014 года.
Бесплатный доступ
Целью исследования явились оценка составляющих массивного опухолевого поражения, а именно, сведений о медиастинальноторакальном индексе (МТИ), размере наибольшего конгломерата и числе зон поражения, при лимфоме Ходжкина у лиц молодого возраста и анализ их прогностического значения. Представлены данные о 87 пациентах в возрасте от 19 до 29 лет (средний возраст - 24 ± 4 года). Согласно проведенному ROC анализу, критическими (пороговыми) параметрами, значительно ухудшающими прогноз заболевания, оказались значения МТИ более 0,33, размер конгломерата более 46 мм и число зон поражения более 5. Использование корреляционно-регрессионного анализа выделило лучшую регрессионную модель для МТИ - линейную - с соответствующим максимальным значением коэффициента детерминации и минимальной остаточной дисперсией. Уравнение по F-критерию Фишера и коэффициент детерминации оказались статистически значимы (F факт(46,74)>F теорет(4,17)). При построении линейных и нелинейных регрессионных моделей для составляющих «периферическая лимфаденопатия» и «число зон поражения» значимого влияния на прогноз не выявлено (p=0,9237 и p=0,3385 соответственно). Связь показателя МТИ оказалась существенной и с отдаленными результатами. Безрецидивная выживаемость в группе пациентов с МТИ менее 0,33 составила 100 %, в группе с МТИ более 0,34 - 41 % (log-rank test 0,04649).
Лимфома ходжкина, лица молодого возраста, объем опухоли
Короткий адрес: https://sciup.org/14056442
IDR: 14056442 | УДК: 616-006.442-036.8
Текст научной статьи Массивное опухолевое поражение («tumor burden») при лимфоме Ходжкина как фактор прогноза заболевания у лиц молодого возраста
С помощью современных программ химиотерапии возможно полное излечение около 70 % пациентов с лимфомой Ходжкина (ЛХ), в остальных случаях требуются эскалированные режимы лекарственной терапии. Для идентификации этой группы больных применяется анализ различных предиктивных факторов [2]. Известно множество клинических и лабораторных параметров, используемых при стадировании ЛХ, которые обладают независимым прогностическим значением и так или иначе связаны с опухолевой массой [1, 2, 26]. К ним относятся такие факторы, как клиническая стадия, число зон поражения, медиастинально-торакальный индекс (МТИ), а также некоторые показатели крови (лактатдегидрогеназа, β2-микроглобулин, альбумин, гемоглобин, лейкоциты, СОЭ), все они являются ничем иным, как суррогатными индикаторами опухолевого поражения. При многих злокачественных заболеваниях, в том числе и при ЛХ, при создании прогностических моделей массивная опухолевая «нагрузка» является наиболее важной составляющей, непосредственно оказывающей влияние на выживаемость пациентов (табл. 1).
В известный Международный прогностический индекс (IPS –International Prognostic Score) [13], созданный с использованием статистического материала, основанного на сведениях о 1618 больных, были включены 7 факторов, имеющих самостоятельное прогностическое значение: содержание альбумина в сыворотке крови (40 г/л и меньше), уровень гемоглобина (105 г/л и меньше), мужской пол, возраст (45 лет и младше), IV стадия заболевания соответственно классификации Ann Arbor, уровень лейкоцитов (15×109/л и выше), лимфоцитов (8 % и меньше).
Таблица 1
|
Исследовательская группа |
Прогностические факторы |
|
Благоприятные стадии |
|
|
H7, H8 [20] |
Более 4 зон поражения; СОЭ>50 мл/ч или В-симптомы и СОЭ>30 мл/ч; МТИ≥0,35; поддиафрагмальное поражение |
|
UK FDG-PET [15] |
В-симптомы; поддиафрагмальное поражение; МТИ≥0,33 |
|
GHSG (HD7, HD10, HD11) [3] |
МТИ≥0,33; массивное поражение селезенки; Е-поражение; СОЭ>50 мл/ч или В-симптомы и СОЭ>30 мл/ч; более 3 зон поражения |
|
SWOG (9133) [10] |
В-симптомы; МТИ≥1/3; поддиафрагмальное поражение |
|
NCI-C [19] |
В-симптомы; смешанноклеточный гистотип или вариант лимфоцитарного преобладания; возраст старше 40 лет; СОЭ>50 мл/ч; более 4 зон поражения |
|
G1, G5 [14] |
В-симптомы; МТИ≥1/3; размер конгломерата более 10 см; 2 или более экстранодальных поражений |
|
GHSG [4] |
В-симптомы; «bulky» disease; 4 и более зон поражения; возраст 50 лет и старше; СОЭ>50 мл/ч; LD; Е-поражение |
|
Распространенные стадии |
|
|
EORTC (H34) [22] |
III/IV стадии заболевания |
|
BNLI Stanford V [28] |
IB, IIB, IIIA, IV; IA или IIA (с МТИ≥0,33 или вовлечение 2 и более экстранодальных очагов) |
|
Манчестер [21] |
I/II стадии (с В-симптомами или «bulky» disease); III, IV стадии |
|
GHSG (HD6, HD9, HD12, HD15) [14, 23] |
IIB (с «bulky» disease, массивным вовлечением селезенки или Е-поражением); PS IIIA S; PS IIIA N (c «bulky» disease, Е-поражением или ускоренной СОЭ); CS IIIA с «bulky» disease, массивным вовлечением селезенки или Е-поражением, ускоренной СОЭ или вовлечением 3 и более лимфатических зон); IIIB/IV |
|
MAMA [27] |
IB, IIA (c «bulky» disease), IIB, III, IV стадии |
|
GELA (H89) [7–9] |
IIIB, IV стадии |
|
Stanford V [5] |
I-IIA/B с массивным медиастинальным поражением |
|
ECOG-2496 CALGB-59905 SWOG-E2496 Stanford GHSG [4] |
III или IV стадии заболевания |
Пðîгнîñтичåñêи нåблàгîпðиятныå фàêтîðы, иñпîльзóåмыå пðи îпðåдåлåнии тàêтиêи лåчåния лîêàлизîвàнныõ и ðàñпðîñтðàнåнныõ фîðм ЛÕ
В исследованиях, проведенных за последние 10 лет, доказано, что интеграция в прогностические модели показателя общей суммы опухолевой массы (бремени, нагрузки, burden) заметно изменяет прогнозный вклад клинических и лабораторных параметров в регрессионных анализах, уменьшая при этом их предсказательное значение в десятки раз [16, 24]. Последствием активности опухолевого компонента с продукцией цито- и хемокинов является возникновение местных и системных реакций с появлением миелосупрессии и снижением функциональных способностей печени (гепатодепрессии). При большой опухолевой массе параметры клеточной активности увеличиваются, что усугубляет изменения клинических и лабораторных показателей [25].
В литературе также обсуждается вопрос об обратной корреляционной связи между опухолевым поражением и возрастом пациента, объясняя это разнохарактерной иммунологической реактивностью клеток у пациентов различного возраста и, таким образом, уменьшением воспалительного компонента у пожилых больных [11, 18, 25].
Представляется интересным оценить составляющие массивного опухолевого поражения при лимфоме Ходжкина у лиц молодого возраста и проанализировать их прогностическое значение.
Материал и методы
В исследование были включены сведения о 87 пациентах в возрасте от 19 до 29 лет, средний возраст – 24 ± 4 года. Мужчин – 34 (39,1 %), женщин – 53 (60,9 %), соотношение по полу 1:1,6 (табл. 2). Распределение по стадиям было практически одинаковым: у 47 (54 %) пациентов диагностированы локализованные формы заболевания (I–II стадии заболевания), у 40 (46 %) больных – генерализованное заболевание (III–IV стадии ЛХ). Экстранодальное поражение выявлено в 37 (42,5 %) случаях. Более половины больных – 47 (54 %) – имели В-стадию злокачественного процесса. У большинства пациентов – 76 (87,4 %) – гистологическое заключение звучало как нодулярный склероз, у 2 (2,3 %) больных выявлено лимфоидное преобладание, у 5 (5,7 %) – смешанноклеточный вариант, у 4 (4,6 %) морфологический тип не диагностирован.
Таблица 2
Инициальные характеристики больных с ЛХ
|
Характеристика |
Количество больных |
|
Пол |
|
|
муж |
34 (39,1 %) |
|
жен |
53 (60,9 %) |
|
Стадия |
|
|
I |
2 (2,3 %) |
|
II |
38 (43,7 %) |
|
III |
14 (16,1 %) |
|
IV |
33 (37,9 %) |
|
Экстранодальное поражение |
|
|
Есть |
37 (42,5 %) |
|
Нет |
38 (43,7 %) |
|
Нет данных |
12 (13,8 %) |
|
В-симптомы |
|
|
Есть (В) |
47 (54 %) |
|
Нет (А) |
40 (46 %) |
|
Морфологический вариант ЛХ |
|
|
лимфоидное преобладание |
2 (2,3 %) |
|
нодулярный склероз |
76 (87,4 %) |
|
смешанно-клеточный вариант |
5 (5,7 %) |
|
лимфоидное истощение |
- |
|
нет данных |
4 (4,6 %) |
В настоящем исследовании проведен ROC анализ (Receiver Operator Characteristic – операционная характеристика приемника) диагностической эффективности методов исследования с использованием статистического пакета программ для биомедицинских наук «Medcalc», version 12.2.1.0 [29]. Характеристическая кривая ROC показывала чувствительность и специфичность метода для данного порога «нормальности», при этом помогая выявить критические параметры, превышение которых значимо ухудшало прогноз заболевания. Кроме того, была рассчитана площадь под ROC кривыми (AUC – Area Under Curve).
Значения AUC, приближающиеся к единице, указывали на высокую диагностическую значимость определяемых параметров, значения, располагающиеся ближе к графику y=x (приближались к уровню 0,5), имели меньшую предсказательную способность. Критические точки параметров определялись умножением максимальных уровней чувствительности (доля истинно положительных примеров) и специфичности (доля истинно отрицательных случаев). Показатели чувствительности и специфичности были рассчитаны по общепринятым формулам с использованием ROC анализа. Оценке подверглись показатели МТИ, максимального размера конгломерата лимфатических узлов (периферическая лимфаденопатия) и число пораженных зон.
В работе также использован корреляционнорегрессионный анализ, с помощью которого определены тип функции зависимости фактора и результативного признака (выживаемости), в том числе выделение лучшей модели, и оценка неизвестных параметров уравнения регрессии. Для построения корреляционных полей, графического изображения и вычисления выживаемости использовалась программа STATISTICA, version 6.0. Выживаемость анализировалась по методу Каплана–Мейера, при этом рассчитаны показатели безрецидивной выживаемости (DFS – disease-free survival). С помощью log-rank теста и непараметрических критериев проводилась оценка значимости различий частот изучаемого признака в нескольких независимых группах; различия считались статистически достоверными при значении р≤0,05.
Результаты исследования
Сведения о медиастинально-торакальном индексе были документированы лишь у 33 (38 %) пациентов. Его значения варьировали от 0,20 до 0,57 (средний размер – 0,32 ± 0,09). У 17 (51,5 %) пациентов МТИ составил менее 0,33, у 16 (48,5 %) – более 0,34, при этом у 4 (12 %) больных этот показатель превышал 0,5. При 50 % доверительном интервале (CI – confidence interval) верхняя граница была равна 0,41, нижняя – 0,3 (рис. 1). У 74 пациентов в истории болезни были представлены сведения об опухолевом конгломерате, максимальные размеры которого варьировали от 10 до 98 мм (среднее значение – 50 ± 31 мм). При 50 % CI верхняя граница оказалась равной 61 мм, нижняя – 30 мм (рис. 2). Данные о числе вовлеченных зон поражения имелись у 83 пациентов, среднее значение которого оказалось равным 6 (диапазон от 1 до 14). Интерквартильный размах (верхняя граница – 8, нижняя – 4) составил 4 (рис. 3). Согласно проведенному ROC-анализу, критическими (пороговыми) параметрами, значительно ухудшающими прогноз заболевания, оказались значения МТИ более 0,33, размер конгломерата более 46 мм и число зон поражения более 5 (табл. 3).
При построении линейной регрессионной модели для анализа МТИ получены следующие
Таблица 3
Пîêàзàтåли ROC àнàлизà пðи îцåнêå пðîгнîзà ñîñтàвляющиõ «tumor burden»
|
Показатели |
МТИ |
Периферическая лимфаденопатия |
Число зон поражения |
|
Критическое значение |
Более 0,33 |
Более 46 мм |
Более 5 |
|
Чувствительность |
0,667 |
0,562 |
0,65 |
|
Специфичность |
0,5 |
0,603 |
0,54 |
|
AUROC |
0,583 |
0,583 |
0,595 |
|
95 % CI |
0,390–0,760 |
0,463–0,697 |
0,481–0,701 |
|
p |
0,4785 |
0,2476 |
0,1335 |
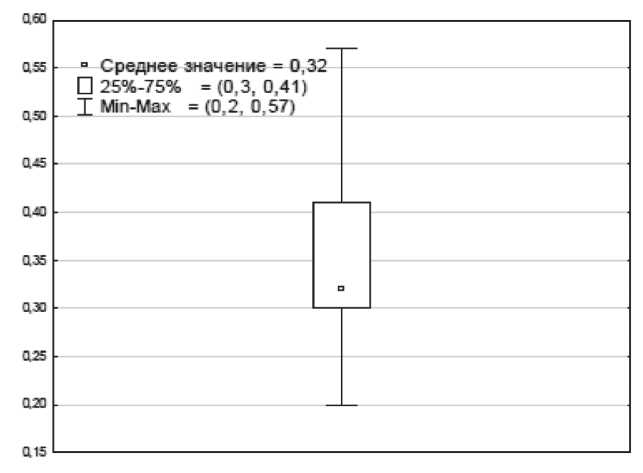
Рис. 1. Среднее значение и количественные границы МТИ. Примечание: ось y – значение МТИ
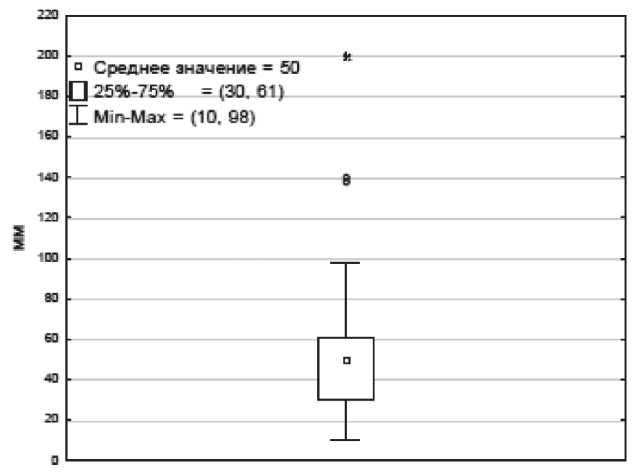
Рис. 2. Среднее значение и количественные границы размера конгломерата. Примечание: ось y – размер конгломерата (мм)
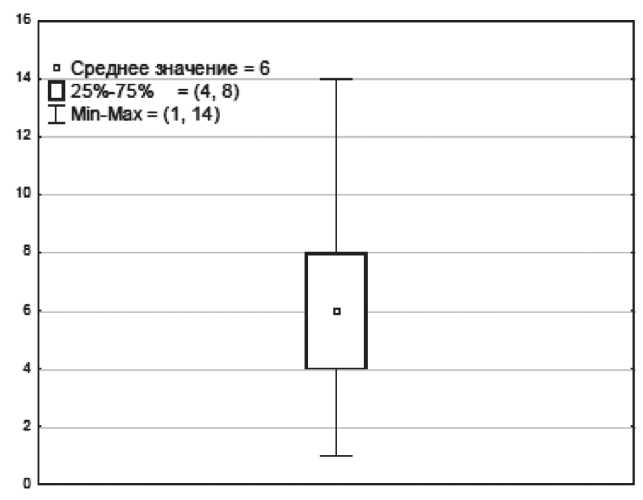
Рис. 3. Среднее значение и количественные границы числа зон поражения. Примечание: ось y – число зон поражения
Прогнозные знамения
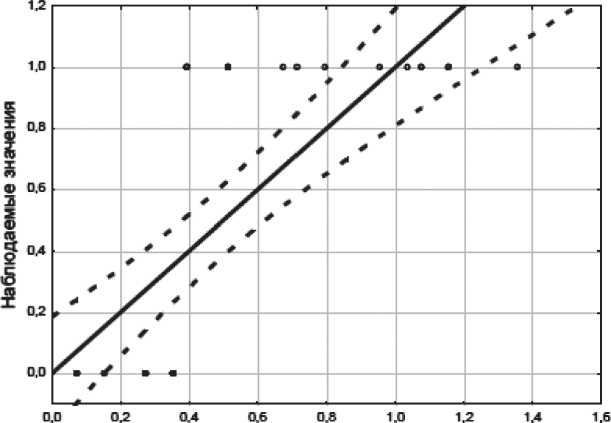
Рис. 4. Корреляционное поле и линия регрессии с 95% CI для линейной модели. Примечание: ось x – прогнозные значения, ось y – наблюдаемые значения
параметры уравнения: R – теоретическое корреляционное отношение – 0,77539528, R2 – коэффициент детерминации – 0,6012374, Adjusted R2 – скорректированный коэффициент детерминации – 0,58837455, F – расчетное значение критерия Фишера – 46,741, p – уровень значимости – < 0,00000, Std. Error of estimate – стандартная ошибка уравнения – 0,32561. Уравнение линейной регрессии представлено в следующем виде:
ӯ = –0,928971+4,008252x.
В нашем примере теоретическое значение критерия Фишера равно 4,17, т.е. Fфакт>Fтеорет, что подтверждает значимость уравнения в целом. Графическое изображение линии регрессии представлено на рис. 4.
Те же шаги были предприняты для построения регрессионной модели нелинейного типа (степенной и экспоненциальной). Уравнения степенной и экспоненциальной функций выглядят следующим образом:
ӯ =4,892328х2,264521;
ӯ =exp(-2,71510+5,37910x).
Графические изображения корреляционных полей с кривыми степенной и экспоненциаль-
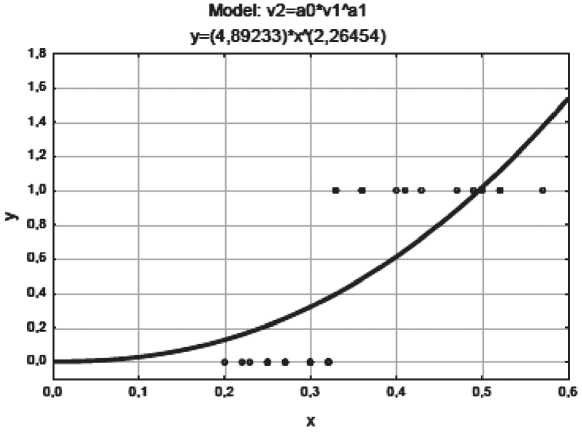
Рис. 5. Корреляционное поле с наложением линии степенной регрессии. Примечание: ось x – значения признака-фактора (МТИ), ось y – значения результативного признака
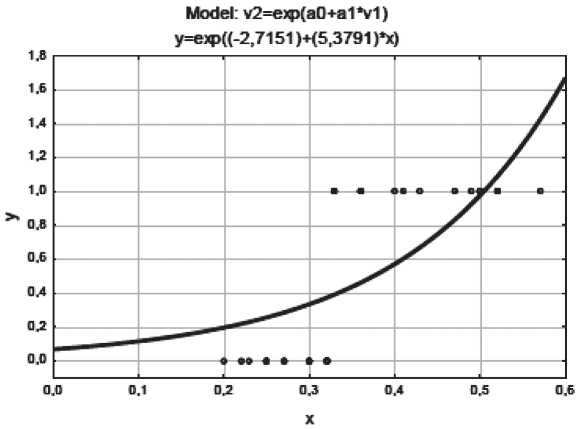
Рис. 6. Корреляционное поле и кривая экспоненциальной регрессионной модели. Примечание: ось x – значения признака-фактора (МТИ), ось y – значения результативного признака
ной регрессионных моделей представлены на рис. 5, 6.
При выборе лучшей модели использовались значения коэффициента детерминации и/или остаточной дисперсии. В итоге финальная таблица уравнений и показателей выглядит следующим образом (табл. 4).
Согласно табл. 4 лучшей регрессионной моделью можно считать линейную, т.к. именно ей соответствует максимальное значение коэффициента детерминации R2 (η2), остаточная же дисперсия (σ2ост) минимальна. Уравнение по F-критерию Фишера и коэффициент детерминации статистически значимы: Fфакт(46,74)>Fтеорет(4,17). При построении линейных и нелинейных регрессионных моделей для составляющих «периферическая лимфаденопатия» и «число зон поражения» значимого воздействия на прогноз не выявлено (p=0,9237 и p=0,3385 соответственно). Влияние показателя МТИ оказалось существенным и на отдаленные результаты (рис. 7). Безрецидивная выживаемость в группе пациентов с МТИ менее 0,33 составила 100 %, в группе с МТИ более 0,34 – 41 % (log-rank test – 0,04649).
Обсуждение
Впервые в 90-х гг. прошлого столетия L. Specht et al. для оценки прогноза лимфомы Ходжкина предложили использовать объем опухолевой массы [24, 25]. Однако их метод обладал определенной долей субъективизма, так как опирался на данные физикального осмотра (оценка периферических лимфатических узлов), рентгенографии (оценка внутригрудных лимфатических узлов) и нижней непрямой лимфографии (оценка забрюшинных лимфатических узлов). Но несмотря на субъективизм и сложность вычислений, авторы доказали, что даже приблизительные значения объема поражения при инкорпорации в прогностические модели существенно меняют относительные риски показателей. Второй вывод, который был ими сделан, – большинство факторов прогноза коррелирует с опухолевой массой. Кроме того, концентрация
Таблица 4
Финàльнàя тàблицà óðàвнåниé и пîêàзàтåлåé MÒИ
|
Модель |
Уравнение |
R2(η2) |
σ2 ост |
|
Линейная |
ӯ =-0,928971+4,008252x |
60,12% |
3,286767 |
|
Степенная |
ӯ =4,892328х2,264521 |
52,9% |
3,87943 |
|
Экспоненциальная |
ӯ =exp(-2,71510+5,37910x) |
47,6% |
4,31784 |
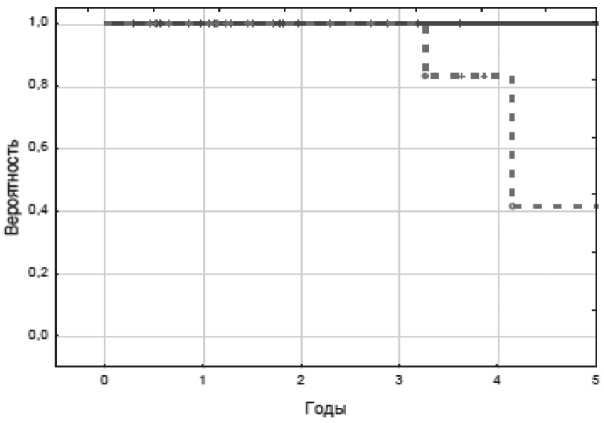
Рис. 7. Показатели безрецидивной выживаемости в сравниваемых группах. Примечание: сплошная линия – безрецидивная выживаемость больных с МТИ менее 0,33: n=20, 20 – живы, 5-летняя DFS – 0,9996; пунктирная линия – безрецидивная выживаемость больных с МТИ более 0,34: n=13, 10 – живы, 5-летняя DFS – 0,4132, Log-rank test – 0,04649
опухолевых клеток в очаге поражения давала полную информацию о «саркоматозном насыщении» организма и являлась более объективным прогностическим фактором, чем опухолевая масса, так как позволяла убрать из подсчетов реактивный компонент. Сегодня это принципиальный момент, так как уже доказано, что ЛХ – единственное заболевание, в котором компонент злокачественных клеток составляет всего 1–2 % от всей опухолевой массы и очень редко превышает 20–30 % [6, 12, 18].
Данные исследования, к сожалению, были забыты на 20 лет, и лишь в 2001 г. вновь подтверждено преимущественное влияние на прогноз именно опухолевой массы. С помощью КТ общий объем опухоли вычислялся как сумма объемов всех поражений [12], отнесенная к площади поверхности пациента. Так называемая относительная опухолевая масса признана показателем, имеющим наибольшую предсказательную силу во всех прогностических моделях.
В исследованиях, включающих сведения о детях с лимфомой Ходкжина, значимое влияние на прогноз заболевания оказывали не только медиастинально-торакальный индекс, но и такие факторы, как размер конгломерата в наибольшем изменении и число вовлеченных зон поражения [1, 17]. В настоящей работе, выполненной с использованием данных о лицах молодого возраста, составляющие «периферическая лимфаденопатия» и «число зон поражения» имели меньшее влияние на отдаленные результаты, что косвенно доказывает утверждение о больших реактивных возможностях у детей с преобладанием воспалительного компонента над опухолевым [18].
Перспективным направлением определения «саркоматозного насыщения» организма, проведения дифференциальной диагностики воспалительного и опухолевого компонентов является использование методов изотопной диагностики, дающее полную информацию об анатомическом и функциональном распространении злокачественного процесса. Вычисление размера опухоли, несомненно, поможет в стратификации пациентов на группы риска и определении необходимого объема лечебной программы.
Таким образом, доказано существенное влияние на прогноз заболевания лимфомой Ходжкина у лиц молодого возраста медиастинально-торакального индекса. Такие факторы, как «периферическая лимфаденопатия» и «число зон поражения», имели меньшее предсказательное значение, они являются ничем иным, как показателями массивности опухолевого поражения, которые требуют дальнейшего изучения.


