Массоперенос при взаимодействии мелкодисперсных оксидов ТiO2 - Сr2O3
Бесплатный доступ
Методом магнетохимического анализа исследован массоперенос при окислении Сr2O3 в системе мелкодисперсных оксидов TiO2-Cr2O3 на воздухе в интервале температур 800-1000 °С Показано, что в процессе взаимодействия окисляется до 10 атомных слоев оксида хрома. Установлено, что массоперенос носит стохастический, ступенчатый характер.
Короткий адрес: https://sciup.org/147158537
IDR: 147158537 | УДК: 145.540
Текст научной статьи Массоперенос при взаимодействии мелкодисперсных оксидов ТiO2 - Сr2O3
Е.А. Белая, В. В. Викторов
Методом магнетохимического анализа исследован массоперенос при окислении Сг2О3 в системе мелкодисперсных оксидов TiO2-Cr2O3 на воздухе в интервале температур 800-1000 °C Показано, что в процессе взаимодействия окисляется до 10 атомных слоев оксида хрома. Установлено, что массоперенос носит стохастический, ступенчатый характер.
Мелкодисперсные системы (МДС) с размером частиц от нескольких сотен единиц до сотен нанометров по сравнению с монолитными аналогичными объектами обладают специфическими, а в ряде случаев уникальными физико-химическими свойствами. Типичными представителями МДС являются мелкодисперсные оксиды р- и 3d- металлов, которые широко используются в качестве неорганических пигментов, катализаторов химических реакций, магнитных порошков, компонентов для получения пластмасс, керамики и др. Примером таких мелкодисперсных оксидов является система Т1О2-Сг2О3, которая представляет интерес для технологии получения полупроводниковой керамики, огнеупорных изделий, а также как составная часть многокомпонентных систем. Исходные оксиды независимо от условий получения и назначения продукта синтеза чаще всего используются в мелкодисперсном состоянии. Оксиды ТЮ2 и Сг2О3 в мелкодисперсном состояния обладают рядом уникальных физико-химических свойств, обусловленных их сильно развитой поверхностью и специфическим состоянием приповерхностного слоя кристалликов. В связи с этим исследованию процессов, которые развиваются при взаимодействии мелкодисперсных кристалликов, уделяется большое внимание [1-3].
На практике, как правило, приходится иметь дело с механической смесью мелкодисперсных оксидов Т1О2 и Сг2О3, а их совместный нагрев при высоких температурах является необходимым этапом во многих технологических процессах. Ранее показано [4-7], что совместный нагрев на воздухе Сг2О3 с Т1О2 или А12О3 приводит к окислению ионов Сг3+ до Сг6+, что противоречит литературным данным по термической стабильности СгО3. При этом наиболее интенсивное окисление происходит с анатазной модификацией диоксида титана [4, 5]. До настоящего времени не существует единого мнения, о причинах окисления С г3 до Сг6+ в мелкодисперсной системе TiO2-Cr2O3. Вопрос о механизме окисления Сг2О3 в системе также остается открытым.
Целью настоящей работы является исследование кинетики массопереноса при взаимодействии мелкодисперсных оксидов TiO2 и Сг2О3 во время их совместного прокаливания на воздухе при температурах 800-1000 °C.
Экспериментальная часть
Исходными препаратами для исследования взяты ТЮ2 марки х.ч. и Сг2О3 марки ч.д.а. Фазовый состав и размер кристалликов, рассчитанный по ширине рентгеновских дифракционных максимумов, следующие: для ct-Cr2O3 d ~ 700 А; для ТЮ2 анатазной модификации d ~ 200 А. Удельная поверхность оксидов для а-Сг2О3 равна 16 м2/г, для анатаза 29 м2/г.
В порошок ТЮ2 добавляли Сг2О3 и перемешивали в бюксах на валках, что позволило сохранить исходную дисперсность и не нарушить состояния поверхности кристалликов в результате механического воздействия. Кинетику массопереноса в период взаимодействия ТЮ2 и Сг2О3 при их совместном прокаливании на воздухе исследовали методом магнетохимического анализа на образце состава 95 мас.% ТЮ2 и 5 мае.% Сг2О3
Величину магнитной восприимчивости образцов, также как и в [7, 8], измеряли по методу Фарадея. Относительная систематическая ошибка при измерении / не превышала 2%. Нагрев
Белая Е.А., Викторов В.В.
образцов в процессе исследования кинетики массопереноса осуществляли с помощью микропечи, вмонтированной между полюсными наконечниками электромагнита. Колебания температуры в зоне реакции не превышали ±1 °C.
Обсуждение результатов
На рис. 1 представлены зависимости магнитной восприимчивости смеси 95 мас.% ТЮ2 - 5 мае.% Сг2О3 от времени изотермической выдержки. Отличительной особенностью в ходе наблюдаемых кинетических зависимостей / = /(т) является ступенчатость процесса взаимодействия оксидов. Магнитная восприимчивость в процессе выдержки уменьшается, что указывает на окисление Сг3+ до Сг6+.
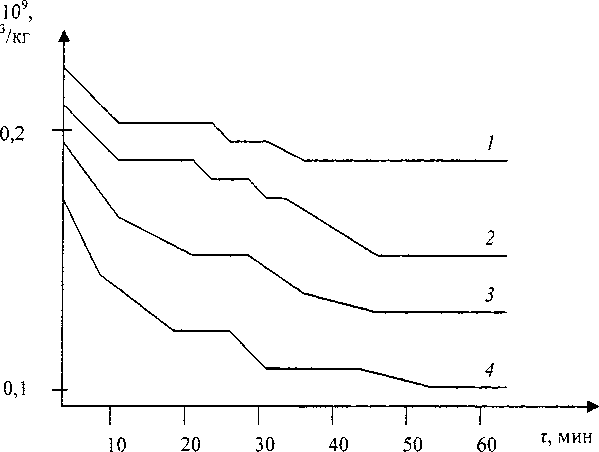
Рис. 1. Зависимости магнитной восприимчивости смеси ТЮ2-Сг2О3 от времени изотермической выдержки:
1 - 800 °C, 2 - 850 °C, 3 - 900 °C, 4-1000 °C
В процессе взаимодействия наблюдаются квазиравновесные состояния, длительность которых зависит от температуры изотермической выдержки.
За параметр, описывающий количественные изменения при взаимодействии оксидов, принимали величину а, определяемую из равенства (1).
« = (1)
— Хх-р где Х«, ХТ’ Хх-р ~ соответственно величины магнитной восприимчивости в начале процесса, в период отсчета времени и в момент достижения химического равновесия между реагирующими оксидами. Если считать, что зависимость магнитной восприимчивости от температуры описывается законом Кюри-Вейса, а постоянная Вейса в процессе взаимодействия меняется незначительно, равенство (1) можно преобразовать к виду
N 6+ а =—тСг_
где - число ионов Сг6+, образующихся к моменту времени т; N^ Сгб+ - число ионов Сг6+, образующихся в момент достижения химического равновесия между реагирующими оксидами.
Таким образом, величину а можно рассматривать как параметр, характеризующий число ионов Сг3+, превращающихся в Сг6+ при взаимодействии оксидов.
В период окисления Сг2О3 в системе ТЮ2-Сг2О3 состояние поверхностного слоя кристалликов Сг2О3 характеризуется величиной коэффициента перекрытия, определяемого из равенства
Здесь №сг - количество ионов Сг3+ на поверхности кристалликов Сг2О3. Число ионов A^e* оп ределяли из равенства (2).
Таким образом, коэффициент перекрытия Псг показывает количество поверхностных монослоев Сг2О3, окисленных в результате взаимодействия с ТЮг-
На рис. 2 представлены зависимости коэффициента перекрытия ПСг от времени изотермической выдержки смеси ТЮ2-Сг2О3 на воздухе при температурах 800-1000 °C.
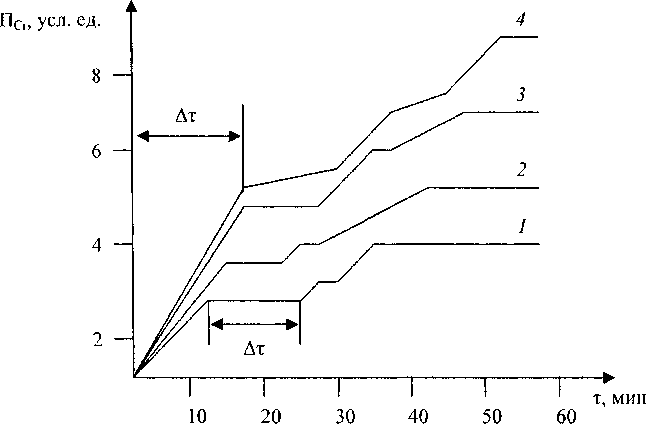
Рис. 2. Зависимость коэффициента перекрытия ПСг от времени изотермической выдержки смеси ТЮ2-Сг2О3: 1 - 800 °C, 2 - 850 °C, 3 - 900 °C, 4 - 1000 °C
Временной интервал Ат возрастает с увеличением температуры изотермической выдержки.
Квазиравновесное состояние на временном интервале Аг'наступает после окисления первых нескольких атомных слоев Сг3О3, причем количество этих слоев, так же как и количество окисленных слоев в момент наступления химического равновесия в системе, экспоненциально возрастает с увеличением температуры изотермической выдержки. Величина кажущейся энергии активации окисления Сг3+ до С г6’ равна 86 кДж/моль. Небезынтересно сравнить найденную нами величину кажущейся энергии активации с энергией активация диффузии ионов Сг3+. В работе [8] дана энергия активации диффузии ионов хрома Сг3+ в Сг3О3, равная 394 кДж/моль, т.е. намного больше полученной. Если считать, что окисление Сг2О3 происходит в результате перехода трех электронов иона Сг3+ в валентную зону или зону проводимости ТЮ2, энергия активации, согласно данным [9], будет равна
^=2^*л. (4)
£ где ^[/( - сумма потенциалов ионизации 4, 5 и 6 электронов иона Cr3+, N^ - число Авогадро;
/ = 4
£ - диэлектрическая проницаемость Т1О2. Коэффициент 2 в (4) означает, что одна молекула Сг2О3 содержит два иона Сг3+. Энергия активации в этом случае равна 340 кДж/моль, т.е. также выше вычисленной нами.
Белая Е.А., Викторов В.В. Массоперенос при взаимодействии______________________________________________________мелкодисперсных оксидов ТЮг-СггОз
Если окисление Сг3+ до Сг6+ связано с испарением хрома и конденсацией его на поверхности кристалликов Т1О2, где и происходит акт элементарного взаимодействия, то количество хрома, которое может испариться с поверхности Сг2О3, может быть вычислено по формуле
Мисп=А5Сгехр(-Е;/ЕТ), (5)
где Ед - энергия активации отрыва хрома с поверхности в газовую фазу.
Согласно [10], энергию активации данного процесса можно принять равной 2/3 теплоты испарения 5„сп.
Количество хрома, который может испариться с поверхности Сг2О3, и количество образовавшихся ионов Nx.pCr6+ в смеси состава 5 мас.% Сг2О3-95 мас.% TiO2 имеют зависимость от температуры изотермической выдержки, представленную в таблице.
Зависимость количества испарившегося хрома Л/исп с поверхности Сг2О31 и количества образовавшихся ионов Nx pCr6* от температуры изотермической выдержки
|
Температура, °C |
800 |
850 |
900 |
1000 |
|
^сп-Ю"19 |
0,352 |
0,354 |
0355 |
0,356 |
|
Ах.рСгб’Ю 19 |
1,99 |
2,78 |
3,56 |
4,1 |
Эти данные не позволяют считать, что окисление Сг3+ до Сг6+ происходит в результате испарения хрома. Более правильным, видимо, будет предположение, что Сг3+ окисляется до Сг6+ на поверхности Сг2О3. Наличие квазиравновесных состояний в период окисления, вероятно, связано с тем, что образующийся продукт реакции, покрывая поверхность кристалликов Сг2О3, задерживает доступ кислорода к зоне реакции до тех пор, пока не произойдет растрескивание и отделение его от поверхности кристалликов Сг2О3. Отделение образующегося соединения Сг6+ происходит из-за упругих напряжений на границе раздела. Этот процесс является стохастическим, поэтому квазиравновесный временной интервал не имеет какой-либо закономерной зависимости от температуры изотермической выдержки.
Выводы
-
1. Методом магнетохимического анализа исследована кинетика массопереноса при окислении хрома на воздухе в системе из мелкодисперсных оксидов TiO2-Cr2O3 Вычислена величина кажущейся энергии активации окисления Сг2О3 при 800-1000 °C.
-
2. Установлено, что в процессе взаимодействия окисляется до 10 атомных слоев Сг2О3 Ква-зиравновесное состояние на временном интервале Ат' наступает после окисления первых нескольких атомных слоев Сг2О3, причем количество этих слоев, так же как и количество окисленных слоев в момент наступления химического равновесия, экспоненциально возрастает с увеличением температуры изотермической выдержки.
-
3. Показано, что массоперенос при взаимодействии оксидов носит стохастический, ступенчатый характер, а окисление Сг3+ до Сг6+ происходит на поверхности кристалликов Сг2О3.
Работа выполнена при финансовой поддержке губернатора Челябинской области, грант РФФИ-Урал № 07-03-96009.
Список литературы Массоперенос при взаимодействии мелкодисперсных оксидов ТiO2 - Сr2O3
- Клещев, Д.Г. Получение нанокристаллических оксидов Ti, Mn, Co, Fe и Zn в водных растворах при термообработке/Д.Г. Клещев//Неорган, материалы. -2005. -Т. 41, № 1. -С. 46-53.
- Волков, С.В. Синтез нанодисперсных порошков сложных оксидов титана и циркония/С.В. Волков, С.М. Малеванный, Э.В. Панов//Журнал неорган, химии. -2002. -Т. 47, № 11. -С. 1749-1754.
- Коленько, Ю.В. Синтез гидротермальным методом нанокристаллических порошков различных кристаллических модификаций TiO2/Ю.В. Коленько, А.А. Бурухин//Журнал неорган. химии. -2002. -Т. 47, № 11. -С. 1755-1762.
- Белая, Е.А. Особенности взаимодействия в системе ТЮ2(анатаз)-Сr2Оз/Е.А. Белая, В.В. Викторов//Вестник ЮУрГУ. Серия «Математика, физика, химия». -2006. -Вып. 7. -№7(62).-С. 219-223.
- Белая, Е.А. Окисление Сr2Oз в системе мелкодисперсных оксидов ТiO2-Сr2O3/Е.А. Белая, В.В. Викторов//Вестник ЮУрГУ. Серия «Математика, физика, химия». -2007. -Вып. 8. -№3(75).-С. 66-69,
- Взаимодействие в системе мелкодисперсных оксидов А12Oз-Сr2Oз при 400-800 °С/В.В. Викторов, В.В. Гладков, А.А. Фотиев и др.//Изв. АН СССР. Сер. Неорган, материалы. -1983.-Т. 19, №6. -С. 930-933.
- Влияние ТiO2 на окисление Сr2Oз в системе мелкодисперсных оксидов А1203-Сг203/В.В. Викторов, В.В. Гладков, А.А. Фотиев и др.//Изв. АН СССР. Сер. Неорган, материалы. -1984. -Т. 20, № 4. -С. 686-688.
- Взаимодействие в системах Al2TiO5-Fe2O3, А12Oз-ТiO2-Fе2Oз, Al2TiO5-Cr2O3/Т.Л. Леканова, Ю.И. Рябков, О.А. Севбо, В.В. Викторов//Неорган, материалы. -2004. -Т. 40, № 11.-С. 1355-1369.
- Ржанов, А.В. Электронные процессы на поверхности полупроводников/А.В. Ржанов. -М.: Наука, 1974.-480 с. 10.
- Френкель, Я.И. О поверхностном ползании частиц у кристалликов и естественной шероховатости кристаллических граней/Я.И. Френкель//ЖЭТФ. -1964. -Т. 16, № 1. -С. 39-


