Математическое моделирование эндокринной системы
Автор: Булгакова Светлана Викторовна, Романчук Наталья Петровна, Тренева Екатерина Вячеславовна
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 3 т.8, 2022 года.
Бесплатный доступ
Гормоны, имея свои уникальные ритмы секреции, оказывают системное влияние на все органы и системы организма человека. Комбинирование математического моделирования и экспериментальных подходов показало, что эти ритмы являются результатом регуляторных процессов, происходящих на многих уровнях организма и требуют постоянного динамического уравновешивания, особенно в ответ на раздражители. В обзоре литературы мы показали, как такой гибридный подход был успешно применен для раскрытия сложных механизмов регуляции углеводного обмена (метаболической оси), гипоталамо-гипофизарно-надпочечниковой и гипоталамо-гипофизарно-гонадной осей. Кроме того, показаны перспективы дальнейшего развития данного направления.
Циркадианные ритмы, ультрадианные колебания, хронотерапия, гибридные системы, математическая модель, эндокринная система, гормоны
Короткий адрес: https://sciup.org/14123624
IDR: 14123624 | УДК: 616.43/57:519.7
Текст обзорной статьи Математическое моделирование эндокринной системы
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616.43/57:519.7
Понимание сложности эндокринной регуляции требует междисциплинарного подхода
Эндокринные оси являются прекрасным примером сложных физиологических регуляторных систем, включающих несколько уровней организации (центральная нервная система, секреторные железы, ткани, клетки, гормоны) и шкалы времени (месячные, циркадные, ультрадианные ритмы). Эти системы обычно проявляют нелинейные реакции, имеют ряд компонентов с несколькими петлями обратной связи и участвуют в перекрестных взаимодействиях друг с другом и другими системами организма (например, иммунной, нервной, репродуктивными системами, желудочно-кишечным трактом). Эндокринные оси также очень динамичны, при этом концентрации гормонов демонстрируют сложное временное поведение в коротких и длинных временных масштабах, что сочетает в себе чувствительность с надежностью и позволяет адаптироваться организму к вызовам внутренней и внешней среды. Что еще более важно, нарушение регуляции этих динамических процессов (особенно когда оно необратимо) может привести к заболеванию [1–6].
Концепцию обратной связи разработал Норберт Винер в середине 20-го века, что легло в основу кибернетики и помогло физиологам понять, как отрицательная обратная связь работает и является ключевыми звеном гомеостаза. В настоящее время в эндокринологии открыты новые механизмы динамической активной регуляции, объясняющие способность предвосхищать события и быстро реагировать на раздражители. Вместо того, чтобы стабилизировать заданные значения в определенном диапазоне, эндокринные оси контролируют динамические явления (например, гормональные ритмы, возбуждение нейронов, температуру тела). Математические модели раскрыли регуляторные механизмы, поддерживающие эту «гомеодинамику», устойчивость эндокринной системы перед разрушающими факторами, пластичность для адаптации к новым динамическим режимам (аллостаз) и разрушение во время болезни. Описанию математических моделей в эндокринологии посвящен ряд работ [7–9]. Тем не менее, более глубокое понимание того, что математическое моделирование может привнести в экспериментальные исследования, могло бы лучше помочь в разработке новых междисциплинарных подходов, направленных на расшифровку сложности эндокринной регуляции.
В данном обзоре литературы на примерах регуляции углеводного обмена, гипоталамо-гипофизарно-надпочечниковой и гипоталамо-гипофизарно-гонадной осей мы показываем, как математические модели могут дать представление о динамической гормональной регуляции, охватывающей несколько пространственно-временных масштабов, и ключевую роль, которую эти модели могут сыграть в развитии хрономедицины . Мы также обсудим пример нового класса гибридных подходов: динамический зажим в электрофизиологии, где можно использовать интеграцию математического моделирования в реальном времени с экспериментальными методами для более глубокого понимания работы секреторных клеток.
Углеводный обмен: от механизмов секреции до координации работы бета-клеток
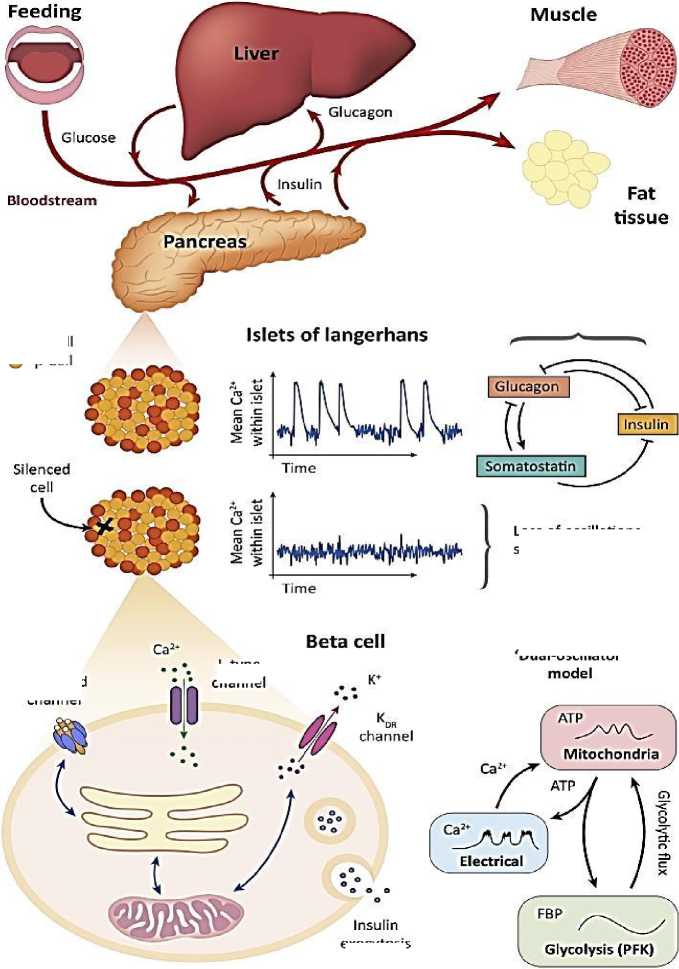
Учитывая тесную связь с сахарным диабетом, секреция инсулина бета-клетками поджелудочной железы (Рисунок 1) была предметом интенсивного изучения в течение столетия [4, 5]. Первичный путь секреции инсулина, стимулируемой глюкозой, связан со сложными механизмами электрической активности плазматической мембраны, которые позволяют ионам Са2+ проникать в клетку и запускать секреторный механизм. Эта электрическая активность связана с клеточным метаболизмом, который действует как датчик глюкозы, повышая внутриклеточное соотношение АТФ/АДФ, вызывая закрытие K-АТФ-каналов, деполяризуя мембрану и приближая ее к порогу для инициации потенциала действия [4]. Математические модели обеспечивают идеальную основу для исследования сложного взаимодействия между метаболическими и электрическими путями в бета-клетках в различных временных масштабах, в которых происходят эти процессы.
L-type channel
Hormone interactions within islets
Loss of oscillations suggests existence of 'hub' cells exocytosis
Рисунок 1. Метаболическая ось (углеводный обмен)
• a Cell О 3 Cell
Vested channel
'Dual-oscillator'
Регулирование уровня глюкозы в плазме крови достигается главным образом за счет взаимодополняющих действий гормонов инсулина, глюкагона и соматостатина. Инсулин способствует всасыванию глюкозы из крови печенью и периферическими тканями, снижая таким образом концентрацию глюкозы в крови. В этих тканях глюкоза затем превращается в гликоген или жир и впоследствии запасается. Глюкагон играет роль, противоположную инсулину, побуждая ткани превращать эти субстраты обратно в глюкозу для секреции в кровоток. Соматостатин ингибирует секрецию инсулина и глюкагона, соответственно, бета- и альфа-клетками, которые находятся в островках Лангерганса поджелудочной железы. Математические модели поведения бета-клеток учитывают электрическую активность ионных каналов, участвующих в секреции инсулина, метаболизм бета-клеток, включая, например, гликолитическую активность и митохондриальные компоненты, показанные в «модели двойного осциллятора».
Большинство математических моделей поведения бета-клеток основаны на модели Чея-Кейзера [10]. Эта модель, описывающая электрическую активность и динамику Ca2+, впоследствии претерпела множество модификаций, в том числе для включения гликолитических и митохондриальных компонентов. Первичная цель этих моделей состоит в том, чтобы выяснить механизмы, вызывающие пульсирующую секрецию инсулина со средним периодом около 5 минут, наблюдаемую у грызунов, собак и людей [11, 12]. С этой целью многие модели рассматривают колебания Ca2+ и гликолитической активности в предположении, что один из этих компонентов, по существу, определяет общий период импульсов секреции инсулина [13]. Тем не менее, разработка и последующий анализ модели двойного осциллятора [14] показали, что эти два механизма могут работать совместно для создания ритмической секреции инсулина (т. е. Са2+ и гликолитическая активность могут колебаться независимо друг от друга, но вместе вызывают к колебаниям временной шкалы, обычно наблюдаемым в экспериментах). Таким образом, эта модель стала бесценным инструментом для изучения взаимодействий этих процессов и подчеркивает важность понимания временных масштабов, в которых они происходят [13]. С тех пор модель с двумя осцилляторами была модифицирована для включения Ca2+ совместно с гликолитической активностью. Эта улучшенная модель интегрированного осциллятора [13, 15] дополнительно подчеркивает, что ни колебания в Ca2+, ни метаболизм сами по себе не определяют общую ритмичность в бета-клетках [16], и иллюстрирует перспективы разработки математических моделей в свете новых экспериментальных данных.
Одной из поразительных особенностей бета-клеток является то, что внутри островков они проявляют тесную синхронизацию регулярных колебаний электрической активности, в то время как изолированные клетки колеблются нерегулярно [17]. Это явление было математически смоделировано путем рассмотрения островка как сети бета-клеток. В соответствии с гипотезой гетерогенности [18] изменчивость в отдельных клетках «сглаживается» межклеточными взаимодействиями, так что сеть можно рассматривать как среднее число клеток в ней. Это привело к идее, что островки, по существу, представляют собой синцитий, при этом ни одна ячейка не определяет общую реакцию сети. Однако это представление было поставлено под сомнение новыми оптогенетическими экспериментами, которые показали, что подавление активности одной (специфической) клетки может нарушать электрические ритмы во всем островке [19]. Наличие этих, так называемых, узловых ячеек можно понять, применив к островку теорию вычислительных графов. Теоретико-графовые модели придают большое значение наличию и характеру взаимодействий внутри островков, а не динамике отдельных бета-клеток [20]. Такие модели подчеркивают зависимость этих взаимодействий от внеклеточной концентрации глюкозы и то, что гетерогенное соединение может привести к возникновению сетей, поддерживающих узловые клетки [21], функции, которые было бы трудно понять без базовой модели.
Несмотря на успех использования теории графов в этой системе, в настоящее время нет ни экспериментальной, ни математической модели, объясняющей результаты эксперимента по молчанию узловых клеток, но вполне вероятно, что для этого потребуется объединить два подхода.
Искусственная поджелудочная железа
Конечной целью лечения сахарного диабета является достижение гликемического контроля; то есть поддержание концентрации глюкозы в крови в пределах определенного диапазона. Больным сахарным диабетом 1 типа со снижением секреции инсулина из-за аутоиммунного разрушения бета-клеток островков Лангерганса экзогенный инсулин обычно вводят в базис-болюсном режиме. В настоящее время доза вводимого инсулина рассчитывается путем оценки содержания углеводов в пище [24]. Кроме того, эти люди должны контролировать уровень глюкозы в течение дня с помощью глюкометров для предотвращения гипо- или гипергликемии. Развитие технологий, таких как непрерывные мониторы глюкозы и инсулиновые помпы с регулируемой дозой, предлагают возможность замкнутого контроля уровня глюкозы в крови посредством их интеграции в искусственную поджелудочную железу [25]. Проводимые ранее испытания искусственной поджелудочной железы были многообещающими [26, 27 ], а перспектива использования математических моделей для понимания динамики и обратной связи между глюкозой, инсулином, глюкагоном и другими гормональными системами предлагает мощный инструмент для поддержки достижений биомедицинской инженерии. Важно отметить, что математические модели могут выявить присущие биологическим системам временные рамки, понимание которых имеет решающее значение для эффективного контроля. С этой целью можно использовать математические модели динамики уровня глюкозы в крови и инсулина для разработки контроля, который является прогностическим, а также реагирующим на изменения тощаковых и постпрандиальных уровней глюкозы в крови [28]. Возможность дальнейшего развития методов контроля с использованием фильтров Калмана открывает возможности для адаптации параметров лежащих в основе моделей к индивидууму с конечной целью достижения индивидуального плана лечения [29].
Ось гипоталамо-гипофизарно-надпочечниковая (ГГН): гормональные ритмы секреции и реакция на стресс
Реакция организма на стресс опосредована несколькими гормонами, наиболее значимым из которых является кортизол. Кортизол принадлежит к группе глюкокортикоидных стероидных гормонов (ГКС) с широким спектром контекстно-зависимых эффектов. Поскольку ГКС быстро секретируются в ответ на физические и психологические стрессоры, они широко известны как гормоны стресса. В клинике синтетические ГКС широко используются в связи с их противовоспалительным эффектом, а также в качестве заместительной гормональной терапии [30]. Уровни циркулирующих глюкокортикоидов — кортизола у человека, кортикостерона у грызунов (CORТ) – динамически контролируются активностью гипоталамо-гипофизарно-надпочечниковой (ГГН) системы (Рисунок 2), которая характеризуется ритмичной секрецией кортикотропин-рилизинг-гормона (КРГ) и аргинин-вазопрессина (АВП) паравентрикулярными ядрами гипоталамуса (ПВГ), адренокортикотропного гормона (АКТГ) гипофизом и CORT надпочечниками. Несмотря на совокупные данные, показывающие важность ритмов секреции CORT для иммунологических, когнитивных, репродуктивных и метаболических функций [30], мало внимания уделялось разработке динамических аспектов терапии глюкокортикоидами. С теоретической точки зрения, понимание того, как ГГН ось поддерживает ритмическую активность, одновременно вызывая быстрые, преходящие и пропорциональные реакции на стрессоры, представляет собой серьезную проблему.
Эндогенные глюкокортикоиды (CORT) являются жизненно важными гормонами, участвующими во многих физиологических процессах, которые являются ключевыми для гомеостаза и выживания (например, опосредование реакции на стресс, противовоспалительные и иммуносупрессивные эффекты, регуляция углеводного обмена). Циркулирующие уровни CORT контролируются ГГН осью. Кортикотропин-рилизинг-гормон (КРГ) и аргинин-вазопрессин (АВП) стимулируют высвобождение адренокортикотропного гормона (АКТГ) гипофизом. АКТГ, в свою очередь, стимулирует надпочечники к синтезу CORT, который в дальнейшем регулирует свой собственный синтез через внутринадпочечниковую петлю обратной связи. Внутри ГГН оси CORT ингибирует АКТГ в гипофизе, а также КРГ и АВП в гипоталамусе, создавая двойную петлю отрицательной обратной связи [7]. Было показано, что эти импульсы играют важную роль в оптимальной реакции нервных процессов, чувствительных к глюкокортикоидам. Однако при патологических состояниях (например, при воспалении, хроническом стрессе, неврологической дисфункции) или при старении эта пульсирующая динамика изменяется, и тесная синхронность между АКТГ и CORT значительно нарушается [30].
Один из ключевых шагов в понимании динамической активности ГГН оси относится к причинно-следственной связи между секрецией AКТГ и CORT. Новаторская математическая модель решила этот вопрос, учтя несколько стадий сигнального пути: активацию предполагаемого рецептора АКТГ в мембране стероидогенных клеток коры надпочечников, его передачу через цАМФ в цитозоле, митохондриальный импорт холестерина (субстрата для CORT), а также синтез и секреция CORT [31]. Модель была адаптирована к скорости секреции надпочечниками кортизола и концентрациям АКТГ в крови, измеренным у собак на фоне внутривенного введения им АКТГ. Важно отметить, что эта модель предсказывала изменения чувствительности надпочечников к небольшим и большим импульсам АКТГ, явление, которое в дальнейшем было идентифицировано и исследовано на других млекопитающих. Последующие модели рассматривали петли обратной связи влияния ГКС на уровне гипофиза и гипоталамуса [32, 33]. Эти модели предложили качественные прогнозы ультрадианных колебаний уровней CORT, генерируемых обратной связью, и возможные способы включения циркадной модуляции. Таким образом ученые [32] показали, что сочетание механизма обратной связи с генератором импульсов, управляемым центральной нервной системой, обеспечивает как ультрадианную, так и циркадную изменчивость секреции гормонов. Эти модели также были направлены на объяснение специфических физиопатологических изменений, таких как стресс, введение синтетических глюкокортикоидов и адреналэктомия. Интересно, что модель Gupta S., (2007) также предложила механизм бистабильности, который мог бы объяснить работу оси ГГН при хроническом стрессе в аллостатическом режиме [33].
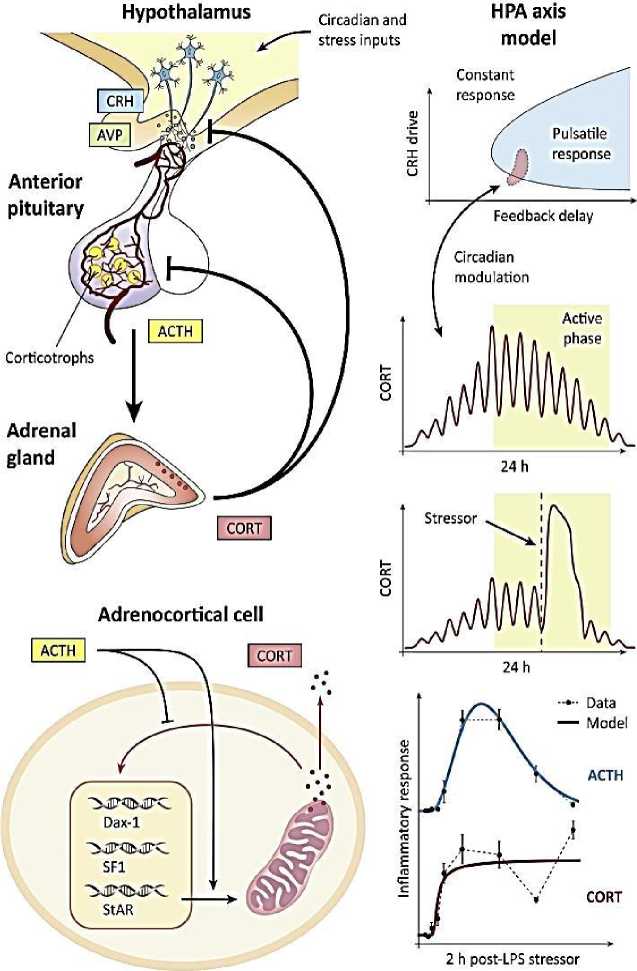
Рисунок 2. Гипоталамо-гипофизарно-надпочечниковая (ГГН) ось
Хотя математические модели Bairagi N. (2008) и Gupta S. (2007) демонстрируют возможность ультрадианных колебаний, генерируемых посредством отрицательной обратной связи, предсказанная частота этих колебаний значительно отличается от околочасовых колебаний, наблюдаемых у людей [32, 33]. Только в работе Walker J. J. (2010) [34] отмечено, что механизмы, лежащие в основе ультрадианных колебаний, были правильно предсказаны как происходящие из петель отрицательной обратной связи между гипофизом и надпочечниками, в то время как гипоталамический импульс обеспечивает источник циркадной модуляции. Эта модель предсказывала околочасовые колебания секреции АКТГ и CORT, поддерживаемые in vivo, даже при наличии постоянного гипоталамического сигнала КРГ. Последующие эксперименты подтвердили то, что гипоталамический «генератор импульсов» [35] не является существенным для генерации ультрадианных колебаний ГКС.
В настоящее время созданы математические модели оси ГГН, связывающие динамику глюкокортикоидов и психическое здоровье [36], а также описывающие реакцию на стресс и воспаление [37, 38].
Понимание того, как здоровые надпочечники достигают быстрой секреции CORT, одновременно предотвращая его неконтролируемое высвобождение в ответ на стрессовые факторы, является ключом к объяснению нарушения регуляции, наблюдаемого при эндокринных заболеваниях, таких как болезнь Аддисона и синдром Кушинга. В этом направлении работа Walker J. J., (2015) [38] объединила экспериментальную физиологию и математическое моделирование, объяснив, как всплески АКТГ могут быть расшифрованы надпочечниками, предполагая, что механизм контроля может включать внутринадпочечниковую петлю отрицательной обратной связи, опосредованную глюкокортикоидным рецептором. Организация молекулярных механизмов, вовлеченных в такую внутриадреналовую регуляцию, была постулирована Spiga F., (2017) [37]. Автор выделил отдельно медленные геномные и быстрые негеномные пути передачи сигналов. Эти механизмы были математически смоделированы как регуляторная сеть, которая не только предсказывала переходные динамические реакции, наблюдаемые во время реакции на стресс, но и объясняла, как надпочечники могут декодировать импульсы АКТГ различной величины, в том числе наблюдаемые во время воспаления.
Хронобиология стресса в норме и патологии
В настоящее время возникла острая потребность в математическом моделировании для ранней диагностики и лечения заболеваний, связанных со стероидами. Надпочечники вырабатывают гормоны, которые играют важную роль в регуляции воспаления, обмена веществ, артериального давления, фертильности и психического здоровья. Уровни гормонов обычно колеблются в течение дня и быстро реагируют на стрессорные факторы (как физические, так и психологические). У всех здоровых людей подобные колебания ритмичные [30]. Однако у пациентов с эндокринными заболеваниями (например, болезни Кушинга, Аддисона, первичный гиперальдостеронизм) наблюдаются нарушения этой ритмичности. Это важно, поскольку диагностика этих состояний затруднена в связи с, как правило, однократным взятием пробы крови на анализ. Следовательно, диагностический процесс часто затягивается, что может привести к неадекватному лечению, к дальнейшему ухудшению здоровья пациента и увеличению экономических затрат. Принимая во внимание внутреннюю динамическую характеристику гормональных ритмов (колебания от нескольких минут до суток), математические модели могут обеспечить быструю классификацию патологических профилей гормонов по сравнению с нормальной физиологической вариабельностью. Более того, исследования J. J. Walker (2015) [38] могут помочь в понимании ожидаемой потребности организма в кортизоле в ответ на различные уровни стресса в норме и патологии. Это особенно важно для пациентов, нуждающихся в пожизненной заместительной терапии стероидами, и ряд исследований показал, что у больных, использующих новый метод инфузии, динамический уровень кортизола восстанавливается до нормального уровня [39, 40]. Тем не менее, остается сложной и важной задачей разработка активного контроля инфузии гормонов, который динамично реагирует на повседневные стрессоры. В этом направлении вычислительные алгоритмы, разработанные на основе математических моделей, могут помочь в разработке устройств для динамической доставки лекарственных препаратов. Подобные подходы к моделированию могут иметь применение в хронотерапии, например, для определения времени лечения хронических воспалительных и метаболических заболеваний, бесплодия и др.
Ось гипоталамус-гипофиз-гонады: раскрытие механизмов пульсации ГнРГ
Гормональные сигналы в гипоталамо-гипофизарно-гонадной (ГГГ) оси (Рисунок 3) имеют решающее значение для репродуктивной функции, при этом ключевым регулирующим процессом является пульсирующее высвобождение гонадотропин-рилизинг гормона (ГнРГ) из гипоталамуса в гипофиз. Математические модели позволили понять, как пульсация ГнРГ контролирует синтез и секрецию гонадотропных гормонов [лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ)] гипофизом. Ранние экспериментальные работы на приматах выявили зависимость секреции гонадотропинов от частоты ГнРГ, показав, что пульсирующий, но не постоянный ритм высвобождения из депо экзогенного ГнРГ может восстанавливать секрецию гонадотропина у животных с поражениями гипоталамуса [41]. Теперь ясно, что секреция гонадотропинов подавляется, когда частота ГнРГ либо слишком высокая, либо слишком низкая, и этот эффект опосредован сложными сигнальными сетями, которые позволяют клеткам по-разному регулировать синтез ЛГ и ФСГ в ответ на частоту ГнРГ [42]. Было предложено несколько математических моделей, показывающих передачу сигналов ГнРГ [43]. Механистическая модель этого пути продемонстрировала тот факт, что нелинейная связь между секрецией гонадотропина и частотой импульсов ГнРГ, скорее всего, связана с конвергентной архитектурой сети прямой связи [43]. Модель предполагает, что декодирование частоты в первую очередь достигается за счет синергетического эффекта нескольких сигнальных путей [например, пути киназы, регулируемой внеклеточным сигналом (ERK) и пути ядерного фактора активированных Т-клеток (NFAT)] на экспрессию связанных с гонадотропином генов. Это несколько противоречит концепции восходящего взаимодействия отрицательной обратной связи, которая, как ранее считалось, играет решающую роль в частотном декодировании. Вместо этого модель показывает, что обратная связь играет другую роль, позволяя гипофизарной системе справляться с межклеточной гетерогенностью и более надежно обрабатывать информацию о ГнРГ [44].
Гонадотропин-рилизинг-гормон (ГнРГ), секретируемый ГнРГ-нейронами, расположенными в гипоталамусе, стимулирует высвобождение гонадотропных гормонов [лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ)] из гипофиза. Высвобождение гонадотропинов зависит от пульсирующей динамики ГнРГ, которая управляется нейронными сетями гипоталамуса. Гонадотропины воздействуют на гонады, инициируя процессы, участвующие в гаметогенезе и овуляции, и запуская высвобождение половых стероидов (эстрадиол, тестостерон, прогестерон), которые по обратной связи воздействуют на мозг и гипофиз, модулируя динамику секреции ГнРГ и ЛГ/ФСГ. Математические модели [45] предложили понимание того, как нейроны гипоталамуса, совместно экспрессирующие кисспептин, нейрокинин-В и динорфин, контролируют пульсирующую динамику секреции ГнРГ и как эти пульсирующие сигналы декодируются отдельными клетками гипофиза.
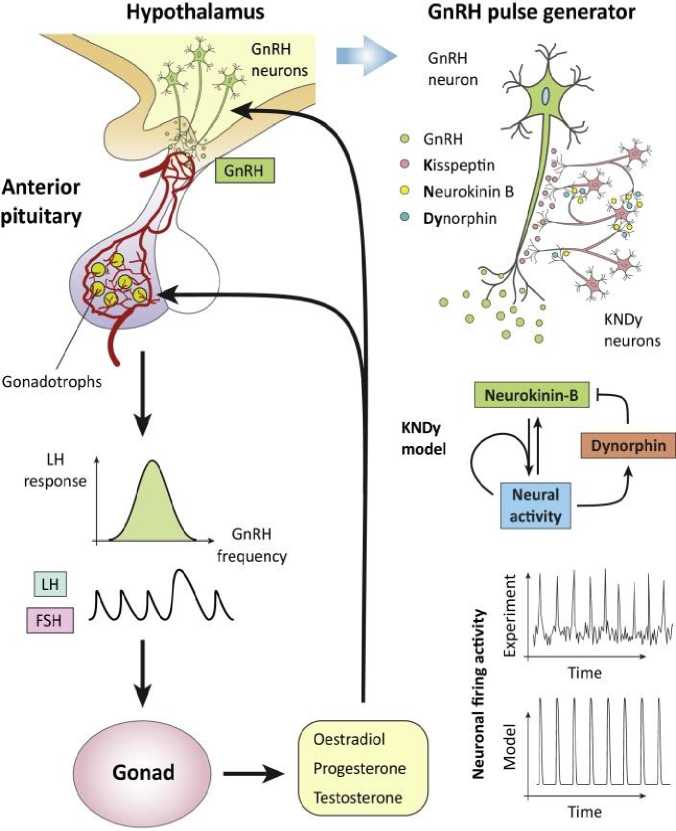
Рисунок 3. Гипоталамо-гипофизарно-гонадная ось (ГГГ)
На уровне гипоталамуса крупнозернистая модель популяции нейронов продвинула наше понимание того, как поддерживается и регулируется пульсация ГнРГ [45]. Модель опирается на экспериментальные работы Clarkson J. (2017) и Qiu J. (2016), которые демонстрируют ключевую роль передачи сигналов нейропептидов в популяции кисспептина дугообразного ядра для генерации импульсов GnRH [46, 47]. Модель поддерживает идею о том, что кисспептин управляет импульсами ГнРГ, действует как осциллятор релаксации за счет нейропептидергических взаимодействий отрицательной и положительной обратной связи, опосредованных нейрокинином В и динорфином соответственно. Кроме того, модель предсказывает, что пульсирующая динамика зависит от базовых уровней активности в популяции кисспептина, и подчеркивает критическое поведение системы по мере увеличения базальной активности. Используя оптогенетику, эти модельные предсказания были подтверждены in vivo, показывая, что импульсы могут непосредственно контролироваться у мышей в эстральном периоде путем избирательного возбуждения кисспептиновых нейронов в аркуатном ядре с помощью непрерывной низкочастотной (1 Гц и 5 Гц) световой стимуляции [45]. Таким образом, это еще один пример того, как даже простые феноменологические модели могут привести к полезным и экспериментально проверяемым выводам.
Математическое моделирование также использовалось для понимания макроскопических процессов, связанных с развитием фолликулов [48]. Хотя известно, что гонадотропины контролируют развитие фолликулов яичников и их секреторную активность, мало внимания уделялось изучению секреции половых стероидов и тому, как они возвращаются к восходящим компонентам оси ГГГ, модулируя секрецию GnRH и гонадотропинов. Эти обратные связи лежат в основе овариального цикла и играют критическую роль в женской физиологии и репродуктивном здоровье, таким образом, представляя уникальную возможность для экспериментальных физиологов, клиницистов и специалистов по математическому моделированию [48].
Гибридные системы: новая парадигма определения того, как части влияют на целое
Подобно альфа- и бета-клеткам поджелудочной железы, пять типов эндокринных клеток передней доли гипофиза (клетки, секретирующие ЛГ, ФСГ, АКТГ, СТГ, пролактин) генерируют электрическую активность в виде всплесков [49]. Электрическая активность доставляет Ca2+ в клетки через ионные каналы, что запускает секрецию гормонов. В отсутствие гипоталамических сигналов гипофизарные гонадотропы высвобождают мало гормонов и с малой скоростью. Напротив, лактотрофы и соматотрофы выбрасывают гормоны болюсом в импульсном режиме, обеспечивают больше времени для проникновения Ca2+ в клетки. Поэтому лактотрофы и соматотрофы имеют высокую базальную скорость высвобождения гормонов [50]. Кроме того, клетки гипофиза отличаются количеством калиевых (ВК) каналов большой проводимости. Лактотрофы и соматотрофы имеют высокую плотность BK-каналов, в то время как гонадотрофы — низкую [51]. Это парадоксально, потому что BK-каналы являются реполяризующими каналами (в нейронах и других типах клеток). Каналы BK обычно быстро открываются во время потенциала действия, уменьшая его продолжительность. Однако в клетках гипофиза, таких как соматотрофы и лактотрофы, BK-каналы, по-видимому, увеличивают продолжительность импульсов, превращая монотонную секрецию в импульсные болюсы.
Математическая модель предсказала, что ассимиляция каналов BK в электрическую активность гонадотропов может изменить динамику их возбуждения с пикового на взрывной. Быстро открываясь в начале потенциала действия, ВК-каналы ограничивают активацию других, более медленных К + -каналов, что, в свою очередь, предотвращает реполяризацию клетки [52]. Анализ модели позволяет предположить, что этот эффект устойчив к изменениям экспрессии других ионных каналов [53]. Метод динамического зажима был использован Tabak J., (2011) для определения роли калиевых (БК) каналов большой проводимости в формировании электрической активности клеток гипофиза (Рисунок 4) .
Традиционно математические модели интегрировались с экспериментами посредством итеративного процесса: предсказания моделей проверяются на соответствие результатам соответствующих экспериментов, а затем модели обновляются для устранения любых расхождений между ними. Хотя многие исследования идут по данному сценарию, тем не менее, гибридные эксперименты позволяют объединить математическую модель и эксперимент в интерактивном режиме, в режиме реального времени. Гибридные системы позволяют нам манипулировать значениями ключевых параметров со свободой математической модели. В то же время эффекты этих манипуляций наблюдаются в реальных биологических системах. Одним из примеров гибридной системы является протокол динамического зажима для электрически возбудимых клеток [7]. В этой системе используется математическая модель для подачи командного сигнала в ячейку, из которой производится электрическая запись. Важно отметить, что, поскольку мембранный потенциал клетки может быть передан модели в реальном времени, ее можно использовать для ввода сигналов, имитирующих ионные токи, которые могут присутствовать или отсутствовать в реальной клетке. Таким образом, можно манипулировать параметрами, связанными с этими токами, или в ячейку могут быть включены совершенно другие каналы. Этот метод был использован J. Tabak, (2011) для определения роли калиевых (БК) каналов большой проводимости в формировании электрической активности клеток гипофиза [53].
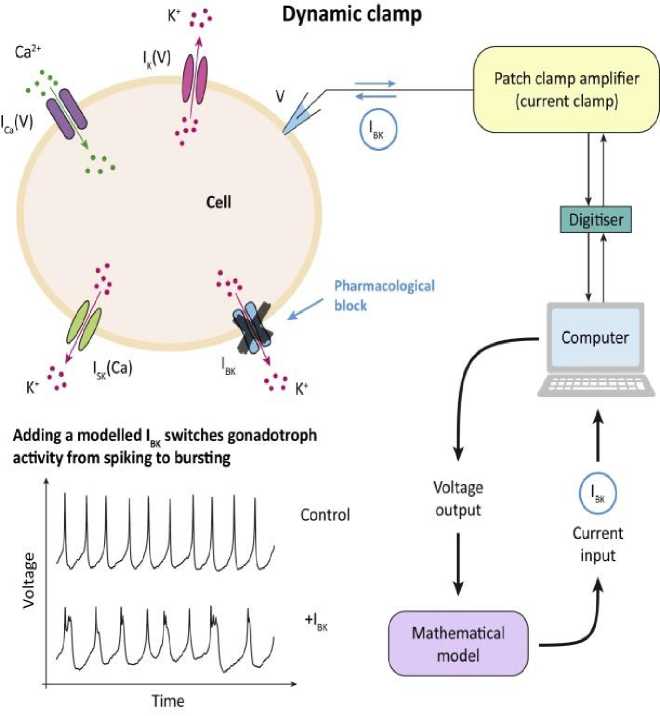
Рисунок 4. Динамический зажим: одновременное математическое моделирование и экспериментальная гибридная система в реальном времени
Динамический зажим сыграл важную роль в установлении роли каналов BK, связав математический механизм, основанный на модели, с реальными клетками гипофиза. Он иллюстрирует способность гибридных систем сочетать эксперименты и математическое моделирование. Другой интересный пример такой системы был разработан Dhumpa R. (2014) [54] и показал, что островки Лангерганса могут синхронизировать свою секрецию инсулина посредством обратной связи с печенью. Для этого они ввели островки, загруженные флуоресцентным индикатором Ca2+, в микрожидкостную камеру и соединили общий Ca2+ сигнал от популяции островков с математической моделью высвобождения глюкозы печенью в ответ на инсулин. Затем смоделированный уровень глюкозы доставляли обратно в островковую камеру. Без обратной связи с печенью островки производили независимые колебания. Однако, как только обратная связь была включена, островки начали синхронизироваться, о чем свидетельствует результирующая общая концентрация колебаний Ca2+, не в фазе с результирующим колебанием глюкозы. Данный факт показал, что печень может действовать как координатор активности в популяции островков, что позволило проверить эффективность этой координации, поскольку скорость обратной связи печени была различной. Таким образом, гибридные системы позволяют нам определить роль, которую играет каждый компонент биологической системы в реальном времени.
Взгляд в будущее
Динамика гормонов в норме и при патологии предложила будущие направления исследований на стыке математического моделирования и экспериментальной нейроэндокринологии. В этом смысле механизмы частотного кодирования и декодирования, лежащие в основе пульсирующей секреции гормонов, остаются малоизученной областью. Например, известно, что ультрадиановая гормональная стимуляция индуцирует опосредованные глюкокортикоидными рецепторами импульсы транскрипции генов [55], и растет понимание того, как динамика передачи сигналов глюкокортикоидов влияет на регуляцию генов, является ключом к разработке эффективных хронотерапевтических средств [56, 57]. Развитие такого понимания, вероятно, будет включать моделирование гормональной пульсации в непрерывном динамическом уравновешивании и стохастических динамических взаимодействиях на уровне связывания ДНК [7].
Еще одна развивающаяся область исследований — перекрестные взаимодействия между эндокринными осями. Например, гиперкортицизм, вызванный хроническим стрессом, синдромом Кушинга или приемом лекарств, является известным фактором риска развития сахарного диабета. Это вызвало необходимость исследования связи между динамикой уровня глюкокортикоидов и секрецией инсулина и инсулинорезистентностью [58, 59].
Точно так же математическая модель, связывающая ГГН и метаболические оси, описывает способ, которым циркадные колебания глюкокортикоидов регулируют цепь транскрипции, лежащую в основе дифференцировки адипоцитов [60], предлагая механизмы, с помощью которых условия, нарушающие пульсирующую секрецию глюкокортикоидов, могут привести к ожирению. Напротив, индуцированная инсулином гипогликемия является острым стрессором, который одновременно значительно активирует ось HPA и ингибирует пульсирующую секрецию ЛГ у крыс [61], что свидетельствует о перекрестных взаимодействиях между метаболической, стрессовой и репродуктивной осями. Гендерные различия в эндокринной регуляции также исследуются с помощью математических методов, о чем свидетельствует модель, изучающая влияние тестостерона на реакцию оси ГГН на стресс [62].
Кроме того, остается еще много не решенных вопросов, касающихся ритма секреции гормонов, его влияния на различные органы и ткани, хронотерапии различных заболеваний и т. д.
Т. о., система природа–общество–человек: целостная, динамическая, волновая, открытая, устойчиво неравновесная система, с выделением не только внутренних связей, но и внешних — с космической средой. Современная наука рассматривает человека, человечество и биосферу как единую систему, с растущими демографическими, продовольственными и медицинскими проблемами. Мозг человека — это биологические, биофизические, нейрофизиологические и медико-социальные парадигмы обмена информацией. Современные коммуникации — это многоуровневые, мультипарадигмальные и междисциплинарные модели обмена информацией. Внедрение авторских разработок в последнее десятилетие позволило сформировать систему алгоритмов и инструментов управления нейропластичностью [63].
Биоэлементология и нутрициология мозга Homo sapiens XXI века — это комбинированное лечение с применением функциональных продуктов питания (персонифицированных по содержанию макро- и микроэлементов, витаминов и клетчатки) и лекарственных препаратов (с положительным влиянием на биомикробиоту) — способных к нормализации патологически измененных биологических ритмов — перспективное направление нейронутрициологии ХХI века [64].
В исследованиях Романчук Н. П. показано, что для нового нейрогенеза и нейропластичности, для управления нейропластичностью и биологическим возрастом человека, для современной нейрофизиологии и нейрореабилитации когнитивных нарушений и когнитивных расстройств необходимо достаточное функциональное и энергетическое питание мозга с использованием современных нейротехнологий ядерной медицины [64].
В исследовании [65], актуализировано дальнейшее изучение: современной мультипарадигмальной психонейроиммуноэндокринологии, категорий «здоровье» и «болезнь», нарушения мышления и памяти, влияния микробиоты и функционального питания на психическое здоровье, показана роль генетики и эпигенетики Новой личности — при редактировании генома, биочипировании, тотальной нейронавигации 5G технологий.
Действие тестостерона или кортизола на финансовые решения отражает их основные функции: для тестостерона — его центральную роль в содействии репродуктивному успеху; для кортизола — его роль в преодолении стресса [66].
Ведущие Центры нейроэкономических исследований разрабатывают нейробиологические и нейроэндокринные технологии для понимания того, как люди принимают решения. Например, гормон окситоцин связывает нас с другими людьми и заставляет работать, чтобы помочь им. Окситоцин также является частью мозгового контура, который заставляет нас погружаться в истории и переживания, вспоминать информацию в них и убеждать нас предпринимать действия [66].
Многие гормоны могут влиять на принятие финансовых решений, но два выделяются как главные кандидаты из-за их биологических функций. Тестостерон играет хорошо зарекомендовавшую себя роль в воспроизводстве, которая включает в себя агрессию, конкурентоспособность и принятие риска, все существенные элементы финансовых отношений, а также успешное воспроизводство. Профессиональные финансы - это прежде всего область мужчин, хотя ситуация постепенно меняется; финансовый мир в основном строится мужчинами, и это отражает то, как гормоны влияют на него. Кортизол является фундаментальным компонентом реакции на стресс и важен для преодоления непредсказуемых или угрожающих событий, а также является общей чертой или следствием финансовых решений, особенно тех, которые принимаются в условиях принуждения [66].
В исследовании [67] показано, что уменьшение времени сна в старших возрастных группах, снижение выработки мелатонина, нарушение режима сон–бодрствование, инсомния, могут способствовать развитию дементных явлений. Направление потоков информации извне в кору головного мозга при бодрствовании и во сне во многом определяется функционированием энторинальной коры головного мозга. Мозг не проживает сновидения в реальном времени, а создает сюжет сновидения, используя информацию, содержащуюся в циклических нейронных цепях (ЦНЦ), что занимает всего несколько миллисекунд.
Качественный сон — обеспечивает нейроэндокринную составляющую медицинской реабилитации когнитивной сферы человека.
Заключение
О сложности структуры и работы эндокринной системы свидетельствуют молекулярные взаимодействия, происходящие на всех уровнях ее организации и необходимые для достижения надежного контроля секреции гормонов. Поразительно, но многие эндокринные оси демонстрируют одни и те же стратегии контроля для регуляции уровня гормонов в пределах гомеостатического диапазона: петли обратной связи, сетевая организация компонентов и совместное их взаимодействие, которое нельзя объяснить исключительно путем изучения работы отдельных клеток. В обзоре литературы мы на примере трех основных эндокринных осей рассмотрели, как математические модели дали глубокое понимание секреции гормонов, что было бы трудно интерпретировать просто получив данные в эксперименте [6, 7].
Современные знания о нейрогенезе мозга и нейрональной дифференциации - будущая концепция глубокой биологии как эффективный подход к разгадке ключевых процессов нейронной регенерации [63].
Хронический стресс и циркадианное рассогласование запускают каскад сбоев в функционировании нейрофизиологических, нейроэндокринных и психонейроиммунных механизмов. Циркадная система синхронизации представляет собой эволюционный программный продукт мозг H. sapiens , который необходим, для выживания и подготовки организма к ожидаемым циклическим вызовам, различной эпигенетической направленности. Циркадианный стресс оказывает патологическое влияние на человека, во все его возрастные периоды жизнедеятельности [63].
Кроме того, в то время как в большинстве экспериментальных исследований достаточно, чтобы «данные говорили сами за себя», существующие экспериментальные протоколы применительно к сложным эндокринным явлениям часто затрудняются объединить данные на разных уровнях организации. В результате взаимодействия между факторами, лежащими в основе эндокринной регуляции, и различные временные рамки, в которых они возникают, часто игнорируются. Именно здесь математические модели предлагают решение для интерпретации данных и понимания лежащей в их основе динамики. Более того, модели помогают нам выйти за рамки того, «что мы можем сделать» на лабораторном столе, и начать задавать вопросы «а что, если». Это не только стимулирует творческое междисциплинарное сотрудничество, но и продвигает область, заменяя статическое, моментальное представление эндокринной функции более сложной многоуровневой регуляцией, лежащей в основе динамики гормонов.
Мозг H. sapiens работая в режиме гениальности (таланта, креативности) требует создания нейроэндокринных и поддержание современных нейрокоммуникаций между новой корой и гиппокампом (библиотекой памяти, винчестером памяти), формированием новых структурно-функциональных нейрокоммуникаций в мозг H. sapiens которые происходят непрерывно на протяжении всей жизнедеятельности от рождения до сверхдолголетия, и имеют творческие преимущества в эпоху современного нейробыта и нейромаркетинга.
Список литературы Математическое моделирование эндокринной системы
- Пятин В. Ф., Романчук Н. П., Булгакова С. В., Романов Д. В., Сиротко И. И., Давыдкин И. Л., Волобуев А. Н. Циркадианный стресс Homo sapiens: новые нейрофизиологические, нейроэндокринные и психонейроиммунные механизмы // Бюллетень науки и практики. 2020. Т. 6. №6. С. 115-135. https://doi.org/10.33619/2414-2948/55/16
- Булгакова С. В., Романчук Н. П., Волобуев А. Н. Новая личность и нейрокоммуникации: нейрогенетика и нейросети, психонейроиммуноэндокринология, 5Рмедицина и 5G-технологии // Бюллетень науки и практики. 2021. Т. 7. №8. С. 202-240. https://doi .org/10.33619/2414-2948/69/26
- Волобуев А. Н., Романчук Н. П., Булгакова С. В. Нейрогенетика мозга: сон и долголетие человека // Бюллетень науки и практики. 2021. Т. 7. №3. С. 93-135. https://doi.org/10.33619/2414-2948/64/12
- Булгакова С. В., Романчук П. И., Тренева Е. В. Инсулин, головной мозг, болезнь Альцгеймера: новые данные // Бюллетень науки и практики. 2020. Т. 6. №3. С. 96-126. https://doi.org/10.33619/2414-2948/52
- Булгакова С. В., Романчук Н. П., Тренева Е. В. Глюкагоноподобный пептид 1, головной мозг, нейродегенеративные заболевания: современный взгляд // Бюллетень науки и практики. 2020. Т. 6. №4. С. 153-172. https://doi.org/10.33619/2414-2948/53/19
- Романчук Н. П., Пятин В. Ф., Волобуев А. Н., Булгакова С. В., Тренева Е. В., Романов Д. В. Мозг, депрессия, эпигенетика: новые данные // Бюллетень науки и практики. 2020. Т. 6. №5. С. 163-183. https://doi.org/10.33619/2414-2948/54/21
- Zavala E., Wedgwood K. C., Voliotis M., Tabak J., Spiga F., Lightman S. L., Tsaneva-Atanasova Mathematical modelling of endocrine systems // Trends in Endocrinology & Metabolism. 2019. V. 30. №4. P. 244-257. https://doi.org/10.1016/j.tem.2019.01.008
- Leng G., MacGregor D. J. Models in neuroendocrinology // Mathematical biosciences. 2018. V. 305. P. 29-41. https://doi.org/10.1016/j.mbs.2018.07.008
- Grant A. D., Wilsterman K., Smarr B. L., Kriegsfeld L. J.Evidence for a coupled oscillator model of endocrine ultradian rhythms // Journal of biological rhythms. 2018. V. 33. №5. P. 475-496. https://doi.org/10.1177/0748730418791423
- Chay T. R., Keizer J. Minimal model for membrane oscillations in the pancreatic beta-cell // Biophysical journal. 1983. V. 42. №2. P. 181-189. https://doi.org/10.1016/S0006-3495(83)84384-7
- P0rksen N. The in vivo regulation of pulsatile insulin secretion // Diabetologia. 2002. V. 45. №1. P. 3-20. https://doi.org/10.1007/s125-002-8240-x
- Hellman B. Pulsatility of insulin release-a clinically important phenomenon // Upsala journal of medical sciences. 2009. V. 114. №4. P. 193-205. https://doi.org/10.3109/03009730903366075
- Bertram R., Satin L. S., Sherman A. S. Closing in on the mechanisms of pulsatile insulin secretion // Diabetes. 2018. V. 67. №3. P. 351-359. https://doi.org/10.2337/dbi17-0004
- Bertram R., Satin L. S., Pedersen M. G., Luciani D. S., Sherman, A. Interaction of glycolysis and mitochondrial respiration in metabolic oscillations of pancreatic islets // Biophysical Journal. 2007. V. 92. №5. P. 1544-1555. https://doi.org/10.1529/biophysj.106.097154
- McKenna J. P., Ha J., Merrins M. J., Satin L. S., Sherman A., Bertram R. Ca2+ effects on ATP production and consumption have regulatory roles on oscillatory islet activity // Biophysical journal. 2016. V. 110. №3. P. 733-742. https://doi.org/10.1016/j.bpj.2015.11.3526
- Marinelli I., Vo T., Gerardo-Giorda L., Bertram R. Transitions between bursting modes in the integrated oscillator model for pancreatic P-cells // Journal of Theoretical Biology. 2018. V. 454. P. 310-319. https://doi.org/10.1016/jjtbi.2018.06.017
- Sherman A., Rinzel J. Model for synchronization of pancreatic beta-cells by gap junction coupling // Biophysical journal. 1991. V. 59. №3. P. 547-559. https://doi.org/10.1016/S0006-3495(91)82271-8
- Smolen P., Rinzel J., Sherman A. Why pancreatic islets burst but single beta cells do not. The heterogeneity hypothesis // Biophysical journal. 1993. V. 64. №6. P. 1668-1680. https://doi.org/10.1016/S0006-3495(93)81539-X
- Johnston N. R., Mitchell R. K., Haythorne E., Pessoa M. P., Semplici F., Ferrer J., Hodson D. J. Beta cell hubs dictate pancreatic islet responses to glucose // Cell metabolism. 2016. V. 24. №3. P. 389-401. https://doi.org/10.1016/j.cmet.2016.06.020
- Gosak M., Markovic R., Dolensek J., Rupnik M. S., Marhl M., Stozer A., Perc M. Network science of biological systems at different scales: A review // Physics of life reviews. 2018. V. 24. P. 118-135. https://doi.org/10.1016/j.plrev.2017.11.003
- Cappon G., Pedersen M. G. Heterogeneity and nearest-neighbor coupling can explain small-worldness and wave properties in pancreatic islets // Chaos: An Interdisciplinary Journal of Nonlinear Science. 2016. V. 26. №5. P. 053103. https://doi.org/10.1063/L4949020
- Ha J., Satin L. S., Sherman A. S. A mathematical model of the pathogenesis, prevention, and reversal of type 2 diabetes // Endocrinology. 2016. V. 157. №2. P. 624-635. https://doi.org/10.1210/en.2015-1564
- Taylor R., Holman R. R. Normal weight individuals who develop type 2 diabetes: the personal fat threshold // Clinical Science. 2015. V. 128. №7. P. 405-410. https://doi.org/10.1042/CS20140553
- Chamberlain J. J., Kalyani R. R., Leal S., Rhinehart A. S., Shubrook J. H., Skolnik N., Herman W. H. Treatment of type 1 diabetes: synopsis of the 2017 American Diabetes Association Standards of Medical Care in Diabetes // Annals of Internal Medicine. 2017. V. 167. №7. P. 493498. https://doi.org/10.7326/M17-1259
- Dai X., Luo Z. C., Zhai L., Zhao W. P., Huang F. Artificial pancreas as an effective and safe alternative in patients with type 1 diabetes mellitus: a systematic review and meta-analysis // Diabetes Therapy. 2018. V. 9. №3. P. 1269-1277. https://doi.org/10.1007/s13300-018-0436-y
- Del Favero S., Bruttomesso D., Di Palma F., Lanzola G., Visentin R., Filippi A.. First use of model predictive control in outpatient wearable artificial pancreas // Diabetes care. 2014. V. 37. №5. P. 1212-1215. https://doi.org/10.2337/dc13-1631
- Kovatchev B., Cheng P., Anderson S. M., Pinsker J. E., Boscari F., Buckingham B. A. Feasibility of long-term closed-loop control: a multicenter 6-month trial of 24/7 automated insulin delivery // Diabetes technology & therapeutics. 2017. V. 19. №1. P. 18-24. https://doi.org/10.1089/dia.2016.0333
- Huang M., Li J., Song X., Guo H. Modeling impulsive injections of insulin: towards artificial pancreas // SIAM Journal on Applied Mathematics. 2012. V. 72. №5. P. 1524-1548. https://doi.org/10.1137/110860306
- Wang Q., Molenaar P., Harsh S., Freeman K., Xie J., Gold C., Ulbrecht J. Personalized state-space modeling of glucose dynamics for type 1 diabetes using continuously monitored glucose, insulin dose, and meal intake: an extended Kalman filter approach // Journal of diabetes science and technology. 2014. V. 8. №2. P. 331-345. https://doi.org/10.1177/1932296814524080
- Булгакова С.В., Тренева Е.В., Захарова Н.О., Николаева А.В. Влияние старения надпочечников на работу различных органов и систем (обзор дитературы). Врач. 2020; 31(6):34-39. https://doi.org/10.29296/25877305-2020-06-06
- Dempsher D. P., Gann D. S., Phair R. D. A mechanistic model of ACTH-stimulated Cortisol secretion // American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 1984. V. 246. №4. P. R587-R596. https://doi.org/10.n52/ajpregu.1984.246AR587
- Bairagi N., Chatterjee S., Chattopadhyay J. Variability in the secretion of corticotropin-releasing hormone, adrenocorticotropic hormone and cortisol and understandability of the hypothalamic-pituitary-adrenal axis dynamics—a mathematical study based on clinical evidence // Mathematical medicine and biology: a journal of the IMA. 2008. V. 25. №1. P. 37-63. https://doi.org/10.1093/imammb/dqn003
- Gupta S., Aslakson E., Gurbaxani B. M., Vernon S. D. Inclusion of the glucocorticoid receptor in a hypothalamic pituitary adrenal axis model reveals bistability // Theoretical Biology and Medical Modelling. 2007. V. 4. №1. P. 1-12. https://doi.org/10.1186/1742-4682-4-8
- Walker J. J., Terry J. R., Lightman S. L. Origin of ultradian pulsatility in the hypothalamic-pituitary-adrenal axis // Proceedings of the Royal Society B: Biological Sciences. 2010. V. 277. №1688. P. 1627-1633. https://doi.org/10.1098/rspb.2009.2148
- Walker J. J., Spiga F., Waite E., Zhao Z., Kershaw Y., Terry J. R., Lightman S. L. The origin of glucocorticoid hormone oscillations // PLoS biology. 2012. V. 10. №6. P. e1001341. https://doi.org/10.1371/journal.pbio.1001341
- Bangsgaard E. O., Ottesen J. T. Patient specific modeling of the HPA axis related to clinical diagnosis of depression //Mathematical biosciences. 2017. T. 287. C. 24-35. https://doi.org/10.1016/j.mbs.2016.10.007
- Spiga F., Zavala E., Walker J. J., Zhao Z., Terry J. R., Lightman S. L. Dynamic responses of the adrenal steroidogenic regulatory network // Proceedings of the National Academy of Sciences. 2017. V. 114. №31. P. E6466-E6474. https://doi.org/10.1073/pnas.1703779114
- Walker J. J., Spiga F., Gupta R., Zhao Z., Lightman S. L., Terry J. R. Rapid intra-adrenal feedback regulation of glucocorticoid synthesis // Journal of the Royal Society Interface. 2015. V. 12. №102. P. 20140875. https://doi.org/10.1098/rsif.2014.0875
- 0ksnes M., Bjornsdottir S., Isaksson M., Methlie P., Carlsen S., Nilsen R. M., L0vas K. Continuous subcutaneous hydrocortisone infusion versus oral hydrocortisone replacement for treatment of addison's disease: a randomized clinical trial // The Journal of Clinical Endocrinology & Metabolism. 2014. V. 99. №5. P. 1665-1674. https://doi.org/10.1210/jc.2013-4253
- Russell G. M., Durant C., Ataya A., Papastathi C., Bhake R., Woltersdorf W., Lightman S. Subcutaneous pulsatile glucocorticoid replacement therapy // Clinical endocrinology. 2014. V. 81. №2. P. 289-293. https://doi.org/10.1111/cen.12470
- Belchetz P. E., Plant T. M., Nakai Y., Keogh E. J., Knobil E. Hypophysial responses to continuous and intermittent delivery of hypothalamic gonadotropin-releasing hormone // Science. 1978. V. 202. №4368. P. 631-633. https://doi.org/10.1126/science.100883
- Stern E., Ruf-Zamojski F., Zalepa-King L., Pincas H., Choi S. G., Peskin C. S., Sealfon S. C. Modeling and high-throughput experimental data uncover the mechanisms underlying Fshb gene sensitivity to gonadotropin-releasing hormone pulse frequency // Journal of Biological Chemistry. 2017. V. 292. №23. P. 9815-9829. https://doi.org/10.1074/jbc.M117.783886
- Pratap A., Garner K. L., Voliotis M., Tsaneva-Atanasova K., McArdle C. A. Mathematical modeling of gonadotropin-releasing hormone signaling // Molecular and cellular endocrinology. 2017. V. 449. P. 42-55. https://doi.org/10.1016/j.mce.2016.08.022
- Voliotis M., Perrett R. M., McWilliams C., McArdle C. A., Bowsher C. G. Information transfer by leaky, heterogeneous, protein kinase signaling systems // Proceedings of the National Academy of Sciences. 2014. V. 111. №3. P. E326-E333. https://doi.org/10.1073/pnas.1314446111
- Voliotis M., Li X. F., De Burgh R., Lass G., Lightman S. L., O'Byrne K. T., Tsaneva-Atanasova K. Mathematical modelling elucidates core mechanisms underpinning GnRH pulse generation // bioRxiv. 2018. P. 245548. https://doi.org/10.1101/245548
- Clarkson J., Han S. Y., Piet R., McLennan T., Kane G. M., Ng J., Herbison A. E.Definition of the hypothalamic GnRH pulse generator in mice // Proceedings of the National Academy of Sciences. 2017. V. 114. №47. P. E10216-E10223. https://doi.org/10.1073/pnas.1713897114
- Qiu J., Nestor C. C., Zhang C., Padilla S. L., Palmiter R. D., Kelly M. J., R0nnekleiv O. K. High-frequency stimulation-induced peptide release synchronizes arcuate kisspeptin neurons and excites GnRH neurons // Elife. 2016. V. 5. P. e16246. https://doi.org/10.7554/eLife.16246.001
- Monniaux D., Michel P., Postel M., Clément F. Multi-scale modelling of ovarian follicular development: From follicular morphogenesis to selection for ovulation // Biology of the Cell. 2016. V. 108. №6. P. 149-160. https://doi.org/10.1111/boc.201500087
- Stojilkovic S. S., Tabak J., Bertram R. Ion channels and signaling in the pituitary gland // Endocrine reviews. 2010. V. 31. №6. P. 845-915. https://doi.org/10.1210/er.2010-0005
- Van Goor F., Zivadinovic D., Stojilkovic S. S. Differential expression of ionic channels in rat anterior pituitary cells // Molecular Endocrinology. 2001. V. 15. №7. P. 1222-1236. https://doi.org/10.1210/mend.157.0668
- Van Goor F., Zivadinovic D., Martinez-Fuentes A. J., Stojilkovic S. S. Dependence of pituitary hormone secretion on the pattern of spontaneus voltage-gated calcium influx // Journal of Biological Chemistry. 2001. V. 276. №36. P. 33840-33846. https://doi.org/10.1074/jbc.M105386200
- Van Goor F., Li Y. X., Stojilkovic S. S. Paradoxical role of large-conductance calcium-activated K+ (BK) channels in controlling action potential-driven Ca2+ entry in anterior pituitary cells // Journal of Neuroscience. 2001. V. 21. №16. P. 5902-5915. https://doi.org/10.1523/JNEUR0SCI.21-16-05902.2001
- Tabak J., Tomaiuolo M., Gonzalez-Iglesias A. E., Milescu L. S., Bertram R. Fast-activating voltage-and calcium-dependent potassium (BK) conductance promotes bursting in pituitary cells: a dynamic clamp study // Journal of Neuroscience. 2011. V. 31. №46. P. 1685516863. https://doi.org/10.1523/JNEUR0SCI.3235-11.2011
- Dhumpa R., Truong T. M., Wang X., Bertram R., Roper M. G. Negative feedback synchronizes islets of Langerhans // Biophysical journal. 2014. V. 106. №10. P. 2275-2282. https://doi.org/10.1016/j.bpj.2014.04.015
- Stavreva D. A., Wiench M., John S., Conway-Campbell B. L., McKenna M. A., Pooley J. R., Hager G. L. Ultradian hormone stimulation induces glucocorticoid receptor-mediated pulses of gene transcription // Nature cell biology. 2009. V. 11. №9. P. 1093-1102. https://doi.org/10.1038/ncb1922
- Biddie S. C., Conway-Campbell B. L., Lightman S. L. Dynamic regulation of glucocorticoid signalling in health and disease // Rheumatology. 2012. V. 51. №3. P. 403-412. https://doi.org/10.1093/rheumatology/ker215
- Strehl C., Buttgereit F. Optimized glucocorticoid therapy: teaching old drugs new tricks // Molecular and cellular endocrinology. 2013. V. 380. №1-2. P. 32-40. https://doi.org/10.1016/j.mce.2013.01.026
- Basse A. L., Dalbram E., Larsson L., Gerhart-Hines Z., Zierath J. R., Treebak J. T. Skeletal muscle insulin sensitivity show circadian rhythmicity which is independent of exercise training status // Frontiers in physiology. 2018. P. 1198. https://doi.org/10.3389/fphys.2018.01198
- Fine N. H., Doig C. L., Elhassan Y. S., Vierra N. C., Marchetti P., Bugliani M., Hodson D. J. Glucocorticoids reprogram P-cell signaling to preserve insulin secretion // Diabetes. 2018. V. 67. №2. P. 278-290. https://doi.org/10.2337/db16-1356
- Bahrami-Nejad Z., Zhao M. L., Tholen S., Hunerdosse D., Tkach K. E., van Schie S., Teruel M. N. A transcriptional circuit filters oscillating circadian hormonal inputs to regulate fat cell differentiation // Cell metabolism. 2018. V. 27. №4. P. 854-868. e8. https://doi.org/10.1016/j.cmet.2018.03.012
- Li X. F., Mitchell J. C., Wood S., Coen C. W., Lightman S. L., O'Byrne K. T. The effect of oestradiol and progesterone on hypoglycaemic stress-induced suppression of pulsatile luteinizing hormone release and on corticotropin-releasing hormone mRNA expression in the rat // Journal of neuroendocrinology. 2003. V. 15. №5. P. 468-476. https://doi.org/10.10467j.1365-2826.2003.01014.x
- Stanojevic A., Markovic V. M., Macesic S., Kolar-Anic L., Vukojevic V. Kinetic modelling of testosterone-related differences in the hypothalamic-pituitary-adrenal axis response to stress // Reaction Kinetics, Mechanisms and Catalysis. 2018. V. 123. №1. P. 17-30. https://doi.org/10.1007/s11144-017-1315-7
- Романчук Н. П. Мозг человека и природа: современные регуляторы когнитивного здоровья и долголетия // Бюллетень науки и практики. 2021. Т. 7. №6. С. 146-190. https://doi .org/10.33619/2414-2948/67/21
- Романчук Н.П. Биоэлементология и нутрициология мозга// Бюллетень науки и практики. 2021. Т. 7. №9. https://doi.org/10.33619/2414-2948/70/22
- Булгакова С. В., Романчук Н. П., Волобуев А. Н. Новая личность и нейрокоммуникации: нейрогенетика и нейросети, психонейроиммуноэндокринология, 5P-медицина и 5G-технологии // Бюллетень науки и практики. 2021. Т. 7. №8. С. 202-240. https://doi .org/10.33619/2414-2948/69/26
- Пятин В. Ф., Маслова О. А., Романчук Н. П., Волобуев А. Н., Булгакова С. В., Романов Д. В., Сиротко И. И. Нейровизуализация: структурная, функциональная, фармакологическая, биоэлементологии и нутрициологии // Бюллетень науки и практики. 2021. Т. 7. №10. С. 145- 184. https://doi.org/10.33619/2414-2948/71/18
- Волобуев А. Н., Романчук П. И., Давыдкин И. Л. Некоторые аспекты функционирования мозга во сне в старших возрастных группах // Врач. 2021. Т. 32. №6. С. 13-16. https://doi.org/10.29296/25877305-2021-06-03


