Математическое моделирование процесса биодеструкции парацетамола актинобактериями рода Rhodococcus
Автор: Вихарева Е.В., Селянинов А.А., Ившина И.Б., Няшин Ю.И.
Журнал: Российский журнал биомеханики @journal-biomech
Статья в выпуске: 2 (36) т.11, 2007 года.
Бесплатный доступ
Определена зависимость константы скорости реакции биокаталитического окисления парацетамола от технологических параметров процесса - температуры инкубации (поддержания контролируемых параметров окружающей среды) родококков и скорости движения орбитального шейкера (прибора с движущейся платформой). Достигнуто соответствие результатов, полученных по теоретическому кинетическому уравнению, с экспериментальными данными. Показана возможность использования разработанного кинетического уравнения для интенсификации процесса биодеструкции парацетамола. Полученное решение задачи оптимизации процесса биодеструкции парацетамола позволяет перейти к характерным параметрам процесса (температура и окружная скорость движения жидкости в лабораторной установке) и к реальным управляющим технологическим параметрам для проведения процесса в промышленных и полупромышленных условиях.
Парацетамол, биологическая деструкция, родококки, кинетическое уравнение, константа скорости реакции, технологические параметры процесса
Короткий адрес: https://sciup.org/146215896
IDR: 146215896 | УДК: 531/534:
Текст научной статьи Математическое моделирование процесса биодеструкции парацетамола актинобактериями рода Rhodococcus
В предыдущих работах [1, 2] на примере парацетамола показана возможность биологической деструкции непригодных к медицинскому использованию лекарственных средств, содержащих в своей структуре фенольную гидроксильную группу. Определены кинетические параметры и разработаны условия интенсификации процесса биоконверсии парацетамола, предусматривающие использование иммобилизованных (лишенных подвижности для повышения их ферментативной активности) в криогеле (геле, полученном путем последовательного нагревания и охлаждения) поливинилового спирта клеток алканотрофных (способных питаться углеводородами, в частности входящими в состав нефти) родококков.
Разработана кинетическая схема реакции биокаталитического окисления парацетамола. В результате предложено два кинетических уравнения, описывающих процесс биодеструкции парацетамола: одно - с учетом концентрации собственно парацетамола, другое - с учетом содержания парацетамола и его метаболитов
( п -аминофенола и других) [2]. Первое кинетическое уравнение позволяет описать сравнительно медленные процессы биодеструкции. Второе кинетическое уравнение позволяет описать интенсивный процесс биодеструкции с использованием иммобилизованных клеток родококков, протекающий до полного разложения вещества за более короткий промежуток времени. Второе кинетическое уравнение имеет более сложное решение, его можно использовать при решении краевых задач о движении раствора и в зависимости от скорости перемешивания и температуры получить изменение концентрации первичного продукта разложения.
Первое кинетическое уравнение вида dx
— = - kx (1) dt оказалось удобным для применения в лабораторной практике. Методика определения константы скорости реакции биокаталитического окисления парацетамола k позволяет получить устойчивые результаты, совпадающие с данными экспериментальных исследований [2]. В связи с этим с целью интенсификации процесса биодеструкции парацетамола использовалось именно это кинетическое уравнение.
По данным авторов, наибольшее влияние на скорость и полноту процесса биодеструкции парацетамола в лабораторных условиях оказывают температура инкубации родококков ( Т , оС) и угловая скорость орбитального вращения жидкости в шейкере ( n , об/мин). Для изучения зависимости k от указанных технологических параметров была поставлена серия экспериментов при различных значениях орбитальной скорости и температуры.
Материалы и методы
Эксперименты по биодеструкции парацетамола проводили в условиях периодического культивирования родококков в колбах Эрленмейера объемом 250 мл на лабораторных шейкерах при температуре 18, 28, 35°С и орбитальной угловой скорости вращения жидкости 160 и 200 об/мин. Пределы изменения орбитальной угловой скорости связаны с возможностями лабораторного шейкера и недостаточным перемешиванием культуральной жидкости при скорости вращения менее 160 об/мин. Температура инкубации ниже 18оС не позволяет провести полную биодеструкцию парацетамола из-за низкой активности бактерий. При Т > 40оС наступает предел выживаемости микроорганизмов. В виду практической направленности работы верхний предел температуры был снижен до 35оС с целью будущего технологического запаса при проведении процесса в промышленных условиях. В связи с этим технологические ограничения имеют вид:
n > 160 об/мин, 18оС < Т < 35оС. (2)
Продолжительность экспериментов составляла 8 суток. В работе использовали наиболее активный штамм (семейство) R. ruber ИЭГМ – Институт экологии и генетики микроорганизмов – 77, предварительно отобранный путем скрининга (отбора наиболее активных штаммов микрорганизмов) из 79 штаммов актинобактерий, поддерживаемых в Региональной профилированной коллекции алканотрофных микроорганизмов (ИЭГМ, http://www.iegm.ru/iegmcol ).
С целью активизации оксигеназ (ферментов, катализирующих окислительновосстановительные процессы) бактериальные клетки до начала процесса биодеструкции выращивали в минеральной среде [3] в присутствии 0,1% фенола. О
сутки
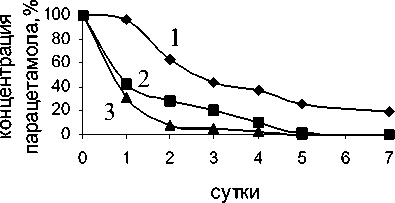
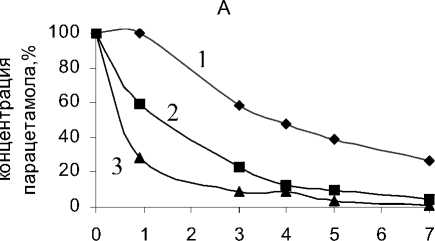
Рис. 1. Изменение содержания парацетамола в процессе биодеструкции клетками R. ruber ИЭГМ 77 при температуре 18оС (1), 28оС (2), 35оС (3) и орбитальной угловой скорости вращения шейкера 160 об/мин (А) и 200 об/мин (Б)
скорости процесса биодеградации парацетамола судили по степени убыли парацетамола из среды культивирования актинобактерий, регистрируемой методом высокоэффективной жидкостной хроматографии [1].
Для перехода к полупромышленной (а далее к промышленной) установке (ферментеру) возникла необходимость поставить в соответствие орбитальную скорость вращения жидкости платформы шейкера и угловую скорость мешалки в ферментере. С этой целью экспериментально была определена окружная скорость вращения жидкости.
Орбитальную угловую скорость вращения жидкости в колбе определяли с помощью видеосъемки верхнего слоя жидкости в разных точках. Угловую скорость вращения мешалки в ферментере определяли по величине «размазывания» при съемке посторонней частицы цифровой камерой с известной выдержкой. Значения окружной скорости рассчитывали по формуле — = v. Об интенсивности перемешивания A t жидкости в колбе и ферментере судили по времени достижения однородного окрашивания жидкости после введения в колбу и ферментер определенного объема раствора метиленового голубого, содержащего соответствующее количество красителя. Интенсивность перемешивания определяли величиной, обратной времени перемешивания:
I пе р = 1/ t пе р [ с ].
Константу скорости реакции рассчитывали по методике, описанной в работе [2] ( k , 1/сут), а также получали путем обработки экспериментальных данных по методу наименьших квадратов ( k ср , 1/сут).
Результаты и их обсуждение
Результаты исследований показали, что скорость процесса биодеструкции парацетамола увеличивается с увеличением орбитальной скорости вращения шейкера и температуры среды инкубации родококков (рис. 1). При n =160 об/мин и Т = 35оС парацетамол полностью исчезает из среды инкубации за 7 суток (рис. 1А), в то время как при n =200 об/мин и Т = 35оС – за 5 суток испытаний (рис. 1Б).
Предложенное кинетическое уравнение адекватно описывает процесс биодеструкции парацетамола, проведенный в указанных условиях (рис. 2).
Расчетные значения k хорошо коррелируют с экспериментальными данными ( k ср ), обработанными по методу наименьших квадратов (табл. 1).
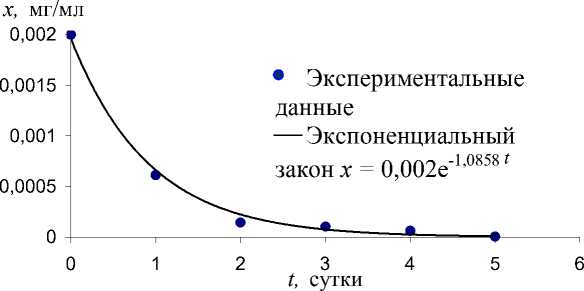
Рис. 2. Зависимость концентрации парацетамола от времени в процессе биодеструкции клетками R . ruber ИЭГМ 77 при n =200 об/мин и Т = 35?С.
Таблица 1
Расчетные и экспериментальные (средние) значения k
|
Т ,оС |
18 |
28 |
35 |
|||
|
n , об/мин |
160 |
200 |
160 |
200 |
160 |
200 |
|
ω, рад/c |
16,75 |
20,93 |
16,75 |
20,93 |
16,75 |
20,93 |
|
x , [г/мл ] |
0,0005352 |
0,0005224 |
0,0000826 |
0,0000232 |
0,0000142 |
0,0000042 |
|
x 0 / x |
3,74 |
3,83 |
24,21 |
86,21 |
140,85 |
476,19 |
|
ln x 0/ x |
1,32 |
1,34 |
3,19 |
4,46 |
4,94 |
6,17 |
|
k , 1/сут |
0,187 |
0,269 |
0,455 |
0,891 |
0,707 |
1,233 |
|
k ср , 1/сут |
0,201 |
0,255 |
0,458 |
0,765 |
0,649 |
1,086 |
Ранее было показано, что с увеличением коэффициента k уменьшается продолжительность процесса биодеструкции парацетамола [2]. Следовательно, в качестве целевой функции можно выбрать зависимость k от технологических параметров k = ƒ (n, Т). (4)
Задача оптимизации примет вид: найти max k ( n , Т ) при ограничениях типа неравенств на технологические параметры
160 об/мин ≤ n ≤ 200 об/мин; 18оС ≤ Т ≤ 35оС. (5)
В виду того, что параметров оптимизации всего два, целесообразно найти оптимальное решение графически (рис. 3).
На рис. 3 параметры Т и n образуют горизонтальную плоскость, а ось k – перпендикулярна плоскости. Штриховкой на горизонтальной плоскости показаны технологические ограничения на орбитальную угловую скорость и температуру среды инкубации родококков. Коэффициент k имеет явную тенденцию к увеличению с повышением температуры и скорости перемешивания. Максимальное значение k находится на границе допустимой области по температуре и имеет тенденцию роста при этой температуре в сторону увеличения скорости перемешивания. В условиях эксперимента k max = 1,233 сут-1 при Т = 35оС и n = 200 об/мин.
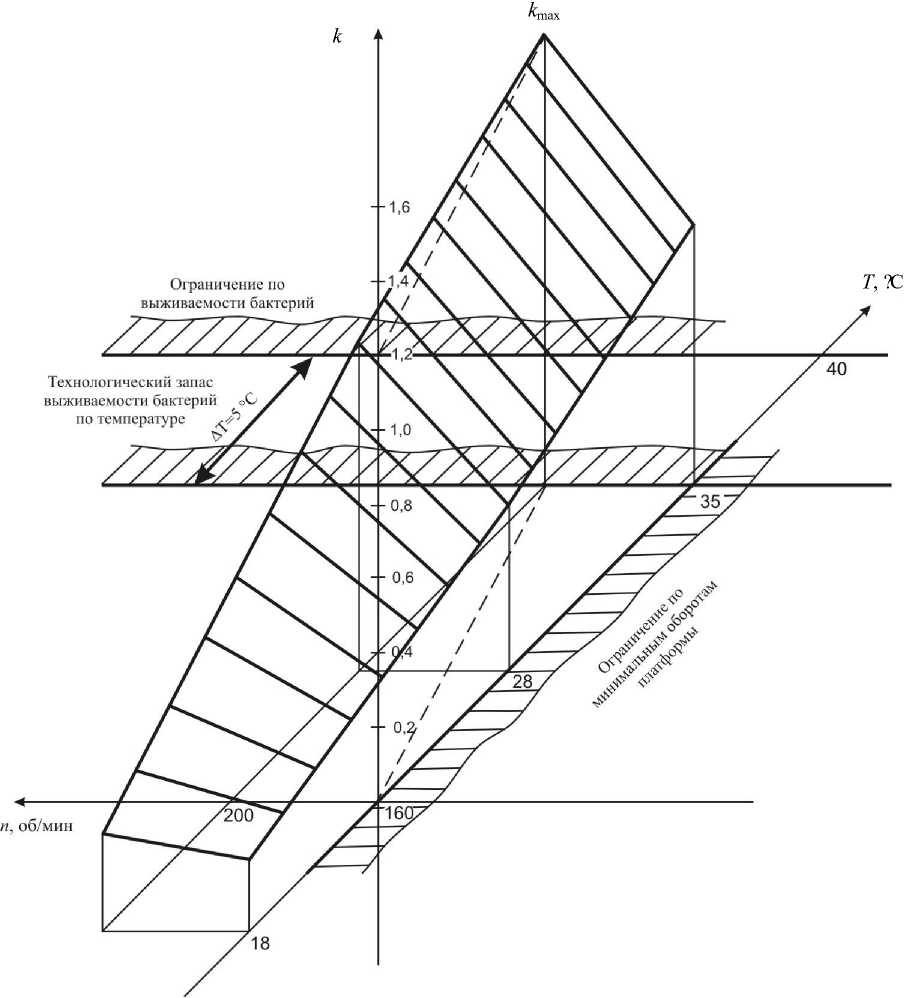
Рис. 3. Зависимость константы скорости реакции k биокаталитического окисления парацетамола клетками R. ruber ИЭГМ 77 от орбитальной угловой скорости вращения шейкера и температуры среды инкубации родококков
Полученное решение задачи оптимизации процесса биодеструкции парацетамола было использовано для перехода к универсальным характеристикам параметров процесса: температуре и скорости перемешивания культуральной жидкости. После определения этих характеристик возможен переход к реальным управляющим технологическими параметрами для проведения процесса в полупромышленных и промышленных условиях. Это обусловлено тем, что температуру в полупромышленной установке (ферментере) (рис. 4) можно привести в соответствие с температурой в лабораторной установке – шейкере (рис. 5), а переход от орбитальной угловой скорости в шейкере к эквивалентной угловой скорости вращения мешалки в ферментере представляется возможным либо через скорость, либо через время перемешивания культуральной жидкости.

Рис. 4. Автоматизированная система Рис. 5. Инкубационный шейкер CERTOMAT IS
«Фермус - 3» (ферментер)
Таблица 2
Результаты определения скорости движения, времени перемешивания и интенсивности перемешивания жидкости в колбе (1) и ферментере (2)
|
Скорость вращения шейкера и мешалки ферментера, об/мин |
Скорость движения жидкости, м/с |
Время перемешивания жидкости, с |
Интенсивность перемешивания, с1 |
|||
|
(1) |
(2) |
(1) |
(2) |
(1) |
(2) |
|
|
160 |
0,64 |
0,17 |
3,0 |
1,0 |
0,33 |
1,00 |
|
200 |
0,85 |
0,23 |
2,5 |
0,7 |
0,40 |
1,43 |
|
240 |
1,10 |
0,33 |
2,0 |
0,5 |
0,50 |
2,00 |
Как видно из табл. 2, экспериментально полученные значения скорости движения жидкости в колбе и ферментере не изменяются строго пропорционально с изменением скорости вращения, однако сохраняют рост с ее увеличением. Этот факт объясняется различным характером движения жидкости в колбе и ферментере. В колбе происходит вращение слоев жидкости, то есть циркуляционное движение по окружности. В ферментере наряду с окружным движением слоев жидкости происходит их перемещение в вертикальном направлении, что улучшает перемешивание жидкости.
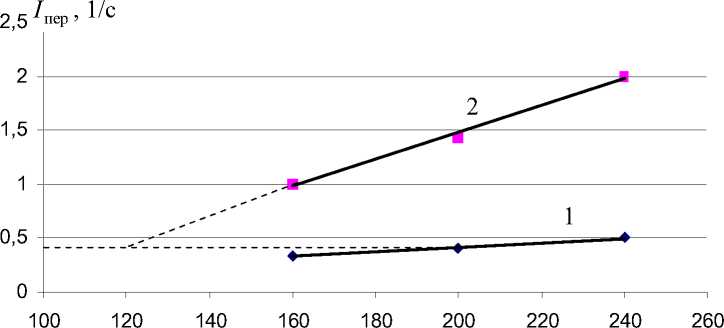
Таким образом, полученные данные по скорости движения жидкости в колбе и ферментере не отражают скорости перемешивания жидкости. В связи с этим предложено использовать вместо скорости перемешивания жидкости интенсивность перемешивания I пер , которая определяется по времени перемешивания. Время перемешивания жидкости в колбе в 3–4 раза больше, чем в ферментере.
Результаты исследования показывают, что чем меньше время перемешивания, тем больше как скорость, так и интенсивность перемешивания жидкости. Следовательно, интенсивность перемешивания отражает скорость перемешивания жидкости. Отсюда появляется возможность связать технические характеристики шейкера и ферментера (орбитальную и угловую скорости) посредством интенсивности перемешивания жидкости.
n , об/мин
Рис. 6. Зависимость интенсивности перемешивания жидкости в колбе (1) и ферментере (2) от скорости вращения шейкера и мешалки ферментера.
Для реализации оптимального значения k max = 1,233 сут-1 при Т = 35оС и n = 200 об/мин в лабораторных условиях необходима интенсивность перемешивания I пер = 0,5 с-1 (рис. 6). Аппроксимируя кривую 2 на рис. 6 прямой, в силу линейности до оптимальной интенсивности перемешивания в колбе (шейкере), находим значение n = 120 об/мин. Это значение можно считать начальной точкой угловой скорости вращения мешалки в ферментере при проведении процесса в полупромышленных условиях. Начальная точка температуры при этом составляет Т = 28оС. Найденные технологические параметры являются начальным приближением для отработки технологии процесса биодеструкции парацетамола в полупромышленных условиях.
Заключение
Установлена зависимость константы скорости реакции биокаталитического окисления парацетамола от технологических параметров процесса: температуры инкубации родококков и орбитальной скорости движения шейкера. Получено решение задачи оптимизации процесса биодеструкции парацетамола в лабораторных условиях. Определены начальные значения технологических параметров (температуры и угловой скорости вращения мешалки ферментера) для проведения процесса в полупромышленных условиях.
Благодарности
Исследования поддержаны грантами РФФИ 04-04-96057, 07-04-96038.


