Математическое моделирование процесса гомогенной конденсации оксида алюминия в смеси с углекислым газом
Автор: Груздь Светлана Анатольевна, Корепанов Михаил Александрович, Чукавина Анна Андреевна
Рубрика: Краткие сообщения
Статья в выпуске: 1 т.13, 2020 года.
Бесплатный доступ
Рассмотрено течение насыщенных паров смеси алюминия, кислорода и углерода в сверхзвуковом сопле. С помощью математической модели расчета равновесного состава гомогенной смеси получены парциальные давления образующихся веществ, включая кластеры оксида. Определены реакции объединения субокислов, которые составляют основную массовую долю, образующихся при конденсации кластеров, полного оксида алюминия. Составлена математическая модель движущегося в сопле сверхзвукового потока в одномерной постановке. Получены расчетные данные по росту радиуса критических зародышей оксида, температуре и суммарному давлению смеси по длине сопла.
Математическое моделирование, гомогенная конденсация, сверхзвуковое сопло, оксид алюминия, субокислы алюминия
Короткий адрес: https://sciup.org/147232980
IDR: 147232980 | УДК: 51-72+519.61 | DOI: 10.14529/mmp200111
Текст краткого сообщения Математическое моделирование процесса гомогенной конденсации оксида алюминия в смеси с углекислым газом
Исследованию горения алюминия и образования его оксида посвящены работы многих авторов [1–5]. Моделирование конденсации оксида алюминия Al 2 O 3 всегда осложнялось тем, что в газообразном состоянии этого вещества не существует [6]. По этой же причине осложнены расчеты получения его кластеров, т.к. распространенные модели конденсации [7, 8] подразумевают конденсацию вещества без изменения химической формулы. Алюминий широко используется в ракетной технике, как часть состава ракетных топлив. Расчеты, связанные с получением состава продуктов сгорания, включают в себя необходимость получения данных по образованию его окислов в движущемся потоке, которые, в свою очередь, осложнены индивидуальными свойствами оксида алюминия. Ранее в работах [9–11] была предложена модель для расчета движущегося насыщенного газа с учетом гомогенной конденсации в соплах, но в виду особенности оксида алюминия применить по аналогии эту модель не представляется возможным. В представленной работе предложена переработанная методика расчета движения насыщенного газа по соплу с учетом агломератов, специально адаптированная для оксида алюминия в среде аргона.
1. Модель образования кластера Al2O3
Ранее в работах [9, 10] была предложена модель для расчета движущегося насыщенного газа с учетом гомогенной конденсации в сверхзвуковых соплах. Данная работа основывается на этой модели с некоторыми доработками, касающиеся особенностей образования оксида алюминия и состава продуктов сгорания. Расчеты условно разделены на два этапа, на первом вычисляется гомогенный состав продуктов сгорания с учетом образующихся кластеров оксида алюминия, на втором с учетом их спонтанной конденсации.
Газообразные продукты горения конденсируются в макроскопические капли жидкого оксида алюминия, получение термодинамических параметров таких кластеров осложнено тем, что A1 2 O 3 в газовой фазе экспериментально не наблюдается, что заставляет менять существующую численную модель гомогенной конденсации. Образование кластеров оксида происходит за счет реакции слипания различных его газообразных окислов, в связи с этим для точного определения термодинамических параметров кластера оксида алюминия необходимо знать – за счет которых именно веществ происходит его образование, а так же состав насыщенной смеси в равновесном и неравновесном состоянии для определения потока массы тех компонентов, которые обеспечивают рост зародышей оксида алюминия. Газообразный оксид алюминия при этом можно считать промежуточным продуктом с коротким периодом существования.
Составляем модель расчета неравновесного состава продуктов сгорания [9], где помимо основных оксидов и окислов, получающихся при сгорании алюминия в среде углекислого газа, присутствуют так же кластеры A1 2 O 3 . Общая система уравнения реакции будет выглядеть как:
' Al + O ^ AlO, 2Al + O ^ AI 2 O, 2Al + 2O ^ Al 2 O 2 , Al + 2O ^ AlO 2 , 2O ^ O 2 ,
< C + O ^ CO, (1)
C + 2O ^ CO 2 ,
4 (2Al + 3O) ^ 4Al 2 O 3 , 7(2Al + 3O) ^ 4Al 2 O 3 , • ••
n(2Al + 3O) ^ nAl2O3, где последние 3 строки - это кластеры размера 4, 7 и до n-го размера, т.е размерный ряд кластеров представлен по аналогии с рядом Фибоначчи, начиная с 4-го размера. Подробно об этом было изложено в работе [9]. Малые агломераты в расчете не учитываются, что позволяет избежать необходимость иметь начальные данные по термодинамическим параметрам субокислов алюминия в газовой фазе, т.к. крупные кластеры рассчитываются по капельной модели [10]. Данные, полученные ранее, показывают, что вклад малых агломератов очень мал, а сверхкритическими кластерами для начала момента спонтанной конденсации являются кластеры размеров от 10 и более. Это все позволило исключить малые агломераты из расчетов [11].
Далее, составляем модель расчета равновесного состава продуктов сгорания, где термодинамические свойства индивидуальных веществ взяты из справочника [13]. Наличие кластеров не учитываются, а образующиеся молекулы оксида алюминия представлены сразу k-фазой. В алгоритме расчетов k-фаза берется как большая молекула, состоящая из 1000 атомов Al2 O3.
Для системы (1) применяем метод расчета равновесного состава смеси [9,12]. Численный эксперимент был проведен для конического сопла с тангенсом угла полураствора 0,1 и с длиной сверхзвуковой части равной 15 см. Соотношение продуктов сгорания алюминия и углекислого газа 1:1. Температура в критике сопла 4100 К, плотность смеси 0,5 кг/м 3 . Моментом начала спонтанной конденсации выбрано число сверхкритических кластеров в количестве 10 15 в 1/м 3 , что для данного сопла наступает при температуре 3987 К, скорость образования сверхкритического кластера 1, 02 · 10 22 зародышей в секунду, состав продуктов сгорания в этом случае представлен парциальными давлениями веществ в таблице:
Таблица
|
Вещество |
Начало конденсации не равновесной |
Начало конденсации равновесной |
∆P |
|
AlO |
0,666 |
0,195 |
0,471 |
|
AlO 2 |
0,023 |
0,005 |
0,018 |
|
Al 2 O |
0,275 |
0,032 |
0,243 |
|
O 2 |
0,675 |
0,396 |
0,279 |
|
Al 2 O 2 |
0,049 |
0,004 |
0,045 |
|
O |
1,184 |
0,875 |
0,309 |
|
CO |
1,439 |
1,495 |
- 0,056 |
|
CO 2 |
0,245 |
0,189 |
0,056 |
|
ΣP |
4,67 |
3,19 |
Конденсация оксида алюминия в присутствии CO 2 идет почти так же, как и в случае чистого кислорода. В обзорной статье [4] представлены основные виды реакций, из которых происходит образование кластеров. Основываясь на результатах этих авторов, а так же анализируя разности парциальных давлений в равновесном и неравновесном состояниях (последний столбец таблицы), делаем вывод, что основной поток массы, для образования кластеров Al 2 O 3 , а так же их роста будет осуществляться за счет 4-х реакций, которые будут вносить наиболее ощутимый вклад:
2AlO + O ↔ Al 2 O 3 ,
Al 2 O + O 2 ↔ Al 2 O 3 , 2AlO + CO 2 ↔ Al 2 O 3 + CO,
Al 2 O + 2CO 2 ↔ Al 2 O 3 + 2CO.
Разница в парциальных давлениях остальных компонентов не значительна, следовательно ощутимого роста массы полного оксида за счет их слияния не будет, поэтому далее в расчетах этими реакциями можно пренебречь.
2. Расчет потока насыщенного газа по соплу с учетом агломератов оксида алюминия
Первый этап численной модели расчета гомогенной конденсации заканчивается моментом образования сверхкритического кластера в достаточном количестве, то есть при N = 10i5 м-3. Второй этап, образование новых агломератов оксида не происходит, идет спонтанный рост существующих за счет реакций (3). Результатом двух последних реакций является выделение побочного продукта -CO.
Первый этап включает в себя следующие уравнения:
– для числа (концентрации) сверхкритических кластеров:
dN
IT = g ’
– для массы сверхкритических кластеров:
dm
If = 0,
– для плотности газовой фазы:
dρ dt
M 2
M 2
- 1
·
ρ · dF · V
F ( x ) dx
-
I g · g cr · m 1 ,
– для температуры потока:
dT _ (k - 1) M 2
It = M 2 - 1
·
dF
F (x) fc ^ V + I g • g cr • m 1 •
T
·
^H cond ρ 0 C V
·
sv
, z
– для скорости потока:
dV dt
M 2
V
-
dF · V,
1 F ( x ) dx
·
·
– для текущей координаты:
dx
dt = ’
– для изменения массовой доли оксидов:
dG
» = 0'
где I g = K k • n g -i • n g -2 — скорость образования сверхкритических кластеров [10,11], n g - 1 и n g - 2 – концентрации докритических кластеров, при коагуляции которых образуется сверхкритический кластер, K k – постоянная скорости коагуляции, g cr – число частиц в сверхкритическом кластере, m – масса кластера, которая после образования достаточного количества сверхкритических кластеров и при начале их роста может быть принята равной массе сверхкритического кластера m o = m i • g cr , или с учетом постепенного накопления сверхкритических кластеров возможно разных размеров, например, при быстром охлаждении (течения в сверхзвуковых соплах) - m o = Р N^ 0 , m 1 = 1oo1g 1 n a — масса моночастицы газа, кг, ^ 1 - мольная масса моногаза, г/моль.
Второй этап включает в себя следующие уравнения:
– для числа (концентрации) сверхкритических кластеров:
dN
IT = 0'
– для массы сверхкритических кластеров (рост в условиях свободномолекулярного режима [8]):
dm dt n cr
+
p 1 - p 1s
/ 2п -R0- T µ 1_1
+
p 1 - p 1s
/ 2п -R0- T
µ 1_2
+
p 2
-
2^
p 2s
+
µ 2_1
p 2 - p 2s
.^ -R0- T
µ 2_2
, (11)
p 3 - p 3s
/ 2п -R0- T µ 3_1
+
p 3 - p 3s
/ 2п -R0- T
µ 3_2
+
p 4
-
p 4s
/ 2n -R0- T µ 4_1
p 4 - p 4s
/ 2п -R0- T
µ 4_2
Г cr = Г 1 •
3 3 · m 4 π m 1 ,
– для плотности газовой фазы:
dp M 2 p dF v n dm
dt M 2 — 1 F (x) dx dt ,
– для температуры потока:
dT = - (k — 1) M 2 ^ T dF V + (dm AH cOnd dt M 2 — 1 F (x) dx dt p 0 CV 1
– для изменения массовой доли оксидов:
dG 1 dm dt ρ0 dt , где в уравнении массы (9) p1 и p1s – значения парциальных давлений неравновесного и равновесного составов того вещества из продуктов 1-й реакции (3), чье изменение в давлении окажется наименьшим, как определено в первом разделе; аналогично для продуктов 2, 3 и 4-й реакций (1.3); µ1_1 и µ1_2 – мольные массы продуктов 1-й реакции (3), µ2_1 и µ2_2 – мольные массы продуктов 2-й реакции соответственно (3), для 3 и 4-й реакций мольные массы компонентов, которые образуют оксид алюминия, т.е без учета мольной массы CO. Уравнения для скорости (5) и текущей координаты сопла (6) остаются неизменными. Во всех уравнениях F(x) - площадь поперечного сечения сверхкритической части сопла (для конического сопла представляет собой линейную функцию от x). В связи с тем что образование агломератов оксида алюминия приводит к уменьшению массовой доли оксидов относительно углекислого газа, то на каждом шаге на обоих этапах помимо пересчета равновесного и неравновесного составов, необходимо еще и учитывать изменение массовой доли оксидов, в связи с чем и вводится в систему уравнение (12).
Обсуждение результатов
Проведен ряд численных расчетов по предложенной модели. На рис. 1 представлены результаты по температуре и давлению потока по длине сопла, а так же радиусу критического кластера. Из графиков видно, что характерное для сверхзвукового сопла падение температуры потока нарушается в момент начала спонтанной конденсации оксида (3987 К), наблюдается резкий скачок температуры, который вполне объясним выделением тепла при переходе вещества от газовой фазы к жидкой. Рост температуры прекращается в момент, когда замедляется рост размера капель конденсата. Схожая картина наблюдается не только с температурой, но и с давлением. На рис. 1 четко наблюдается отклонение давления в момент начала роста капель.
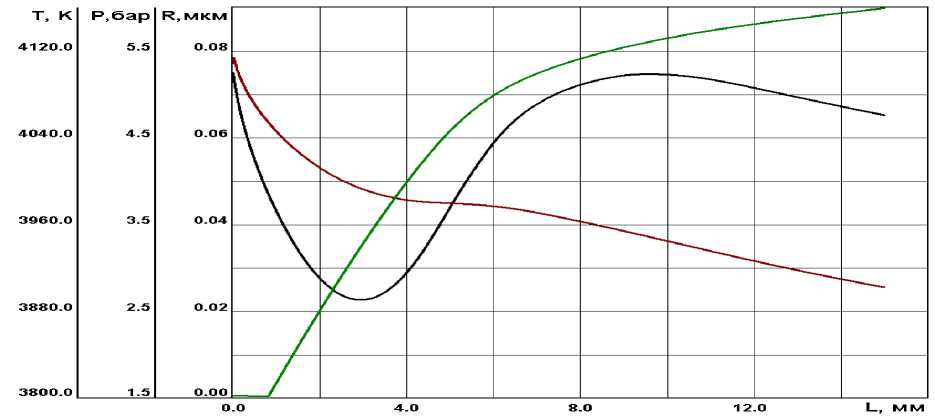
Рис. 1 . Температура, давление и радиус частиц оксида алюминия
В [1, 3] отмечается, что оксид алюминия, образующийся из газовой фазе, имеет субмикронный размер, а согласно полученным расчетным значениям (см. рис. 2) средний радиус образовавшейся капли, после момента спонтанной конденсации, достигает размеров порядка 0, 1 мкм. Из рис. 3 видно, что с ростом частиц оксида алюминия парциальные давления субокислов алюминия приближаются к своим равновесным значениям.
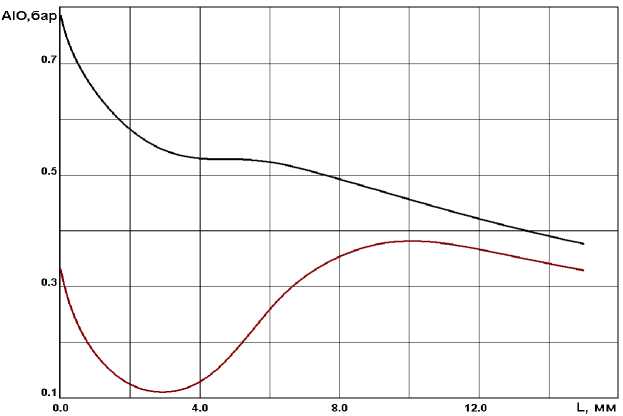
Рис. 2 . Парциальные давления AlO (равновесное и неравновесное)
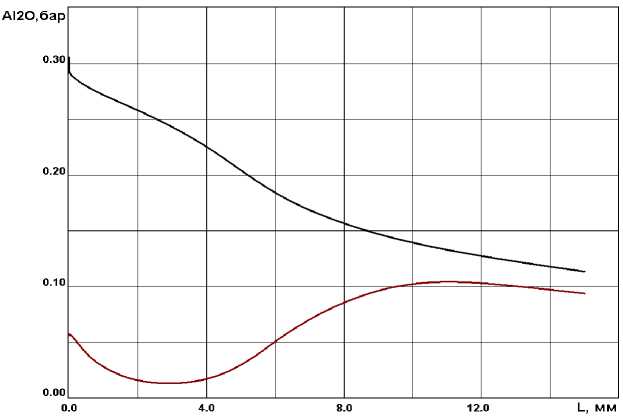
Рис. 3 . Парциальные давления Al 2 O (равновесное и неравновесное)
Публикация подготовлена в рамках работ по проекту 13.06.01/18КМА, реализуемому на основании Приказа ректора ИжГТУ имени М.Т. Калашникова от 29 декабря 2018 г. № 1493.
Список литературы Математическое моделирование процесса гомогенной конденсации оксида алюминия в смеси с углекислым газом
- Похил, П.Ф. Горение порошкообразных металлов в активных средах / П.Ф. Похил, А.Ф. Беляев, Ю.В. Фролов, В.С. Логачев, А.И. Коротков. - М.: Наука, 1972.
- Бабук, В.А. Моделирование эволюции высокодисперсного оксида в составе потока продуктов сгорания алюминизированного твердого топлива / В.А. Бабук, Н.Л. Будный // Химическая физика и мезоскопия. - 2017. - Т. 19, № 1. - С. 5-19.
- Малинин, В.И. Внутрикамерные процессы в установках на порошкообразных металлических горючих: дис. док. техн. наук / В.И. Малинин. - Екатеринбург; Пермь: УрО РАН, 2006.
- Бекстед, М.В. Математическое моделирование горения одиночной алюминиевой частицы / М.В. Бекстед, У. Лианг, К.В. Паддуппаккам // Физика горения и взрыва. - 2005. - Т. 41, № 6. - C. 15-33.
- Savel'ev, A.M. The Formation of (Al2O3)n Clusters as a Probable Mechanism of Aluminum Oxide Nucleation During the Combustion of Aluminized Fuels: Numerical Analysis / A.M. Savel'ev, A.M. Starik // Combustion and Flame. - 2018. - № 196. - P. 223-236.
- Сандарам, Д. Горение наночастиц алюминия (обзор) / Д. Сандарам, В. Янг, В.Е. Зарко // Физика горения и взрыва. - 2015. - Т. 51, № 2. - С. 37-63.
- Анисимов, М.П. Нуклеация: теория и эксперимент / М.П. Анисимов // Успехи химии. - 2003. - Т. 72, № 7. - С. 664-705.
- Гидаспов, В.Ю. Модели образования наночастиц в потоках газа: учебно-методический комплекс / В.Ю. Гидаспов, У.Г. Пирумов, И.Э. Иванов, Н.С. Северина. - Калуга; Москва: Эйдос, 2011.
- Корепанов, М.А. Моделирование течений с гомогенной конденсацией / М.А. Корепанов, С.А. Груздь // Химическая физика и мезоскопия. - 2015. - Т. 17, № 1. - С. 55-63.
- Корепанов, М.А. Моделирование гомогенной конденсации с учетом квазиравновесной концентрации малых агломератов / М.А. Корепанов, С.А. Груздь // Химическая физика и мезоскопия. - 2014. - Т. 16, № 1. - С. 63-67.
- Корепанов, М.А. Математическое моделирование турбулентных течений с гомогенной конденсацией в сверхзвуковых соплах / М.А. Корепанов, С.А. Груздь // Химическая физика и мезоскопия. - 2016. - Т. 18, № 3. - С. 370-380.
- Алемасов, В.Е. Теория ракетных двигателей / В.Е. Алемасов, А.Ф. Дергалин, А.П. Тишин. - М.: Машиностроение, 1969.
- Термодинамические свойства индивидуальных веществ. Справочное издание / Л.В. Гурвич, И.В. Вейц, В.А. Медведев. - М.: Наука, 1978.


