Механизм коррозионного процесса углеродистой стали в водно-солевой агрессивной среде
Автор: Сикачина А.А.
Журнал: Juvenis scientia @jscientia
Рубрика: Химия
Статья в выпуске: 1, 2016 года.
Бесплатный доступ
В рамках научной работы квантовохимическим методом производится исследование механизма коррозии стали в агрессивной водно-солевой среде, порождаемой 30%-ным раствором азотнокислого аммония. Представлен смоделированный полуэмпирического метода ZINDO/1 процесс адсорбции неорганических ионов на кластере железа (имеющегося в стали в количестве 97%). В процессе исследования были получены и проанализированы: составы полученных комплексов, плотности зарядов на атоме железа полученных комплексов, график, отображающий зависимость заряда центрального ионообразующего атома от скорости коррозии.
Азотнокислый аммоний, скорость коррозии, электрохимическая коррозия, адсорбция, сталь ст3, парциальные эффективные заряды, плотность заряда
Короткий адрес: https://sciup.org/14110071
IDR: 14110071
Текст научной статьи Механизм коррозионного процесса углеродистой стали в водно-солевой агрессивной среде
Методика проведения эксперимента: В рамках статьи исследовались гетерогенные системы открытого термодинамического типа «Ст3/дистиллированная вода» и «Ст3/NH4NO3, 30%».
Реализуемая технология проведения численного эксперимента описана в [2]. Размер металлокластера указывается по тексту работы.
Данные по скорости коррозии, полученной по определенной методике, были взяты из [1, с. 48].
При задании исходной структуры, в файле-задании был учтен мезомерный эффект по структуре иона. В работе контролировались следующие дескрипторы электронной структуры: заряды на гетероатомах (by Mulliken) q, плотность заряда (на 1 атом железа) Feρq и состав получившихся соединений FexL, где L – неорганические ионы.
Результаты и обсуждение: в гетерогенной системе «Ст3/дистиллированная вода», имеющая рН = 5, часть молекул воды присутствует в форме гидроксониевых ионов, поэтому появляется адсорбционный комплекс состава Fe[H3O+] (треугольная структура) (Feρq = - 0,081, поэтому вызываемая ионизация лимитируется лишь величиной рН) и адсорбционный комплекс состава Fe4[H2O] (Feρq = - 0,120). Низкая скорость коррозии объясняется преобладающим присутствием последнего (тетраэдрической формы)1, что представлено на рис. 12:
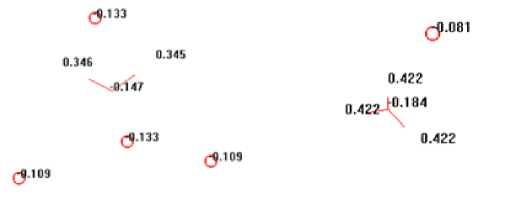
Рис. 1. Комплексы, порождаемые преобладающими в системе «Ст3/ дистиллированная вода» ионами с обозначениями их парциальных эффективных зарядов
В гетерогенной системе «Ст3/NH4NO3, 30%», имеющая рН = 5 появляется адсорбционный комплекс состава Fe[H4N+]3 треугольной конфигурации (Feρq = - 0.106, что говорит о прочности связи Fe-N и образовании пленок на металле), что представлено на рис. 2:
0.106
0.325 0 325

0.306 0 325
Рис. 2. Один из комплексов, порождаемый преобладающими в системе «Ст3/NH4NO3, 30%» ионами с обозначениями их парциальных эффективных зарядов
Также образуется адсорбционный комплекс состава Fe8[O3N—] (Feρq = - 0.194), рассмотренный ниже.
При сравнении состава комплексов Fe8[O3N—] и Fe4[H2O] очевидно, что при однопорядковых величинах плотности заряда в комплексе Fe4[H2O] атомы железа получают большую электронную плотность, учитывая, что их четыре, чем в первом комплексе, несмотря на присутствие в таковом сильного отрицательного заряда.
Наиболее неоднозначная ситуация прослеживается с анионом нитрата NO3— , адсорбирующегося на стали по реакции (используемый на данном этапе кластер состоял из 8 атомов железа), что представлено на рис. 3:
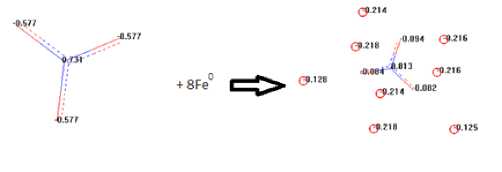
Рис. 3. Второй из комплексов (справа), порождаемый преобладающими в системе «Ст3/NH4NO3, 30%» ионами с обозначениями их парциальных эффективн4ых 3зарядов. Механизм его появления
Очевидно, что по модулю заряды на гетероатомах NO3— по модулю не очень отличаются, поэтому и окислительные свойства такового в растворе незначительны. Другое происходит с частицей ад -NO3— в составе Fe8[O3N—], где резко возрастают заряды атомов кислорода и азота. Адсорбируясь, нитрат-а-нион восстанавливается на катодных участках поверхности стали, с генерацией катионов из атомов железа (металла) в таковой (используемый на данном этапе кластер состоял из 6 атомов железа), что представлено на рис. 4:
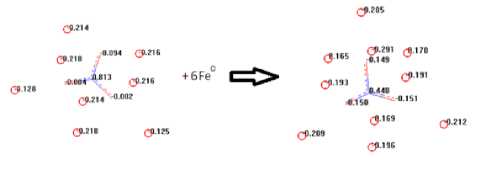
Рис. 4. Адсорбция Fe8[O3N—] на металлокластере, порождающая растворение стали
Происходит образование Fe10 [O3N—] (Feρq = - 0.099) с сильным понижением заряда центрального ионообразующего атома (процесс восстановления) и повышением заряда атомов кислорода. Катионы железа несут заряды порядка 0,16. Во-вторых, явно наличествует высокая плотность заряда на железе, что в [3, с. 49] является основополагающим в миссии защиты от коррозии. Следовательно, именно первое явление является в данном случае основополагающим.
Адсорбционный комплекс состава Fe10[O3N—] благодаря
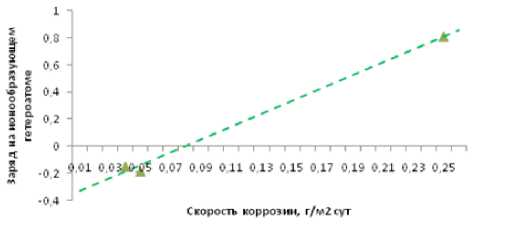
Рис. 5. Зависимость окислительных свойств нитрат-иона от скорости коррозии крайне низкому значению Feρq неустойчив и ионизируется:
Fe10[O3N—] = Fe0.165 + Fe0.169 + Fe0.170 + Fe7[O3N—]
Плотность заряда в Fe7[O3N—] равна - 0,214, т.е. резко повышается. Таким образом, с каждых 8 атомов железа, защищенных от окисления, 3 атома железа таковому подвергаются, а это основа коррозионного процесса.
Адсорбционный комплекс состава Fe[H4N+] является ингибирующим процесс растворения металла — более сильно ингибирующим, чем адсорбционный комплекс состава Fe[H3О+], что объясняется более высокой плотностью заряда на железе первого комплекса, тогда как второй имеет значительную тенденцию к распаду.
Согласно графической зависимости «скорость коррози-и-заряд» изображенной на рис. 5, очевидно, что при повышении окислительных свойств аниона соли (повышении заряда центрального атома) скорость коррозии возрастает. Полное отсутствие коррозии (путем ингибирования) фиксируется при заряде центрального ионообразующего атома -0.400.
Список литературы Механизм коррозионного процесса углеродистой стали в водно-солевой агрессивной среде
- Коррозия углеродистой стали в 30-процентном растворе аммиачной селитры /О. П. Мансуров //Молодой ученый. -2015. -№5. -С. 47-50.
- Сикачина А.А., Белоглазов С.М. Исследование сульфаниламидов на предмет возможности к адсорбции на стали//Электронное научное издание «AUDITORIUM». -Курск: Изд-во Курского Государственного Университета -№4 (2015).
- Сикачина А.А. Квантов химическое моделирование адсорбции органических соединений на стали марки Ст3 /А. А. Сикачина//Современная химия: Успехи и достижения: материалы междунар. мол. науч. конф. (г. Санкт-Петербург, июль 2015 г.). -Чита, 2015. -С. 49.


