Механизм образования наноструктурированного порошка нитрида титана в режиме самораспространяющегося высокотемпературного синтеза в системе "гексафтортитанат аммония-азид натрия"
Автор: Амосов А.П., Бичуров Г.В., Титова Ю.В., Шиганова Л.А.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Физика и электроника
Статья в выпуске: 3-1 т.11, 2009 года.
Бесплатный доступ
Содержатся результаты экспериментально-теоретических исследований процесса синтеза нитрида титана в системе "гексафтортитанат аммония - азид натрия" в режиме горения. Определены параметры горения и синтеза, установлен механизм образования нитрида титана. Показано, что нитрид титана кристаллизуется в виде наноструктурированного порошка.
Нитрид титана, горение, азид натрия, нанопорошок
Короткий адрес: https://sciup.org/148198578
IDR: 148198578 | УДК: 775-798.2
Текст научной статьи Механизм образования наноструктурированного порошка нитрида титана в режиме самораспространяющегося высокотемпературного синтеза в системе "гексафтортитанат аммония-азид натрия"
СВС в качестве азотируемого элемента не газообразный азот, а галоидную соль, содержащую титан и аммонийный радикал, а в качестве азотирующего реагента - азид натрия (режим СВС-Аз). В этом случае процесс образования нитрида титана будет проходить в газовой фазе, и получение нанопорошка нитрида титана становится возможным [9-11]. При этом стехиометрическое уравнение реакции будет выглядеть следующим образом: (NH 4 ) 2 TiF 6 + 6 NaN 3 = TiN + 6 NaF + 4 H 2 ↑ + 9,5 N 2 ↑ .(1)
Целью работы является определение условий синтеза наноразмерного порошка нитрида титана и установление механизма его образования.
В связи с отсутствием в исследуемой системе горючего элемента (металлического титана), дающегося основной тепловой эффект в типовых реакциях [9-11], были выполнены термодинамические расчеты возможности осуществления реакции (1). Расчёт температуры горения проводится в предположении отсутствия теплопотерь и с учетом полного превращения реагентов в системах. Основным условием для определения температуры горения является равенство энтальпий исходных веществ при начальной температуре Т0 и конечных продуктов при температуре Тад. Это означает, что всё выделившееся при реакции тепло идёт на нагрев продуктов горения от начальной температуры до температуры горения. Расчет адиабатической температуры горения этой системы проводился с учетом 100%-ного превращения реагентов в конечные продукты синтеза.
В табл. 1 представлена зависимость адиабатической температуры горения и равновесных концентраций продуктов синтеза от содержания галоидной соли в системе “n(NH4)2TiF6 + 6NaN3”.
Из табл. 1 видно, что адиабатическая температура горения в зависимости от содержания галоидной соли в системе находится в пределах 400-
Таблица 1. Зависимость адиабатической температуры горения и равновесных концентраций продуктов синтеза от содержания галоидной соли в системе “n(NH4)2TiF6 + 6NaN3”
|
n(NH 4 ) 2 TiF 6 , моль |
Т ад , К |
D = о 3 |
NaF, моль |
TiN, (т) |
Na, (г) |
N 2 , (г) |
H 2 , (г) |
Энтальпия, кДж |
||
|
г |
ж |
т |
||||||||
|
1 |
1947,24 |
7,65 |
0,06 |
5,88 |
1,00 |
0,06 |
3,50 |
3,97 |
-2456,71 |
|
|
1,01 |
1943,44 |
7,69 |
0,06 |
5,91 |
1,01 |
0,03 |
3,51 |
3,99 |
-2482,57 |
|
|
1,05 |
1901,21 |
7,93 |
0,05 |
5,95 |
1,05 |
0,01 |
3,53 |
4,05 |
-2586,40 |
|
|
1,1 |
1838,04 |
8,28 |
0,03 |
5,97 |
1,10 |
0,002 |
3,55 |
4,10 |
-2716,17 |
|
|
1,2 |
1714,28 |
9,01 |
0,01 |
5,99 |
1,20 |
3,60 |
4,20 |
-2973,74 |
||
|
1,5 |
1374,75 |
11,25 |
6,00 |
1,50 |
3,75 |
4,50 |
-3748,92 |
|||
|
2 |
1127,27 |
15,00 |
6,00 |
2,00 |
4,00 |
5,00 |
-5041,18 |
|||
|
3 |
412,68 |
22,50 |
6,00 |
3,00 |
— |
4,50 |
6,00 |
-7628,35 |
||
1950 К. В тоже время известно [1, 2], что полное образование нитрида титана наблюдается при температуре не ниже 1450 К. Поэтому наиболее приемлемыми системами для синтеза нитрида титана являются системы с содержанием галогенида от стехиометрического1,0 моля до 1,2 моля. Побочными продуктами реакции (1) в данном случае являются фторид натрия NaF, водород и азот.
Экспериментальная часть работы сводилась к проведению синтеза нитрида титана в реакторе постоянного давления объемом 4,5 литра [9]. Образцы со смесью “n(NH4)2TiF6 + 6NaN3” в насыпном виде устанавливались в рабочую часть реактора. К верхнему торцу образцов подводилась вольфрамовая спираль, после чего инициировалось горение и синтез нитрида титана путем кратковременной подачи электрического импульса на вольфрамовую спираль. Давление азота в реакторе составляло 4 МПа. Образцы имели диаметр 30 мм и высоту 45 мм. В каждый образец вводились вольфрам-рениевые термопары, связанные с аналого-цифровым преобразователем, предназначенные для регистрации температуры и скорости горения. Результаты экспериментов, представляющие зависимость температуры горения (Т), скорости горения (U), кислотно-щелочного баланса промывной воды (полнота прохождения реакции - рН), относительного количества газовыделения (скачок давления в реакторе DР), выхода нитрида титана от содержания галоидной соли в системе “n(NH4)2TiF6 + 6NaN3” представлены в табл. 2.
Из табл. 2 видно, что температура и скорость горения, а также практический выход нитрида титана и скачок давления в реакторе с увеличением содержания галогенида в системе падают, в то время как по теории выход нитрида титана должен возрастать. Такое противоречие объясняется тем, что при понижении температуры записанные в первом столбце таблицы реакции реализуются не полностью, не до конца, причем чем ниже температура, тем меньше степень превращения исходных реагентов в целевой продукт реакции. Необходимо отметить, что образование нитрида титана, близкое к теоретическому, наблюдается уже при температурах горения порядка 950 °С, что объясняется повышенной активностью реагентов в зоне горения при этих температурах и наличием промежуточных реакций при участии натрия. Под активностью реагентов следует понимать наличие в зоне реакции атомарного азота, который образуется при термическом разложении азида натрия [12].
Максимальный выход нитрида титана наблюдается при n=1,0-1,2. При содержании галоидной соли n=1,5-3,0 моля горение системы становится нестабильным и некоторые образцы сгорают не полностью. Кислотно-щелочной баланс промывной воды переходит из щелочной среды в кислую за счет образования HF.
Типичный вид осциллограммы горения смеси при синтезе нитрида титана выглядит следующим образом (рис. 1).
Рентгенофазовый анализ проводили на рентгеновском дифрактометре “Дрон-3,0” с использованием Ka излучения медного и кобальтового анодов. Образцы снимались в интегральном режиме со скоростью счетчика 1-2 градуса в минуту и со скоростью ленты 720 мм в час в интервале углов 2q с 20 до 80 градусов. Режим съемки: напряжение 28 кВт, сила тока 8-10 мА, щели Соллера с углом расходимости 1°30', щели на трубке 2 x 8 мм, щели на детекторе 0,25 мм. Съемка проводилась с вращением при наличии b-фильтра. Расшиф-
Таблица 2. Зависимость выходных параметров горения и синтеза от содержания галоидной соли в системе “n(NH4)2TiF6 - NaN3”
|
Систем а |
Т, ° С |
U, см/с |
рН |
А Р, МПа |
Выход TiN, г |
|
|
теор. |
практ. |
|||||
|
(NH 4 ) 2 TiF 6 +6NaN 3 = =TiN+6NaF+9,5N 2 +4H 2 |
1080 |
0,76 |
12-10 |
1,5 |
2,28 |
2,26 |
|
1,01(NH 4 ) 2 TiF 6 +6NaN 3 = =1,01TiN+6NaF+9,505N 2 +4,01H 2 +0,06H F |
1080 |
0,70 |
12-10 |
1,5 |
2,32 |
2,27 |
|
1,05(NH 4 ) 2 TiF 6 +6NaN 3 = =1,05TiN+6NaF+9,525N 2 +4,05H 2 +0,3HF |
1020 |
0,6 |
11-10 |
1,5 |
2,36 |
2,31 |
|
1,1(NH 4 ) 2 TiF 6 +6NaN 3 = =1,1TiN+6NaF+9,55N 2 +4,1H 2 +0,6HF |
950 |
0,5 |
10 |
1,4 |
2,43 |
2,33 |
|
1,2(NH 4 ) 2 TiF 6 +6NaN 3 = =1,2TiN+6NaF+9,6N 2 +4,2H 2 +1,2HF |
920 |
0,45 |
8 |
1,2 |
2,58 |
2,01 |
|
1,5(NH 4 ) 2 TiF 6 +6NaN 3 = =1,5TiN+6NaF+9,75N 2 +4,5H 2 +3HF |
850 |
0,40 |
8 |
1,0 |
3,38 |
1,85 |
|
2(NH 4 ) 2 TiF 6 +6NaN 3 = =2TiN+6NaF+10N 2 +5H 2 +6HF |
820 |
0,36 |
6 |
1,0 |
3,53 |
1,09 |
|
3(NH 4 ) 2 TiF 6 +6NaN 3 = =3TiN+6NaF+10,5N 2 +6H 2 +12HF |
710 |
0,17 |
4-3 |
0,9 |
3,96 |
0,54 |
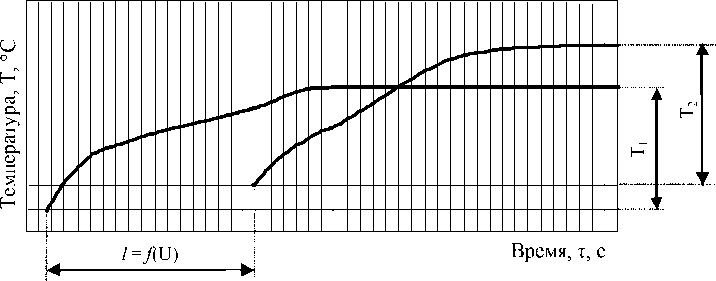
Рис. 1. Типичный вид осциллограммы горения системы “n(NH4)2TiF6 - NaN3” T1 - температура горения, зафиксированной первой термопарой; T2 - температура горения, зафиксированной второй термопарой ;
l - расстояние между термопарами в образце
ровка рентгенограмм проводилась с помощью картотеки Американского Общества Испытания Материалов (ASTM) как расчетным путем, так и по компьютерной программе “Xrayan”. Результаты рентгенофазового состава продуктов исследуемых реакций представлены в табл. 3.
Сравним фазовый состав нитрида титана, синтезированного при n=1 (стехиометрическое соотношение исходных компонентов) и при n=2 (рис. 2).
Из рис. 2 видно, что при одинаковых условиях промывки при n=1 получается чистый нитрид титана, а при n=2 - его не удается полностью отмыть от гексафтортитаната натрия. В то время как фторид натрия в обоих случаях удаляется промывкой полностью. Необходимо отметить, что в непромытом нитриде титана, синтезированном при стехиометрическом соотношении компонентов (n=1), распределение фаз в целевом продукте соответствует соотношению
NaF > TiN, а при n=2 - NaF > Na3TiF6 > TiN.
Исследование размера и топографии поверхности порошка нитрида титана проводилось с помощью растрового электронного микроскопа JSM-6390A фирмы “Jeol”. Топография поверхности и размеры частиц порошка нитрида титана, синтезированного в системе n(NH4)2TiF6 - 6NaN3, приведены на рис. 3.
Из представленных фотографий видно, что при стехиометрическом соотношении компонентов в системе (n=1), нитрид титана синтезируется в виде частиц, состоящих из нитевидных кристаллов диаметром не более 100 нм, которые можно классифицировать как нановолокно. При n=1,01-1,05 порошок нитрида титана представляет собой частицы со структурой, в которой наблюдается переход от нановолокон к нанокристаллитам со средним размером 100-200 нм. При n=1,1-1,5 порошок нитрида титана представляет собой смесь нано- и субмикронных кристал-
Табл . 3. Фазовый состав продукта синтеза нитрида титана
|
Уравнение химической реакции |
Фазовый состав продуктов горения |
|
(NH 4 ) 2 TiF 6 + 6NaN 3 = TiN + 6NaF + 9,5N 2 + 4H 2 |
TiN, NaF |
|
1,01(NH 4 ) 2 TiF 6 + 6NaN 3 = 1,01TiN + 6NaF + 9,505N 2 + 4,01H 2 + 0,06HF |
TiN, NaF |
|
1,05(NH 4 ) 2 TiF 6 + 6NaN 3 = 1,05TiN + 6NaF + 9,525N 2 + 4,05H 2 + 0,3HF |
TiN, NaF |
|
1,1(NH 4 ) 2 TiF 6 + 6NaN 3 =1,1TiN + 6NaF + 9,55N 2 + 4,1H 2 + 0,6HF |
TiN, NaF |
|
1,2(NH 4 ) 2 TiF 6 + 6NaN 3 = 1,2TiN + 6NaF + 9,6N 2 + 4,2H 2 + 1,2HF |
TiN, NaF |
|
1,5(NH 4 ) 2 TiF 6 + 6NaN 3 = 1,5TiN + 6NaF + 9,75N 2 + 4,5H 2 + 3HF |
TiN, NaF, Na 3 TiF 6 |
|
2(NH 4 ) 2 TiF 6 + 6NaN 3 = 2TiN + 6NaF + 10N 2 + 5H 2 + 6HF |
TiN, NaF, Na 3 TiF 6 |
|
3(NH 4 ) 2 TiF 6 + 6NaN 3 = 3TiN + 6NaF + 10,5N 2 + 6H 2 + 12HF |
TiN, NaF, Na 3 TiF 6 |
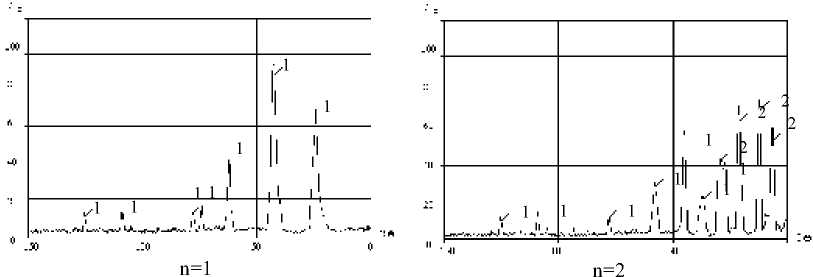
Рис. 2. Рентгенограммы промытого нитрида титана, синтезированного в системе “n(NH4)2TiF6 - 6NaN3” : 1 – TiN; 2 – Na3TiF6
литов. При n>1,5 конечный продукт синтеза, представляющий собой смесь нитрида титана с полупродуктами, имеет частицы неправильной формы субмикронных и наноразмеров.
На основании результатов исследования размеров и топографии частиц нитрида титана можно сделать вывод о том, что в системе “гексаф-тортитанат аммония - азид натрия” порошок нитрида титана получается в виде наноструктурированных частиц. Эти частицы могут иметь нановолокнистую структуру с диаметром волокон 50-100 нм и нанокристалличес-кую структуру со средним размером кристаллитов 100-200 нм.
Цвет синтезированного порошка нитрида титана преимущественно черный с частичками золотистого, который наблюдается во внутренних слоях образца. Черный цвет указывает на то, что размер частиц нитрида титана менее 1 мкм, а золотистый – на спекание частиц во внутренних слоях образца. Частиц, имеющих золотистый цвет, в общей массе порошка нитрида титана содержится не более 1 %.
С целью установления механизма образования нитрида титана в системе “n(NH4)2TiF6 -6NaN3” воспользуемся результатами экспериментов, связанных с закалкой образцов и результатами рентгенофазового анализа. Метод закал- ки основан на резком сбросе давления азота в реакторе с 4 МПа до 0,1-0,2 МПа в процессе синтеза с последующей остановкой фронта горения и анализом промежуточных продуктов реакции в образовавшемся слое.
Результаты рентгенофазового анализа промежуточных продуктов горения свидетельствует о наличии следующих фаз: фторида натрия, гексафтортитаната натрия, титана и нитрида титана. Причем NaF > Na3TiF6 > Ti > TiN.
На основании полученных экспериментальных результатов можно сформулировать стадийность образования наноструктурированного порошка нитрида титана системе “гексафтортита-нат аммония – азид натрия”.
Фазовый переход в (NH4)2TiF6 начинается при температуре 650 °C [13,14], а в азиде натрия – при 300 °C [12]. Поэтому первую реакцию стадийности образования нитрида титана из исследуемой системы можно записать, как термическое разложение азида натрия:
6 NaN3 → 6 Na + 9 N2 ↑ .
Образовавшийся натрий вступает в реакцию с (NH4)2TiF6, замещая аммонийный радикал с выделением аммиака [13,14]:
-
3 Na + (NH4)2TiF6 → Na3TiF6 + 2 NH3- + H2 ↑ .
Затем часть оставшегося натрия вступает в реакцию восстановления с частью образовавше-

n = 1

n = 1,01

n = 1,05

n = 1,1

n = 1,2

n = 1,5

n = 2
Рис. 3. Топография поверхности микро- и нанопорошка нитрида титана, синтезированного в системе n(NH4)2TiF6 - 6NaN3

n = 3
гося гексафтортитаната натрия. Эта реакция известна как реакция получения титана [9,10] и проходит при температурах не выше 600°C:
-
3 Na + x Na3TiF6 → x Ti + 6x NaF + 3(1-x) Na ↑ .
Оставшаяся часть гексафтортитаната натрия в присутствии HF вступает в реакцию термического разложения с образованием TiF3. Фторид водорода и частичное образование нитрида титана могут проходить параллельно. Эти реакции описаны в работах [9-14] и проходят при температурах 600-1100°C:
(1-x) Na3TiF6 → (1-x) TiF3 + 3(1-x) NaF.
(1-x) TiF3 + 2 NH3 → (1-x) TiN + 3(1-x) HF ↑ + 1,5(1+x) H2- + 0,5(1-x) N2 ↑
3(1-x) HF + 3(1-x) Na → 3(1-x) NaF + 1,5(1-x) H2 ↑ .
Другая часть нитрида титана образуется по реакции:
x Ti + 0,5x N2 → x TiN (~1100°C).
Суммарная реакция имеет вид:
(NH4)2TiF6 + 6 NaN3 → [x TiN + (1-x) TiN] + [6x NaF + 3(1-x) NaF + 3(1-x) NaF] +
-
+ [H2 + 1,5 (1+x) H2 +1,5 (1-x) H2] + [9 N2 -0,5x N2 + 0,5x N2]
или
(NH4)2TiF6 + 6 NaN3 → TiN + 6 NaF + 4 H2 ↑ + 9,5 N2 ↑ .
Все представленные химические реакции являются полуколичественной оценкой представленной химической стадийности и механизма образования нитрида титана в системе “гек-сафтортитанат аммония - азид натрия” в режиме горения и рассматриваются как наиболее вероятные.
ВЫВОДЫ
-
1. Использование системы “гексафтортита-нат аммония (NH4)2TiF6 - азид натрия NaN3” в процессе СВС позволило получить нанострук-
- турированный порошок нитрида титана с частицами нановолокнистой структуры с диметром волокон 50-100 нм и нанокристаллической структуры со средним размером кристаллитов 100-200 нм.
-
2. Произведены термодинамические расчеты, свидетельствующие о возможности образования нитрида титана в системе “гексафтортитанат аммония - азид натрия”.
-
3. Выявлено влияние содержания галоидной соли в исходной смеси порошков на характеристики горения и продуктов синтеза.
-
4. Установлен механизм образования нитрида титана в системе “гексафтортитанат аммония - азид натрия” в режиме горения.
Работа выполнена при финансовой поддержке проекта 2.1.2/2483 Аналитической ведомственной целевой программы Рособразования “Развитие научного потенциала высшей школы” на 2009-2010 годы.
Список литературы Механизм образования наноструктурированного порошка нитрида титана в режиме самораспространяющегося высокотемпературного синтеза в системе "гексафтортитанат аммония-азид натрия"
- Самсонов Г.В. Нитриды.-Киев: Наукова думка, 1969. 380 с.
- Самсонов Г.В., Кулик О.П., Полищук В.С. Получение и методы анализа нитридов.-Киев: Наукова думка, 1978. 320 с.
- А.с. №255221 (СССР). Способ синтеза тугоплавких неорганических соединений/Мержанов А.Г., Шкиро В.М., Боровинская И.П.-Заявл. 1967. -1170735, опубл. БИ, №10.-1971.
- Мержанов А.Г., Боровинская И.П., Шкиро В.М. Явление волновой локализации автотормозящихся твердофазных реакций: Открытия СССР//Бюл.изобр.-1984.-№ 32.-С.3.
- Мержанов А.Г., Боровинская И.П. Самораспространяющийся высокотемпературный синтез тугоплавких неорганических соединений//Докл. АН СССР. 1972. т.204. -№ 2. С.366-369.
- Мержанов А.Г., Боровинская И.П., Володин Ю.Е. О механизме горения пористых металлических образцов в азоте//Докл. АН СССР, 1972. т.206. № 4. C.905-908.
- Концепция развития самораспространяющегося высокотемпературного синтеза как области научно технического прогресса/Сб.науч.статей под ред.А.Г.Мержанова. Черноголовка: Территория, 2003. 368 с.
- Амосов А.П., Боровинская И.П., Мержанов А.Г. Порошковая технология самораспространяющегося высокотемпературного синтеза материалов: Учебное пособие. М.: Машиностроение 1, 2007. 568 с.
- Амосов А.П., Бичуров Г.В. Азидная технология самораспространяющегося высокотемпературного синтеза микро и нанопорошков нитридов: Монография. М.: Машиностроение 1, 2007. 526 с.
- George Bichurov. The use of halides in SHS azide technology/International journal Self Propagating High Temperature Synthesis. Vol.9. № 2. 2000. pp.247-268.
- Амосов А.П., Бичуров Г.В., Шиганова Л.А., Родина Т.Ю. Перспективы применения азидных систем для самораспространяющегося высокотемпературного синте за нитридов при использовании галоидных солей различных классов//Вестник машиностроения. -№ 3. 2006. М.: Машиностроение, 2006. С.54-55.
- Бирюков А.С., Булатов Е.Д., Гридин С.А. Элементарные процессы при термическом разложении азида натрия//Химическая физика. 1985. том 4. № 1. С.79-87.
- Горощенко Я.Г. Химия титана. Киев: Наукова думка, 1970. 415 с.
- Лучинский Г.П. Химия титана. М: Химия, 1971. 470 с.


