Механизм развития генитального пролапса после гистерэктомии у женщин Узбекской популяции
Автор: Шомиров Дилшод Абдухамидович, Надырханова Наталья Суратовна, Нишанова Фируза Пулатовна
Журнал: Re-health journal @re-health
Рубрика: Акушерство и гинекология
Статья в выпуске: 3 (19), 2023 года.
Бесплатный доступ
Данная статья посвящена актуальным проблемам гинекологии, как генитальный пролапс после гистероэктомии. Обледовано 121 женщин в возрасте от 26 до 64 лет. В ходе исследования этих женщин разделили на 2 группы: основную группу 91 женщин с ГППГЭ, а контрольную группу 30 здоровых женщин без пролапса гениталии. По результатам молекулярно-генетического исследования, провоспалительный цитокин IL-17 играет важную роль в развитии пролапса гениталии у женщин узбекской популяции.
Пролапс, Узбекская популяция, интерлейкин, ген
Короткий адрес: https://sciup.org/14128246
IDR: 14128246 | УДК: 618.14 - 065.873 - 055.2
Текст научной статьи Механизм развития генитального пролапса после гистерэктомии у женщин Узбекской популяции
Введение. В гинекологической практике наиболее часто диагностируется патология тазового дна - пролапс гениталий. До сих пор нет единого мнения об этиологии, патогенезе опущения органов малого таза [1,4,10].
Появившиеся в последнее время сообщения о пролапсе гениталий у нерожавших женщин, а также у женщин после кесарева сечения, свидетельствует о конституциональном факторе и генетической предрасположенности в развитии данной патологии. В связи с этим, необходимо оценка факторов риска, а также доклинических признаков генитального пролапса у женщин как детородного, так и перименопаузального возраста. Для данного контингента женщин выбор оптимальной тактики лечения основан на определении патогенетических факторов заболевания.
В научных изданиях имеются ряд работ по исследованию экспрессии генов в тканях тазового дна при пролапсах. Имеются данные о том, что причиной развития пролапса гениталий у женщин молодого возраста в большинстве случаев являются наследственные заболевания соединительной ткани. Достаточно изучена роль гена ERa и ERP, а также их рецепторов в развитии пролапса гениталий [2,4,5,9].
Провоспалительный цитокин интерлейкин-17 (ИЛ-17) является Т-клсточным полипептидом, который секретируется в основном субпопуляцией CD4+ Т-хелперов (ИЛ 17-клетками), а также ЕК-клетками, нейтрофилами, макрофагами, дендритными, плазматическими и тучными клетками. ИЛ-17 впервые был описан в 1953 г., а как уникальная Т-хелперная клеточная линия идентифицирован в 2005 г. двумя группами авторов [2,3,4,6].
Основными мишенями ИЛ-17 являются лейкоциты, эпителиальные и эндотелиальные клетки, а также фибробласты, на цитоплазматической мембране которых имеются специфические к нему рецепторы (ИЛ-17Р), включающие также другие рецепторы семейства ИЛ-17 (ИЛ-17А, ИЛ-17В, ИЛ-17С, и др. [3,7,8,11].
В настоящее время ИЛ-17 считают одним из важнейших регуляторов естественного и адаптивного иммунитета в организме, особенно проявляющегося при различных воспалительных заболеваниях и аутоиммунных нозологиях, включающих сахарный диабет, а также онкологические заболевания. Несмотря на многочисленные молекулярно-генетические исследования, гена ИЛ 17 в патогенезе генитального пролапса до сих не нашли должного внимания в литературе.
Целью исследования. Изучить роль полиморфного варианта С/G гена ИЛ 17 провоспалительного цитокина в патогенезе генитального пролапса.
Методы исследования. Нами обследовано 121 женщин в возрасте от 26 до 64 лет. Среди 121 пациенток основную группу составили -91 (75,2%) женщин с ГНН1 Э, а контрольную -30 здоровых женщин без ГП (рис 1).
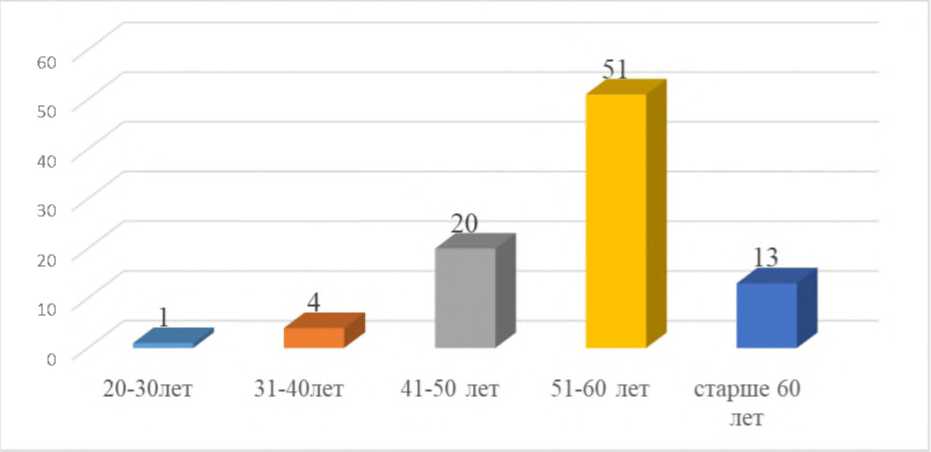
Рисунок 1. Возрастные аспекты обследуемых женщин (абс).
Молекулярно-генетическое обследование биоматериалов (ДНК) выполняли на базе ГУ РСНПМЦАГ. Объектом и предметом исследования явились образцы ДНК 121 женщин, ген ИЛ23. Образцы ДНК выделяли из лимфоцитов периферической крови в соответствии с модифицированной методикой. Концентрация и чистота выделенной ДНК оценивались при измерении оптической плотности ДНК-содержащих растворов при длине волны 260 и 280 нм против ТЕ на спектрофотометре NanoDrop 2000 (США).
Генотипирование полиморфизма гена ИЛ 17 проводили на ПИР амплификаторе в реальном времени Rotor Gene 6000 Модель 65Н0-100 (Австралия), с использованием тест-системы компании «Синтол» Кат. №-NP_555_100_RG (Россия), по инструкции производителя. Статистический анализ результатов проведен с использованием пакета статистических программ «OpenEpi 2009, Version 2.3». Частоту вариантов аллелей и генотипов (^вычисляли по фopмyлe:f=n/2N и f=n/N.
Результаты исследования. Результаты молекулярно-генетических исследований С/G гена ИЛ 17 провоспалительного цитокина у обследованных пациенток представлены в таблице 1.
Таблица 1
Частота распределения аллельных вариантов и полиморфизма гена (rs 612242) гена ИЛ-17 у женщин с ГППГЭ и контрольной здоровой группы женщин N -число обследованных пациентов; *п - число исследованных аллели; * - показатель достоверности по отношению к контрольной группы (Р<0,05)
Результаты молекулярно-генетических исследований гена (rs 612242) С/G гена
|
№ |
Группа |
Частота аллелей |
Частота распределения генотипов |
||||||||
|
С |
G |
С/С |
C/G |
G/G |
|||||||
|
*п |
О/ /О |
*п |
О/ /О |
п |
О/ /О |
п |
О/ /О |
п |
О/ /О |
||
|
1. |
Основная группа п=91(182) ' |
91 |
50* |
91 |
50* |
0 |
91 |
100* |
0 |
0 |
|
|
2 |
Контрольная группа п=30 (60) |
56 |
93,3 |
4 |
6,6 |
27 |
90 |
2 |
6,6 |
1 |
3.3 |
ИЛ-17 показали, что функциональный аллель С в основной группе женщин с ГППГЭ выявлялся в 50% случаев (91/182), а в контрольной группе женщин без ГПП1Э встречался - в 93,3% случаев ( 56/60), что в 1,8 раз превышал показателей основной группы (х2=3 5,5; р<0,0009; OR=0,07; 95%С1 0,02-0,21). Мутантный аллель «G» выявлялся также в 50% случаев в основной группе женщин с ГП (91/182), тогда как в контрольной группе в 6,6% случаев (4/60), что в 11,4 раза было ниже по сравнению с основной группой. (х2=35,53; р<0,0009; OR=14,0; 95%С14,8 -40,2); (таблица 1).
Нами также проанализированы ассоциации полиморфизма генотипов гена ИЛ17. Так, анализ полиморфизма генотипов (rs612242) С/G гена ИЛ-17 показал, что функциональный генотип С/С гена ИЛ-17 в контрольной группе здоровых женщин выявлялся в 90% случаях ( 27/30), тогда как в основной группе женщин с Г1П11 Э в наших случаях не определялся ( /2=110,5; р<0 ; OR=0; 95%С1 0,0-0,01).
Интересным оказался тот факт, что гетерозиготный вариант С/G гена ИЛ-17 в основной группе определялся у всех женщин с Г1П11 Э , что составило 100% (91/182) случаев, тогда как в контрольной группе - у 2 из 30, что составило 6,6% случаев, что 15,2 раза было ниже по сравнению с основной группой. (%2=110,5; р<0; OR=2086,2; 95%С1 97,3 -44734,03);. Полученные данные имели статистически достоверный характер (Р <0,05).
Статистический анализ показал значимости данного различия в частоте выявляемости гетерозиготного генотипа. Тогда как гомозиготный вариант G/G генотипа ассоциации полиморфизма (rs 612242) С/G гена ИЛ-17 определялся у 1 женщины контрольной группы, что составило 3,3% (1/30), а у женщин основной группы данный генотип не определялся. (х2=И0,5; р<0; OR=0,11 95%С1 0,00-2,71) (таблица 2).
Таблица 2
Показатели различия в частоте встречаемости аллелей и генотипов полиморфизма rs612242 С/G гена ИЛ-17 в основной и контрольной группах
|
Аллели и генотипы |
Основная группа |
Контрольная группа |
Статистическое различие |
|
Аллель С |
91 |
56 |
%2=35,53; р<0,0009; OR=14,0; 95%С1 4,8 -40,2 |
|
Аллель G |
91 |
4 |
|
|
Генотип С/С |
0 |
27 |
Х2=1 Ю,5; р<0 ; OR=0; 95%С1 0,0-0,01 |
|
Генотип C/G |
91 |
2 |
у2=110,5; р<0; OR=2086,2; 95%С1 97,3 -44734,03 |
|
Генотип G/G |
0 |
1 |
Х2=1 Ю,5; р<0; OR=0,11 95%С1 0,002,71 |
Полученные данные свидетельствует о том, что носительство неблагоприятного аллеля G (rs612242) гена ИЛ-17 может явиться диагностическим маркером риска развития к формированию генитального пролапса после гистерэктомии, повышающей ее риск в 14 раза (OR=14,0).
Результаты молекулярно-генетических анализов было проанализирована в зависимости от сопутствующей патологии женщин с ГП. (рис.2).
Сопоставление полученных результатов с сопутствующей патологией у женщин с ГП показало, что у них наиболее часто диагностировали инфекции мочеполового тракта (хронический пиелонефрит, цистит) - 39,5%, метаболический синдром (ожирение) - 33,3%, анемию - 29,6% и варикозная болезнь н/к - в 22,2% соответственно.
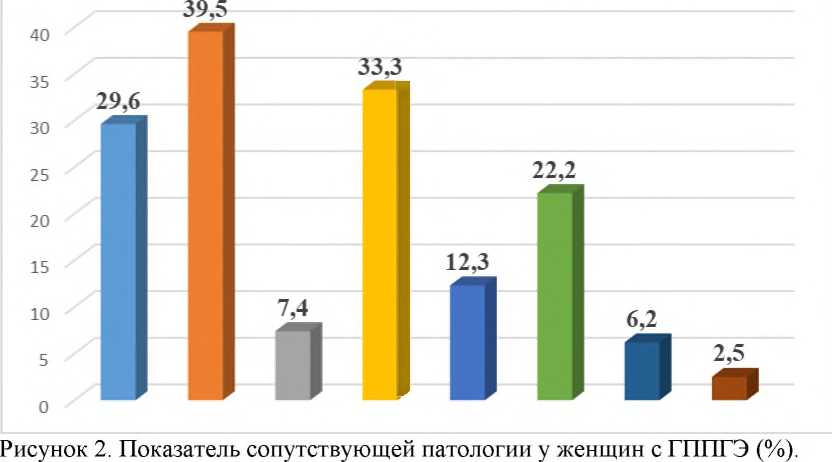
На наш взгляд, сопутствующая патология у женщин с ГП играет важную роль в клиническом течения заболеваемости. Дисбаланс в иммунной системе в выработке провоспалительного цитокина обусловлено хроническим воспалительным заболеваниям, обусловленной условно-патогенными микроорганизмами на фоне метаболического синдрома, в частности при ожирения.
Анализ полученных результатов свидетельствует о значимую связи неблагоприятного вариантного аллеля «О» полиморфизма (rs612242) гена ИЛ-17, способствующий к замене С на G в аминокислотной последовательности, с развитием генитального пролапса на фоне инфекционно-воспалительного процесса урогенитальной системы и метаболического синдрома. Установлено, что высокий риск развития генитального пролапса после гистерэктомии у женщин, и в случае наличия в геноме вариантного аллеля G полиморфизма увеличен в 14 раз (OR=14).
Следует отметить, что гетерозиготный генотип С/G полиморфизма rs 612242 гена ИЛ-17 является генетической детерминантой, являющиеся повышенным фактором риска предрасположенности к развитию Г11111 Э, повышающей ее риск в 2086,2 раз (OR=2086,2). (Р <0,05).
Анализ полученных данных свидетельствует о том, что с носительством неблагоприятного аллеля G гена ИЛ-17 риск развития ГППГЭ может наблюдаться у женщин с метаболическим синдромом (ожирение) и заболеванием мочеполовой системы, что требует пристального внимания диспансерного учета в кабинетах женщин в первичном здравоохранения. Также представляет важное значение заболевание сосудистой системы, эндокринопатия, заболевания крови, которые являются провоцирующими факторами, способствующие развитию ГППГЭ.
Таблица 3
Ожидаемая и наблюдаемая частота распределения генотипов по РХВ полиморфизма (rs612242) гена ИЛ-17 в основной группе женщин с ГППГЭ:
|
Генотипы |
частота генотипов |
х2 |
Р |
|
|
наблюдаемая |
ожидаемая |
|||
|
С/С |
0 |
60,6 |
0.250 |
0 |
|
C/G |
100,0 |
34,5 |
0.500 |
|
|
G/G |
0 |
4,9 |
0.250 |
|
|
Всего |
100,00 |
100,00 |
60,78 |
|
Нами проанализирована оценка выявляемости ожидаемой и наблюдаемой частоты генотипов изучаемых полиморфных генов, потенциально ассоциированных с развитием и патогенезом заболеваний в соответствии распределения частот равновесию Харди-Вайнберга (ХВ) (таблица 3).
Как следует из таблицы, показатели частоты распределения генотипов по РХВ полиморфизма rs612242 С/G гена ИЛ-17 в основной группе женщин с ГП показали наблюдаемую частоту выявляемости благоприятных генотипов С/С - в 0 %, наблюдаемые гетерозиготных генотипов C/G - 100% и мутантных гомозиготных генотипов - G/G-0% случаев соответственно, тогда как ожидаемая частота благоприятных генотипов увеличилась - в 60,6% , а гетерозиготные генотипы снизились ь в 2,9 раз и составило-34,5% случаев и ожидаемые гомозиготные мутантные генотипы G/G составили - 4,9% случаев соответственно. Полученные результаты имеют статистически достоверный характер (Р <0,05).
Результаты исследования проанализированы в группе контрольных пациенток без ГППГЭ (таблица 4.). Тогда как в группе контроле, наблюдаемая частота функциональных генотипов С/С регистрировалось в 90%, а ожидаемая - 59,4%, гетерозиготный вариант С/G гена ИЛ-17 наблюдалось - в 6,7% случаев, а ожидаемая - в 35,3% случаев, что в 5,3 раза повышалось по сравнению с показателями с наблюдаемыми генотипами, (Р <0,05).
Таблица 4
Ожидаемая и наблюдаемая частота распределения генотипов по РХВ полиморфизма rs612242 гена ИЛ-17 в контрольной группе женщин без ГППГЭ:
|
Генотипы |
частота генотипов |
х2 |
Р |
|
|
наблюдаемая |
ожидаемая |
|||
|
C/C |
90,0 |
59,4 |
0,871 |
0,19 |
|
C/G |
6,7 |
35,3 |
0,124 |
|
|
G/G |
3,3 |
5,3 |
0,004 |
|
|
Всего |
100,00 |
100,00 |
1,69 |
|
Тогда как неблагоприятный генотип G/G в наблюдаемой частоты составил -3,3%, а ожидаемая частота составило - 5,3% случаев. Полученные данные имеют важное значение в прогнозирование риска развития акушерских осложнений, в частности генитального пролапса, (таблица 4).
Сравнительный анализ ожидаемой и наблюдаемой частот генотипов данного полиморфизма выявлено статистически значимого отклонения показателей (Р<0.05) во всех исследуемых группах. Данный факт указывает на соответствие наблюдаемой доли генотипов в изучаемых выборках равновесию Харди-Вайнберга.
Таким образом, аллель G и гетеро/гомозиготные генотипы С/G полиморфизма гена ИЛ-17 являются значимыми маркерами повышенного риска развития ГППГЭ у женщин трудоспособного возраста в узбекской популяции. (Р<0.05) (%2=110,5; р<0; OR=2086,2; 95%С1 97,3 -44734,03). Аллель С и функционально благоприятный генотип С/С являются достоверными протективными маркерами в отношении развития патологии (х2=35,53; р<0,0009; OR=0,07; 95%С1 0,02 -0,21; %2=35,53; р<0,0009; OR=14,0; 95%С14,8 -40,2).
Анализ полученных результатов свидетельствует о том, что у женщин с носительством аллельного варианта G и гетерозиготного С/ G гена ИЛ-17 имеется риск формирования генитального пролапса на фоне инфекции мочеполового тракта и метаболического синдпрома.
Заключение. Таким образом, результаты опубликованных в литературе и проведенных нами собственных исследований свидетельствуют о том, что провоспалительный цитокин IL-17 играет важную роль в развитии ГП у женщин узбекской популяции. ИЛ-17 - представляет мембранный гликопротеин, являющиеся главным агентом, индуцирует созревание гематопоэтические предшественники. Его рецептор и интерлейкин играют важную роль во многих воспалительных и аутоиммунных заболеваниях, что было нами определено в соматических патологиях предшествующих генитальный пролапс.
Список литературы Механизм развития генитального пролапса после гистерэктомии у женщин Узбекской популяции
- Rusina, E.I. Lower urinary tract dysfunction in women with pelvic organ prolapse: diagnostic problems // Journal of Obstetrics and Women’s Diseases. – 2018. – Vol. 67 (4). – P. 4-12 (in Russian).
- Shkarupa D.D. Combined pelvic floor repair on levels I and II support defects: Posterior intravaginal sling and subfascial colporrhaphy/ D.D. Shkarupa, N.D. Kubin, E.A. Shapovalova, A.O. Zaytseva, A.V. Pisarev // Akusherstvo i Ginekologiya. – 2016. – Vol. 8. – P. 99-105 (in Russian).
- Shkarupa D.D. Patent 2661042 RU. S1 MPK A61B 17/00, A61B 17/42, A61F 2/02. The method of surgical reconstruction of the pelvic floor / D.D. Shkarupa, N.D. Kubin, E.A. Shapovalova, A.O. Zaytseva. - № 2017119821; request 06.06.17; published 11.07.18. – Bulletin № 20 (in Russian).
- Su, T.H. Single- incision mesh repair versus traditional native tissue repair for pelvic organ prolapse: results of a cohort study / T.H. Su, H.H. Lau, W.C. Huang, C.H. Hsieh, R.C. Chang, C.H. Su // Int Urogynecol J. – 2014. – Vol. 25(7). – P. 901–908.
- Thomas V., Shek C., Guzman Rojas R.A. et al. The latency between pelvic floor trauma and presentation for prolapse surgery. Ultrasound Obstet.Gynecol. – 2013;42 (S1):39.
- Trutnovsky, G. Pelvic floor dysfunction - does menopause duration matter? / G. Trutnovsky, R. Guzman-Rojas, A. Martin, H.P. Dietz // Maturitas. – 2013. – Vol. 76(2). – P.134-138.
- Utomo, E. Validation of the Pelvic Floor Distress Inventory (PFDI-20) and Pelvic Floor Impact Questionnaire (PFIQ-7) in a Dutch population / E. Utomo, B.F. Blok, A.B. Steensma, I.J. Korfage. // Int Urogynecol J. – 2014. – Vol.25(4). – P.531-44.
- Vitale, S.G. Transvaginal bilateral sacrospinous fixation after second recurrence of vaginal vault prolapse: efficacy and impact on quality of life and sexuality / S.G. Vitale, A.S. Lagana, M. Noventa // Biomed Res Int. – 2018. – P. 6.
- Volloyhaug I., Wong V., Shek K.L. et al. Does levator avulsion cause distension of the genital hiatus and perineal body? Int.Urogynecol. J. – 2013;24:1161-65.
- Wilkins, M. F. Epidemiology of Pelvic Organ Prolapse / M. F. Wilkins, J.M. Wu // Current Obstetrics and Gynecology Reports. – 2016. – Vol. 5(2). – P. 119–123.
- Wright, J.D. Nationwide trends in the performance of inpatient hysterectomy in the United States / J.D. Wright, T.J. Herzog, J. Tsui // Obstet Gynecol. – 2013. –Vol. 122(2 Pt 1). – P. 233-241.


