Механизм взаимодействия и фазообразования в системе мелкодисперсных оксидов ТiO2-Сr2О3
Бесплатный доступ
Методом магнетохимического анализа исследован массоперенос при окислении O2O3 в системе мелкодисперсных оксидов ТiO2-Сr2O3 на воздухе в интервале температур 800-1000 °С. Показано, что стадией, предшествующей образованию твердых растворов, является частичное окисление Сr3+-> Сr6+. При этом окисление происходит на глубину до 10 поверхностных слоев Сr2O3. Исследована устойчивость ионов Сгб+ в процессе хранения смесей после прокаливания на воздухе. Показано, что при хранении в обычных условиях происходит восстановление Сr6+ до Сr3+. Восстановление обусловлено частичной гидратацией поверхности кристалликов Сr2О3 и TiO2. Показана возможная роль поверхностных протонов ОН- - групп в этом процессе.
Короткий адрес: https://sciup.org/147158594
IDR: 147158594 | УДК: 540.145
Текст научной статьи Механизм взаимодействия и фазообразования в системе мелкодисперсных оксидов ТiO2-Сr2О3
Мелкодисперсные системы (МДС) с размером частиц от нескольких сотен единиц до сотен нанометров по сравнению с крупнокристаллическими объектами обладают специфическими, а в ряде случаев уникальными физико-химическими свойствами. Типичными представителями МДС являются мелкодисперсные оксиды р и 3d металлов, которые широко используются в качестве неорганических пигментов, катализаторов химических реакций, магнитных порошков, компонентов для получения пластмасс, керамики и др. Примером таких мелкодисперсных оксидов является система ТЮ2-Сг20з, представляющая интерес для технологии получения полупроводниковой керамики, огнеупорных изделий, а также как составная часть многокомпонентных систем. Исходные оксиды независимо от условий получения и назначения продукта синтеза чаще всего используются в мелкодисперсном состоянии. Оксиды ТЮ2 и Сг20з в мелкодисперсном состояния обладают рядом уникальных физико-химических свойств, обусловленных их сильно развитой поверхностью и специфическим состоянием приповерхностного слоя кристалликов. В связи с этим исследованию процессов, которые развиваются при взаимодействии мелкодисперсных кристалликов уделяется большое внимание [1-3].
На практике, как правило, приходится иметь дело с механической смесью мелкодисперсных оксидов ТЮ2 и Сг20з, а их совместный нагрев при высоких температурах является необходимым этапом во многих технологических процессах. Ранее показано [4-7], что совместный нагрев на воздухе Сг20з с Т1О2 или А120з приводит к окислению ионов Сг3+ до Сг6+, что противоречит литературным данным по термической стабильности СгОз. При этом наиболее интенсивное окисление происходит с анатазной модификацией диоксида титана [4-5]. До настоящего времени не существует единого мнения, о причинах окисления Сг3+ до Сг6+ в мелкодисперсной системе TiO2-Сг2О3. Вопрос о механизме окисления Сг20з в системе также остается открытым.
Целью настоящей работы является исследование механизма окисления Сг3+—»Сг6+ в мелкодисперсной системе ТЮ2-Сг20з, а также кинетики массопереноса при взаимодействии оксидов во время их совместного прокаливания на воздухе при температурах 800-1000 °C.
Экспериментальная часть
Для исследования взяты а-Сг20з и TiO2 марки «х.ч». Диоксид титана использовали анатазной и рутильной модификации, которые получали прокаливанием гидратированного диоксида титана (ГДТ) при 600 и 1000 °C соответственно. В свою очередь ГДТ получали по способу, детально описанному в [8], путем термического гидролиза растворов сульфатных соединений Ti (IV). Гидролиз проводили в присутствии анатазных зародышей, которые согласно [8] являются центрами образования первичных частиц ГДТ в процессе его гидролиза. Смеси состава 95 % ТЮ2 и 5 % Сг20з готовили тщательным перемешиванием оксидов в агатовой ступке до получения образцов однородного цвета. Полученные смеси прокаливали в фарфоровых тиглях в интервале температур 850-1000 °C в течении часа, которые исследовали рентгенографическим и химическим анализами как сразу после охлаждения смесей, так и в процессе хранения в обычных условиях в течении 720 сут. Количественный и качественный фазовый анализ образцов проводили на дифрактрометре ДРОН-3 М с Ка-излучением кобальта. Количественный фотоколориметрический анализ хрома (VI) и хрома (III) проводили по методикам подробно описанным в [9].
Спектры диффузного отражения до и после прокаливания смесей снимали на спектрофотометре СФ-10. ИК-спектры исследуемых образцов получали на двухлучевом ИК-спектрометре UR-10 по стандартной методике [10]. Спектры ЭПР записывали на радиоспектрометре РЭ-1306. Термогравиметрический анализ проводили на дериватографе Q-155 D (F. Paulik, J. Paulik, L. Er-dey).
Обсуждение результатов
В наших экспериментах химическим анализом установлено, что прокаливание мелкодисперсного оксида Сг20з на воздухе в температурном интервале 600-1200 °C ведет к частичному окислению ионов Сг3+ до Сг6+. При прокаливании Сг20з совместно с ТЮ2 в тех же условиях относительное содержание ионов Сг6+ возрастает почти на три порядка [11]. В температурном интервале 1000-1200 °C в системе идет образование твердого раствора Сг20з в ТЮ2 [12], тогда как электронно-микроскопические исследования показали, что спекания оксидов даже при длительных выдержках при этих температурах не происходит. Сопоставление данных магнетохимиче-ского и химического анализов на содержание в системе ионов Сг6+ показало симбатное изменение этих величин от концентрации Сг2Оз и температуры прокаливания (рис. 1).
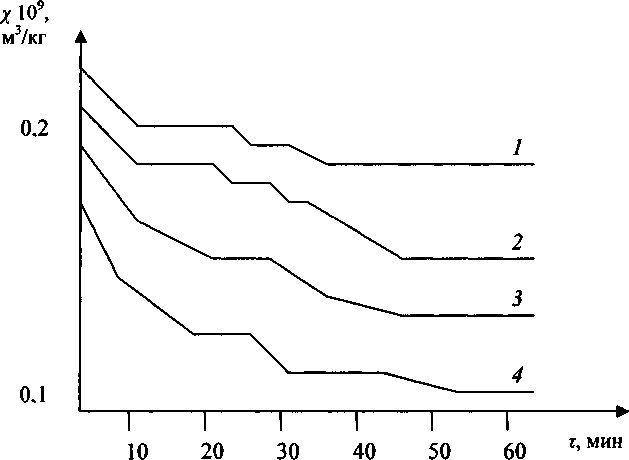
Рис.1. Зависимости магнитной восприимчивости смеси ТЮ2-Сг2О3 от времени изотермической выдержки:
1 - 700 °C; 2 - 750 °C; 3 - 800 °C; 4 - 850 °C
Кинетические исследования показали, что взаимодействие мелкодисперсных оксидов ТЮ2 и Сг20з на воздухе носит многостадийный ступенчатый характер [И]. Характерной особенностью процесса взаимодействия является наличие квазиравновесных состояний. Математическая обработка показала, что наиболее адекватно экспериментально наблюдаемые кинетические зависимости на начальных стадиях взаимодействия описываются уравнениями, предполагающими в качестве лимитирующей стадии химические поверхностные процессы на границе раздела фаз.
Анализ массопереноса в системе показал, что при взаимодействии оксидов ТЮ2 и Сг20з окисляются до 10-12 атомных слоев Сг20з, причем скорость роста этих слоев на начальных ста- днях взаимодействия экспоненциально возрастает с увеличением температуры изотермической выдержки. Кажущаяся энергия активации этого процесса 86 кДж/моль. Такое малое значение энергии активации процесса позволяет утверждать, что окисление Сг3+ до Сг6+ в системе происходит на поверхности СггО3 и не связано с испарением хрома на поверхность кристалликов ТЮг.
Термодинамическим анализом показано [11], что причиной окисления Сг3+ до Сг6+ при прокаливании мелкодисперсного СггО3 отдельно и в смеси с ТЮ2 может являться частичная гидратация поверхности кристалликов мелкодисперсных оксидов. При этом количество ионов Сг6+, которое образуется в смесях после прокаливания, хорошо согласуется с расчетными значениями количества групп ОН , образующихся на поверхности кристалликов ТЮг и Сг2О3. Исследование устойчивости ионов Сг6+ в процессе хранения смесей (рис. 2), а также исследование ИК-спектров прокаленных смесей [11] хорошо согласуются с данными предположениями.
Таким образом, на основании вышеизложенных экспериментальных фактов можно предложить следующую модель фазообразования и взаимодействия в системе мелкодисперсных оксидов TiO2-Cr2O3. Поскольку окисление Сг3+ до Сг6+ происходит на поверхности кристалликов Сг2О3, в этом процессе можно выделить следующие необходимые стадии. На стадии I происходит гидратация поверхности исходных оксидов с образованием связей Ме-ОН. Гидратация поверхности оксидов ТЮг и Сг2О3 происходит при комнатной температуре и подтверждена нами в исследовании ИК-спектров исходных оксидов. Прокаливание СггО3 на воздухе (стадия II) ведет к окислению только тех катионов Сг3+, которые имеют связи Сг3+-ОН, поверхность кристалликов Сг2О3 при этом дегидратируется. Коэффициент перекрытия ионами Сг6+ поверхности кристалликов Сг20з по данным химического анализа после прокаливания оксида на воздухе при 600 °C равен Пхсг - 0,008, тогда как коэффициент перекрытия группами ОН" поверхности кристалликов Сг2О3 согласно теории двойного заряженного слоя Понсг= 0,006.
Роль протонов в окислении Сг3+ до Сгб+ в данном случае наиболее вероятно обусловлено следующим. Изменение энтальпии для реакции диссоциации
ОН^О2 + 1Г, (1)
ДН°298 = 263 7 кДж/моль. Однако, на поверхности кристалликов СггО3 энергия образования протона, согласно реакции (1), может значительно уменьшиться, приблизительно в с2 раз. Диэлектрическая проницаемость Сг2О3 б~10. Снижение энергии образования протона обусловлено поляризацией групп ОН" кристаллическим полем Сг2О3. Если на поверхности Сг2О3 образуются структуры Сг3+-ЗОН", то окисление Сг3+ до Сг6+ после прокаливания Сг2О3 на воздухе схематично можно представить:
Сг^-ЗН^-О2^ 0,75Ю2-> Сг6++ЗО2"+ЗН+0,75 О2-> «СгО3» +1,5 Н2О, где под «СгО3» подразумевается сложное оксидное соединение с Сг6+.
Обмен электронами от Сг3+ к кислороду О2 непосредственно осуществляется через протоны, т.е.
Сг3+-Зе-> Сг6+
Зе+ЗН4-* ЗН ЗН-Зе-ЗН4 Зе + 0,75О2-> 1,5О2
Аналогичным образом происходят процессы окисления структур Сг3+ -ОН О2 и Сг3+-2ОН~ 0,5О2", которые были обнаружены на поверхности Сг2О3[13]
При взаимодействии ТЮг с Сг2О3 (стадия III) дальнейшее окисление Сг3+ до Сг6+ в системе связано с диффузией ионов Сг3+ из приповерхностных слоев на поверхность кристалликов СггО3. Перенос малого, но макроскопического количества ионов Сг3+ на поверхность Сг2О3 невозможен, поскольку появляется двойной заряженный слой, который препятствует дальнейшей диффузии ионов Сг . Однако ионы Сг3+ на поверхности кристалликов Сг2О3 захватывают ОН" группы с поверхности ТЮг и окисляются до Сг6+, давая возможность дальнейшей диффузии ионов Сг3+. Поверхность кристалликов ТЮг при этом дегидратируется. Отмеченный выше экспериментальный факт о значительном влиянии ТЮг на окисление СггО3 хорошо согласуется с данными предположениями. Коэффициент перекрытия ионами Сг6+ поверхности кристалликов ТЮ2 после прокаливания смесей 95 мас.% ТЮг и 5 мас.% Сг2О3 на воздухе при 600 °C по данным химического анализа, nXTi= 0,018, тогда как коэффициенты перекрытия группами ОН-поверхности кристалликов соответствующего оксида Понп = 0,023.
Диффузия ионов Сг3+ и их окисление до Сг6+ на поверхности кристалликов Сг20з связано с образованием вакансий в катионной подрешетке оксида. Образование катионных вакансий в решетке Сг20з сопровождается появлением в объеме кристалликов ионов Сг6+, поэтому данные магнетохимического анализа примерно в два раза превышают данные химического анализа на содержание Сг6+, поскольку ионы Сг6+ из объема кристалликов не выщелачиваются в процессе химического анализа.
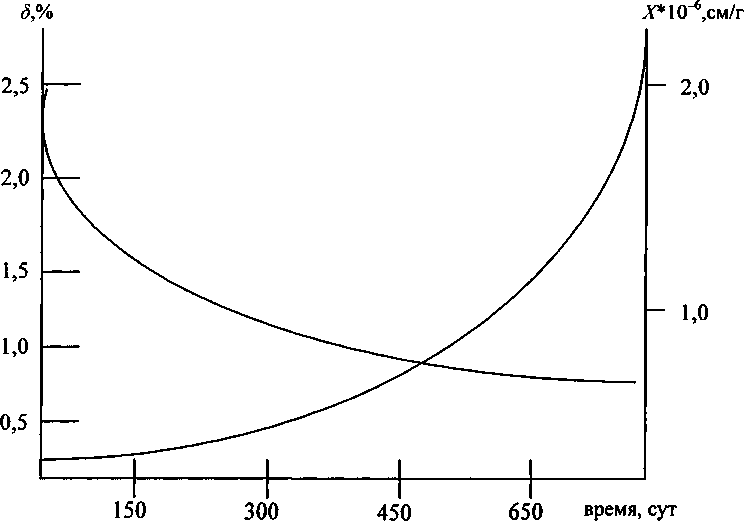
Рис. 2. Зависимость эффективности окисления СггО3 б (1) и магнитной восприимчивости (2) от времени хранения прокаленной смеси
Окисление Сг20з при взаимодействии с ТЮ2 происходит на глубину до десяти атомных слоев Сг20з [5]. Наличие квазиравновесных состояний в период окисления Сг2О3 в системе TiO2-Сг2Оз связано с тем, что образующийся продукт реакции «СгОз» покрывая поверхность кристалликов Сг20з, задерживает доступ кислорода к зоне реакции до тех пор, пока не произойдет отслоение «СгОз» от поверхности кристалликов Сг20з. Отслоение «СгОз» происходит за счет накопления упругих напряжений на границе раздела фаз, возникающих из-за несоответствия параметров «СгОз» и Сг20з. Разность молярных объемов «СгОз» и Сг2О3 составляет 27 %. Отделившийся оксид «СгОз» при температурах ~600-850 °C плавится и в виде жидкой фазы переносится на поверхность кристалликов TiO2. При температурах выше 600 °C «СгОз» на поверхности кристалликов TiO2 разлагается до Сг2Оз, магнитная восприимчивость образцов при этом увеличивается и в дальнейшем происходит образование твердого раствора Сг2Оз в ТЮ2 [11].
Таким образом, массоперенос хрома в системе при совместном прокаливании мелкодисперсных оксидов TiO2 и Сг2О3 на воздухе в температурном интервале 800-1200 °C осуществляется через жидкую фазу «СгОз». При этом энергия активации этого процесса значительно понижается, а образование твердого раствора Сг20з в ТЮ2 происходит при температурах ниже таммановской.
Выводы
-
1. Методом магнетохимического анализа исследована кинетика массопереноса при взаимодействии в системе мелкодисперсных оксидов ТЮ2-Сг20з Вычислена величина кажущейся энергии активации окисления Сг20з в системе при 800-1000 °C.
-
2. Исследованы окислительно-восстановительные процессы в системе мелкодисперсных оксидов TiO2-Cr2O3 при прокаливании исходных смесей на воздухе и хранении в обычных условиях.
-
3. Установлено, что в процессе взаимодействия окисляется до 10 атомных слоев Сг2О3. Ква-зиравновесное состояние наступает после окисления первых нескольких атомных слоев Сг2О3, причем количество этих слоев, так же как и количество окисленных слоев в момент наступления химического равновесия в системе, экспоненциально возрастает с увеличением температуры изотермической выдержки.
-
4. Показано, что на воздухе при температурах 800-1000 °C в мелкодисперсной системе ТЮ2 - Сг2О3 состояние иона Сг6+ оказывается более устойчивым, тогда как при комнатных температурах более устойчивы ионы Сг3+.
-
5. Установлено, что в процессе хранения происходит восстановление ионов Сг6+ до Сг3+. При этом данный процесс полностью обратим.
Список литературы Механизм взаимодействия и фазообразования в системе мелкодисперсных оксидов ТiO2-Сr2О3
- Клещев Д.Г. Получение нанокристаллических оксидов Ti, Mn, Co, Fe и Zn в водных растворах при термообработке/Д.Г. Клещев//Неорган. материалы. 2005. Т. 41, № 1. С. 46-53.
- Волков С.В Синтез нанодисперсных порошков сложных оксидов титана и циркония/С.В. Волков, С.М. Малеванный, Э.В. Панов//Журнал неорганической химии. 2002. Т. 47, № 11. С. 1749-1754.
- Коленько Ю.В. Синтез гидротермальным методом нанокристаллических порошков различных кристаллических модификаций TiO2/Ю.В. Коленько, A.A. Бурухин//Журнал неорганической химии. 2002. Т. 47, № 11. С 1755-1762.
- Белая Е.А. Особенности взаимодействия в системе ТiO2(анатаз)-Сr2O3/Е.А. Белая, В.В. Викторов//Вестник ЮУрГУ. Серия «Математика, физика, химия». 2006. Вып. 7. № 7(62). С. 219-223.
- Белая Е.А. Окисление Сr2O3 в системе мелкодисперсных оксидов ТiO2-Сr2O3/Е.А. Белая, В.В. Викторов//Вестник ЮУрГУ. Серия «Математика, физика, химия». 2007. Вып. 8. № 3(75). С. 66-69.
- Викторов В.В. Взаимодействие в системе мелкодисперсных оксидов А12O3-Сr2O3 при 400-800 °С/В.В. Викторов, В.В. Гладков, А.А. Фотиев и др.//Изв. АН СССР. Сер. «Неорган. материалы». 1983. Т. 19, № 6. С. 930-933.
- Викторов В.В. Влияние TiO2 на окисление Сr2Oз в системе мелкодисперсных оксидов Аl2O3-Сr2O3/В.В. Викторов, В.В. Гладков, А.А. Фотиев и др.//Изв. АН СССР. Сер. «Неорган. материалы». 1984. Т. 20, № 4. С. 686-688.
- Беленький Е.Ф. Химия и технология пигментов/Е.Ф. Беленький, И.В. Рискин. Л.: Химия, 1974. 656 с.
- Золотов Ю.А. Основы аналитической химии/Ю.А. Золотов. М.: Высшая школа, 1999. 351с.
- Лоусон, К. Инфракрасные спектры поглощения неорганических веществ/К. Лоусон. М.: Мир, 1964. 297 с.
- Белая Е.А. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ В СИСТЕМЕ ТIO2 CR2О3 ИЗ МЕЛКОДИСПЕРСНЫХ ОКСИДОВ /Е.А. Белая, В.В. Викторов//Неорган. материалы. 2007. Т. 43, № 12. С. 1469-1471.
- Белая Е.А. Особенности образования твердых растворов в системе ТiO2-Сr2O3/Е.А. Белая, В.В. Викторов//Неорган. материалы. 2008. Т. 44, № 1. С. 68-72.
- Моррисон С. Химическая физика поверхности твердого тела/С. Моррисон. М.: Мир, 1980. 488 с.


