Механизмы и клиническое значение нефропротективного действия ингибиторов натрий-глюкозного котранспортёра 2 типа
Автор: Пчелин И.Ю., Василькова О.Н., Шишкин А.Н., Байрашева В.К., Худякова Н.В.
Журнал: Juvenis scientia @jscientia
Рубрика: Медицинские науки
Статья в выпуске: 1, 2019 года.
Бесплатный доступ
В статье представлены данные о механизмах и клиническом значении нефропротективного действия ингибиторов натрий-глюкозного котранспортёра 2 типа (SGLT2). Обсуждаются эффекты, связанные с влиянием представителей данной фармакологической группы на скорость клубочковой фильтрации, уровень гликемии, диурез, кетогенез и другие факторы. Проанализированы результаты недавно проведённых экспериментальных и клинических исследований, направленных на изучение отдельных аспектов нефропротективного действия ингибиторов SGLT2 при сахарном диабете 2 типа и других патологических состояниях.
Сахарный диабет, пероральные сахароснижающие препараты, ингибиторы натрий-глюкозного котранспортёра 2 типа, ингибиторы sglt2, хроническая болезнь почек, диабетическая нефропатия, нефропротекция
Короткий адрес: https://sciup.org/14113478
IDR: 14113478 | УДК: 616.379-008.64 | DOI: 10.32415/jscientia.2019.01.01
Текст научной статьи Механизмы и клиническое значение нефропротективного действия ингибиторов натрий-глюкозного котранспортёра 2 типа
Funding: The study was supported by Russian Foundation for Basic Research according to the research project No. 17-54-04080.
В настоящее время для лечения пациентов с сахарным диабетом (СД) 2 типа доступно большое количество пероральных сахароснижающих препаратов (ПСП) с различными механизмами действия [1]. Несмотря на высокую эффективность ПСП в отношении нормализации гликемии, у значительной доли пациентов с СД 2 типа развиваются хронические осложнения, среди которых наиболее неблагоприятным прогностическим значением обладают диабетическая нефропатия и сердечно-сосудистые осложнения [2]. В связи с этим все современные препараты для лечения СД 2 типа исследуются на предмет их нефро- и кардиопротективных свойств [3, 4]. За последние годы было получено много принципиально новых данных о плейотропных эффектах представителей одного из последних классов ПСП – ингибиторов натрий-глюкозного котранспортёра 2 типа (SGLT2) [5, 6].
В почках здорового человека ежедневно происходит фильтрация около 180 г глюкозы и практически полная её реабсорбция, которая более чем на 90% опосредуется на-трий-глюкозным котранспортёром 2 типа, расположенным на поверхности эпителия проксимальных канальцев [7].
Редко встречающиеся генетические дефекты SGLT2 (мутации гена SLC5A2) приводят к выраженной глюкозурии, но не ассоциированы при этом с неблагоприятными почечными исходами [8].
При СД 2 типа наблюдается up-регуляция SGLT2, что значительно повышает возможность почек реабсорбировать глюкозу и обеспечивает отсутствие потерь глюкозы с мочой в среднем до уровня гликемии 10 ммоль/л [9]. Установлено, что одним из механизмов регуляции экспрессии SGLT2 является аутокринный: провоспалительные цито- кины (интерлейкин-6 и фактор некроза опухолей альфа), продуцируемые клетками почечного эпителия, способны повышать экспрессию SGLT2 этим же типом клеток [10]. В другом исследовании, проведённом с использованием клеток проксимальных канальцев почек человека, было продемонстрировано, что up-регуляция SGLT2 происходит не непосредственно под действием повышенных концентраций глюкозы, а в результате воздействия на эти клетки трансформирующего фактора роста бета, гиперпродукция которого характерна для диабетического поражения почек [11].
В большом количестве исследований было показано, что ингибирование SGLT2 приводит к широкому спектру потенциально благоприятных при СД 2 типа физиологических сдвигов. Основные прямые и опосредованные почечные эффекты ингибиторов SGLT2 при СД 2 типа суммированы на рис. 1. Ниже, на основе анализа результатов ключевых экспериментальных и клинических исследований последних лет, обсуждаются отдельные аспекты нефропротективного действия ингибиторов SGLT2.
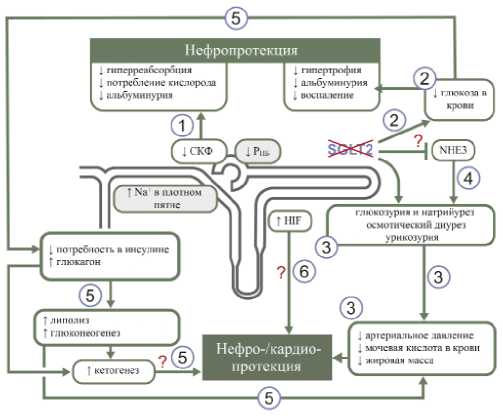
Рисунок 1. Основные механизмы нефропротективного действия ингибиторов SGLT2 (адаптировано из V. Vallon, S. С. Thompson [12]) (1) Уменьшение реабсорбции глюкозы и натрия в прохимальных канальцах приводит к повышению давления в пространстве Боумена (РПБ), снижению скорости клубочковой фильтрации (СКФ), а также оказывает влияние на функцию клеток плотного пятна юкстагломерулярного аппарата. (2) Нормализуя уровень глюкозы в крови, ингибиторы SGLT2 опосредованно блокируют повышение уровня конечных продуктов гликирования, гиперпродукцию провоспалительных цитокинов и другие негативные последствия гипергликемии. (3) Ингибиторы SGLT2 обладают диуретическим, натрийуретическим и урикозурическим действием, что способствует снижению объема внеклеточной жидкости, артериального давления, уровня мочевой кислоты в крови и массы тела. (4) Предполагается наличие связи между активностью натрий-глюкозного котранспортёра 2 типа и натрий-водородного ионообменного белка (NHE3), что может оказывать дополнительное благоприятное воздействие на уровень артериального давления. (5) Снижение потребности в инсулине и повышение уровня глюкагона приводят к активации липолиза и глюконеогенеза и, как следствие, к незначительному повышению уровня кетонов, которые способны оказывать кардио- и нефро-протективные эффекты. (6) Ингибирование SGLT2 может повышать продукцию в почках фактора, индуцируемого гипоксией (HIF), обладающего нефропротективными свойствами.
Экспериментальные исследования. В первых экспериментальных исследованиях, направленных на изучение нефпропротективных свойств ингибирования натрий-глю-козного котранспортёра, использовался флоризин – конкурентный ингибитор SGLT1 и SGLT2 природного происхождения, не пригодный для использования в клинической практике в связи с наличием у него выраженных побочных эффектов [9]. В исследовании S. Malatiali et al. было про- демонстрировано, что флоризин уменьшает выраженность гломерулярной гиперфильтрации у крыс со стреп-тозотоцин-индуцированным СД [13]. В работе H. Osorio et al., использовавшей ту же модель СД, отмечено снижение показателей оксидативного стресса [14]. В исследовании, проведённом на мезангиальных клетках крыс, было показано, что добавление флоризина блокирует изменение размера этих клеток при их инкубации в растворе с высоким содержанием глюкозы [15].
В большинстве исследований, проведенных на различных генетических и негенетических моделях диабетического поражения почек с использованием современных синтетических ингибиторов SGLT2 (эмпаглифлозин, дапа-глифлозин, лусеоглифлозин, тофоглифлозин), было также подтверждено наличие у данной фармакологической группы выраженных нефропротективных свойств.
На мышах линии BTBR ob/ob было показано, что применение эмпаглифлозина ассоциировано со снижением уровня альбуминурии и экспрессии маркеров воспаления, уменьшением гипертрофии клубочков и экспансии мезангиального матрикса, однако при введении этим лабораторным животным ангиотензина II сохранялся только антиаль-буминурический эффект [16].
В исследовании на мышах линии db/db введение эмпа-глифлозина уменьшало экспрессию генов фибронектина и трансформирующего фактора роста бета, но не оказывало влияния на уровень альбуминурии и экскрецию с мочой маркеров повреждения канальцев KIM-1 и нейтрофильного желатиназо-ассоциированного липокалина (NGAL) [17].
В работе M. Gangadharan Komala et al. применение эм-паглифлозина (в отличие от телмисартана) не оказывало нефропротективного действия на мышей с нокаутом гена эндотелиальной синтазы оксида азота (eNOS), индукция СД у которых осуществлялась с помощью введения низких доз стрептозотоцина [18].
По данным A. Ojima et al. (2015), применение эмпаг-лифлозина у крыс со стрептозотоцин-индуцированным СД приводило к уменьшению экспрессии рецептора конечных продуктов гликирования, а также к снижению экскреции с мочой маркера оксидативного стресса 8-OH-дезоксигуано-зина и маркера канальцевого повреждения L-FABP (печёночной формы белка, связывающего жирные кислоты). При этом в данном исследовании сравнительно небольшой продолжительности (4 недели), не наблюдалось антиальбу-минурического эффекта ингибирования SGLT2 [19].
Другой ингибитор SGLT2, дапаглифлозин, в исследовании, проведённом с использованием мышей линии db/ db, также продемонстрировал выраженные нефропротек-тивные свойства. В частности, было отмечено уменьшение инфильтрации почек макрофагами, подавление мезангиальной экспансии и интерстициального фиброза, снижение альбуминурии. При этом показатели клиренса креатинина и артериального давления не претерпели значимых изменений [20].
В исследовании T. Hatanaka et al., на мышах линии Акита (модель СД 1 типа) было проведено сравнение эффектов терапии дапаглифлозином и инсулинотерапии. После 12 недель лечения не наблюдалось значимых межгрупповых различий по уровню гликемии, HbA1c, массе тела и артериальному давлению, однако диурез и потребление жидкости были выше в группе, получавшей ингибитор SGLT2. У мышей, получавших дапаглифлозин, морфологические изменения почек (инфильтрация макрофагами, интерсти- циальный фиброз) были менее выраженными, чем у животных, находившихся на инсулинотерапии. При изучении культуры клеток проксимальных канальцев было продемонстрировано также уменьшение выраженности оксида-тивного стресса под действием дапаглифлозина [21].
Еще одно сравнительное исследование, сопоставившее нефропротективные эффекты тофоглифлозина и лозарта-на, было проведено на мышах линии db/db. В работе было показано, что как тофоглифлозин, так и лозартан способны снижать уровень альбуминурии на 50-70%, однако только ингибитор SGLT2 уменьшал выраженность гипертрофии клубочков [22].
Большинство исследователей сходятся во мнении, что снижение уровня альбуминурии в экспериментальных исследованиях наблюдается при использовании высоких доз ингибиторов SGLT2, тогда как другие эффекты (противофи-бротический, противовоспалительный, торможение окси-дативного стресса) проявляются в более широком диапазоне доз [23].
В сравнительном исследовании, проведённом с использованием негенетической модели крыс с инсулинорези-стентностью на фоне высокожирового питания, было показано, что ингибитор SGLT2 дапаглифлозин обладает более выраженным нефропротективным потенциалом, чем метформин [24].
Изучение комбинированной нефропротективной терапии на модели стрептозотоцин-индуцированного СД у соль-чувствительных крыс (линии Dahl S) показало, что применение ингибитора SGLT2 лусеоглифлозина в сочетании с ингибитором АПФ лизиноприлом ассоциировано с более выраженными благоприятными эффектами (гипотензивное действие, уменьшение почечной гиперфильтрации и протеинурии), чем назначение любого из этих препаратов в отдельности [25]. В другом исследовании было показано, что применение эмпаглифлозина совместно с метформином обладает преимуществом в отношении влияния на синтез в почках коллагена IV типа и фактора роста соединительной ткани [17].
В последние годы активно изучается эффективность и безопасность ингибиторов SGLT2 при хронической болезни почек со значительным снижением клубочковой фильтрации. В исследовании L. Li et al. (2018), было продемонстрировано, что ингибирование SGLT2 у крыс, перенесших субтотальную нефрэктомию (без СД), не приводит к внутрипочечной и системной активации ренин-ангио-тензин-альдостероновой системы, что, по данным ряда исследователей, может быть побочным эффектом данного фармакологического воздействия в случае развития гипонатриемии на фоне выраженной почечной патологии [26]. В другом исследовании было показано, что применение дапаглифлозина у крыс, перенесших субтотальную нефрэктомию, не ассоциировано с уменьшением экспрессии в почках профибротических цитокинов и замедлением прогрессирования нефросклероза [27]. При менее значительном уменьшении объёма функционирующей почечной ткани на фоне СД нефропротективные свойства ингибиторов SGLT2 сохраняются, что было продемонстрировано на мышах с СД 2 типа линии KK/Ay, подвергшихся односторонней нефроэктомии [28]. В работе, изучавшей эффекты ингибирования SGLT2 у животных с хронической болезнью почек, индуцированной диетой, содержащей избыточное количество оксалатов, дапаглифлозин не продемонстрировал благоприятных почечных эффектов. Таким образом, наличие у данного класса препаратов нефропротективных свойств при недиабетическом поражении почек и их практическая значимость в настоящее время вызывают сомнения [29].
Тем не менее, экспериментально подтверждено наличие у ингибиторов SGLT2 нефропротективных эффектов, опосредованных их влиянием на экспрессию фактора, индуцируемого гипоксией (HIF-1). Соответствующие данные были получены на модели ишемии-реперфузии почек у мышей [30]. Другими авторами было показано, что в условиях гипоксии экспрессия SGLT1 и SGLT2 клетками эпителия канальцев снижается [31].
Менее изученным является вопрос возможных органо-протективных и, в частности, нефропротективных эффектов, связанных с накоплением продуктов кетогенеза, который активируется на фоне ингибирования SGLT2. В экспериментальном исследовании, проведенном T. Shimazu et al., было показано, что введение мышам одного из таких метаболитов, бета-гидроксибутирата, ассоциировано со снижением экспрессии в почках маркеров оксидативного стресса и перекисного окисления липидов после внутривенной инъекции параквата [32]. Кроме того, существуют экспериментальные доказательства использования почками кетоновых тел в качестве энергетического субстрата. В условиях кето-немии их утилизация резко возрастает, что ингибирует захват почками других субстратов и уменьшает потребление кислорода [33].
Клинические исследования. Одним из наиболее крупных клинических исследований, в которых изучались неф-ропротективные эффекты ингибиторов SGLT2, является исследование EMPA-REG OUTCOME. В данном исследовании нефропротективное действие эмпаглифлозина проявлялось не только при назначении его в максимальной дозе 25 мг в сутки, но и при использовании дозы 10 мг в сутки. Добавление эмпаглифлозина к стандартной терапии (около 80% больных получали ингибиторы АПФ или блокаторы рецепторов ангиотензина) было ассоциировано со снижением риска прогрессирования нефропатии с развитием макроальбуминурии на 38%, удвоения сывороточного уровня креатинина – на 44%, начала заместительной почечной терапии – на 55%. В то же время терапия ингибитором SGLT2 не приводила к снижению вероятности развития у пациентов микроальбуминурии, что было распространённым событием как в основной группе, так и в группе, получавшей плацебо (51,5% и 51,2%, соответственно). На начальном этапе терапии эмпаглифлозином наблюдалось предсказуемое снижение СКФ, однако в дальнейшем величина СКФ в основной группе оставалась относительно стабильной (снижение на 0,19±0,11 мл/мин/1,73 м2 в год), в то время как в группе, получавшей плацебо, наблюдалось более выраженное снижение СКФ (на 1,67±0,13 мл/мин/1,73 м2 в год). Кроме того, после отмены эмпаглифлозина отмечался рост СКФ, что ещё больше увеличивало межгрупповые различия по данному показателю [34]. Помимо очевидных механизмов кардио- и нефропротективного действия эмпаглифло-зина, ярко продемонстрированного в EMPA-REG OUTCOME, в научной литературе обсуждается возможное клиническое значение усиления кетогенеза и роли соответствующих энергетических субстратов [35].
В исследовании CANVAS было изучено влияние ингибитора SGLT2 канаглифлозина на сердечно-сосудистые и почечные исходы при СД 2 типа. Результаты исследования показали, что добавление канаглифлозина к стандартной терапии было ассоциировано со снижением на 47% риска достижения комбинированной конечной точки, включавшей устойчивое повышение концентрации сывороточного креатинина в 2 раза, развитие терминальной стадии хронической болезни почек и смерть от почечных причин. В группе, получавшей плацебо, средняя величина ежегодного снижения СКФ была на 1,2 мл/мин/1,73 м2 больше. Среднее значение отношения альбумин/креатинин мочи в группе пациентов, получавших канаглифлозин, было ниже на 18% [36].
В исследовании DECLARE-TIMI 58 назначение пациентам с СД 2 типа дапаглифлозина в дополнение к стандартной терапии было ассоциировано со снижением на 24% риска достижения комбинированной конечной точки, включавшей устойчивое снижение СКФ не менее чем на 40% до уровня ниже 60 мл/мин/1,73 м2, развитие терминальной стадии хронической болезни почек и смерть от почечных или сердечно-сосудистых причин [37].
Нефропротективное действие ингибиторов SGLT2 при СД 2 типа считается класс-эффектом, что косвенно подтверждается как результатами вышеописанных исследований, так и некоторыми вторичными анализами [38]. Данных о соотношении нефропротективных эффектов различных представителей этой фармакологической группы мало, и получены они были преимущественно с помощью непрямых сравнений. В крупном мета-анализе, обобщившем результаты лечения более 39 тысяч пациентов из 58 исследований, было косвенным образом подтверждено превосходство эмпаглифлозина. Пациенты, получавшие эмпаглифлозин, имели более низкий риск достижения комбинированных конечных точек, включавших повышение креатинина, снижение СКФ и развитие терминальной стадии ХБП, не только по сравнению с больными, принимавшими плацебо, но и по сравнению с теми, кто получал дапаглифлозин или канаглифлозин. У пациентов на терапии дапаглифлозином, по результатам данной работы, относительный риск неблагоприятных почечных исходов был выше, чем у больных, принимавших плацебо. Кроме того, эмпаглифлозин оказался единственным ингибитором SGLT2, способным снижать риск развития острого повреждения почек по сравнению с плацебо [39].
В работе D. Z. Cherney et al. при назначении эмпаглифло-зина пациентам с СД 1 типа, имеющим почечную гиперфильтрацию, наблюдалось уменьшение сывороточной концентрации оксида азота, увеличение сопротивления почечных сосудов, снижение эффективного почечного плазмотока и СКФ. Данные изменения регистрировались как в условиях гипер-, так и в условиях нормогликемии. В то же время эти параметры значимо не изменялись при применении эмпа-глифлозина у пациентов с СД 1 типа и нормальными значениями СКФ [40]. Вторичный анализ результатов данного исследования с расчётом показателей внутрипочечной гемодинамики по методу D. M. Gomez [41] показал, что у пациентов с гиперфильтрацией даже при нормальном системном артериальном давлении и нормоальбуминурии наблюдалась внутриклубочковая гипертензия, которая уменьшалась на фоне терапии эмпаглифлозином за счёт изменения сопротивления афферентных почечных сосудов [42].
При проведении анализа влияния ингибитора SGLT2 дапаглифлозина на экскрецию маркеров воспаления и повреждения канальцев почек была установлена способность данного препарата уменьшать выделение с мочой молекулы повреждения почек KIM-1 и интерлейкина-6. В то же время экскреция других маркеров (моноцитарного хемоат- трактантного белка 1, нейтрофильного желатиназо-ассоциированного липокалина и печёночной формы белка, связывающего жирные кислоты) не изменялась [43].
Большое внимание исследователи уделяют изучению эффективности и безопасности ингибиторов SGLT2 у пациентов, имеющих ХБП со снижением СКФ. В исследовании EMPA-REG OUTCOME были продемонстрированы благоприятные почечные эффекты эмпаглифлозина при СД 2 типа, как в группе пациентов с СКФ≥60 мл/мин/1,73 м2, так и у пациентов с СКФ 30-59 мл/мин/1,73 м2 [34]. В исследовании DERIVE оценивались эффективность и безопасность дапаглифлозина у пациентов с СД 2 типа и ХБП 3а стадии. Применение дапаглифлозина в этой группе больных было ассоциировано со статистически значимым снижением гликированного гемоглобина, индекса массы тела и систолического артериального давления без повышения риска неблагоприятных событий [44]. В мета-анализе, включившем результаты 11 клинических исследований, было показано, что влияние дапаглифлозина на гематокрит, массу тела и систолическое артериальное давление не зависит от исходных значений СКФ. Кроме того, более выраженное снижение уровня альбуминурии происходит у пациентов с наиболее низкой СКФ [45].
Значительный интерес представляет изучение неф-ропротективных эффектов комбинированной терапии, включающей ингибиторы SGLT2. В настоящее время проводится исследование RACELINES (Renal Actions of Combined Empagliflozin and LINagliptin in Type 2 diabetES, NCT03433248), направленное на изучение почечных эффектов комбинации эмпаглифлозина и ингибитора дипепти-дилпептидазы-4 линаглиптина. Дизайн исследования предполагает добавление к терапии метформином в первой группе – эмпаглифлозина на 8 недель с последующим переходом на комбинацию эмпаглифлозин+линаглиптин, во второй группе – линаглиптина на 8 недель с последующим переходом на комбинацию эмпаглифлозин+линаглиптин, в контрольной группе – гликлазида с последующим увеличением его дозы через 8 недель. По результатам планируется оценить влияние эмпаглифлозина и линаглиптина на СКФ, экскрецию альбумина и электролитов, pH мочи, индекс массы тела, функцию бета-клеток поджелудочной железы и биохимические показатели [46]. Безопасность комбинации эмпаглифлозина и линаглиптина была продемонстрирована в проведенном ранее исследовании [47].
Опыт изучения почечных эффектов ингибиторов SGLT2 у пациентов, не страдающих сахарным диабетом, на текущий момент крайне ограничен. В настоящее время проводится исследование, в котором с помощью метода функциональной магнитно-резонансной томографии оценивается влияние эмпаглифлозина на оксигенацию ткани почек здоровых добровольцев с различным индексом массы тела [48]. В работе Н. Rajasekaran et al. изучались эффекты назначения да-паглифлозина пациентам с фокально-сегментарным гломерулосклерозом в течение 8 недель, значимого влияния на почечную гемодинамику и уровень протеинурии выявлено не было [49]. Ожидается публикация результатов плаце-бо-контролируемого исследования RECEDE-CHF, посвященного изучению эффектов добавления эмпаглифлозина к терапии петлевыми диуретиками в группе пациентов с хронической сердечной недостаточностью. Помимо влияния на диурез, в исследовании планируется оценить изменения уровня цистатина С, СКФ, экскреции натрия и альбумина с мочой на фоне комбинированной терапии [50].
Заключение. Таким образом, для ингибиторов SGLT2 характерно наличие многокомпонентного нефропротек-тивного действия, которое подтверждается результатами как экспериментальных, так и клинических исследований. Почечные эффекты представителей данной фармакологической группы имеют точки соприкосновения с большим количеством звеньев патогенеза диабетической нефропатии, в связи с чем нефропротективный потенциал ин-
ЛИТЕРАТУРА гибиторов SGLT2 максимально реализуется в условиях наличия СД и остаётся не вполне ясным в случае другой патологии почек. В настоящее время наибольшую научную и практическую значимость представляет изучение сравнительной эффективности различных ингибиторов SGLT2 в отношении нефропротекции, а также возможностей персонализации лечения и комбинированной фармакотерапии.
-
1. Thrasher J. Pharmacologic Management of Type 2 Diabetes Mellitus: Available Therapies // Am. J. Cardiol. 2017 . Vol. 120. S. 1. P. S4-S16. doi: 10.1016/j. amjcard.2017.05.009.
-
2. Демидова Т.Ю. Сосудистые осложнения сахарного диабета 2 типа за гранью гликемического контроля // Сахарный диабет. 2010 . №3. С. 111-116.
-
3. Muskiet M.H., Tonneijck L., Smits M.M. et al. Pleiotropic effects of type 2 diabetes management strategies on renal risk factors // Lancet Diabetol. Endocrinol. 2015 . Vol. 3. P. 367-381. doi: 10.1016/S2213-8587(15)00030-3.
-
4. Bonadonna R.C., Borghi C., Consoli A., Volpe M. Novel antidiabetic drugs and cardiovascular risk: Primum non nocere // Nutr. Metab. Cardiovasc. Dis. 2016 . Vol. 26. P. 759-766. doi: 10.1016/j.numecd.2016.05.007.
-
5. Vallianou N.G., Geladari E., Kazazis C.E. SGLT-2 inhibitors: Their pleiotropic properties // Diabetes Metab. Syndr. 2017 . Vol. 11. P. 311-315. doi: 10.1016/j. dsx.2016.12.003.
-
6. Satoh H. Pleiotropic effects of SGLT2 inhibitors beyond the effect on glycemic control // Diabetol. Int. 2018 . Vol. 9. P. 212-214. doi: 10.1007/s13340-018-0367-x.
-
7. Maltese G., Abou-Saleh A., Gnudi L., Karalliedde J. Preventing diabetic renal disease: the potential reno-protective effects of SGLT2 inhibitors // Br. J. Diabetes Vasc. Dis. 2015 . Vol. 15. P. 114-118. doi: 10.15277/bjdvd.2015.031.
-
8. Prie D. Familial renal glycosuria and modifications of glucose renal excretion // Diabetes Metab. 2014 . Vol. 40. S. 1. P. S12-S16. doi: 10.1016/S1262-3636(14)72690-4.
-
9. Vallon V. The mechanisms and therapeutic potential of SGLT2 inhibitors in diabetes mellitus // Annu. Rev. Med. 2015 . Vol. 66. P. 255-270. doi: 10.1146/ annurev-med-051013-110046.
-
10. Maldonado-Cervantes M.I., Galicia O.G., Moreno-Jaime B. et al. Autocrine modulation of glucose transporter SGLT2 by IL-6 and TNF-α in LLC-PK1 cells // J. Physiol. Biochem. 2012 . Vol. 68. P. 411-420. doi: 10.1007/s13105-012-0153-3.
-
11. Panchapakesan U., Pegg K., Gross S. et al. Effects of SGLT2 inhibition in human kidney proximal tubular cells – renoprotection in diabetic nephropathy? // PLoS One. 2013 . Vol. 8. e54442. doi: 10.1371/journal.pone.0054442.
-
12. Vallon V., Thomson S.C. Targeting renal glucose reabsorption to treat hyperglycaemia: the pleiotropic effects of SGLT2 inhibition // Diabetologia. 2017 . Vol. 60. P. 215-225. doi: 10.1007/s00125-016-4157-3.
-
13. Malatiali S., Francis I., Barac-Nieto M. Phlorizin prevents glomerular hyperfiltration but not hypertrophy in diabetic rats // Exp. Diabetes Res. 2008 . Vol. 2008. ID305403. doi: 10.1155/2008/305403.
-
14. Osorio H., Coronel I., Arellano A. et al. Sodium-glucose cotransporter inhibition prevents oxidative stress in the kidney of diabetic rats // Oxid. Med. Cell. Longev. 2012 . Vol. 2012. ID542042. doi: 10.1155/2012/542042.
-
15. Wakisaka M., Nagao T., Yoshinari M. Sodium glucose cotransporter 2 (SGLT2) plays as a physiological glucose sensor and regulates cellular contractility in rat mesangial cells // PLoS ONE. 2016 . Vol. 11. e0151585. doi: 10.1371/journal.pone.0151585.
-
16. Gembardt F., Bartaun C., Jarzebska N. et al. The SGLT2 inhibitor empagliflozin ameliorates early features of diabetic nephropathy in BTBR ob/ob type 2 diabetic mice with and without hypertension // Am. J. Physiol. Renal Physiol. 2014 . Vol. 307. P. F317-F325. doi: 10.1152/ajprenal.00145.2014.
-
17. Gallo L.A., Ward M.S., Fotheringham A.K. et al. Once daily administration of the SGLT2 inhibitor, empagliflozin, attenuates markers of renal fibrosis without improving albuminuria in diabetic db/db mice // Sci Rep. 2016 . Vol. 26. e26428. doi: 10.1038/srep26428.
-
18. Gangadharan Komala M., Gross S., Mudaliar H. et al. Inhibition of kidney proximal tubular glucose reabsorption does not prevent against diabetic nephropathy in type 1 diabetic eNOS knockout mice // PLoS One. 2014 . Vol. 9. e108994. doi: 10.1371/journal.pone.0108994.
-
19. Ojima A., Matsui T., Nishino Y. et al. Empagliflozin, an Inhibitor of Sodium-Glucose Cotransporter 2 Exerts Anti-Inflammatory and Antifibrotic Effects on Experimental Diabetic Nephropathy Partly by Suppressing AGEs-Receptor Axis // Horm. Metab. Res. 2015 . Vol. 47. P. 686-692. doi: 10.1055/s-0034-1395609.
-
20. Terami N., Ogawa D., Tachibana H. et al. Long-term treatment with the sodium glucose cotransporter 2 inhibitor, dapagliflozin, ameliorates glucose homeostasis and diabetic nephropathy in db/db mice // PLoS One. 2014 . Vol. 24. e100777. doi: 10.1371/journal.pone.0100777.
-
21. Hatanaka T., Ogawa D., Tachibana H. et al. Inhibition of SGLT2 alleviates diabetic nephropathy by suppressing high glucose-induced oxidative stress in type 1 diabetic mice // Pharmacol. Res. Perspect. 2016 . Vol. 4. e00239. doi: 10.1002/prp2.239 .
-
22. Nagata T., Fukuzawa T., Takeda M. et al. Tofogliflozin, a novel sodium-glucose co-transporter 2 inhibitor, improves renal and pancreatic function in db/ db mice // Br. J. Pharmacol. 2013 . Vol. 170. P. 519-531. doi: 10.1111/bph.12269.
-
23. Kawanami D., Matoba K., Takeda Y. et al. SGLT2 Inhibitors as a Therapeutic Option for Diabetic Nephropathy // Int. J. Mol. Sci. 2017 . Vol. 18. P. E1083. doi: 10.3390/ijms18051083.
-
24. Jaikumkao K., Pongchaidecha A., Chueakula N. et al. Renal outcomes with sodium glucose cotransporter 2 (SGLT2) inhibitor, dapagliflozin, in obese insulin-resistant model // Biochim. Biophys. Acta. 2018 . Vol. 1864. P. 2021-2033. doi: 10.1016/j.bbadis.2018.03.017.
-
25. Kojima N., Williams J.M., Slaughter T.N. et al. Renoprotective effects of combined SGLT2 and ACE inhibitor therapy in diabetic Dahl S rats // Physiol. Rep. 2015 . Vol. 3. e12436. doi: 10.14814/phy2.12436.
-
26. Li L., Konishi Y., Morikawa T. et al. Effect of a SGLT2 inhibitor on the systemic and intrarenal renin-angiotensin system in subtotally nephrectomized
rats // J. Pharm Sci. 2018 . Vol. 137. P. 220-223. doi: 10.1016/j.jphs.2017.10.006.
-
27. Zhang Y., Thai K., Kepecs D.M., Gilbert R.E. Sodium-glucose linked cotransporter-2 inhibition does not attenuate disease progression in the rat remnant kidney model of chronic kidney disease // PLoS ONE. 2016 . Vol. 11. e0144640. doi: 10.1371/journal.pone.0144640.
-
28. Tahara A., Takasu T. Prevention of progression of diabetic nephropathy by the SGLT2 inhibitor ipragliflozin in uninephrectomized type 2 diabetic mice // Eur. J. Pharmacol. 2018 . Vol. 830. P. 68-75. doi: 10.1016/j.ejphar.2018.04.024.
-
29. Ma Q., Steiger S., Anders H.J. Sodium glucose transporter-2 inhibition has no renoprotective effects on non-diabetic chronic kidney disease // Physiol. Rep. 2017 . Vol. 5. e13228. doi: 10.14814/phy2.13228.
-
30. Chang Y.-K., Choi H., Jeong J.Y. et al. Dapagliflozin, SGLT2 Inhibitor, attenuates renal ischemia-reperfusion injury // PLoS ONE. 2016 . Vol. 11. e0158810. doi: 10.1371/journal.pone.0158810.
-
31. Zapata-Morales J.R., Galicia-Cruz O.G., Franco M., Morales F.M. Hypoxia-inducible factor-1α (HIF-1α) protein diminishes sodium glucose transport 1 (SGLT1) and SGLT2 protein expression in renal epithelial tubular cells (LLC-PK1) under hypoxia // J. Biol. Chem. 2014 . Vol. 289. P. 346-357. doi: 10.1074/ jbc.M113.526814.
-
32. Shimazu T., Hirschey M.D., Newman J. et al. Suppression of oxidative stress by beta-hydroxybutyrate, an endogenous histone deacetylase inhibitor // Science. 2013 . Vol. 339. P. 211-214. doi: 10.1126/science.1227166.
-
33. Guder W.G., Wagner S., Wirthensohn G. Metabolic fuels along the nephron: pathways and intracellular mechanisms of interaction // Kidney Int. 1986 . Vol. 29. P. 41-45.
-
34. Wanner C., Inzucchi S.E., Zinman B. et al. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes // N. Engl. J. Med. 2016 . Vol. 375. P. 323334. doi: 10.1056/NEJMc1611290.
-
35. Mudaliar S., Alloju S., Henry R.R. Can a Shift in Fuel Energetics Explain the Beneficial Cardiorenal Outcomes in the EMPA-REG OUTCOME Study? A Unifying Hypothesis // Diabetes Care. 2016 . Vol. 39. P. 1115-1122. doi: 10.2337/dc16-0542.
-
36. Perkovic V., de Zeeuw D., Mahaffey K.W. et al. Canagliflozin and renal outcomes in type 2 diabetes: results from the CANVAS Program randomised clinical trials // Lancet Diabetes Endocrinol. 2018 . Vol. 6. P. 691-704. doi: 10.1016/S2213-8587(18)30141-4.
-
37. Wiviott S.D., Raz I., Bonaca M.P. et al. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes // N. Engl. J. Med. 2018 . Nov 10. [Epub ahead of print]. doi: 10.1056/NEJMoa1812389.
-
38. Clegg L.E., Heerspink H.J.L., Penland R.C. et al. Reduction of Cardiovascular Risk and Improved Estimated Glomerular Filtration Rate by SGLT2 Inhibitors, Including Dapagliflozin, Is Consistent Across the Class: An Analysis of the Placebo Arm of EXSCEL // Diabetes Care. 2019 . Vol. 42. P. 318-326. doi: 10.2337/dc18-1871.
-
39. Tang H., Li D., Zhang J. et al. Sodium-glucose co-transporter-2 inhibitors and risk of adverse renal outcomes among patients with type 2 diabetes: A network and cumulative meta-analysis of randomized controlled trials // Diabetes Obes. Metab. 2017 . Vol. 19. P. 1106-1115. doi: 10.1111/dom.12917
-
40. Cherney D.Z., Perkins B.A., Soleymanlou N. et al. Renal hemodynamic effect of sodium-glucose cotransporter 2 inhibition in patients with type 1 diabetes mellitus // Circulation. 2014 . Vol. 129. P. 587-597. doi: 10.1161/CIRCULATIONAHA.113.005081.
-
41. Gomez D.M. Evaluation of renal resistances, with special reference to changes in essential hypertension // J. Clin. Invest. 1951 . Vol. 30. P. 1143-1155.
-
42. Skrtic M., Yang G.K., Perkins B.A. Characterisation of glomerular haemodynamic responses to SGLT2 inhibition in patients with type 1 diabetes and renal hyperfiltration // Diabetologia. 2014 . Vol. 57. P. 2599-2602. doi: 10.1007/s00125-014-3396-4.
-
43. Dekkers C.C.J., Petrykiv S., Laverman G.D. et al. Effects of the SGLT-2 inhibitor dapagliflozin on glomerular and tubular injury markers // Diabetes Obes Metab. 2018 . Vol. 20. P. 1988-1993. doi: 10.1111/dom.13301.
-
44. Fioretto P., Del Prato S., Buse J.B. et al. Efficacy and safety of dapagliflozin in patients with type 2 diabetes and moderate renal impairment (chronic kidney disease stage 3A): The DERIVE Study // Diabetes Obes. Metab. 2018 . Vol. 20. P. 2532-2540. doi: 10.1111/dom.13413.
-
45. Petrykiv S., Sjostrom C.D., Greasley P.J. Differential Effects of Dapagliflozin on Cardiovascular Risk Factors at Varying Degrees of Renal Function // Clin. J. Am. Soc. Nephrol. 2017 . Vol. 12. P. 751-759. doi: 10.2215/CJN.10180916.
-
46. U. S. National Library of Medicine Clinical Trials Database . URL: https://clinicaltrials.gov .
-
47. Lewin A., DeFronzo R.A., Patel S. et al. Initial combination of empagliflozin and linagliptin in subjects with type 2 diabetes // Diabetes Care. 2015 . Vol. 38. P. 394-402. doi: 10.2337/dc14-2365.
-
48. Muller M.E., Pruijm M., Bonny O. et al. Effects of the SGLT-2 Inhibitor Empagliflozin on Renal Tissue Oxygenation in Non-Diabetic Subjects: A Randomized, Double-Blind, Placebo-Controlled Study Protocol // Adv Ther. 2018 . Vol. 35. P. 875-885. doi: 10.1007/s12325-018-0708-y.
-
49. Rajasekeran H., Reich H.N., Hladunewich M.A. et al. Dapagliflozin in focal segmental glomerulosclerosis: a combined human-rodent pilot study // Am. J. Physiol. Renal Physiol. 2018 . Vol. 314. P. F412-F422. doi: 10.1152/ajprenal.00445.2017.
-
50. Mordi N.A., Mordi I.R., Singh J.S. Renal and Cardiovascular Effects of sodium-glucose cotransporter 2 (SGLT2) inhibition in combination with loop Diuretics in diabetic patients with Chronic Heart Failure (RECEDE-CHF): protocol for a randomised controlled double-blind cross-over trial // BMJ Open. 2017 . Vol. 7. E018097. doi: 10.1136/bmjopen-2017-018097.
Список литературы Механизмы и клиническое значение нефропротективного действия ингибиторов натрий-глюкозного котранспортёра 2 типа
- Thrasher J. Pharmacologic Management of Type 2 Diabetes Mellitus: Available Therapies//Am. J. Cardiol. 2017. Vol. 120. S. 1. P. S4-S16 DOI: 10.1016/j.amjcard.2017.05.009
- Демидова Т.Ю. Сосудистые осложнения сахарного диабета 2 типа за гранью гликемического контроля//Сахарный диабет. 2010. №3. С. 111-116.
- Muskiet M.H., Tonneijck L., Smits M.M. et al. Pleiotropic effects of type 2 diabetes management strategies on renal risk factors//Lancet Diabetol. Endocrinol. 2015. Vol. 3. P. 367-381 DOI: 10.1016/S2213-8587(15)00030-3
- Bonadonna R.C., Borghi C., Consoli A., Volpe M. Novel antidiabetic drugs and cardiovascular risk: Primum non nocere//Nutr. Metab. Cardiovasc. Dis. 2016. Vol. 26. P. 759-766 DOI: 10.1016/j.numecd.2016.05.007
- Vallianou N.G., Geladari E., Kazazis C.E. SGLT-2 inhibitors: Their pleiotropic properties//Diabetes Metab. Syndr. 2017. Vol. 11. P. 311-315 DOI: 10.1016/j.dsx.2016.12.003
- Satoh H. Pleiotropic effects of SGLT2 inhibitors beyond the effect on glycemic control//Diabetol. Int. 2018. Vol. 9. P. 212-214 DOI: 10.1007/s13340-018-0367-x
- Maltese G., Abou-Saleh A., Gnudi L., Karalliedde J. Preventing diabetic renal disease: the potential reno-protective effects of SGLT2 inhibitors//Br. J. Diabetes Vasc. Dis. 2015. Vol. 15. P. 114-118 DOI: 10.15277/bjdvd.2015.031
- Prie D. Familial renal glycosuria and modifications of glucose renal excretion//Diabetes Metab. 2014. Vol. 40. S. 1. P. S12-S16 DOI: 10.1016/S1262-3636(14)72690-4
- Vallon V. The mechanisms and therapeutic potential of SGLT2 inhibitors in diabetes mellitus//Annu. Rev. Med. 2015. Vol. 66. P. 255-270 DOI: 10.1146/annurev-med-051013-110046
- Maldonado-Cervantes M.I., Galicia O.G., Moreno-Jaime B. et al. Autocrine modulation of glucose transporter SGLT2 by IL-6 and TNF-α in LLC-PK1 cells//J. Physiol. Biochem. 2012. Vol. 68. P. 411-420 DOI: 10.1007/s13105-012-0153-3
- Panchapakesan U., Pegg K., Gross S. et al. Effects of SGLT2 inhibition in human kidney proximal tubular cells -renoprotection in diabetic nephropathy?//PLoS One. 2013. Vol. 8. e54442 DOI: 10.1371/journal.pone.0054442
- Vallon V., Thomson S.C. Targeting renal glucose reabsorption to treat hyperglycaemia: the pleiotropic effects of SGLT2 inhibition//Diabetologia. 2017. Vol. 60. P. 215-225 DOI: 10.1007/s00125-016-4157-3
- Malatiali S., Francis I., Barac-Nieto M. Phlorizin prevents glomerular hyperfiltration but not hypertrophy in diabetic rats//Exp. Diabetes Res. 2008. Vol. 2008. ID305403 DOI: 10.1155/2008/305403
- Osorio H., Coronel I., Arellano A. et al. Sodium-glucose cotransporter inhibition prevents oxidative stress in the kidney of diabetic rats//Oxid. Med. Cell. Longev. 2012. Vol. 2012. ID542042 DOI: 10.1155/2012/542042
- Wakisaka M., Nagao T., Yoshinari M. Sodium glucose cotransporter 2 (SGLT2) plays as a physiological glucose sensor and regulates cellular contractility in rat mesangial cells//PLoS ONE. 2016. Vol. 11. e0151585 DOI: 10.1371/journal.pone.0151585
- Gembardt F., Bartaun C., Jarzebska N. et al. The SGLT2 inhibitor empagliflozin ameliorates early features of diabetic nephropathy in BTBR ob/ob type 2 diabetic mice with and without hypertension//Am. J. Physiol. Renal Physiol. 2014. Vol. 307. P. F317-F325 DOI: 10.1152/ajprenal.00145.2014
- Gallo L.A., Ward M.S., Fotheringham A.K. et al. Once daily administration of the SGLT2 inhibitor, empagliflozin, attenuates markers of renal fibrosis without improving albuminuria in diabetic db/db mice//Sci Rep. 2016. Vol. 26. e26428 DOI: 10.1038/srep26428
- Gangadharan Komala M., Gross S., Mudaliar H. et al. Inhibition of kidney proximal tubular glucose reabsorption does not prevent against diabetic nephropathy in type 1 diabetic eNOS knockout mice//PLoS One. 2014. Vol. 9. e108994 DOI: 10.1371/journal.pone.0108994
- Ojima A., Matsui T., Nishino Y. et al. Empagliflozin, an Inhibitor of Sodium-Glucose Cotransporter 2 Exerts Anti-Inflammatory and Antifibrotic Effects on Experimental Diabetic Nephropathy Partly by Suppressing AGEs-Receptor Axis//Horm. Metab. Res. 2015. Vol. 47. P. 686-692 DOI: 10.1055/s-0034-1395609
- Terami N., Ogawa D., Tachibana H. et al. Long-term treatment with the sodium glucose cotransporter 2 inhibitor, dapagliflozin, ameliorates glucose homeostasis and diabetic nephropathy in db/db mice//PLoS One. 2014. Vol. 24. e100777 DOI: 10.1371/journal.pone.0100777
- Hatanaka T., Ogawa D., Tachibana H. et al. Inhibition of SGLT2 alleviates diabetic nephropathy by suppressing high glucose-induced oxidative stress in type 1 diabetic mice//Pharmacol. Res. Perspect. 2016. Vol. 4. e00239 DOI: 10.1002/prp2.239
- Nagata T., Fukuzawa T., Takeda M. et al. Tofogliflozin, a novel sodium-glucose co-transporter 2 inhibitor, improves renal and pancreatic function in db/db mice//Br. J. Pharmacol. 2013. Vol. 170. P. 519-531 DOI: 10.1111/bph.12269
- Kawanami D., Matoba K., Takeda Y. et al. SGLT2 Inhibitors as a Therapeutic Option for Diabetic Nephropathy//Int. J. Mol. Sci. 2017. Vol. 18. P. E1083 DOI: 10.3390/ijms18051083
- Jaikumkao K., Pongchaidecha A., Chueakula N. et al. Renal outcomes with sodium glucose cotransporter 2 (SGLT2) inhibitor, dapagliflozin, in obese insulin-resistant model//Biochim. Biophys. Acta. 2018. Vol. 1864. P. 2021-2033 DOI: 10.1016/j.bbadis.2018.03.017
- Kojima N., Williams J.M., Slaughter T.N. et al. Renoprotective effects of combined SGLT2 and ACE inhibitor therapy in diabetic Dahl S rats//Physiol. Rep. 2015. Vol. 3. e12436 DOI: 10.14814/phy2.12436
- Li L., Konishi Y., Morikawa T. et al. Effect of a SGLT2 inhibitor on the systemic and intrarenal renin-angiotensin system in subtotally nephrectomized rats//J. Pharm Sci. 2018. Vol. 137. P. 220-223 DOI: 10.1016/j.jphs.2017.10.006
- Zhang Y., Thai K., Kepecs D.M., Gilbert R.E. Sodium-glucose linked cotransporter-2 inhibition does not attenuate disease progression in the rat remnant kidney model of chronic kidney disease//PLoS ONE. 2016. Vol. 11. e0144640 DOI: 10.1371/journal.pone.0144640
- Tahara A., Takasu T. Prevention of progression of diabetic nephropathy by the SGLT2 inhibitor ipragliflozin in uninephrectomized type 2 diabetic mice//Eur. J. Pharmacol. 2018. Vol. 830. P. 68-75 DOI: 10.1016/j.ejphar.2018.04.024
- Ma Q., Steiger S., Anders H.J. Sodium glucose transporter-2 inhibition has no renoprotective effects on non-diabetic chronic kidney disease//Physiol. Rep. 2017. Vol. 5. e13228 DOI: 10.14814/phy2.13228
- Chang Y.-K., Choi H., Jeong J.Y. et al. Dapagliflozin, SGLT2 Inhibitor, attenuates renal ischemia-reperfusion injury//PLoS ONE. 2016. Vol. 11. e0158810 DOI: 10.1371/journal.pone.0158810
- Zapata-Morales J.R., Galicia-Cruz O.G., Franco M., Morales F.M. Hypoxia-inducible factor-1α (HIF-1α) protein diminishes sodium glucose transport 1 (SGLT1) and SGLT2 protein expression in renal epithelial tubular cells (LLC-PK1) under hypoxia//J. Biol. Chem. 2014. Vol. 289. P. 346-357 DOI: 10.1074/jbc.M113.526814
- Shimazu T., Hirschey M.D., Newman J. et al. Suppression of oxidative stress by beta-hydroxybutyrate, an endogenous histone deacetylase inhibitor//Science. 2013. Vol. 339. P. 211-214 DOI: 10.1126/science.1227166
- Guder W.G., Wagner S., Wirthensohn G. Metabolic fuels along the nephron: pathways and intracellular mechanisms of interaction//Kidney Int. 1986. Vol. 29. P. 41-45.
- Wanner C., Inzucchi S.E., Zinman B. et al. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes//N. Engl. J. Med. 2016. Vol. 375. P. 323-334 DOI: 10.1056/NEJMc1611290
- Mudaliar S., Alloju S., Henry R.R. Can a Shift in Fuel Energetics Explain the Beneficial Cardiorenal Outcomes in the EMPA-REG OUTCOME Study? A Unifying Hypothesis//Diabetes Care. 2016. Vol. 39. P. 1115-1122 DOI: 10.2337/dc16-0542
- Perkovic V., de Zeeuw D., Mahaffey K.W. et al. Canagliflozin and renal outcomes in type 2 diabetes: results from the CANVAS Program randomised clinical trials//Lancet Diabetes Endocrinol. 2018. Vol. 6. P. 691-704 DOI: 10.1016/S2213-8587(18)30141-4
- Wiviott S.D., Raz I., Bonaca M.P. et al. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes//N. Engl. J. Med. 2018. Nov 10 DOI: 10.1056/NEJMoa1812389
- Clegg L.E., Heerspink H.J.L., Penland R.C. et al. Reduction of Cardiovascular Risk and Improved Estimated Glomerular Filtration Rate by SGLT2 Inhibitors, Including Dapagliflozin, Is Consistent Across the Class: An Analysis of the Placebo Arm of EXSCEL//Diabetes Care. 2019. Vol. 42. P. 318-326 DOI: 10.2337/dc18-1871
- Tang H., Li D., Zhang J. et al. Sodium-glucose co-transporter-2 inhibitors and risk of adverse renal outcomes among patients with type 2 diabetes: A network and cumulative meta-analysis of randomized controlled trials//Diabetes Obes. Metab. 2017. Vol. 19. P. 1106-1115 DOI: 10.1111/dom.12917
- Cherney D.Z., Perkins B.A., Soleymanlou N. et al. Renal hemodynamic effect of sodium-glucose cotransporter 2 inhibition in patients with type 1 diabetes mellitus//Circulation. 2014. Vol. 129. P. 587-597 DOI: 10.1161/CIRCULATIONAHA.113.005081
- Gomez D.M. Evaluation of renal resistances, with special reference to changes in essential hypertension//J. Clin. Invest. 1951. Vol. 30. P. 1143-1155.
- Skrtic M., Yang G.K., Perkins B.A. Characterisation of glomerular haemodynamic responses to SGLT2 inhibition in patients with type 1 diabetes and renal hyperfiltration//Diabetologia. 2014. Vol. 57. P. 2599-2602 DOI: 10.1007/s00125-014-3396-4
- Dekkers C.C.J., Petrykiv S., Laverman G.D. et al. Effects of the SGLT-2 inhibitor dapagliflozin on glomerular and tubular injury markers//Diabetes Obes Metab. 2018. Vol. 20. P. 1988-1993 DOI: 10.1111/dom.13301
- Fioretto P., Del Prato S., Buse J.B. et al. Efficacy and safety of dapagliflozin in patients with type 2 diabetes and moderate renal impairment (chronic kidney disease stage 3A): The DERIVE Study//Diabetes Obes. Metab. 2018. Vol. 20. P. 2532-2540 DOI: 10.1111/dom.13413
- Petrykiv S., Sjostrom C.D., Greasley P.J. Differential Effects of Dapagliflozin on Cardiovascular Risk Factors at Varying Degrees of Renal Function//Clin. J. Am. Soc. Nephrol. 2017. Vol. 12. P. 751-759 DOI: 10.2215/CJN.10180916
- U. S. National Library of Medicine Clinical Trials Database. URL: https://clinicaltrials.gov.
- Lewin A., DeFronzo R.A., Patel S. et al. Initial combination of empagliflozin and linagliptin in subjects with type 2 diabetes//Diabetes Care. 2015. Vol. 38. P. 394-402 DOI: 10.2337/dc14-2365
- Muller M.E., Pruijm M., Bonny O. et al. Effects of the SGLT-2 Inhibitor Empagliflozin on Renal Tissue Oxygenation in Non-Diabetic Subjects: A Randomized, Double-Blind, Placebo-Controlled Study Protocol//Adv Ther. 2018. Vol. 35. P. 875-885 DOI: 10.1007/s12325-018-0708-y
- Rajasekeran H., Reich H.N., Hladunewich M.A. et al. Dapagliflozin in focal segmental glomerulosclerosis: a combined human-rodent pilot study//Am. J. Physiol. Renal Physiol. 2018. Vol. 314. P. F412-F422 DOI: 10.1152/ajprenal.00445.2017
- Mordi N.A., Mordi I.R., Singh J.S. Renal and Cardiovascular Effects of sodium-glucose cotransporter 2 (SGLT2) inhibition in combination with loop Diuretics in diabetic patients with Chronic Heart Failure (RECEDE-CHF): protocol for a randomised controlled double-blind cross-over trial//BMJ Open. 2017. Vol. 7. E018097 DOI: 10.1136/bmjopen-2017-018097


