Механизмы нарушения функции эндотелия и внутренних органов на фоне экспозиции хлоридом кобальта (экспериментальное исследование)
Автор: Гиголаева Л.В., Тибилов А.Г.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Экспериментальные модели и инструментальные исследования для оценки риска в гигиене и эпидемиологии
Статья в выпуске: 3 (15), 2016 года.
Бесплатный доступ
Поступление кобальта в организм человека является фактором риска развития легочных и сердечно-сосудистых нарушений здоровья. В данной работе отражены результаты исследований функциональных и биохимических механизмов развития эндотелиальной дисфункции и патологии внутренних органов при кобальтовой интоксикации в эксперименте. Выявлен системно-органный характер активации окислительных процессов по данным повышения вторичного продукта малонового диальдегида в эритроцитах и гомогенатах внутренних органов, а также участие дисбаланса антиокислительной системы в развитии липопероксидации, изучены особенности нарушения NO-образующей функции эндотелия и участие в этом процессе L-аргинина и аналога эндогенного ингибитора экспрессии eNOS -L-NC-аргинина, метилового эфира (L-NAMEилиL-nitro-arginin-methil-ester) при кобальтовой интоксикации в условиях активации окислительных процессов. Хроническая кобальтовая интоксикация у крыс приводит к активации окислительных процессов, при этом происходит угнетение активности супероксиддисмутазы, а концентрация каталазы и церулоплазмина повышается. Нарушаются обмен холестерина, продукция оксида азота и его биодоступность, что сопровождается изменением микроциркуляторной гемодинамики висцеральных органов. Проведена оценка функционального состояния внутренних органов по данным активности Na+,К+-АТФ-азы в гомогенатах, а также по активности органоспецифических и экскреторного ферментов в сыворотке крови на фоне кобальтовой интоксикации и выявлена роль изменений обмена холестерина как фактора риска атерогенеза в нарушении биодоступности оксида азота. Для патогенетической коррекции выявленных нарушений применен способ с использованием эндогенного антиоксиданта коэнзима Q10 и регуляторов экспрессии eNOS: L-аргинина, L-NAME, а также их комбинаций с коэнзимом Q10.
Атерогенез, оксид азота, перекисное окисление липидов, антиокислительная система, микроциркуляторная гемодинамика, хлорид кобальта, холестерин
Короткий адрес: https://sciup.org/14237963
IDR: 14237963 | УДК: 577.352.3
Текст научной статьи Механизмы нарушения функции эндотелия и внутренних органов на фоне экспозиции хлоридом кобальта (экспериментальное исследование)
кантом являются предприятия цветной металлургии.
Токсичность высоких концентраций кобальта обусловлена его гипоксическим действием, активацией перекисного окисления липидов (ПОЛ) и истощением антиоксидантной защиты (АОЗ) [1, 2, 7, 8]. Избыточное поступление в организм кобальта индуцирует перекисное окисление липидов и способствует формированию окислительного стресса, сопровождающегося дисфункцией эндотелия, повреждением биологических макромолекул, мембранных структур клеток и ферментов [8, 17]. Принимая на себя действие солей тяжелых цветных металлов, эндотелий становится прямой мишенью для повреждения, и эндотелиальная дисфункция играет патогенетическую роль в повреждении мембран клеток внутренних органов в условиях окислительного стресса. В механизме развития эндотелиальной дисфункции в условиях активации окислительных процессов играет роль снижение продукции оксида азота – основного вазодилатирующего фактора и его биодоступность [2, 6, 8, 14–16]. В нарушении транспорта NO в гладкомышечную клетку сосуда может быть значимо изменение метаболизма холестерина как фактора риска атерогенеза [6].
Исследованиями Peters K. et al. [16] показано, что двухвалентные ионы кобальта (Co2+) индуцируют экспрессию генов, реагирующих с гипоксией. В силу этого соединения кобальта используются даже для имитации гипоксии [11]. В свою очередь дисбаланс в оксидантно-антиоксидантной системе является существенным фактором риска развития патологии легочных структур, к примеру, бронхолегочной дисплазии [2].
Высокие дозы кобальта, попадающие в организм через дыхательные пути на вредных производствах, приводят к повышению содержания в крови холестерина, бета-липопротеидов, общих липидов и снижению лецитин-холестеринового коэффициента [17].
Вместе с тем в литературе весьма недостаточно представлены данные о влиянии окислительных процессов на метаболизм оксида азота как фактора риска развития сосудистых осложнений на фоне кобальтовой интоксикации, патогенетическим звеном которых становится нарушение функции эндотелия. В механизмах развития дисфункции эндотелия несомненную роль играет изменение метаболизма оксида азота – важного вазодилатирующего фактора. Изучение причинно-следственных связей акти- вации окислительных процессов метаболизма оксида азота при сосудистых осложнениях и разработке способов патогенетической коррекции – актуальная научная задача.
Учитывая вышеизложенное, цель исследования определяли как изучение влияния хлорида кобальта на биохимические показатели дисфункции эндотелия у крыс в эксперименте с кобальтовой интоксикацией.
Материалы и методы. Исследования проводились на 275 крысах-самцах линии «Вис-тар» одной возрастной группы (10–14 мес.), массой 175–220 г. Подопытные крысы были разбиты на 10 групп по 15–20 голов. Содержание животных и проведение экспериментов осуществляли в полном соответствии с «Правилами проведения работ с использованием экспериментальных животных» (Минобразования СССР, 1984), а также принципами Хельсинкской декларации (2000) и международными рекомендациями (этический кодекс) по проведению медико-биологических исследований с использованием животных (Совет международных научных организаций, 1985) В контрольную группу 1 входили интактные животные (n = 22), по возрасту и массе сопоставимые с основной группой, 55 голов составляли резервную группу. Кобальтовую интоксикацию у крыс опытных групп моделировали введением хлорида кобальта в дозе 6 мг/кг массы животного (исходя из DL50). Данная доза была оптимальной (подбирали по степени убывания), так как не влекла за собой гибели животного и в то же время вызывала соответствующие изменения со стороны изучаемых процессов. Развитие токсических влияний прослеживали в течение 30 дней. Во время эксперимента крысы находились на стандартном пищевом рационе и имели свободный доступ к питьевой воде, световой режим – естественный.
В эксперименте исследовались следующие показатели: интенсивность ПОЛ в мембранах эритроцитов по данным изменения концентрации малонового диальдегида (МДА) колориметрическим методом с тиобарбитуровой кислотой [1]; состояние антиокислительной системы (АОС) оценивали по активности каталазы [4] и супероксиддисмутазы (СОД) по методу аутоокисления адреналина, концентрацию церулоплазмина (ЦП) в сыворотке крови – по методу Равина [3]. О нарушении обмена холестерина судили по концентрации общего холестерина (ОХС) в сыворотке крови и его содержа- нии в липопротеидах низкой плотности (ЛНП) и липопротеидах высокой плотности (ЛВП). Концентрацию суммарных метаболитов NOХ определяли по реакции диазотирования Грисса [2].
Результаты и их обсуждение. У экспериментальных крыс на фоне длительной кобальтовой интоксикации, вызванной парентеральным введением хлорида кобальта, развиваются системные окислительные процессы. Зарегистрировано повышение концентрации МДА не только в эритроцитах, но и в гомогенатах почечной ткани: в корковом слое – на 212 %, в мозговом слое – на 92 % (при р <0,001); печеночной ткани – на 48,3 % и миокардиальной ткани – на 52,1 % (при р <0,001). Изучение корреляционных взаимосвязей между содержанием кобальта в плазме крови и активностью ПОЛ в эритроцитах выявило прямую корреляцию между этими показателями при затравке хлоридом кобальта в течение месяца. Анализ активности ферментов АОС показал достоверное ( р <0,001) снижение активности СОД в сыворотке крови и эритроцитах (на 27,7 %), повышение активности каталазы (на 64,1 %) и концентрации церулоплазмина (на 11,9 %), что следует рассматривать как возможное проявление клеточной компенсаторной реакции.
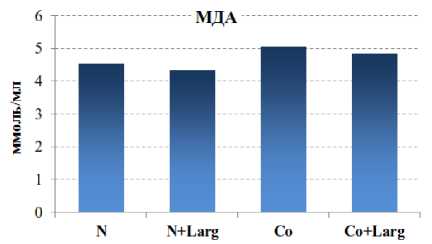
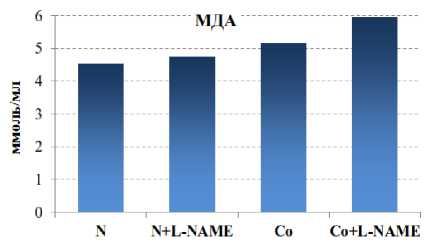
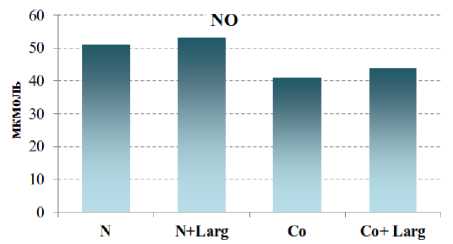
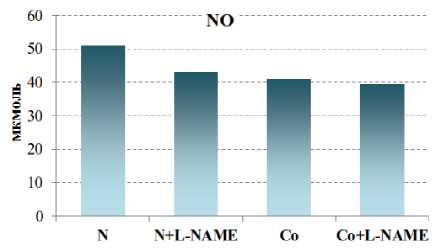
При интоксикации хлоридом кобальта у крыс на фоне активации окислительных процессов выявлено снижение концентрации суммарных метаболитов NO на 19,7 % ( р <0,001) и повышение при этом концентрации МДА – продукта ПОЛ – на 10,9 % (рис. 1). Для подтверждения роли этих химических факторов проведен корреляционный анализ, который показал наличие отрицательной сильной связи между повышением МДА в крови и снижением концентрации суммарных метаболитов NO ( r = –0,72).
В цепи механизмов, ведущих к развитию дефицита NO и дисфункции эндотелия, ключевым звеном является концентрация L-аргинина [10]. Для выяснения роли доступности субстрата L-аргинина для фермента NO-синтазы в специальной серии экспериментов вводили ежедневно в течение 4 недель крысам с кобальтовой интоксикацией L-аргинин в дозе 10 мг/кг веса тела. По окончании эксперимента определяли в сыворотке крови концентрацию оксида азота и показатели активации окислительных процессов. Полученные результаты продемонстрировали повышение концентрации NO в крови на фоне введения L-аргинина крысам с длительной интоксикацией сравнительно с данными,
1 – контроль; 2 – N+L-аргинин;
3 – Со; 4 – Со+L-аргинин
1 – контроль; 2 – N+L-NAME;
3 – Co; 4 – Co+L-NAME
б
а
Рис. 1. Изменения концентрации МДА и суммарных метаболитов NO на фоне донора NO-L-аргинина ( а ) и ингибитора eNOS – L-NAME при кобальтовой интоксикации ( б )
полученными только при кобальтовой интоксикации ( р <0,001). Введение L-аргинина крысам с длительной интоксикацией хлоридом кобальта вызвало уменьшение степени выраженности дисбаланса в системе «свободнорадикальное окисление (СРО) – АОЗ» и одновременно статистически достоверное повышение концентрации суммарных метаболитов NO в сыворотке крови. Введение же интактными затравленным крысам ингибитора еNOS–L-NAME показало, что содержание метаболитов ПОЛ возрастает, одновременно снижается концентрация суммарных метаболитов NO.
Выявленная активация СРО при введении интактным и особенно затравленным животным ингибитора еNOS – L-NAME может быть обусловлена так называемым «разобщением» ре-дуктазного и оксидазного доменов еNOS, когда фермент вместо NO продуцирует активные формы кислорода (АФК). Следовательно, в сыво- ротке крови концентрация NO может определяться содержанием субстрата синтеза L-аргинина, экспрессией эндотелиальной NO-синтазы, уровнем эндогенного ингибитора экспрессии еNOS и нарушением биодоступности NO.
Еще одним важным процессом, в определенной степени детерминирующим эффективность образования NO, является влияние окисленных ЛНП и лизофосфатидилхолина (продукта реакции, катализируемого фосфолипазой и ассоциированной с ЛНП) на транспорт L-аргинина в эндотелиальную клетку (ЭК) (рис. 2–4).
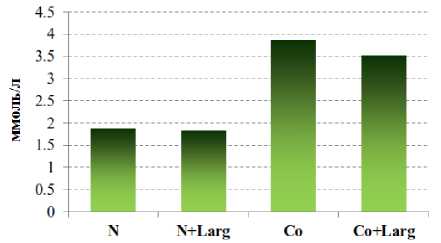
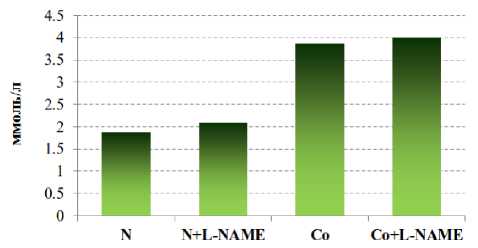
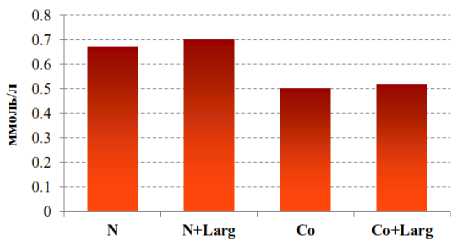
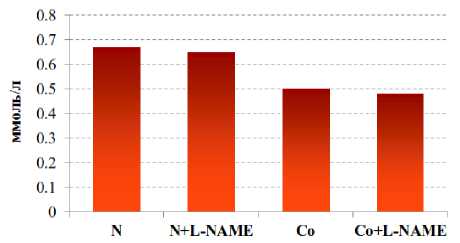
Анализ данных показал статистически достоверное повышение концентрации ОХС на 105,8 % ( р <0,001) в сыворотке крови у крыс с кобальтовой интоксикацией. Анализ распределения ХС в липопротеинах различной плотности показал снижение его уровня в ЛВП на 25,3 % и повышение в ЛНП на 186,3 %, т.е. в атерогенных ЛП-комплексах.
a б
Рис. 2. Изменение концентрации общего холестерина на фоне донора NO-L-аргинина ( а ) и ингибитора eNOS – L-NAME ( б ) при кобальтовой интоксикации (N – контроль)
a б
Рис. 3. Изменение концентрации липопротеидов высокой плотности на фоне донора NO-L-аргинина ( а ) и ингибитора eNOS – L-NAME ( б ) при кобальтовой интоксикации (N – контроль)
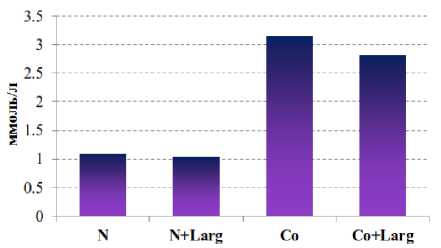
а
Рис. 4. Изменение концентрации липопротеидов низкой плотности на фоне донора NO-L-аргинина ( а ) и ингибитора eNOS – L-NAME ( б ) при кобальтовой интоксикации (N – контроль)
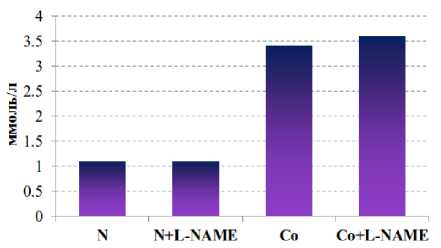
б
В стадии длительного воздействия хлоридом кобальта происходит гиперхолестеринемия и гипер-β-липопротеинемия, а это вследствие атерогенеза способствует повреждению эндотелия сосудов. Следует предположить, что в условиях повышенного содержания в крови реактивных форм кислорода, особенно радикала гидроксила ОН - - как наиболее реакционноспособного и вторичного продукта ПОЛ–МДА, происходит окислительная модификация ЛНП, включая пе-реокисление липидов и образование конъюгированных диенов, углеродная модификация (apо) β, а также энзиматическое превращение фосфолипазой фосфатидилхолина в лизофосфатидил-холин. Измененные, окисленные ЛНП (оЛНП) нарушают транспорт L-аргинина из сыворотки крови в ЭК, имеется и дефицит L-аргинина, субстрата синтеза NO, в результате снижается образование оксида азота и его биодоступность.
Исследовали показатели ПОЛ, активность мембранного фермента – Na,K-АТФ-азы, а также активность органоспецифических ферментов: АлАТ, АсАТ, ГГТП и экскреторного фермента – щелочной фосфатазы у крыс в длительной стадии кобальтовой интоксикации.
Полученные данные показали снижение активности Na,K-АТФ-азы в обоих слоях почечной ткани ( р <0,001), а также в печеночной и миокардиальной тканях. О повреждении кардиомиоцитов свидетельствует увеличение концентрации МДА в них, снижение активности Na,K-АТФ-азы, а также повышение в сыворотке крови АсАТ, являющейся наиболее органоспецифической для миокарда.
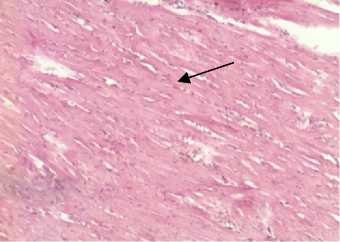
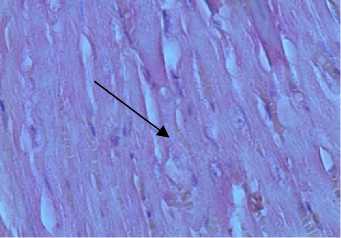
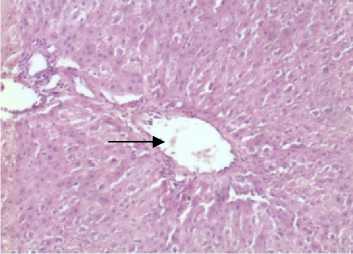
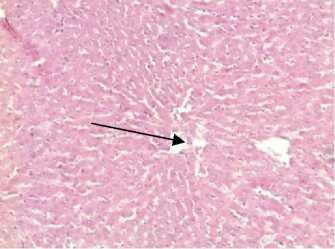
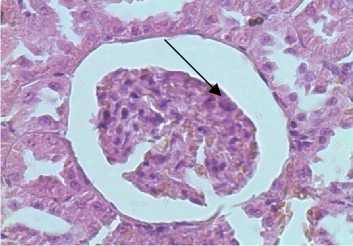
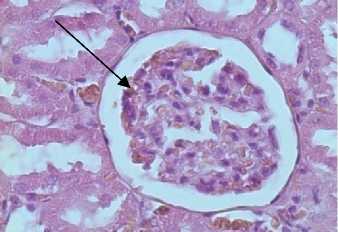
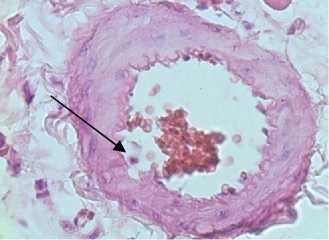
Токсические эффекты реализуются путем развития и прогрессирования эндотелиальной дисфункции и нарушением висцеральных органов: почек, печени, миокарда. Кобальтовая интоксикация вызывает, помимо функциональных изменений, нарушения морфологической структуры эндотелия сосудов и клеток внутренних органов. Полученные результаты были подтверждены гистологическими данными почечной, печеночной, миокардиальной тканей и эндотелия сосудов микроциркуляторного русла (рис. 5).
На срезах тканей внутренних органов у крыс с кобальтовой интоксикацией на фоне L-аргинина отмечались: частичная фрагментация кардиомиоцитов; умеренная паренхиматозно-белковая дистрофия и частичное исчезновение гликогена в гепатоцитах; умеренная гиалиновокапельная дистрофия канальцев и расширение мочевых пространств; умеренное утолщение сосудов микроциркуляторного русла.
На срезах тканей крыс с кобальтовой интоксикацией на фоне L-NAME (на рис. 5 фотографии справа) изменения более выражены. Отмечается: фрагментация и распад кардиомиоцитов, исчезновение поперечной исчерченности в большинстве кардиомиоцитов; расширение мочевых пространств, полнокровие клубочков, выраженная гиалиново-капельная дистрофия мочевых канальцев; выраженная паренхиматозно-белковая дистрофия печеночной ткани, умеренная жировая дистрофия (капли в виде прозрачных включений); умеренное утолщение эндотелия сосудистой стенки, неравномерность (шероховатость) сосудистой стенки.
Для коррекции выявленных нарушений, мы использовали коэнзим Q 10 и его комбинацию с L-аргинином и L-NAME. Исследование влияния коэнзима Q 10 и его комбинации с L-аргинином на состояние ПОЛ выявили существенное угнетение ПОЛ – статистически достоверное снижение концентрации МДА ( р <0,001) в крови на фоне коэнзима Q10 и его комбинации с L-аргинином. В другом варианте исследований на фоне L-NAME – ингибитора фермента
а
б
в
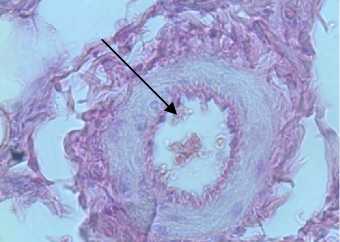
Рис. 5. Изменения морфологической структуры тканей внутренних органов и эндотелия сосудов микроциркуляторного русла у крыс с кобальтовой интоксикацией на фоне L-аргинина (слева) и на фоне ингибитора eNOS - L-NAME (справа) (окраска - гематоксилином и эозином, ув. х 400): а – миокардиальная ткань; б – печеночная ткань; в – почечная ткань; г – эндотелий сосудов микроциркуляторного русла
г
еNOS, эндогенный антиоксидант вызвал менее значимое угнетение интенсивности ПОЛ и снижение концентрации МДА в эритроцитах. При сравнительном анализе результатов ингибирования ПОЛ наиболее эффективным является коэнзим Q10 и его комплекс с L-аргинином.
Выводы. На фоне длительной индуцированной кобальтовой интоксикации активируются окислительные процессы. Повышается концентрация МДА в эритроцитах, в печеночной и миокардиальной тканях, гомогенатах коркового и мозгового вещества почек. В антиокисли-тельной системе отмечается дисбаланс, характеризующийся снижением активности суперокси-ддисмутазы в эритроцитах и компенсаторным повышением активности каталазы и концентра- ции церулоплазмина в сыворотке крови. Активация окислительных процессов сопровождается снижением концентрации суммарных метаболитов NO вследствие дефицита субстрата синтеза L-аргинина и повышения в крови ингибитора экспрессии eNOS-АДМА, установленные исследованиями на фоне введения аналога эндогенного ингибитора L-NAME.
Отмечается снижение активности Na,K-АТФ-азы в гомогенатах почечной, печеночной и миокардиальной тканях, а также повышение активности в сыворотке крови следующих ферментов: трансаминаз – АлАт, АсАт, а также ГГТП и щелочной фосфатазы, что свидетельствует о нарушении гидрофобности цитоплазматических мембран клеток и повышении их проницаемости.
Список литературы Механизмы нарушения функции эндотелия и внутренних органов на фоне экспозиции хлоридом кобальта (экспериментальное исследование)
- Бондаренко Л.В. Генетическая токсикология//Экологическая генетика. -2007. -Т. 5, № 1. -С. 39-41.
- Горюнов И.А., Джиоев И.Г. Особенности состояния перекисного окисления липидов и антиоксидантной активности при респираторном дистресс-синдроме у новорожденных//Вестник Международной академии наук экологии и безопасности жизнедеятельности. -2009. -Том 14, № 5. -С. 208-211.
- Камышников В.С. Определение содержания (активности) церулоплазмина//Справочник по клинико-биохимической лабораторной диагностике. -Минск, 2003. -Т. 2. -С. 71-79.
- Метод определения каталазы/М.А. Королюк, Л.И. Иванова, И.Г. Майорова, В.Ц. Токарев//Лабораторное дело. -1988. -№ 1. -С. 16-19.
- Oксид aзота: рoль в рeгуляции биoлoгичeских функций, мeтoдыoпрeдeлeния в крoви чeлoвека/В.А. Мeтeльскaя, Н.Г. Гумaнoва, Н.В. Перова, Р.Г. Оганов//Лабoрaтoрная мeдицинa. -2005. -№ 7. -С. 19-24.
- О санитарно-эпидемиологической обстановке в Республике Северная Осетия-Алания в 2014 г. . -Владикавказ, 2015. -URL: http://15rospotrebnadzor.ru/upload/document/1375867985.pdf (дата обращения: 15.06.2016).
- Отиев М.А., Дзугкоев С.Г., Можаева И.В. Биохимические маркеры дисфункции эндотелия на фоне экспозиции хлоридом кобальта в эксперименте у крыс//Здоровье и образование в ХХI веке. -2017. -Т. 17, № 3. -С. 67-71.
- Системный окислительный стресс и биохимические маркеры повреждения внутренних органов/С.Г. Дзугкоев, И.В. Можаева, Л.В. Гиголаева, Е.А. Такоева, Ф.С. Дзугкоева, О.И. Маргиева//Фундаментальные исследования. -2014. -№ 7. -С. 478-481.
- Аsakаwа T., Mаtsushitа S. Cоlоring cоnditiоns of thiоbarbituric аcid tеst, fоr dеtеcting lipidhyd11rоperоxides//Lipids. -1980. -Vol. 15. -P. 137-140.
- Böger R.H., Bode-Böger S.M. The clinical pharmacology of L-arginine//Annu. Rev. Pharmacol. Toxicol. -2001. -Vol. 41. -P. 79-99.
- Cobalt chloride-induced signaling in endothelium leading to the augmented adherence of sickle red blood cells and transendothelial migration of monocyte-like HL-60 cells is blocked by PAF-receptor antagonist/C. Sultana, Y. Shen, C. Johnson, V.K. Kalra//J. Cell. Physiol. -1999. -Vol. 179. -P. 67-78.
- Heavy metal ion induction of adhesion molecules and cytokines in human endothelial cells/M. Wagner, C.L. Klein, H. Kleinert, C. Euchenhofer, U. Forstermann, C.J. Kirkpatrick//The role of NF-kappaB, I kappaB-alpha and AP-1. Pathobiology. -1997. -Vol. 65. -P. 241-252.
- In vivo study of the effect of systemic hypoxia on leukocyte-endothelium interactions/N. Baudry, G. Danialou, J. Boczkowski, E. Vicaut//Am. J. Respir. Crit. Care. Med. -1998. -Vol. 158. -P. 477-483.
- Krantz S.B. Erythropoietin//Blood. -1991. -Vol. 77. -P. 419-434.
- Miranda K.M., Espey M.G., Wink D. A rapid, simple spectrophotometric method for simultaneous detection of nitrate and nitrite//Nitrtic Oxide: Biol & Chem. -2001. -№ 5. -P. 62-71.
- Paradoxical effects of hypoxia-mimicking divalent cobalt ions in human endothelial cells in vitro/K. Peters, H. Schmidt, R.E. Unger, G. Kamp, F. Pröls, B.J. Berger, C. Kirkpatrick//Molecular and Cellular Biochemistry. -2005. -Vol. 270, № 1. -Р. 157-166.
- Van Hinsbergh V.W. Regulatory functions of the coronary endothelium//Mol. Cell. Biochem. -1992. -Vol. 116. -P. 163-169


