Механизмы угнетения и восстановления гемопоэза у больных раком молочной железы в условиях химиотерапии по схеме доксорубицин/доцетаксел
Автор: Гольдберг Виктор Евгеньевич, Хричкова Т.Ю., Жданов В.В., Попова Н.О., Шаталова В.А., Симолина Е.И., Бурштейн Е.С., Дудникова Е.А., Подоплекин Д.М.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 6 (48), 2011 года.
Бесплатный доступ
Изучены токсические эффекты комбинации доксорубицин/доцетаксел у больных раком молочной железы III-IV стадии в отношении эритроидного и гранулоцитарного ростков гемопоэза, а также детально исследованы процессы их восстановления. Показано, что интенсивное созревание эритроидных и гранулоцитарных колониеобразующих единиц обеспечивает регенерацию кроветворения даже в условиях сниженной пролиферативной активности данных клеток, что, в свою очередь, ведет к накоплению в костном мозгу зрелых эритрокариоцитов, а также незрелых и зрелых нейтрофильных гранулоцитов.
Рак молочной железы, химиотерапия, эритропоэз, гранулоцитопоэз
Короткий адрес: https://sciup.org/14056761
IDR: 14056761 | УДК: 618.19-006.6:612.119:615.28
Текст научной статьи Механизмы угнетения и восстановления гемопоэза у больных раком молочной железы в условиях химиотерапии по схеме доксорубицин/доцетаксел
В настоящее время четко обозначены критерии отбора больных раком молочной железы (РМЖ) для цитостатической терапии: метод показан при агрессивном течении, наличии висцеральных метастазов или большом количестве опухолевых очагов, при негативных рецепторах эстрадиола и прогестерона в опухоли, при повышенной экспрессии Her-2-neu, при коротких сроках безмета-статического периода болезни, и чаще молодым менструирующим женщинам [1, 6].
Наиболее эффективными и часто используемыми являются комбинации, включающие антрациклины и таксаны, особенно у больных с висцеральными метастазами и, в частности, с метастазами в печени. По мнению ряда исследователей, эффективность комбинации доцетаксела с доксорубицином в качестве I линии химиотерапии составляет от 55 до 94 %, при II линии лечения – от 36 до 59% и сопровождается наиболее высокой выживаемостью [5, 10, 11].
Предпосылками для создания схемы доксору-бицин/доцетаксел явились: наибольшая эффективность каждого препарата в режиме монотерапии, отсутствие перекрестной резистентности и фар- макокинетического взаимодействия, различные механизмы их действия и профили токсичности, за исключением миелосупрессивных эффектов вышеназванных цитостатиков. В частности, при оценке гематологической токсичности указанной схемы выявлено, что нейтропения III–IV степени развилась у 85–90 %, а фебрильная нейтропения – у 30–40 % пациенток, получавших лечение комбинацией доксорубицин/доцетаксел [8, 9].
Учитывая несомненную клиническую значимость последствий миелосупрессии, а также принимая во внимание тот факт, что патогенетически обоснованный подбор гемостимулирующих средств невозможен без глубокого понимания процессов, развивающихся со стороны системы крови на фоне цитостатической терапии, можно утверждать, что изучение механизмов угнетения и восстановления эритроидного и гранулоцитарного ростков гемопоэза в условиях химиотерапии представляет несомненный интерес.
Цель настоящего исследования – изучение механизмов подавления и восстановления системы крови под действием комбинации доцетаксела с доксорубицином у больных раком молочной железы III–IV стадии.
Материал и методы
Было обследовано 47 больных с морфологически верифицированным РМЖ III–IV стадий. Все пациентки получали химиотерапию по схеме, включающей внутривенное введение 50 мг/м2 доксорубицина (адриабластин, Фармация и Апджон С.п.А., Италия) в 1-й день и 75 мг/м2 доцетаксела (таксотер, Авентис Фарма, С.А., Франция) – во 2-й день. Длительность цикла составляла два дня, а интервал между курсами – 3 нед. Показатели системы крови оценивали на протяжении 3 курсов химиотерапии.
Капиллярную кровь для исследования забирали до и после каждого цикла цитостатического лечения. Проведение преднизолоновых проб и стернальных пункций осуществляли до начала лечения, а также после I и II курсов химиотерапии. Определение показателей периферической крови (эритроциты, гемоглобин, лейкоциты, гемограмма) и дифференциальный подсчет миелограмм в стернальном пунктате производили стандартными гематологическими методами [4].
Клонирование клеток-предшественников гра-нулоцитопоэза (КОЕ-Г) и эритропоэза (КОЕ-Э)
из неприлипающих кариоцитов костного мозга и периферической крови больных, выделенных на градиенте плотности Histopaque–1077 (Sigma, США) (концентрация клеток 2,0×105 мл), осуществляли в полувязкой питательной среде на основе метилцеллюлозы. Интенсивность дифференцировки гемопоэтических предшественников определяли по величине индекса созревания (соотношение колоний к кластерам). Пролиферативную активность КОЕ изучали методом клеточного самоубийства с использованием гидроксимочевины [3].
Статистическую обработку полученных данных проводили методом вариационной статистики с использованием t-критерия Стьюдента.
Протокол исследования одобрен этическим комитетом НИИ онкологии СО РАМН.
Результаты и обсуждение
При применении исследуемой схемы в лечении больных РМЖ прослеживались адекватные компенсаторные сдвиги со стороны эритроидного ростка кроветворения: ускоренная дифференцировка незрелых эритрокариоцитов приводила к значительному возрастанию содержания в костном мозгу зрелых элементов эритропоэза, способных восполнять дефицит клеток в периферической крови, что и объясняло отсутствие лабораторных признаков анемии у данной группы пациентов.
Глубокий резерв красного ростка гемопоэза, представленный коммитированными клетками-предшественниками, значительно возрастал в условиях химиотерапии по схеме доксорубицин/ доцетаксел (рис. 1В). Как известно, полноценным механизмом гемопоэтической репарации является ускорение деления кроветворных предшественников на фоне высокой интенсивности их созревания [2]. Именно такая ситуация наблюдалась со стороны КОЕ-Э в костном мозгу у больных РМЖ при применении исследуемого химиотерапевтического режима, что проявилось в росте на 35 % от исходного уровня доли эритроидных прекурсоров в S-фазе митотического цикла уже перед вторым курсом лечения (рис. 1Д). Далее имело место снижение указанного показателя на фоне прогрессивного нарастания (до 127 % от уровня до начала химиотерапии) скорости созревания колониеобразующих единиц эритропоэза (рис. 1Д, 1Е).
Проведенные нами исследования показали, что общее количество лейкоцитов (ОКЛ) у пациентов, леченных с использованием препарата из группы
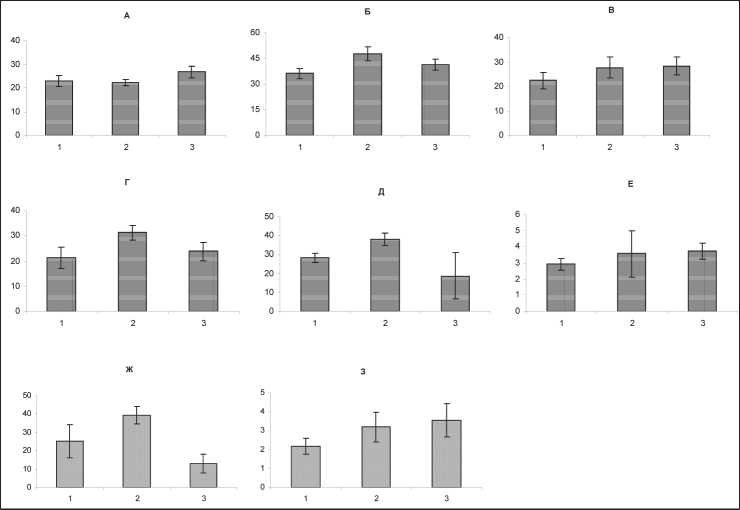
Рис. 1. Изменения содержания незрелых (А, %) и зрелых форм нейтрофильных гранулоцитов (Б, %), количество КОЕ-Э
(В, на 105 неприлипающих мононуклеаров), количество КОЕ-Г (Г, на 105 неприлипающих мононуклеаров), доля КОЕ-Э в S-фазе митотического цикла (Д, %), интенсивность созревания КОЕ-Э (Е), доля КОЕ-Г в S-фазе митотического цикла (Ж, %), интенсивность созревания КОЕ-Г (З) в костном мозгу больных раком молочной железы III–IV стадии в динамике противоопухолевой химиотерапии по схеме доксорубицин/доцетаксел. По оси абсцисс – сроки исследования (1 – до лечения, 2 – после первого курса, 3 – после второго курса), по оси ординат – значения показателя; доверительные интервалы при р<0,05
таксанов в сочетании с доксорубицином, уменьшилось более чем в 2 раза, уже после первого курса химиотерапии. По окончании 3-недельного перерыва отмечалось почти полное восстановление числа лейкоцитов, сменяющееся достоверным падением в ответ на второй курс специального лечения, однако менее выраженным, чем после завершения первого курса. В дальнейшем количество лейкоцитов сохранялось на достаточно высоком уровне, достоверно не отличаясь от значений до начала цитостатического воздействия. Уменьшение ОКЛ в большей степени было обусловлено снижением содержания сегментоядерных нейтрофилов в периферической крови, что является закономерным результатом воздействия цитостатических препаратов на клеточную продукцию.
Анализ стернальных пунктатов показал наличие компенсаторных сдвигов со стороны гранулоцитарного ростка кроветворения. Так, уже перед началом второго курса химиотерапии содержание зрелых нейтрофильных гранулоцитов (ЗНГ) достоверно выросло более чем на 31 % в сравнении с уровнем до начала лечения (рис. 1Б). В дальнейшем, в следующей точке оценки, имело место достоверное возрастание как ЗНГ, так и незрелых нейтрофильных гранулоцитов в среднем на 15 % от исходного уровня (рис. 1А, 1Б). Это обстоятельство, возможно, обусловлено отсутствием значительных повреждений комбинацией доксорубицин/ доцетаксел способных к митозу предшественников гранулоцитопоэза, что создает основу для активации регенераторных процессов в костном мозгу на ранних этапах цитостатической болезни [2] и косвенно свидетельствует о нарастающей активации в ходе химиотерапии как процессов пролиферации, так и дифференцировки клеток гранулоцитарного ряда под воздействием указанных препаратов.
Подтверждением данного предположения является существенное увеличение содержания в кроветворной ткани коммитированных предшественников гранулоцитопоэза как следствие активации процессов пролиферации и дифференцировки вышеназванных клеток уже по окончании первого курса химиотерапии (рис. 1Г, 1Ж, 1З). После вто-
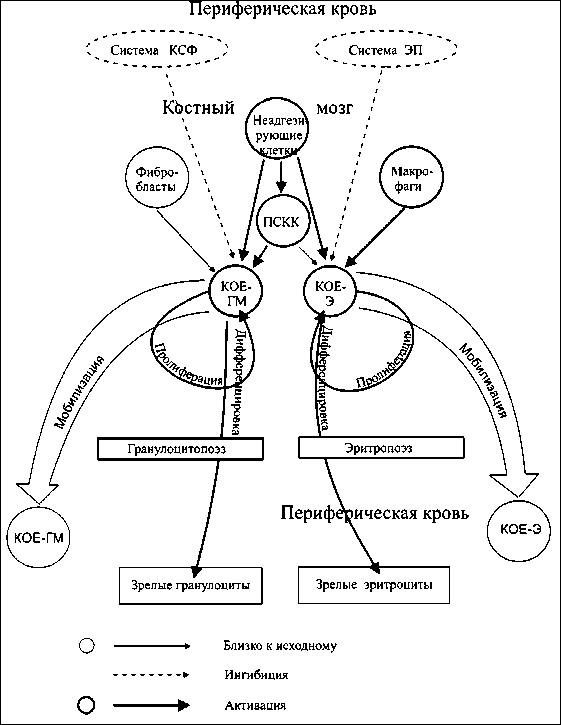
Рис. 2. Схема регуляции эритроидного и гранулоцитарного ростков кроветворения в условиях применения химиотерапевтической схемы доксорубицин/доцетаксел у больных раком молочной железы III–IV стадии
рого курса число КОЕ-Г оставалось повышенным, хотя и без достоверных различий в сравнении с исходным уровнем, что связано, с одной стороны, с определенным истощением пролиферативного потенциала клеток-предшественников (рис. 1Ж), а с другой – с еще более значительным увеличением (в 1,6 раза) индекса созревания гранулоцитарных прекурсоров (рис. 1З).
Таким образом, можно заключить, что в условиях цитостатической терапии по схеме доксорубицин/ доцетаксел важнейшее значение в поддержании кроветворения на должном уровне и нивелировании токсических эффектов химиопрепаратов играет ускорение созревания гемопоэтических предшественников, накапливающихся в костном мозгу в результате возрастания их пролиферативной активности на ранних этапах цитостатической болезни. Увеличение интенсивности дифференцировки указанных элементов (даже в условиях подавления пролиферации) приводит к возрастанию клеточности в отделах морфологически дифференцируемых и зрелых элементов костного мозга и периферической крови (рис. 2).
Полученные данные о механизмах, лежащих в основе изменений в системе крови под влиянием изученной схемы химиотерапии, во многом объясняют достаточно хорошую переносимость препаратов, что особенно актуально в связи с расширяющимся диапазоном применения таксан-содержащих режимов цитостатического лечения [7].
Выявленные закономерности могут быть положены в основу разработки патогенетически обоснованных методов коррекции нарушений со стороны системы крови при лечении цитостатической миелосупрессии, возникающей в условиях химиотерапии по схеме доксорубицин/доцетаксел, а также создания новых оригинальных препаратов, стимулирующих кроветворение.


