Меланиновая белково-энергетическая добавка из личинок Hermetia illucens в питании телят
Автор: Некрасов Р.В., Зеленченкова А.А., Чабаев М.Г., Ушакова Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Кормовые и биоактивные добавки
Статья в выпуске: 2 т.53, 2018 года.
Бесплатный доступ
Насекомые - один из природных источников различных биологически активных веществ, в том числе меланина. В связи с возможностью промышленного разведения некоторых видов насекомых для кормовых целей и производством различных продуктов переработки их биомассы необходима оценка биологической эффективности получаемых веществ. Целью настоящей работы было изучение эффективности использования меланиновой белково-энергетической добавки (МБЭД) из личинок мухи Hermetia illucens в кормлении телят черно-пестрой породы для повышения их сохранности и интенсивности роста. Исследования проводили на 30 телятах черно-пестрой породы в молочный период выращивания на базе ЭХ «Кленово-Чегодаево» (г. Москва). По принципу животных-аналогов сформировали три группы (по 10 гол. в каждой). Животные I (контрольной) группы получали основной рацион согласно схеме кормления, принятой в хозяйстве. В первый период опыта (телята 1-2-месячного возраста) животным II опытной группы скармливали индивидуально перорально 5,0 мл МЭБД (6 мг меланина·гол.-1·сут-1), животным III опытной группы - 7,5 мл (9 мг меланина·гол.-1·сут-1). Начиная с 3-месячного возраста, дозу добавки увеличили соответственно до 7,5 и 10 мл·гол.-1·сут-1. Продолжительность опыта составляла 89 сут. МЭБД получали из смеси личинок и предкуколок мухи Hermetia illucens (в соотношении 1:1), выращенных на дробленом зерне кукурузы. Ежедневно оценивали поедаемость кормов и оплату корма продукцией. Телят взвешивали индивидуально в начале и конце опыта, а также ежемесячно в период опыта. По завершении эксперимента у животных из каждой группы ( n = 3) брали кровь. В образцах цельной и стабилизированной крови оценивали биохимические и гематологические показатели. Также определяли лизоцимную, бактерицидную и фагоцитарную активность. Экскременты собирали индивидуально от телят из каждой группы ( n = 3) в конце эксперимента. Изучение химического состава МБЭД показало отсутствие в ней сырой клетчатки (хитина) при высоком содержании протеина, жира, минеральных веществ. Концентрация меланина составляла 1,2 мг/мл. МБЭД практически не содержала патогенных микроорганизмов, была нетоксичной. Среднесуточный прирост у телят из II и III групп был выше, чем у их аналогов из контрольной группы на 46,44 и 27,34 г, или на 4,23 и 2,49 %. Во II и III опытных группах наблюдалось снижение расхода корма на 1 кг прироста соответственно на 4,1 и 2,4 % по сравнению с контролем. Содержание общего белка в сыворотке крови у телят опытных групп уменьшалось на 3,45 и 2,71 г/л за счет уменьшения фракций альбуминов на 1,86 и 1,29 г/л и глобулинов - на 1,60 и 1,43 г/л. Наблюдалось снижение активности АлАТ на 4,3 IU/л (р 0,05 для II группы). Содержание лизоцима, лизис, бактерицидная активность в крови у телят опытных групп оказались практически одинаковыми - соответственно 0,47 и 0,49 мкг/л; 27,27 и 28,28 %; 80,39 и 82,35 %. При этом у телят из II и III групп показатель фагоцитарной активности был выше на 5,94 и 6,95 % (р 5 и 10,3×105 КОЕ/г, бифидобактерий - на 0,33×108 и 1,07×108 КОЕ/мл. Отмечалось повышение количества лактозоположительных кишечных палочек по сравнению с таковым у контрольных животных на 1,196×105 и 1,11×105 КОЕ/г (р -1·сут-1 в опытных группах телят в сравнении с контролем.
Телята, личинки, меланин, иммунитет, микрофлора
Короткий адрес: https://sciup.org/142214171
IDR: 142214171 | УДК: 636.22/.28.084.1:636.085.8:595.7 | DOI: 10.15389/agrobiology.2018.2.374rus
Текст научной статьи Меланиновая белково-энергетическая добавка из личинок Hermetia illucens в питании телят
На современном этапе развития животноводства остается не до конца решенной проблема низкой сохранности молодняка из-за высокой заболеваемости животных респираторными и желудочно-кишечными болезнями, приводящими к снижению интенсивности роста и нередко к гибели. Молочный и следующий за ним переходный период выращивания наиболее важны в жизни молодняка, поскольку потребность в питательных веществах из-за интенсивного роста животных велика, а развитие ферментативных систем желудочно-кишечного тракта еще не завершилось. Если 374
в молочный период в антибактериальной защите теленка важную роль играет молоко матери, то в переходный период риск заболеваний особенно велик, так как доля молока в рационе постепенно уменьшается, а собственная иммунная система находится на этапе становления (1). В структуре заболеваний новорожденных телят (1-30 сут) основное место занимают нарушения функции пищеварения, проявляющиеся диареей и, как следствие, резко выраженной дегидратацией, энофтальмией, токсемией и иммунодефицитом (2). Главной причиной массовых гастроэнтеритов телят становятся инфекционные агенты, в том числе вирусы, микробы, простейшие и грибы, вирулентность которых повышается на фоне неблагоприятных условий кормления и содержания (3).
В последние годы для лечения и профилактики инфекционных заболеваний животных бактериальной этиологии широко используются антимикробные лекарственные препараты, что не всегда дает желаемый результат. Это можно объяснить приспособительной изменчивостью микроорганизмов, а также возникновением у животных иммунодефицитных состояний под воздействием лекарственных препаратов (4). Как следствие, все больше внимания уделяется изучению и производству биологически активных кормовых добавок, действие которых направлено на стимуляцию неспецифического иммунитета животных (5, 6), профилактику и лечение смешанных желудочно-кишечных инфекций и расстройств пищеварения, вызванных нарушением микробиоценоза пищеварительного тракта (7, 8). В этой связи перспективны природные средства — растительные препараты, а также экстракты, полученные из органов и тканей животных (9, 10). Значительный интерес представляет черный пигмент меланин (11). Это высокомолекулярный биополимер нерегулярной структуры, относящийся к классу конденсированных фенольных соединений, которые обусловливают темную окраску покрова насекомых, волос человека, клеточной стенки грибов, растений и микроорганизмов (12). Наличие в его молекуле разнообразных функциональных групп, высокостабильных парамагнитных центров, сопряженной системы двойных связей обеспечивают разнообразное применение меланина в качестве фото-, радиопротектора и антиоксиданта (13).
Меланин относят к числу самых мощных природных антиоксидантов. Присутствие меланина в кормах может способствовать их длительному хранению (14). В процессе пищеварения меланин частично усваивается при участии микрофлоры кишечника, частично функционирует как энтеросорбент, регулятор перистальтики, нормализует состав кишечной микрофлоры. Он служит активным антидотом при острых отравлениях, на ранней стадии отравления эффективно выводит токсины из пищеварительного тракта до их всасывания в кровь (15). Меланин применяют при лечении и профилактике заболеваний печени, стрессе, онкологических болезнях. Использование меланина оказывает омолаживающее воздействие на организм, это сильнейший природный адаптоген (16).
Одним из природных источников различных биологически активных веществ, в том числе меланина, служат насекомые (17). В связи с возможностью промышленного разведения некоторых видов насекомых для кормовых целей и производством различных продуктов переработки их биомассы необходима оценка биологической эффективности получаемых веществ (18).
Заслуживают внимания личинки мухи черная львинка ( Hermetia illucens ). Этот биологический объект рассматривается как наиболее перспективный вид для промышленного разведения и использования биомассы личинок в составе кормов для животных (19, 20), а также аквакультуры
(21, 22). Они не аккумулируют пестициды или микотоксины (23, 24), содержат большое количество белка и жира (25). Химический состав личинок частично зависит от состава питательной среды, на которой они выращиваются (26). При этом их липидный профиль частично имитирует липидный профиль субстрата, а микронутриенты, такие как минералы и витамины, могут легко в них накапливаться (27). В работе N.S. Liland с соавт. (28) подтверждается пластичность питательного состава личинок, позволяющая накапливать как липидные, так и различные водорастворимые соединения.
Черный пигмент меланин и его влияние на продуктивность животных и качество мяса при скармливании изучены мало. А.И. Бастраков с соавт. (29) показали высокие антиинфекционные свойства меланин-хито-занового комплекса из подмора и пустых оболочек куколок. Применение добавки из личинок мухи Hermetia illucens потенциально может ускорить рост и развитие молодняка сельскохозяйственных животных, повысить их сохранность и стрессоустойчивость. Ее скармливание животным позволит дополнительно обеспечить растущий организм важнейшими питательными элементами, поскольку личинки мухи содержат полноценные белки и сбалансированное соотношение минеральных веществ (30).
В настоящей работе меланиновая белково-энергетическая добавка (МБЭД), полученная из личинок мухи Hermetia illucens , впервые использовалась в питании сельскохозяйственных животных. Ее скармливание приводило к улучшению состава кишечного микробиоценоза, снижению числа случаев диареи у телят в молочный и переходный периоды выращивания, улучшению конверсии кормов рациона, повышению среднесуточных приростов и сохранности молодняка.
Нашей целью было изучение эффективности использования меланиновой белково-энергетической добавки, получаемой из личинок мухи Hermetia illucens , в кормлении телят черно-пестрой породы для повышения их сохранности и интенсивности роста.
Методика . Исследования провели в 2017 году на 30 телятах чернопестрой породы в молочный период выращивания (1-4 мес) на базе экспериментального хозяйства «Кленово-Чегодаево» (г. Москва). По принципу животных-аналогов сформировали три группы по 10 гол. в каждой. Животные I (контрольной) группы получали основной рацион согласно схеме кормления, принятой в хозяйстве. Рацион состоял из комбикорма, цельного и регенерированного молока, сена злаково-разнотравного и силоса кукурузного, минеральных добавок. В рацион телят из II и III групп была включена меланиновая белково-энергетическая добавка. С начала опыта животным II опытной группы скармливали индивидуально перорально 0,5 мл МЭБД (6 мг меланина•гол.-1•сут-1), животным III опытной группы — 7,5 мл (9 мг меланина•гол.-1•сут-1). С 3-месячного возраста дозу увеличивали соответственно до 7,5 и 10 мл•гол. - 1•сут - 1. Продолжительность опыта составляла 89 сут. Ежедневно оценивали поедаемость кормов животными и оплату корма продукцией по расходу кормов на единицу прироста живой массы. Телят взвешивали индивидуально в начале и конце опыта (в утренние часы перед кормлением), а также ежемесячно в период опыта для определения валового и среднесуточного прироста живой массы.
Корма, входящие в рацион животных, отбирали для химического анализа согласно ГОСТ Р ИСО 6497-2011. Расчет обменной энергии проводили на основании содержания сырых питательных веществ (31), расчет рационов — с использованием программного комплекса КормОптимаЭкс-376
перт (Версия 2016.15.1.1, ООО «Корморесурс»).
МБЭД получали из смеси личинок и предкуколок мухи Hermetia illucens (в соотношении 1:1), выращенных на дробленом зерне кукурузы, посредством разведения отжатой массы в дистиллированной воде в соотношении 1:3 и последующей стерилизации суспензии при 100 ° С в течение 2 ч в качалочных колбах (по 250 мл суспензии). Дозу скармливания МБЭД рассчитывали, исходя из содержания водорастворимого меланина в добавке, которое определяли в отобранной аликвоте осаждением меланина НСl из 100 мл суспензии и высушиванием осадка. Предварительно суспензию центрифугировали 15 мин при 1200 g для отделения немеланиновой составляющей (центрифуга ОПн-8, АО ТНК «ДАСТАН», Россия). Полученный осадок меланина отделяли центрифугированием в том же режиме, нейтрализовали, сушили и взвешивали. В подготовленной к испытаниям суспензии концентрация меланина составляла 1,2 мг/мл.
Определяли состав МБЭД: первоначальное содержание влаги (ГОСТ Р 54951), воздушно-сухое вещество (ГОСТ 31640-2012), протеин (ГОСТ 32044.1-2012), жир (ГОСТ 32905-2014), клетчатку (ГОСТ 31675-2012), БЭВ (расчетным способом), количество золы (ГОСТ 32933-2014), валовую, обменную энергию (расчетным способом), кальций (ГОСТ 32904-2014), фосфор (ГОСТ Р 51420-99). Также образец МБЭД исследовали на наличие Staphylococcus aureus , Pseudomonas aeruginosa , Salmonella spp., Escherichia coli (гемолитическая), Staphylococcus saprophyticus , Enterobacter spp., Citrobacter spp., дрожжеподобных грибов и плесеней. Оценивали общую токсичность с использованием 3-5-суточной культуры инфузорий Tetryhymena pyriformis , степень токсичности — по выживаемости инфузорий в тестируемой среде.
Экскременты собирали индивидуально от телят из каждой группы ( n = 3) в конце эксперимента. Определяли микробиологический профиль в последовательных разведениях с учетом числа выросших колоний. Микробиологический анализ образцов содержимого желудочно-кишечного тракта исследовали методом высева последовательных 10-кратных разведений на накопительные и дифференциально-диагностические среды глубинным способом (1,0 мл) и поверхностно (0,2 мл) с последующим подсчетом колониеобразующих единиц (КОЕ/г или КОЕ/мл).
При выделении и определении количества условно-патогенных микроорганизмов навеску образца высевали в жидкую селективную среду, выполняли инкубирование, пересев культуральной жидкости на агаризован-ную селективно-диагностическую среду и подтверждение принадлежности выделенных типичных и атипичных колоний к конкретному виду микроорганизмов. Видовую идентификацию микроорганизмов осуществляли по следующим критериям: морфология колоний, выросших на дифференциальнодиагностических средах, результаты микроскопирования, биохимическая идентификация на микробиологических средах («ФБУН ГНЦ прикладной микробиологии и биотехнологии», Россия) и с использованием панелей тест-систем («BioMerieux», Франция). Молочнокислые микроорганизмы (лакто- и бифидобактерии) выделяли на МRS и Бифидум-среде, бактерии рода кишечной палочки (БГКП) — на агаре Эндо-ГРМ, гемолитические организмы (Streptococcus spp. и Е. coli) — на мясопептонном агаре (МПА) с добавлением 5 % дефибринированной бараньей крови, дрожжи и дрожжеподобные грибы — на агаре Сабуро с добавлением 5 % теллурита калия. Учитывали результаты на чашках с 30-300 колониями. Численность микроорганизмов (N) вычисляли по формуле N = m^ V-1 • d-1, где m — среднеарифметическое число колоний, выросших на двух чашках Петри; V — объем инокулята, высеянного на каждую чашку, см3; d — коэффициент разведения.
По завершении эксперимента брали кровь у животных из каждой группы ( n = 3). В образцах цельной и стабилизированной крови определяли биохимические (содержание общего белка, альбуминов, глобулинов, креатинина, мочевины, общего билирубина, общего холестерина, кальция, фосфора, глюкозы, активность щелочной фосфотазы — ЩФ, аспартатаминотрансферазы — АсАТ, аланинаминотрасферазы — АлАТ) и гематологические (количество гемоглобина, эритроцитов, лимфоцитов, гематокрит) показатели по стандартным методикам. Также определяли лизоцимную и бактерицидную активность сыворотки крови и фагоцитарную активность общепринятыми методами: бактерицидную активность (БА) оценивали фотонефелометрически, содержание лизоцима — по В.И. Мутовину (1974), фагоцитарную активность (ФА) — по поглощающей и переваривающей способности клеток крови.
Исходя из данных по затратам кормов, их стоимости и полученного прироста, рассчитывали возможный экономический эффект от использования изучаемой добавки в молочный период выращивания телят.
Результаты обрабатывали биометрически методом дисперсионного анализа (ANOVA), используя программу Statistica 10 («StatSoft, Inc.», США, 2011; . Вычисляли среднеарифметические значения (М), среднеквадратическую ошибку (±m) и уровень значимости (р). Результаты считали высокодостоверными при р < 0,001 и достоверными при р < 0,01 и р < 0,05. При р < 0,1, но р > 0,05 отмечали тенденцию к достоверности полученных данных. При р > 0,1 разницу считали недостоверной.
180.00
160,00
140.00
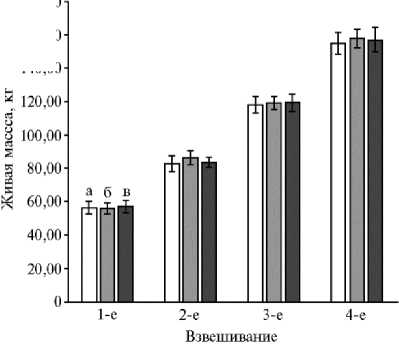
Динамика живой массы телят-молочников чернопестрой породы при включении в рацион меланиновой белково-энергетической добавки из личинок мухи Hermetia illucens : а — I группа (контроль n = 10), б — II группа ( n = 10), в — III группа ( n = 10). Описание групп см. в разделе «Методика» ( n = 10, M ± m , экспериментальное хозяйство «Кленово-Че-годаево», г. Москва, 2017 год).
Результаты. По некоторым данным (32), биологический эффект МБЭД может проявляться при дозе 0,1 мг/кг живой массы. Исходя из этого, рассчитывали количество этой потенциальной кормовой добавки в эксперименте.
При культивировании на дробленом зерне кукурузы биомасса личинок черной львинки содержала 36 % протеина и 45 % жира. При обезжиривании прямым отжимом из 1 кг сырой биомассы получалось 775 г отжимной массы (с влажностью 70 %).
Изучение химического состава МБЭД в сравнении с отделенным концентратом протеина (табл. 1) выявило высокое содержание сырой клетчатки — хитина в воздушно-сухом веществе
(ВСВ) концентрата протеина при полном его отсутствии в составе МБЭД. Также в ВСВ МБЭД было обнаружено высокое содержание протеина, жира, минеральных веществ. Концентрация меланин, обладающего особой ценностью, составляла 1,2 мг/мл. Исследование добавки на наличие патогенных микроорганизмов показало практически полное их отсутствие. Добавка была также признана нетоксичной.
В начале опыта все телята имели практически равную живую массу — от 56,0 до 56,90 кг (табл. 2, рис.). Включение в состав их рациона МБЭД из личинок H. illucens способствовало увеличению живой массы. В конце опыта этот показатель у телят из II и III опытных групп был выше, чем в контроле, соответственно на 2,8 и 2,0 кг, или на 1,81 и 1,29 %.
-
1. Сравнительный анализ химического состава меланиновой белково-энергетической добавки (МБЭД) и концентрата протеина, полученных из личинок мухи Hermetia illucens
-
2. Интенсивность роста, сохранность животных и затраты корма в опыте на телятах-молочниках черно-пестрой породы при включении в рацион меланиновой белково-энергетической добавки из личинок мухи Hermetia illucens ( M ± m , экспериментальное хозяйство «Кленово-Чегодаево», г. Москва, 2017 год)
Показатель
Группа
I (контроль, n =
10) 1
II ( n = 10) 1
III ( n = 10)
Живая масса, кг: в начале опыта
56,30±4,02
56,00±3,45
56,90±3,79
в конце опыта
155,00±6,67
157,80±5,76
157,00±7,42
К контролю, %
100,00
101,81
101,29
Валовой прирост, кг
97,67±5,18
101,80±5,25
100,10±7,64
Среднесуточный прирост, г
1097,38±58,23
1143,82±58,98
1124,72±85,82
К контролю, %
100,00
104,23
102,49
Сохранность животных, %
90,00
100,00
100,00
Валовой расход ОЭ, МДж•гол. - 1•сут - 1
2830,20
2830,20
2830,20
Расход ЭКЕ на 1 гол/сут
3,18
3,18
3,18
Затраты кормов, ЭКЕ/кг прироста
2,90
2,78
2,83
К контролю, %
100,00
95,90
97,60
П р и м е ч а н и е. ОЭ — обменная энергия, ЭКЕ — энергетическая кормовая единица. см. в разделе «Методика».
Описание групп
-
3. Гематологические показатели и некоторые показатели резистентности у телят-молочников черно-пестрой породы при включении в рацион меланиновой белково-энергетической добавки из личинок мухи Hermetia illucens ( M ± m , экспериментальное хозяйство «Кленово-Чегодаево», г. Москва, 2017 год)
|
Показатель |
Образец корма |
|||
|
МБЭД |
концентрат протеина |
|||
|
НВ |
1 ВСВ |
НВ 1 |
ВСВ |
|
|
Первоначальная влага, % |
71,06 |
1,89 |
||
|
Воздушно-сухое вещество, % |
28,94 |
100,00 |
98,11 |
100,00 |
|
Протеин, г/кг |
94,46 |
326,40 |
533,62 |
543,90 |
|
Жир, г/кг |
126,84 |
438,29 |
50,82 |
51,80 |
|
Сырая клетчатка (хитин), г/кг |
183,07 |
186,60 |
||
|
БЭВ, г/кг |
17,68 |
61,09 |
92,62 |
94,40 |
|
Зола, г/кг |
38,20 |
132,00 |
76,13 |
77,60 |
|
Валовая энергия, МДж/кг |
7,36 |
25,43 |
19,99 |
20,38 |
|
Обменная энергия, МДж/кг |
5,45 |
18,83 |
14,55 |
14,83 |
|
Кальций, г/кг |
4,68 |
16,17 |
15,00 |
15,29 |
|
Фосфор, г/кг |
3,58 |
12,37 |
5,10 |
5,20 |
П р и м е ч а н и е. НВ — натуральное вещество, ВСВ — воздушно-сухое вещество; БЭВ — безазотистые экстрактивные вещества. Прочерки означают, что хитин не выявили.
Среднесуточный прирост у телят из II и III групп был выше, чем у их аналогов из контрольной группы, на 46,44 и 27,34 г, или на 4,23 и 2,49 %. Самые высокие показатели роста отмечались во II группе. За счет увеличения среднесуточного прироста во II и III опытных группах наблюдалось снижение расхода корма на 1 кг прироста соответственно на 4,1 и 2,4 % по сравнению с контролем. Животные охотно потребляли МБЭД, отказов от него не наблюдали. Телята опытных групп меньше болели, случаев диареи не зафиксировали. Во II и III группах сохранность молодняка составила 100 %, тогда как в I группе — 90 % (выбытие одного теленка).
Изученные показатели крови существенно не различались между группами, оставаясь в пределах физиологической нормы, тем не менее, имелись некоторые особенности (табл. 3). Так, содержание общего белка во II и III группах снижалось соответственно на 3,45 и 2,71 г/л по сравнению с контролем за счет уменьшения количества альбуминов на 1,86 и 1,29 г/л и глобулинов на 1,6 и 1,43 г/л. Отметим, что только по содержанию общего белка нельзя полностью оценить качество питания. Активность АлАТ и АсАТ в сыворотки крови телят служит дополнительным показателем полноценности белкового питания, интенсивности белкового обмена и характеризует функциональное состояние печени животных. Было установлено достоверное уменьшение активности АлАТ у телят из III опытной группы на 4,3 IU/л по сравнению с контрольной (р < 0,05). Во II группе этот показатель был ниже контроля на 2,38 IU/л. Такую же тенденцию можно отметить в активности АсАТ: у животных из II и III опытных групп она была ниже контрольной соответственно на 7,63 и 7,93 IU/л. Снижение активности этих ферментов косвенно характеризует стабилизирующее действие изучаемого фактора питания на свободные аминокислоты, которые меньше подвергаются катаболизму и эффективнее используются в биосинтезе белка.
|
Показатель |
Группа |
||
|
I (контроль, n = 3) |
II ( n = 3) |
III ( n = 3) |
|
|
Белок общий, г/л |
78,56±2,17 |
75,11±1,74 |
75,85±1,05 |
|
Альбумины, г/л |
33,08±1,16 |
31,22±0,64 |
31,79±1,36 |
|
Глобулины, г/л |
45,49±3,33 |
43,89±1,12 |
44,06±1,43 |
|
Коэффициент А/Г |
0,74±0,08 |
0,71±0,01 |
0,72±0,05 |
|
Холестерин, ммоль/л |
3,37±0,03 |
3,60±0,38 |
3,12±0,36 |
|
Креатинин, мкмоль/л |
68,58±6,99 |
70,39±3,27 |
62,76±4,40 |
|
Мочевина, ммоль/л |
5,40±0,41 |
5,10±0,50 |
6,49±0,39 |
|
Билирубин общий, мкмоль/л |
8,10±3,06 |
8,46±0,66 |
7,17±0,84 |
|
АлАТ, IU/л |
15,86±1,03 |
13,48±1,54 |
11,56±0,71* |
|
АсАТ, IU/л |
65,52±5,69 |
57,89±5,67 |
57,59±3,04 |
|
Триглицериды, ммоль/л |
0,94±0,04 |
0,95±0,03 |
0,86±0,11 |
|
Щелочная фосфатаза, IU/л |
361,33±24,35 |
435,48±56,05 |
244,71±65,05 |
|
Глюкоза, ммоль/л |
5,17±0,14 |
5,15±0,21 |
4,66±0,85 |
|
Кальций, ммоль/л |
2,84±0,08 |
2,87±0,07 |
2,83±0,08 |
|
Фосфор, ммоль/л |
2,93±0,03 |
3,12±0,11 |
2,72±0,33 |
|
Отношение Са/Р |
1,25±0,02 |
1,19±0,02 |
1,40±0,21 |
|
Железо мкмоль/л |
35,64±2,03 |
34,55±2,39 |
31,64±2,27 |
|
Лейкоциты, ½109/л |
12,92±0,25 |
13,26±0,88 |
12,30±0,51 |
|
Эритроциты, ½1012/л |
10,74±0,32 |
10,83±0,31 |
11,17±0,43 |
|
Гемоглобин, г/л |
105,37±5,39 |
102,40±3,77 |
108,77±2,28 |
|
Гематокрит, % |
41,21±2,18 |
41,92±0,81 |
41,98±0,83 |
|
Лизис, % |
28,28±1,01 |
27,27±1,75 |
27,27±1,75 |
|
Лизоцим: |
|||
|
мкг/мл сыворотки |
0,49±0,02 |
0,47±0,03 |
0,47±0,03 |
|
уд. ед. а, ед. а/мг белка |
1,59±0,10 |
1,60±0,13 |
1,59±0,12 |
|
БАСК, % |
82,35±0,00 |
80,39±1,30 |
80,39±1,30 |
|
ФА, % |
48,20±1,45 |
54,14±1,84 |
55,15±1,83* |
|
ФИ |
3,39±0,18 |
2,98±0,09 |
3,28±0,14 |
|
ФЧ |
1,63±0,10 |
1,61±0,06 |
1,81±0,09 |
П р и м еч а ни е. А/Г — альбумины/глобулины, АлАТ — аланинаминотрасфераза, АсАТ — аспартатаминотрансфераза, Са/Р — кальций/фосфор, БАСК — бактерицидная активность сыворотки крови, ФА — фагоцитарная активность, ФИ — фагоцитарный индекс, ФЧ — фагоцитарное число; уд. ед. а — удельные единицы активности. Описание групп см. в разделе «Методика».
* Различия с контролем статистически значимы при р < 0,05.
Введение в рацион телят-молочников МБЭД из личинок H. illucens достоверно не отразилось на активности щелочной фосфатазы, концентрации кальция и фосфора в сыворотке крови при некотором повышении отношения Са/Р у животных из III опытной группы. Содержание лизоцима, процент лизиса, бактерицидная активность в крови у телят подопытных групп оказались практически одинаковыми — соответственно 0,47 и 0,49 мкг/л; 27,27 и 28,28 %; 80,39 и 82,35 %. При этом у телят II и III групп показатель ФА был выше на 5,94 и 6,95 % (р < 0,05 для III группы) по сравнению с контролем.
У животных из II и III опытной группы количество лактобактерий в содержимом толстого кишечника увеличилось соответственно на 2,23½105 и 10,3½105 КОЕ/г, бифидобактерий — на 0,33½108 и 1,07½108 КОЕ/мл по сравнению с показателями в контрольной группе (табл. 4). Отмечалось уменьшение количества лактозоположительных кишечных палочек на 1,196½105 и 1,11½105 КОЕ/г (р < 0,05 для III группы). Лактозоотрицательных кишечных палочек у животных опытных групп не обнаружили, в то время как у одного теленка из контрольной группы зафиксировали их наличие (см. табл. 3).
4. Качественный и количественный состав микрофлоры толстого отдела кишечника у телят-молочников черно-пестрой породы при включении в рацион меланиновой белково-энергетической добавки из личинок мухи Hermetia illucens ( M ± m , экспериментальное хозяйство «Кленово-Чегодаево», г. Москва, 2017 год)
|
Микроорганизмы |
Группа |
||
|
I (контроль, n = 3) |
II ( n = 3) |
III ( n = 3) |
|
|
Лактобактерии, ½105 КОЕ/г |
3,10±1,35 |
5,33±0,99 |
13,4±3,68* |
|
Бифидобактерии, ½108 КОЕ/мл |
1,33±1,04 |
1,66±0,84 |
2,40±1,30 |
|
Гемолитические микроорганизмы, КОЕ/г: |
|||
|
стрептококки, ½103 |
2,20±0,08 |
2,30±0,53 |
2,35±0,69 |
|
Escherichia coli |
Не обнаружено |
Не обнаружено |
Не обнаружено |
|
Кишечная палочка, КОЕ/г: |
|||
|
лактозоположительная, ½105 |
1,20±1,20 |
0,004±0,001 |
0,09±0,09 |
|
лактозоотрицательная |
Обнаружено в 1 образце |
Не обнаружено |
Не обнаружено |
|
Грибы рода Candida , КОЕ/г |
Не обнаружено |
Не обнаружено |
Не обнаружено |
П р и м е ч а н и е. КОЕ — колониеобразующая единица. Описание групп см. в разделе «Методика». * Различия с контролем статистически значимы при р < 0,05.
Расход МБЭД в расчете на 1 гол. за период опыта во II и III опытных группах составил соответственно 520,0 мл и 742,5 мл. Стоимость 1 л добавки — 100,00 руб. На 1 гол. расход составил 52,00 и 74,25 руб. за период опыта. Прибыль от условной реализации в I контрольной группе была (+)1355,35 руб., во II группе (+)1737,00руб., в III — (+)1536,25 руб. В опытных группах показатель увеличился за счет дополнительного прироста живой массы, полученного в результате обогащения рационов телят-молочников МБЭД. Об этом же свидетельствуют данные по дополнительной прибыли, полученной от каждого теленка из II и III групп в период опыта. Так, за весь период она составила соответственно (+)381,65 и (+)180,90 руб., или (+)4,29 и (+)2,03 руб.•гол. - 1•сут - 1 по сравнению с контролем.
Другие авторы сообщали об антистрессовом эффекте меланина, произведенного дрожжами Nadsoniella nigra X-1 (33): при его добавлении в рацион (0,1 мг/кг) не было случаев заболеваний и гибели поросят-отъе-мышей. Показано (34, 35), что у стрессированных животных меланин способствует нормализации протеиназно-ингибиторного потенциала и предупреждает развитие цитолитического синдрома поджелудочной железы.
Таким образом, различия в интенсивности роста телят под влиянием испытуемых доз меланиновой белково-энергетической добавки (МБЭД) из личинок мухи Hermetia illucens были недостоверными, что указывает на возможность увеличения суточной нормы ввода добавки. Следует отметить положительное воздействие микродозы МБЭД на показатели неспецифического иммунитета и состав кишечного микробиоценоза у подопытных животных. Биологическое действие МБЭД коррелировало с более высокими показателями роста, сохранности животных, конверсии корма. Дозы МБЭД установлены экспериментально и не являются окончательно рекомендуемыми, поскольку биологическая эффективность добавки изучалась впервые. Необходимы дальнейшие исследования биологического действия как личинок Hermetia illucens, так и препаратов физиологически активных веществ, полученных из них, на здоровье и продуктивность у разных ви- дов сельскохозяйственных животных, птицы, рыб.
Список литературы Меланиновая белково-энергетическая добавка из личинок Hermetia illucens в питании телят
- Hulbert L.E., Moisa S.J. Stress, immunity, and the management of calves. J. Dairy Sci., 2016, 99(4): 3199-3216 ( ) DOI: 10.3168/jds.2015-10198
- Лисицын В.В. Заболевание молодняка крупного рогатого скота вирусной этиологии. Ветеринария сельскохозяйственных животных, 2013, 3: 6-12.
- Мищенко В.А., Павлов Д.К., Думова В.В., Никешина Т.Б., Гетманский О.И., Кононов А.В., Лисицын В.В. Экологические особенности заболеваний пищеварительной системы новорожденных телят. Ветеринарная патология, 2005, 3: 34-38.
- Красочко П.А. Биотехнологические основы конструирования и использования иммунобиологических препаратов для молодняка крупного рогатого скота. Автореф. докт. дис. Щелково, 2009.
- Тараканов Б.В. Биопрепараты для повышения эффективности использования кормов, Зоотехния, 1993, 8: 16-18.
- Abbas K.A. The synergistic effects of probiotic microorganisms on the microbial production of butyrate in vitro. McNair Scholars Research Journal, 2010, 2(1): 8.
- Chu G.M., Lee S.J., Jeong H.S., Lee S.S. Efficacy of probiotics from anaerobic microflora with prebiotics on growth performance and noxious gas emission in growing pigs. Anim. Sci. J., 2011, 82(2): 282-290 ( ) DOI: 10.1111/j.1740-0929.2010.00828.x
- Таирова А.Р., Кузнецов А.И. Влияние различных доз хитозана на иммунный статус бычков. Ветеринарный врач, 2001, 4: 49-51.
- Тетерев И.И. Прополис в животноводстве и ветеринарии. Киров, 1998: 54-58.
- Ушакова Н.А., Наумова Е.И., Павлов Д.С., Чернуха Б.А. Способ получения биологически активной кормовой добавки из растительного сырья. Патент 2202224 (РФ) МПК7 A 23 K 1/165. Институт проблем экологии и эволюции им. А.Н. Северцова РАН (РФ). 2001104906/13 Заявл. 22.02.2001. Опубл. 20.04.2003. Бюл. № 12.
- Островский М.А., Донцов А.Е. Физиологические функции меланина в организме. Физиология человека, 1985, 11(4): 670-678.
- Барабой В.А. Структура, биосинтез меланоцитов, их биологическая роль, перспективы применения. Успехи современной биологии, 2000, 117: 86-92.
- Донцов А.Е. Защитное действие меланинов при окислительном стрессе. Lambert Academic Publishing, Saarbrűcken, 2014.
- Wang J.-M., Ao A.-H., Qiao C.-S., Zhong Y., Zhang Y.-Y. The research progress of melanin. Adv. Mat. Res., 2011, 204-210: 2057-2060 (doi: 10.4028/www.scientific.net/AMR.204-210.2057).
- Meredith P., Sarna T. The physical and chemical properties of eumelanin. Pigm. Cell Res., 2006, 19: 572-594 ( ) DOI: 10.1111/j.1600-0749.2006.00345.x
- Lia H.-J., Lic J.-X., Zhao Z. Characterization of melanin extracted from apricot (Armeniaca sibirica) and its effect on hydrazine-induced rat hepatic injury. ScienceAsia, 2016, 42: 382-391 (doi: 10.2306/ScienceAsia1513-1874.2016.42.382).
- Зуева О.Ю. Разработка биотехнологических процессов получения биологически активных соединений из медоносных пчел и исследование их свойств. Автореф. канд. дис. Щелково, 2004.
- Bußler S., Rumpold B.A., Jander E., Rawel H.M., Schlüter O.K. Recovery and techno-functionality of flours and proteins from two edible insect species: Meal worm (Tenebrio molitor) and black soldier fly (Hermetia illucens) larvae. Heliyon, 2016, 2(12): e00218 ( ) DOI: 10.1016/j.heliyon.2016.e00218
- Makkar H.P.S., Tran G., Heuzé V., Ankers P. State-of-the-art on use of insects as animal feed. Anim. Feed Sci. Tech., 2014, 197: 1-33 ( ) DOI: 10.1016/j.anifeedsci.2014.07.008
- Sánchez-Muros M.-J., Barroso F.G., Manzano-Agugliaro F. Insect meal as renewable source of food for animal feeding: a review. J. Clean. Prod., 2014, 65: 16-27 ( ) DOI: 10.1016/j.jclepro.2013.11.068
- Barroso F.G., de Haro C., Sánchez-Muros M.-J., Venegas E., Martínez-Sánchez A., Pérez-Bañón C. The potential of various insect species for use as food for fish. Aquaculture, 2014, 422-423: 193-201 ( ) DOI: 10.1016/j.aquaculture.2013.12.024
- Bondari K., Sheppard D.C. Soldier fly, Hermetia illucens L., larvae as feed for channel catfish, Ictalurus punctatus (Rafinesque), and blue tilapia, Oreochromis aureus (Steindachner). Aquaculture and Fisheries Management, 1987, 18(3): 209-220 ( ) DOI: 10.1111/j.1365-2109.1987.tb00141.x
- Bosch G., Fels-Klerx H.J.V., Rijk T.C., Oonincx D.G.A.B. Aflatoxin B1 tolerance and accumulation in black soldier fly larvae (Hermetia illucens) and yellow mealworms (Tenebrio molitor). Toxins, 2017, 9(6): 185 ( ) DOI: 10.3390/toxins9060185
- Wang Y.S., Shelomi M. Review of black soldier fly (Hermetia illucens) as animal feed and human food. Foods, 2017, 6(10): 91 ( ) DOI: 10.3390/foods6100091
- Nowak V., Persijn D., Rittenschober D., Charrondiere U.R. Review of food composition data for edible insects. Food Chem., 2016, 193: 39-46 ( ) DOI: 10.1016/j.foodchem.2014.10.114
- Čičková H., Newton G.L., Lacy R.C., Kozánek M. The use of fly larvae for organic waste treatment. Waste Manage., 2015, 35: 68-80 ( ) DOI: 10.1016/j.wasman.2014.09.026
- Van Huis A. Potential of insects as food and feed in assuring food security. Annu. Rev. Entomol., 2013, 58: 563-583 ( ) DOI: 10.1146/annurev-ento-120811-153704
- Liland N.S., Biancarosa I., Araujo P., Biemans D., Bruckner C.G., Waagbø R., Torstensen B.E., Lock E.-J. Modulation of nutrient composition of black soldier fly (Hermetia illucens) larvae by feeding seaweed-enriched media. PLoS ONE, 2017, 12(8): e0183188 ( ) DOI: 10.1371/journal.pone.0183188
- Бастраков А.И., Донцов А.Е., Ушакова Н.А. Муха черная львинка Hermetia illucens в условиях искусственного разведения -возобновляемый источник меланин-хитозанового комплекса. Известия Уфимского научного центра РАН, 2016, 4: 77-79.
- van Huis A., van Itterbeeck J., Klunder H., Mertens E., Halloran A., Muir G., Vantomme P. FAO Forestry Paper 171. Edible insects: future prospects for food and feed security. FAO, Rome, Italy, 2013.
- Кирилов М.П., Махаев Е.А., Первов Н.Г., Пузанова В.В., Аникин А.С. Методика расчета обменной энергии в кормах на основе содержания сырых питательных веществ (для крупного рогатого скота, овец, свиней). Дубровицы, 2008: 32.
- Добавка меланин в питание поросят раннего отъема. Практический эксперимент. Свиноводство для всех. Режим доступа: http://svinovodstvo.blogspot.ru/2014/06/dobavki-dlja-porosjat.html#more. Дата обращения: 01.04.2018.
- Chyizhanska N., Beregova T. Effect of melanin isolated from Antarctic yeasts on preservation of pig livestock after ablactation. УАЖ, 2009, 8: 382-385.
- Слободяник Н.М., Слободяник В.М., Непорада К.С., Берегова Т.В. Вплив меланiну на ферментативну активнiсть пiдшлункової залози в умовах гострого стресу. Вiстник проблем бiологiї i медицини, 2017, 4 (1/139): 253-256.
- Slobodyanyk N., Beregova T., Neporada K. Pancreatic enzymes activity under the conditions of acute stress and melanin administration depending on the stress resistance. J. Pharm. Pharmacol., 2015, 3: 232-236 ( ) DOI: 10.17265/2328-2150/2015.05.004


