Меланофоры рыб в реализации свободнорадикальных клеточно-тканевых механизмов онкогенеза
Автор: Сахаров А.В., Лошенко В.И., Макеев А.А., Арбузова Е.Н.
Статья в выпуске: 3 т.259, 2024 года.
Бесплатный доступ
Работа посвящена изучению роли хроматофор рыб в реализации клеточных и органно- тканевых механизмов, их адаптации к действию повреждающих факторов. В работе дана морфологическая характеристика патологического новообразования в области жаберной крышки карася (Саrаssius gibеliо), добытого из депрессивного водоема с высоким уровнем антропогенной нагрузки. Клеточная атипия, нарушение дифференцировки клеток и дезорганизация структуры покровного эпителия жаберной крышки характеризует развитие дисплазии покровного эпителия жаберной крышки на начальных этапах развития процесса. При манифестации процесса в структуре эпителия отдельных сосочков обнаруживается фрагментация базальной мембраны, нарушение стратификации эпителия и развитие гиперкератоза. Данная морфологическая картина характерна для плоскоклеточного ороговевающего рака.
Серебряный карась, жаберная крышка, эпителий, меланофоры, онкогенез, свободные радикалы, антиоксидантная защита
Короткий адрес: https://sciup.org/142242489
IDR: 142242489 | УДК: 591.2; 639.371.5 | DOI: 10.31588/2413_4201_1883_3_259_211
Текст научной статьи Меланофоры рыб в реализации свободнорадикальных клеточно-тканевых механизмов онкогенеза
В настоящее время не вызывает сомнений, что клетки, синтезирующие пигменты в различных тканевых компартментах, обеспечивают реализацию важнейших физиологических процессов у позвоночных и беспозвоночных животных, растений и грибов [1]. По мере расширения имеющихся представлений о биологической роли пигментов становится совершенно очевидным их важное участие в реализации активности всех без исключения функциональных систем организма. Целесообразность существования огромного многообразия окрасок покровов тела рыб остается до настоящего времени одним из не решенных вопросов [9]. Результаты, полученные С. Ю. Петуховым и Ю. П. Толмачевым (2015), Д. В. Праздниковым и Ф. Н. Шкилем (2018) весьма убедительно объясняют причины и значение возникающих межвидовых и внутривидовых различий окраски тела отдельных групп рыб и особенности их преобразований в филогенезе [10-11]. Эти материалы имеют важное значение для понимания фундаментальных закономерностей биологии и экологии водных животных. Однако использование современных методов исследований позволило сместить акцент работ в направлении изучения различных классов пигментов с популяционно-видового и онтогенетического, до клеточного и молекулярно-генетического уровней организации живой системы. Такой подход позволил приблизиться к пониманию значения пигмент-синтезирующих клеток в реализации морфофункциональных преобразований в организме водных животных уже на ранних этапах онтогенеза, начиная от оплодотворения икры, периоды эмбрионально-личиночного развития и более поздние сроки онтогенеза [4]. Сведения по данной проблематике, накопленные в результате наблюдений на различных видах живых организмов, указывают на способность пигментных клеток посредством экспрессии специфических белков обеспечивать осуществление гораздо более важных, чем предполагалось ранее морфогенетических преобразований, как в норме, так и при изменении параметров среды обитания рыб или воздействии на организм патогенов [3].
Считается, что синтензирующие меланин клетки у различных живых организмов принимают активное участие в окислительно-восстановительных процессах и регуляции редокс-гомеостаза как в норме, так патологии [14]. Анализ публикаций отечественных и зарубежных авторов указывает на крайне недостаточную информации относительно участия хроматофор рыб в реализации клеточных и органно-тканевых механизмов адаптации к действию повреждающих факторов [4]. В этой связи изучение значения меланофоров рыб в реализации свободнорадикальных клеточно-тканевых механизмов онкогенеза определяет высокую актуальность настоящего исследования.
Целью работы являлось изучение роли меланофоров у рыб вида серебряный карась ( Саrаssius gibеliо ) в морфогенезе опухолевого роста покровного эпителия.
Материал и методы исследований. Исследование проводилось в период октября 2020 – март 2021 гг. на 32 особях рыб серебряного карася ( Саrаssius gibеliо ) средней массой 1431, 41±12 граммов. Рыбы добыты из экологически депрессивного водоема с высоким уровнем антропогенной нагрузки [5]. Объектом изучения являлись участки неопластических образований, локализованных в области костей жаберной крышки, которые забирали единым комплексом. Материал фиксировали в 10 % растворе нейтрального формалина и далее декальцинировали в насыщенном растворе трилона Б. При вырезке патологического материала соблюдали предельную осторожность и сохраняли целостность тканевого комплекса, включающего костную ткань и зоны опухолевого роста. Образцы обезвоживали в изопропиловом спирте и заливали в гистомикс по стандартной методике. Срезы толщиной 510 мкм готовили на ротационном полуавтоматическом микротоме SLEE CUT 5062 (Германия), а затем окрашивали гематоксилином Бемера и эозином. Распределение суммарных кислых гликозаминогликанов (ГАГ) изучали путем постановки гистохимической реакции с альциановым синим по Стидмену. Реакцию на коллаген определяли по Маллори.
Исследование гистологических препаратов осуществляли с использованием комплекса оптикоструктурного анализа Axio Imager.M2 c программным обеспечением для анализа изображений AxioVision Z2 M2 (CARL ZEISS, Германия). Цифровая обработка материала осуществлялась при помощи CCD-камеры AxioCam HR c программным обеспечением Zen Lite (CARL ZEISS, Германия).
Содержание первичных и вторичных продуктов свободнорадикального перекисного окисления липидов (СПОЛ), активность ключевых ферментов системы антиоксидантной защиты (АОЗ) изучали в рекомендации Е. Б. Меньщиковой с соавт. (2006) [8]. Уровень диеновых конъюгатов (ДК) определяли в реакции с гептанизопропаноловой смесью. Содержание малонового диальдегида (МДА) исследовали в реакции с трихлоруксусной и 2-тиобарбитуровой кислотами. Активность каталазы (КАТ) выявляли в реакции перекиси водорода с добавлением молибдата аммония. Активность супероксидисмутазы (СОД) определяли по ингибированию скорости восстановления тетразолия нитросинего в системе феназинметасульфата и НАД∙Н. [7]. Статистическую обработку результатов исследования проводили на основе вычисления средних величин (M) и их ошибок (m) с учетом объема выборки (n). Различия всех исследуемых показателей оценивали методом вариационной статистики по t-критерию Стьюдента и считали достоверными при Р ≤ 0,05. Все расчеты проводили по общепринятым формулам с использованием пакета программ Miсrosoft Excel 2010.
Результаты исследований. По уровню развития патологического процесса в области жаберных крышек карася обнаружены особи, как с незначительными, так и чрезмерно развитыми по площади новообразованиями. В случае слабо выраженного патологического процесса измененная ткань имеет площадь до 11,31±1,98 см3 (Рисунок 1 А). Ее поверхность преимущественно гладкая или слегка бугристая, бледно-розового или серого цвета. Морфология патологических образований представлена паренхимой в форме многочисленных эпителиальных разрастаний сферической формы и стромой (Рисунок 1 Б.) На светооптическом уровне паренхима состоит из активно пролиферирующих клеток многослойного плоского эпителия (Рисунок 1 В). В структуре ткани заметны очаговые пигментные образования чернозеленого цвета (рис 1 А). В зависимости от выраженности процесса морфологическая картина измененной ткани покровного эпителия жаберной крышки соответствует либо гиперплазии, либо слабовыраженной дисплазии. Морфологические критерии дисплазии в данном случае основываются на наличие трех основных диагностических признаков – клеточная атипия, нарушение дифференцировки клеток эпителия и, в целом дезорганизация структуры покровного эпителия жаберной крышки (Рисунок 1 Г).
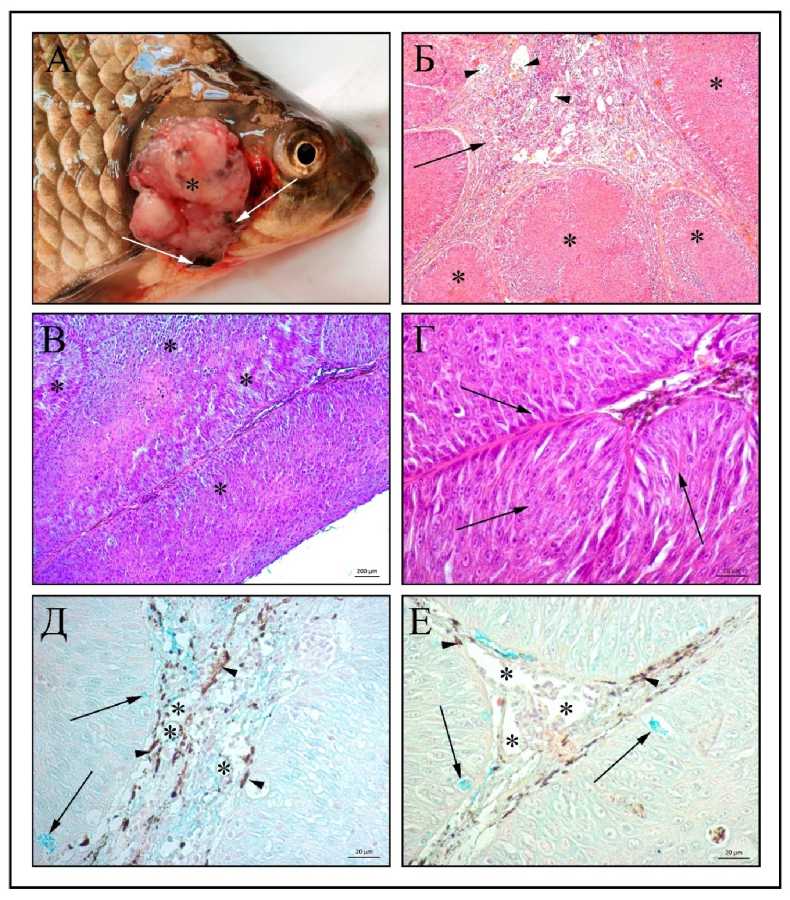
Рисунок 1 – А. Звездочкой обозначено новообразование, стрелками – участки гиперпигментации новообразования; Б. Звездочками обозначены эпителиальные узелки новообразования, стрелкой – строма новообразования, головками стрелок – кровеносные сосуды; В. Звездочками обозначены участки активно-пролиферирующих клеток многослойного плоского эпителия; Г. Стрелками обозначены участки дезорганизации покровного эпителия жаберной крышки; Д, Е. Звездочками обозначены кровеносные сосуды, стрелками – положительная реакция цитоплазмы кератиноцитов на кислые ГАГ, головками стрелок – локализация меланофоров
Наличие многочисленных межклеточных щелей, вероятно, обусловлено потерей или снижением темпов экспрессии интенсивно пролиферирующими клетками эпителия молекул адгезии и замедлением времени формирования межклеточных контактов.
Строма патологического образования обильно васкуляризирована (Рисунок 1 Б, Е, Д). В просвете кровеносных сосудов и периваскулярном пространстве идентифицируются многочисленные лейкоциты, среди которых преобладают клетки лимфоцитарного профиля. На препаратах, окрашенных альциановым синим, отчетливо видны многочисленные активно пролиферирующие кератиноциты, цитоплазма которых дает положительную реакцию на ГАГ (Рисунок 1 Д). В межклеточном веществе стромы заметно обилие меланофоров, локализованных в области формирования кровеносных капилляров (Рисунок 1 Д, Е).
При наличии у обследованных рыб обширных новообразований в области костей жаберной крышки последние имеют бугристую поверхность темнозеленого или черного цвета неправильной формы с нечеткими контурами.
Дезорганизация эпителия новообразования по уровню атипии клеток и их дифференцировки отличается вариабельностью структурнофункциональных преобразований. Одни имеют схожее строение с описанной выше тканью рыб, у которых патологический процесс ограничен гиперплазией и начальными этапами дисплазии. В исследуемых образцах рыб с массивными новообразованиями морфологическая картина эпителия имеет признаки глубокого нарушения структурной организации. Неоплазма возвышается над поверхностью жаберной крышки и ее размеры варьируют от 11,31±1,98 см3 и до 33,15 см3 (Рисунок 2 А). На светооптическом уровне опухоль состоит из множества сосочков, что само по себе является проявлением атипизма ткани (Рисунок 2 Б).
На обзорных препаратах, окрашенных гематоксилином и эозином, отчетливо заметно, что клетки базального слоя теряют характерное для нормального эпителия строение. Вытянутые, призматической формы эпителиоциты выстраиваются перпендикулярно базальной мембране и между клетками становятся заметными широкие межклеточные щели (Рисунок 2 В). Среди эпителиоцитов, лежащих выше базального слоя, заметны фигуры атипического митоза, клетки с признаками летального повреждения. В структуре эпителия отдельных сосочков обнаруживается фрагментация базальной мембраны и нарушение стратификации эпителия (Рисунок 2 Г, Д). Кроме того, обращает внимание наличие многочисленных кератиноцитов с оксифильной цитоплазмой и участками ее просветления в околоядерной зоне (Рисунок 2 Е).
В центре эпителиального сосочка видны обширные полости, содержащие клеточный детрит и субстрат, по тинкториальным свойствам напоминающий меланин или липофусцин (Рисунок 3 А). Клеток воспаления в таких образованиях и на их периферии не обнаружено. На поверхности сосочка эпителий имеет признаки гиперкератоза (Рисунок 3 Б).
Применение гистохимической реакции на ГАГ и коллаген удачно демонстрирует возможность реализации дифференциального патоморфологического подхода к идентификации структуры новообразования. В реакции с альциановым синим среди клеточного состава эпителия заметно высокое содержание эпителиоцитов, синтезирующих слизистый секрет. В структуре опухоли паренхима преобладает строму по объему, коллагеновые фибриллы которой интенсивно окрашиваются в реакции по Маллори (Рисунок 3 В). Строма образована типичной рыхловолокнистой соединительной тканью с развитой сетью кровеносных сосудов. Капилляры чрезмерно расширены. В просвете кровеносных сосудов и периваскулярном пространстве идентифицируется высокое содержание лимфоцитов (Рисунок 3 Г). По ходу капиллярной сети периваскулярно располагаются многочисленные меланофоры (Рисунок 3 Д). Изменение тинкториальных свойств патологически измененного покровного эпителия и костной ткани в области os paraeoperculum и os operculum, указывает на чрезмерное увеличение темпов ремоделирования костного матрикса и повышение порозности костей жаберной крышки (Рисунок 3 Е).
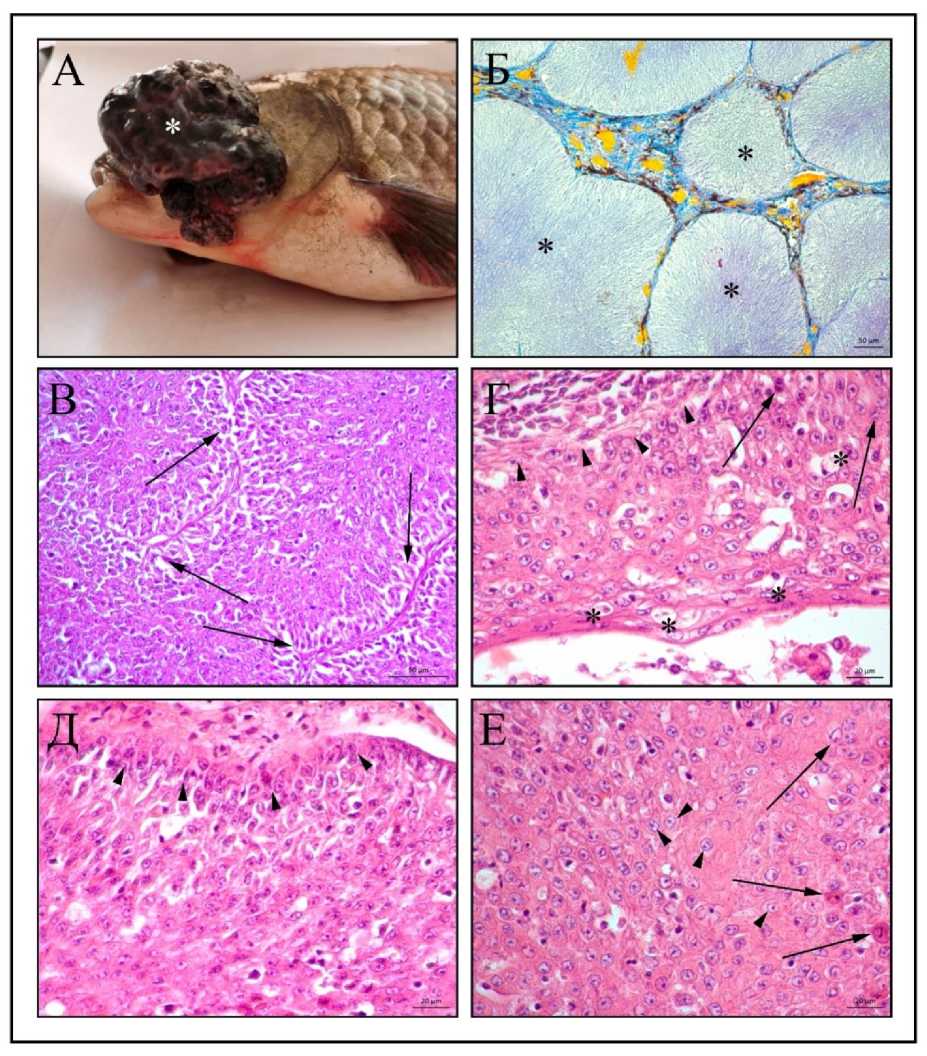
Рисунок 2 – А. Звездочкой обозначено новообразование; Б. Звездочками обозначены эпителиальные узелки новообразования; В. Стрелками обозначены межклеточные щели; Г. Головками стрелок обозначено нарушение целостности базальной мембраны, стрелками – фигуры атипического митоза, звездочками – клетки с признаками летального повреждения; Д. Головками стрелок обозначено нарушение целостности базальной мембраны; Е. Головками стрелок обозначены клетки с оксифильной цитоплазмой и участками её просветления в околоядерной зоне, стрелками – фигуры атипического митоза
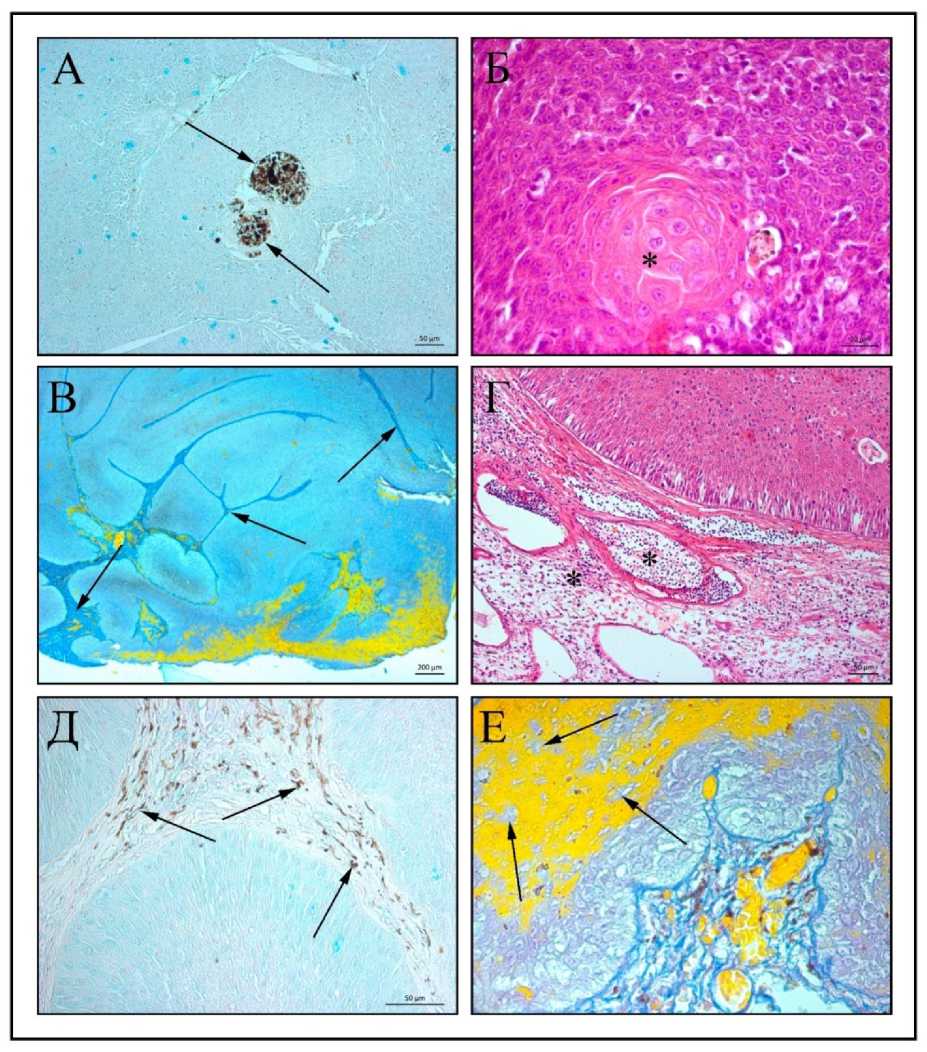
Рисунок 3 – А. Стрелками обозначены локализация клеточного детрита в центре эпителиального сосочка; Б. Звездочкой отмечен участок гиперкератоза в структуре эпителия; В. Стрелками обозначена интенсивная реакция на коллаген; Г. Звездочками обозначена локализация лимфоцитов в просвете кровеносных сосудов стромы; Д. Стрелками обозначена локализация меланофоров; Е. Стрелками обозначены участки остеолиза костного матрикса
При изучении состояния системы АОЗ в гомогенатах ткани опухоли нами установлена депрессия ключевых ферментов системы антоксидантной защиты СОД, КАТ и превышение уровня ДК и МДА по сравнению с интактными участками эпителия жаберной крышки карася (Таблица 1).
Оценивая полученные результаты, с позиции единства структуры и функции, закономерно возникает вопрос относительно природы данного патологического образования в области жаберной крышки карася. На ранних этапах развития процесса в структуре эпителия опухолевого образования рыб пролиферация клеток эпителия происходит без нарушения целостности базальной мембраны и структуры эпителиального пласта в целом. По мере дальнейшего развития патологического процесса в цитоплазме клеток обнаруживается не характерное для нормы усиление реакции на ГАГ. Структура такого эпителия напоминает муцинпродуцирующее интраэпителиальное поражение шейки матки у человека SMILE (stratified mucin – producing intraepithelial lesion) при инфицировании вирусом папилломы человека (ВПЧ). В публикации J. J. Park с соавторами (2000) приводится мнение, что поражение мультипотентной стволовой клетки эпителиального пласта ВПЧ приводит к развитию гиперплазии, плоскоклеточной интраэпителиальной неоплазии и малигнизации in situ [12]. В нашем исследовании на причастность к неопластическому процессу вирусного патогена указывает наличие среди клеток эпителия жаберной крышки кератиноцитов с зоной просветления цитоплазмы в околоядерной зоне, которые напоминают койлоциты – клетки инфицированные ВПЧ.
Таблица 1 – Показатели липопероксидации и активности системы антиоксидантной защиты в гомогенатах эпителиальной ткани жаберной крышки карася
|
Исследуемые показатели |
Локализация |
|
|
эпителий интактных участков |
эпителиома |
|
|
ДК, нмоль/г |
4,47±0,27 |
25,11±1,46 * |
|
МДА, нмоль/г белка |
32,93±6,35 |
205,41±15,80* |
|
КАТ, моль/мин/мг белка |
11,22±0,91 |
1,47±0,29 ** |
|
СОД, усл. ед./ мг белка |
1,47±0,34 |
0,32±0,13* |
Примечание. Различия статистически достоверны между показателями образцов интактных участков жаберной крышки и эпителиомы, *Р≤0,05, **Р≤0,01
В структуре эпителиальных узлов отмечаются признаки избыточного ороговения в виде интенсивно оксифильных концентрических образований, которые дают картину плоскоклеточного ороговевающего рака. Описанные особенности гистотопографии тканевого комплекса в строме патологического образования карася свидетельствуют о существовании причинно-следственной связи между функциональной активностью меланофоров и повреждением кератиноцитов, предположительно NO.
Опираясь на собственные результаты и данные литературных источников инфицирование покровного эпителия вирусным патогеном начинается с клеток базального слоя. В случае вирусного папилломатоза, например, человека инфицирование происходит в результате травмы глубоких слоев эпителия слизистой оболочки. В нашей работе наличие в сосудах стромы опухоли, расположенных на границе с базальным слоем эпителия высокого содержания лимфоцитов, которые, как известно, принимают активное участие в механизмах противовирусной защиты клеток не исключает возможности проникновения вируса гематогенным путем. Предпринятый ранее нами патоморфологический анализ образцов печени, почек, кишечника и жабер рыб с опухолевыми образованиями не позволил выявить характерных признаков их повреждения. Следовательно, в рамках настоящей работы без проведения специальных исследований однозначно ответить на этот вопрос не представляется возможным. Вместе с тем, факт активной пролиферации кератиноцитов является стереотипной реакцией клеток на их сублетальное повреждение. В зависимости от тяжести процесса морфологическая картина повреждения развивается в направлении от гиперплазии эпителия к дисплазии и очаговой малигнизации. По мнению C. Romero-Graillet с соавторами (1997) пролиферирующие кератиноциты экспрессируют паракринные факторы, активирующие пролиферацию муцинсекретирующих клеток. Данные литературы и результаты иммуногистохимии свидетельствуют об участии кератиноцитов и меланофор в синтезе NO [13].
С точки зрения функциональной морфологии повышение количества меланисинтезирующих клеток в опухолевой ткани имеет дуалистическую природу. С одной стороны, рост опухоли требует ее адекватного кровоснабжения. В этом плане экспрессия меланофорами NO обеспечивает активный рост сосудов в строме неоплазмы. С другой стороны, биологический смысл увеличения меланофор связан со способностью свободнорадикальной молекулы NO повреждать инфицированные вирусным патогеном клетки эпителия. Анализ состояния активности свободнорадикальных процессов в опухолевой ткани карася подтверждает наличие высокого уровня окислительных процессов и развитие окислительного стресса (Таблица 1).
Необходимо отметить, что у более низко организованных животных, например, насекомых меланин участвует в инкапсуляции проникшего в организм патогена и заживление ран [5]. При таком варианте в ходе инкапсуляции чужеродный объект заключается в капсулу из разрушенных и меланизированных клеток. Подобную реакцию можно наблюдать при ранении мягких тканей тела насекомого, где меланин выступает в качестве мощного механического барьера, изолирующего чужеродные объекты, предотвращающий рост паразитов и ингибирующий микробиальные хитиназы и протеазы [6, 15]. Кроме того, во время каскада ферментативных реакций, приводящих к образованию меланина, возникает также ряд промежуточных высокореактивных продуктов, опосредующих киллерный механизм при инкапсуляции и гранулообразовании.
Считается, что меланины, особенно эумеланины, демонстрируют выраженные окислительно-восстановительные свойства и могут принимать участие в одноэлектронных и двухэлектронных окислительно-восстановительных реакциях, приводящих к генерации супероксидных радикалов. Последние, как известно, способствуют необратимому повреждению молекулы ДНК, летальному повреждению клеток и субклеточных структур, развитию опухолевого процесса [2].
Заключение. Таким образом, результаты исследования дают все основания считать, что в основе молекулярных механизмов развития опухолевого процесса у рыб важная роль принадлежит активным метаболитам кислорода, а меланин синтезирующие клетки выступают в роли клеточнотканевых регуляторов онкогенеза.
Список литературы Меланофоры рыб в реализации свободнорадикальных клеточно-тканевых механизмов онкогенеза
- Грачева, Н. В. Меланины. Перспективы и проблемы использования в промышленности / Н. В. Грачева, В. Ф. Желтобрюхов. – Волгоград: Волгоградский государственный технический университет, 2019. – 92 с.
- Вострикова, С. М. Активные формы кислорода и антиоксиданты в канцерогенезе и терапии опухолей / С. М. Вострикова, А. Б. Гринев, В. Г. Гогвадзе // Биохимия.– 2020.– Т. 85.– №. 10.– С. 1474-1488.
- Кеберлайн, О. В. Изменение содержания естественных антиоксидантных соединений в икре зеркального карпа при различных технологиях обесклеивания / О. В. Кеберлайн, А. В. Сахаров, А. Е. Просенко // Проблемы биологии и биологического образования в педагогических вузах. – 2013. – С. 53-54.
- Кеберлайн, О. В. Роль каротиноидов в механизмах адаптации эмбрионов зеркального карпа к технологическим нагрузкам при разведении в аквакультуре / О. В. Кеберлайн, А. В. Сахаров, А. А. Макеев, А. Е. Просенко // Современные проблемы науки и образования. – 2012. – №. 6. – С. 543-543.
- Кофанова, А. С. Карась серебряный как индикатор состояния акваторий, подвергнутых деструктивному влиянию мегаполиса / А. С. Кофанова, И. В. Перминов, В. И. Лошенко и др. // Актуальные проблемы биологической и химической экологии: Материалы VII Международной научно-практической конференции. – Москва: МГОУ, 2021. – С. 187-191.
- Крюков, В. Ю. Иммуносупрессия насекомых ядом паразитоида Habrobracon hebetor увеличивает чувствительность метода выделения энтомопатогенных грибов из почв / В. Ю. Крюков, М. В. Тюрин, О. Г. Томилова, О. Н. Ярославцева, Н. А. Крюкова, Б. А. Дуйсембеков, Ю. С. Токарев, В. В. Глупов // Известия Российской академии наук. Серия биологическая. – 2017. – № 4. – С. 401-405.
- Лошенко, В. И. Экспериментальное обоснование роли активных метаболитов кислорода в формировании экотоксичности в акватории приплотинного участка гидроэлектростанции / В. И. Лошенко, А. В. Сахаров, А. Е. Просенко, Е. И. Рябчикова // Современные проблемы науки и образования. – 2014. – №. 5. – С. 589-589.
- Меньщикова, Е. Б. Окислительный стресс. Прооксиданты и антиоксиданты. / Е. Б. Меньщикова, В. З. Ланкин, Н. К. Зенков и др. – М: Фирма «Слово», 2006. – 556 с.
- Павлов, Д. А., Изменчивость Upeneus tragula (Mullidae): цветовые морфы острова Том (Сиамский залив, Южно-Китайское море) / Д. А. Павлов, Н. Г. Емельянова // Вопросы ихтиологии. – 2018. – Т. 58. – №. 3. – С. 331-341.
- Петухов, С. Ю. Исследование разнообразия окраски обыкновенного окуня Perca fluviatilis в разнотипных водоёмах Байкальского региона / С. Ю. Петухов, Ю. П. Толмачева // Вопросы ихтиологии. – 2015. – Т. 55. – №. 6. – С. 734-734.
- Праздников, Д. В. Роль гетерохроний в формировании разнообразия окрасок костистых рыб: экспериментальные данные на примере цихловых рыб (Сichlidae: perciformes) / Д. В. Праздников, Ф. Н. Шкиль // Биологическое разнообразие: изучение, сохранение, восстановление, рациональное использование. – 2018. – С. 32-35.
- Park, J. J. Stratified mucinproducing intraepithelial lesions of the cervix: adenosquamous or columnar cell neoplasia? / J. J. Park, D. Sun, B. J. Quade, C. Flynn, E. E. Sheets, A. Yang, F. McKeon, C. P. Crum // The American journal of surgical pathology. – 2000. – Т. 24. – №. 10. – P. 1414-1419.
- Romero-Graillet, C. Nitric oxide produced by ultraviolet-irradiated keratinocytes stimulates melanogenesis / C. Romero-Graillet, E. Aberdam, M. Clement, J. P. Ortonne, R. Ballotti // The Journal of clinical investigation. – 1997. – Т. 99. – №. 4. – P. 635-642.
- Sichel, G. Relationship between melanin content and superoxide dismutase (SOD) activity in the liver of various species of animals / G. Sichel, C. Corsaro, M. Scalia, S. Sciuto, E. Geremia // Cell Biochemistry and Function. – 1987. – Т. 5. – №. 2. – P. 123-128.
- Söderhäll, K. Prophenoloxydase activating system and melanization / K. Söderhäll // Developmental and comparative immunology. – 1982. – Vol. 6. – № 4. – P. 601-611.


