Мелкоклеточный рак пищевода, результаты лечения редкой гистологической формы
Автор: Тонеев Е.А., Фирстов А.А., Нуретдинов Д.И., Савенко Е.Ю., Анохина Е.П., Мартынов А.А., Карабанова Ю.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 3 т.23, 2024 года.
Бесплатный доступ
Цель исследования - продемонстрировать результаты лечения двух пациентов с мелкоклеточным раком пищевода. Описание клинических случаев. Пациенту М. на первом этапе лечения проведена полихимиотерапия по схеме: этопозид 100 мг/м2, внутривенно, в 1-3-й дни + цисплатин 80 мг/м2 в 1-й день; цикл 21 день до 6 курсов, ланреотид 120 мг подкожно, цикл 28 дней, далее химиолучевое лечение (ХЛТ). Получил 1 курс полихимиотерапии (ПХТ), перенес удовлетворительно. Затем проведен курс 3D-конформной лучевой терапии на область поражения на фоне 2 курсов химиотерапии по схеме: этопозид 120 мг/м2 + цисплатин 80 мг/м2. На фоне лечения отмечается регрессия дисфагии до I степени. В настоящий момент продолжает лечение по схеме: этопозид 100 мг/м2, внутривенно в 1-3-й дни ++ цисплатин 80 мг/м2 в 1-й день; цикл 21 день, ланреотид 120 мг, подкожно, цикл 28 дней , переносит удовлетворительно. Пациенту А. проводилась ПХТ по схеме: этопозид 120 мг/м2 + цисплатин 80 мг/м2. После 4 курсов ПХТ по данным контрольной МСКТ выявлено прогрессирование заболевания в виде увеличения размеров забрюшинных лимфоузлов. Проведен курс дистанционной лучевой терапии на область первичного опухолевого очага. Курс лучевой терапии перенес относительно удовлетворительно. В дальнейшем, в связи с прогрессированием заболевания и ухудшением объективного состояния пациента назначено симптоматическое лечение. Пациент умер от прогрессирования заболевания через 9 мес после постановки диагноза.
Мелкоклеточный рак пищевода, полихимиотерапия, химиолучевая терапия, выживаемость
Короткий адрес: https://sciup.org/140305924
IDR: 140305924 | УДК: 616.329-006.6-036.8 | DOI: 10.21294/1814-4861-2024-23-3-178-185
Текст научной статьи Мелкоклеточный рак пищевода, результаты лечения редкой гистологической формы
Рак пищевода (РП) представляет собой гетерогенную группу злокачественных заболеваний с высокой заболеваемостью и смертностью. В 2020 г. во всем мире зарегистрировано более 0,6 млн новых случаев и 0,54 млн смертей от РП. Рак пищевода встречается в нескольких гистологических формах: плоскоклеточный рак, аденокарцинома, первичная саркома пищевода, мелкоклеточный рак и редкие типы, такие как лимфома, меланома и др. Большинство видов РП представляют собой плоскоклеточный рак или аденокарциному. Мелкоклеточный рак пищевода (МРП) является редким гистологическим типом данной локализации. Частота встречаемости среди злокачественных новообразований пищевода составляет 0,4–2,8 %. С момента его первого упоминания в 1952 г. в литературе описано лишь несколько сотен случаев МРП. В отечественной литературе упоминается о нескольких клинических наблюдениях больных с МРП [1].
Первичный МРП характеризуется высоким злокачественным потенциалом, с быстрым метастазированием, что определяет негативный прогноз. По данным зарубежных авторов, общая 5-летняя выживаемость при МРР составляет 6,7–18 %
[2, 3]. Редкость патологии объясняет отсутствие консенсуса в отношении стандартов лечения. Рандомизированных исследований для оценки эффективности лечения МРП не проводилось. При выявлении МРП лечение зависит от степени распространенности опухолевого процесса, а также объективного статуса пациента.
С учетом редкости наблюдений в данной публикации демонстрируется тактика лечения двух пациентов с МРП.
Наблюдение 1. Пациент М., 67 лет, обратился в ГУЗ «Областной клинический онкологический диспансер» г. Ульяновска в октябре 2023 г. с жалобами на дисфагию, которая появилась в июне 2023 г., за медицинской помощью не обращался. При ухудшении симптоматики выполнил фибро-гастродуоденоскопию (ФГДС) в поликлинике по месту жительства, заключение: новообразование нижней трети пищевода (на 32 см от резцов), выполнена биопсия. Направлен в онкологический диспансер для дальнейшего обследования и лечения. При обращении: индекс Карновского 70 % ECOG 1–2 балла. Индекс массы тела 23,24 кг/м2.
В ГУЗ «Областной клинический онкологический диспансер» выполнена повторная ФГДС: на расстоянии 34 см от края резцов крупнобу-
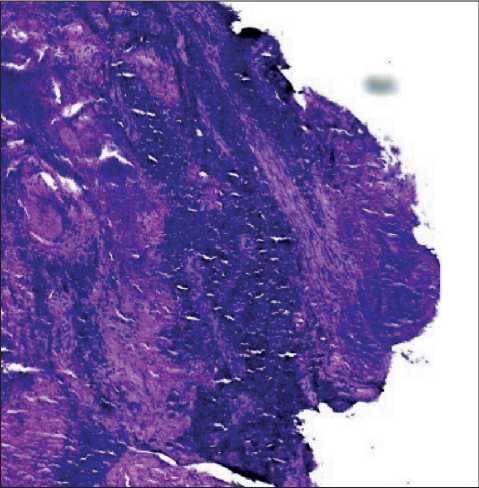
Рис. 1. Микрофото. Мелкоклеточный нейроэндокринный рак пищевода. Окраска гематоксилином и эозином, ×100. Примечание: микрофото выполнено авторами Fig. 1. Microphoto. Small cell neuroendocrine cancer of the esophagus. Hematoxylin and eosin staining, ×100.
Note: created by the authors гристые разрастания слизистой с глубокими изъязвлениями. Стенки ригидные, с контактной кровоточивостью. Протяженность образования до 40 см от края резцов. При микроскопическом исследовании биопсийного материала выявлена опухоль, состоящая из солидных комплексов, в которых определяются клетки мелкого размера, с минимальной цитоплазмой, с мелкодисперсным хроматином, без четко выраженных ядрышек, отмечаются краш-феномен и высокая митотическая активность (рис. 1). При иммуногистохимическом исследовании опухолевые клетки позитивны к TTF1, CD56 и Хромогранину, демонстрируют dotlike экспрессию с CK PAN, экспрессия р63 и СК5/6 в опухоли не выявлена, индекс Ki67 до 90 % (рис. 2).
Заключение: мелкоклеточный нейроэндокринный рак пищевода.
По данным мультиспиральной компьютерной томографии (МСКТ) органов грудной клетки выявлена опухоль средней и нижней трети пищевода, протяженностью 104 мм, признаки метастатического поражения параэзофагеальных и медиастинальных лимфоузлов (от бифуркации до диафрагмы) (рис. 3). По данным КТ органов брюшной полости и МРТ головного мозга с внутривенным контрастированием отдаленных метастазов не обнаружено. Уровень специфических маркеров в крови: Хромогранин А – 189,50 мкг/л, Серотонин – 52 нг/мл, без признаков карциноидного синдрома.
После дообследования проведен мультидисци-плинарный консилиум врачей в составе торакального хирурга, радиотерапевта и химиотерапевта, постановлен диагноз: Мелкоклеточный рак нижней трети пищевода T3N2M0 III cтадии (TNM8) c множественными метастазами в регионарные и средостенные лимфоузлы. Дисфагия II–III степени.
Согласно действующим клиническим рекомендациям Министерства здравоохранения России по лечению нейроэндокринных опухолей (ID:610, год утверждения – 2020), на первом этапе лечения назначена полихимиотерапия (ПХТ) по схеме: этопозид 100 мг/м2, внутривенно в 1–3-й дни + цисплатин 80 мг/м2 в 1-й день; цикл 21 день, лан-реотид 120 мг, подкожно, цикл 28 дней, далее – химиолучевое лечение (ХЛТ). Больной получил 1 курс ПХТ по представленной схеме, перенес удовлетворительно, гематологических осложнений не отмечалось. Далее проведен курс 3D-конформной лучевой терапии РОД 1,8 Гр, СОД 45 Гр, ритм 5 дней в нед) на область первичной опухоли в нижней трети пищевода, а также параэзофагельных, паратрахеальных и парагастральных лимфоузлов
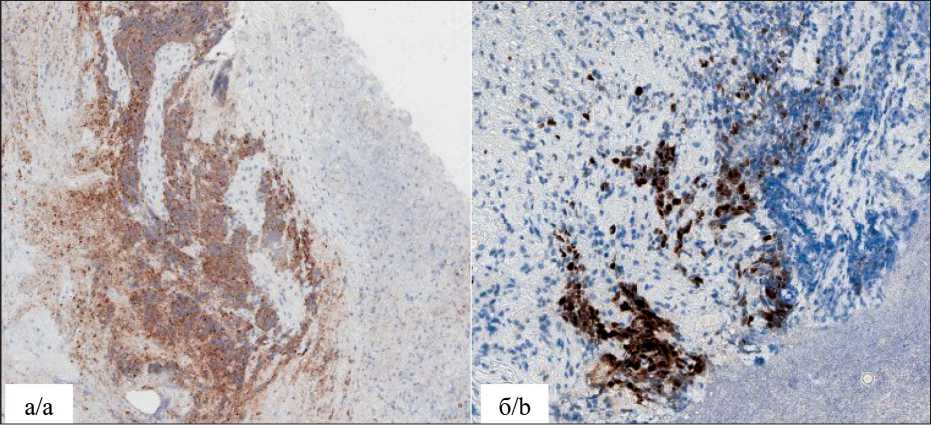
Рис. 2. Микрофото. Иммуногистохимическое исследование с антителами к Хромогранину (а), ×100 и Ki67 (б), ×200. Примечание: микрофото выполнено авторами
Fig. 2. Microphoto. Immunohistochemical study with antibodies to Chromogranin (a), ×100 and Ki67 (b), ×200.
Note: created by the authors
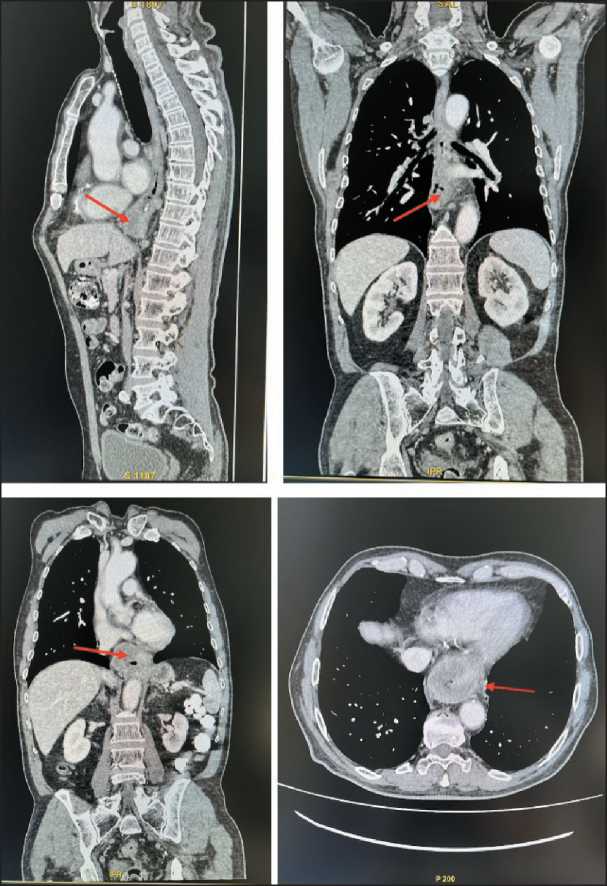
Рис. 3. МСКТ органов грудной клетки и брюшной полости. Стрелкой указана опухоль нижней трети пищевода.
Примечание: снимки выполнены авторами
Fig. 3. Multispiral computed tomography of the chest and abdominal organs. The arrow indicates the tumor of the lower third of the esophagus. Note: created by the authors
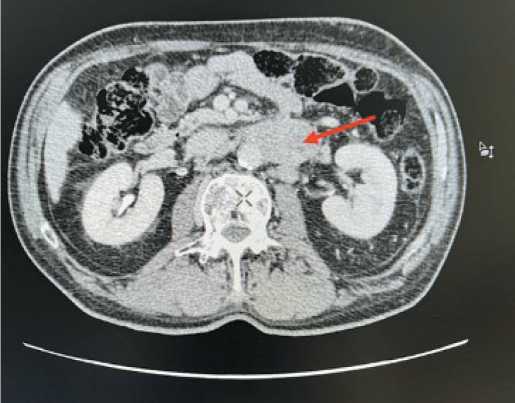
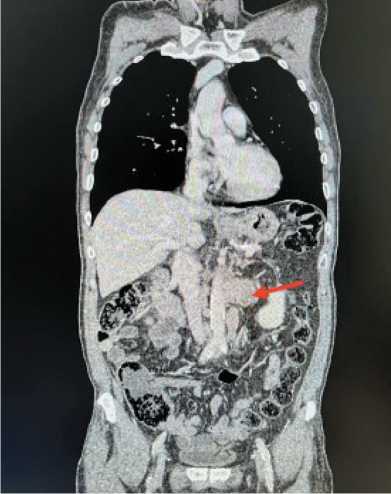
Рис. 4. МСКТ органов грудной клетки и брюшной полости. Стрелками отмечено поражение забрюшинных лимфоузлов.
Примечание: снимки выполнены авторами
Fig. 4. Multispiral computed tomography of the chest and abdominal organs. The arrows marked the involvement of retroperitoneal lymph nodes. Note: created by the authors
методом IMRT под ежедневным визуальным контролем, аппарат – TomoTherapy HDА, фиксация-подставка под ноги, BreastBoard. На фоне 2 курсов химиотерапии по схеме: этопозид 120 мг/м2, внутривенно в 1–3-й дни + цисплатин 80 мг/м2 в 1-й день; цикл 21 день. Перенес ХЛТ удовлетворительно. На фоне проводимого лечения отмечается регрессия дисфагии до 1 степени.
При контрольном обследовании, по данным МСКТ органов грудной клетки, органов брюшной полости, малого таза, МРТ головного мозга с контрастным усилением – положительная динамика (RECIST-PR). Осмотрен химиотерапевтом, рекомендовано продолжить лечение по схеме: этопозид 100 мг/м2, внутривенно в 1–3-й дни + цисплатин 80 мг/м2 в 1-й день; цикл 21 день, ланрео-тид 120 мг, подкожно, цикл 28 дней, до признаков прогрессирования или неприемлемой токсичности. На момент представления статьи продолжает лечение, переносит удовлетворительно.
Наблюдение 2. Пациент А., 55 лет, обратился в ГУЗ «Областной клинический онкологический диспансер» г. Ульяновска в апреле 2021 г. с жалобами на дисфагию, боли в эпигастрии по ВАШ 4–6 баллов, недостаточно купируемые приемом нестериодных противовоспалительных препаратов. Впервые указанные жалобы отметил в конце февраля 2021 г., обратился в поликлинику по месту жительства, где по данным ФГДС на расстоянии 34 см от края резцов выявлены крупнобугристые разрастания слизистой с глубокими изъязвлениями. Стенки ригидные, с контактной кровоточивостью. Протяженность образования до 25 см от края резцов, взята биопсия. Направлен в онкологический диспансер на консультацию к торакальному хирургу. При обращении: индекс Карновского 70 % ECOG 2 балла. Индекс массы тела 22,6 кг/м2.
По данным МСКТ органов грудной клетки и брюшной полости с контрастным усилением: опухоль средней и нижней трети пищевода, протяженность поражения 78 мм. Признаки метастатического поражения параэзофагеальных, паракардиальных лимфоузлов. Множественные очаговые образования в печени до 14 мм, па-рааортальные лимфоузлы, размером 30×56 мм, интераортокавальные – 18 мм (рис. 4). При морфологическом исследовании с последующим иммуногистохимическим подтверждением верифицирован мелкоклеточный нейроэндокринный рак пищевода. Уровень специфических маркеров в крови: Хромогранин А – 62,50 мкг/л, Серотонин – 61 нг/мл.
После комплексного дообследования проведен мультидисциплинарный консилиум врачей в составе торакального хирурга, радиотерапевта и химиотерапевта, постановлен диагноз: Рак нижней трети пищевода cT3N0M1(hep) IV стадия, метастазы в печень, лимфоузлы грудной клетки, параэ-зофагеальные, паракардиальные, парааортальные лимфоузлы. Дисфагия I–II степени. Хронический болевой синдром. С учетом распространенности и гистологической формы опухолевого процесса, согласно действующим клиническим рекомендациям Министерства здравоохранения России по лечению нейроэндокринных опухолей (ID:610, год утверждения – 2020), решением консилиума рекомендована ПХТ по схеме: этопозид 120 мг/м2, внутривенно, в 1–3-й дни + цисплатин 80 мг/м2 в 1-й день; цикл 21 день. После 4 курсов ПХТ по данным контрольной МСКТ выявлено прогрессирование заболевания в виде увеличения размеров забрюшинных лимфоузлов (RECIST-PD). В связи с усилением болей в брюшной полости назначены трансдермальные терапевтические системы «фентанил» 75 мкг/час раз в 72 ч, с удовлетворительным эффектом. С учетом выраженного болевого синдрома осмотрен радиотерапевтом, рекомендован курс паллиативной лучевой терапии на забрюшинные лимфоузлы. Проведена дистанционная лучевая терапия на область первичной опухоли и наиболее массивных конгломератов пораженных метастазами забрюшинных лимфатических узлов, РОД 3 Гр. СОД 36 Гр. Лучевая терапия проводилась в статическом режиме на аппарате TomoTherapy HDA, методом IMRT, с ежедневной визуализацией.
В дальнейшем, в связи с прогрессированием заболевания и объективным состоянием пациента (ECOG 3–4 балла) назначено симптоматическое лечение. Пациент умер от прогрессирования заболевания через 9 мес после постановки диагноза.
Обсуждение
Первичный мелкоклеточный рак пищевода является редким гистологическим типом. Впервые данный гистологический тип описан в 1952 г. K. McKeown, и, несмотря на достаточно большой срок, прошедший от первой публикации, данные по МРП очень ограничены [2]. Симптоматика пациентов с МРП, как правило, не отличается от клинических проявлений рака пищевода часто встречающихся гистологических вариантов [3]. В обоих наших наблюдениях пациенты обратились за медицинской помощью в связи с появлением дисфагии.
Как известно, прогноз пациентов с типичными гистологическими формами РП зависит от степени распространенности и ответа на проводимое лечение, при МРП неблагоприятный прогноз связан с более ранним метастазированием и быстрым прогрессированием на фоне лечения. Обычно пациенты с МРП обращаются за специализированной медицинской помощью при распространенном опухолевом процессе, чаще всего отмечаются раннее метастатическое поражение регионарных лимфатических узлов и гематогенные метастазы в печень и надпочечники [4, 5]. В наших наблюдениях при обращении у пациентов отмечалось множественное поражение средостенных и забрюшинных лимфатических узлов. В одном случае, кроме этого, имелись множественные метастазы в печень.
Проблема эффективного лечения МРП связана с редкостью данной патологии, отсутствием клинических рекомендаций, стратегия лечения, как правило, зависит от объективного состояния пациента. H.H. Wang et. al. показали, что хирургическое лечение МРП приводит к снижению продолжительности жизни по сравнению с ХЛТ. Первичная операция с адъювантным лечением или без него привела к неудовлетворительным результатам [6] . M.B. Meng et al. продемонстрировали схожие результаты, по их данным, МРП лучше всего реагирует на мультимодальное лечение, включающее химиотерапию в сочетании с лучевой терапией [7]. В целом, по данным литературы, химиолучевое лечение МРП дает наибольшую медиану выживаемости, равную 45 мес [4]. В наших наблюдениях одному пациенту проведена ХЛТ с положительным эффектом в виде уменьшения размеров основного опухолевого очага, регрессии дисфагии. Во втором наблюдении паллиативная лучевая терапия проводилась с целью уменьшения размеров образования и купирования болевого синдрома, назначение одновременной химиолучевой терапии расценено как нецелесообразное и ввиду тяжести пациента было сопряжено с развитием тяжелых осложнений.
Стандартно схемы химиотерапии при лечении мелкоклеточного рака основаны на применении платины с комбинацией других химиопрепаратов (этопозид, иринотекан, доцетаксел) [8]. Таким образом, при лечении МРП используются такие же схемы, как и при лечении мелкоклеточного рака легкого, и в исследованиях продемонстрирована их эффективность [9]. Использование доксорубицина, винкристина и циклофосфамида возможно во второй линии химиотерапии [10]. Несмотря на успехи в иммунотерапии рака пищевода, все достижения связаны с лечением преимущественно плоскоклеточных форм данной опухоли [11].
Использование ингибитора PD-L1 (дурвалумаб 1500 мг) и схемы химиотерапии EС (этопозид и карбоплатин) стало новым стандартом первой линии терапии мелкоклеточного рака легкого, в литературе показано увеличение 12-месячной выживаемости без прогрессирования при использовании ингибиторов PD-L1 + EС по сравнению с EС – 18 vs 5 % [12]. Аналогичные результаты получены отечественными и зарубежными исследователями при комбинации химиотерапии с иммунопрепаратом атезолизумаб. В исследовании С.В. Гамаюнова и соавт. продемонстрировано увеличение общей и безрецидивной выживаемости при мелкоклеточном раке легкого при использовании химиотерапии в сочетании с атезолизумабом [13]. К сожалению, применение иммунотерапии при лечении МРП ограничено малым количеством зарубежных исследований и вследствие этого отсутствием в российских клинических рекомендациях ее использования при лечении внелегочных локализаций мелкоклеточного рака.
Согласно метаанализу Al Mansoor et al., общая выживаемость при МРП в зависимости от возраста на момент постановки диагноза для пациентов в возрасте 50 лет и моложе составляла 17,2 мес, для пациентов старше 50 лет – 9,2 мес (p<0,005) [14]. Стадия опухолевого процесса рассматривается как ключевой прогностический фактор выживаемости. При МРП I–IIA стадии медиана выживаемости у пациентов, которым выполнено хирургическое вмешательство, составляет 29 мес по сравнению с 17,4 мес у неоперированных больных. У паци- ентов с МРП IIB–III стадии, получавших комплексное химиолучевое лечение, медиана общей выживаемости составляет 13,0 мес, у пациентов без лечения – 6,1 мес. Химиолучевое лечение у данной категории пациентов повышает медиану общей выживаемости до 25,7 мес, в то время как у тех, кто был оперирован и получал адъювантную химиотерапию, медиана общей выживаемости составила 12,3 мес. Медиана общей выживаемости при МРП IV стадии у пациентов, получавших химиотерапию, в 3 раза выше, чем при симптоматическом лечении [15]. В наших наблюдениях у пациента с МРП IV стадии срок наблюдения составил 9 мес, у второго пациента с МРП III стадии срок наблюдения на момент представления статьи составляет 6 мес, без признаков прогрессирования на фоне лечения.
Список литературы Мелкоклеточный рак пищевода, результаты лечения редкой гистологической формы
- Mamontov A.S., Frank G.A., Kuznetsov V.V. Melkokletochnyi rak pishchevoda. Rossiiskii onkologicheskii zhurnal. 2005; (1): 52-4.
- Gollard R., Ellis C., VanderHarten C. Small cell/neuroendocrine tumors of the esophagus: presentation of two cases and review of the literature. Tumori. 2010; 96(5): 780-3. https://doi.org/10.1177/030089161009600524.
- Wu Z., Ma J.Y., Yang J.J., Zhao Y.F., Zhang S.F. Primary small cell carcinoma of esophagus: report of 9 cases and review of literature. World J Gastroenterol. 2004; 10(24): 3680-2. https://doi.org/10.3748/wjg.v10.i24.3680.
- Alfayez M. Primary small cell oesophageal carcinoma: A retrospective study of different treatment modalities. World J Clin Oncol. 2020; 11(10): 836-43. https://doi.org/10.5306/wjco.v11.i10.836.
- Miao H., Li R., Chen D., Hu J., Chen Y., Wen Z. Survival outcomes and prognostic factors of primary small cell carcinoma of the esophagus. J Thorac Dis. 2021; 13(5): 2790-802. https://doi.org/10.21037/jtd-20-3334.
- Wang H.H., Zaorsky N.G., Meng M.B., Wu Z.Q., Zeng X.L., Jiang B., Jiang C., Zhao L.J., Yuan Z.Y., Wang P. Multimodality therapy is recommended for limited-stage combined small cell esophageal carcinoma. Onco Targets Ther. 2015; 8: 437-44. https://doi.org/10.2147/OTT.S76048.
- Meng M.B., Zaorsky N.G., Jiang C., Tian L.J., Wang H.H., Liu C.L., Wang J., Tao Z., Sun Y., Wang J., Pang Q.S., Zhao L.J., Yuan Z.Y., Ping W. Radiotherapy and chemotherapy are associated with improved outcomes over surgery and chemotherapy in the management of limited-stage small cell esophageal carcinoma. Radiother Oncol. 2013; 106(3): 317-22. https://doi.org/10.1016/j.radonc.2013.01.008.
- Wu Y.H., Zhang K., Chen H.G., Wu W.B., Li X.J., Zhang J. Primary small cell esophageal carcinoma, chemotherapy sequential immunotherapy: A case report. World J Clin Cases. 2021; 9(22): 6478-84. https://doi.org/10.12998/wjcc.v9.i22.6478.
- Ji A., Jin R., Zhang R., Li H. Primary small cell carcinoma of the esophagus: progression in the last decade. Ann Transl Med. 2020; 8(7): 502. https://doi.org/10.21037/atm.2020.03.214.
- Akiyama Y., Iwaya T., Shioi Y., Endo F., Chiba T., Otsuka K., Nitta H., Koeda K., Mizuno M., Uesugi N., Kimura Y., Sasaki A. Effectiveness of neoadjuvant chemotherapy with cisplatin and irinotecan followed by surgery on small-cell carcinoma of the esophagus: A case report. Int J Surg Case Rep. 2015; 17: 121-5. https://doi.org/10.1016/j.ijscr.2015.11.005.
- Kakeji Y., Oshikiri T., Takiguchi G., Kanaji S., Matsuda T., Nakamura T., Suzuki S. Multimodality approaches to control esophageal cancer: development of chemoradiotherapy, chemotherapy, and immunotherapy. Esophagus. 2021; 18(1): 25-32. https://doi.org/10.1007/s10388-020-00782-1.
- Pacheco J.M. Immunotherapy for extensive stage small cell lung cancer. J Thorac Dis. 2020; 12(10): 6212-24. https://doi.org/10.21037/jtd.2020.01.37.
- Gamayunov S.V., Shegurova M.M., Ovchinnikova E.G., Shumskaya I.S., Kleiment'eva T.P. Opyt primeneniya atezolizumaba v kombinirovannoi terapii melkokletochnogo raka legkogo: analiz sobstvennykh dannykh. Onkologiya. Zhurnal im. P.A. Gertsena. 2022; 11(3): 36-40. https://doi.org/10.17116/onkolog20221103136.
- Al Mansoor S., Ziske C., Schmidt-Wolf I.G. Primary small cell carcinoma of the esophagus: patient data metaanalysis and review of the literature. Ger Med Sci. 2013; 11. https://doi.org/10.3205/000180.
- Zou B., Li T., Zhou Q., Ma D., Chen Y., Huang M., Peng F., Xu Y., Zhu J., Ding Z., Zhou L., Wang J., Ren L., Yu M., Gong Y., Li Y., Chen L., Lu Y. Adjuvant Therapeutic Modalities in Primary Small Cell Carcinoma of Esophagus Patients: A Retrospective Cohort Study of Multicenter Clinical Outcomes. Medicine (Baltimore). 2016; 95(17). https://doi.org/10.1097/MD.0000000000003507.


