Местная медикаментозная терапия раневой инфекции у больных с синдромом диабетической стопы
Автор: Осинцев Е.Ю., Мельситов В.А., Бугаева И.О.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Хирургия
Статья в выпуске: 2 т.8, 2012 года.
Бесплатный доступ
Цель: оценка и сравнение параметров раневого процесса у больных с гнойно-некротическими формами синдрома диабетической стопы при использовании современных перевязочных материалов и традиционной схемы местной медикаментозной терапии хронических ран. Материалы и методы. Клиническая часть работы основана на результатах комплексного исследования параметров раневого процесса у 154 больных синдромом диабетической стопы. Результаты. Оптимальные результаты лечения раневой инфекции получены в группе больных с нейропатической формой синдрома диабетической стопы при использовании высокотехнологичных перевязочных материалов. Заключение. Современные интерактивные повязки позволяют активно вмешиваться в течение всех фаз раневого процесса у больных с гнойно-некротическими осложнениями сахарного диабета
Раневая инфекция, сахарный диабет, синдром диабетической стопы
Короткий адрес: https://sciup.org/14917526
IDR: 14917526
Текст научной статьи Местная медикаментозная терапия раневой инфекции у больных с синдромом диабетической стопы
Стандартные схемы местной медикаментозной терапии раневой инфекции не обеспечивают удовлетворительных результатов в лечении гнойно-некротических осложнений СД. По-прежнему 40-60% всех нетравматичных ампутаций нижних конечностей производится у больных СДС [3]. Согласно данным Государственного регистра больных «Сахарный диабет», в России частота ампутаций в этой группе варьирует от 0,76 до 18,2 (в среднем 6,4) случая на 1000 больных. Популяционные исследования показали, что большие ампутации составляют от 48,9 до 60,0%, а согласно когортным исследованиям 24% [2]. Появление на фармацевтическом рынке новых классов антисептических препаратов и интерактивных перевязочных материалов требует стандартизации подхода к местной терапии хронической раневой инфекции у больных СД.
Цель нашего исследования заключалась в оценке и сравнении параметров раневого процесса у больных с гнойно-некротическими формами СДС при использовании современных перевязочных материалов и традиционной схемы местной медикаментозной терапии хронических ран.
Методы. Клиническая часть работы основана на результатах комплексного обследования и лечения 154 больных СДС. Исследование проведено на кафедре хирургии и онкологии ФПК и ППС ГБОУ ВПО «Саратовский ГМУ им. В. И. Разумовского» Минздравсоцразвития России на базе центра «Диабетическая стопа» ГУЗ «Областная клиническая больница» за период с 2005 по 2010 г.
Согласно рекомендациям Международного консенсуса по диабетической стопе [3] все пациенты были разделены на 2 группы в зависимости от патогенетического варианта СДС. Первую группу составили 85 (55,2%) больных с нейропатической формой синдрома диабетической стопы (НПФСДС). Вторая группа из 69 (44,8%) больных представлена пациентами с нейроишемической формой (НИФСДС) синдрома диабетической стопы (таблица).
Распределение больных в зависимости от патогенетического варианта синдрома диабетической стопы
|
Изучаемые группы |
Клинические формы синдрома диабетической стопы |
Всего |
|
|
нейропатическая форма |
нейроишемическая форма |
||
|
Основная |
40,3% (n=62) |
31,2% (n=48) |
71,5% (n=110) |
|
Сравнения |
14,9% (n=23) |
13,6% (n=21) |
28,5% (n=44) |
|
Итого |
55,2% (n=85) |
44,8% (n=69) |
100% (n=154) |
Средний возраст больных составил 52,7±3,8 года. Распространенность инфекционного процесса соответствовала II–III степени по Wagner F. M., 1979 [3, 4]. Средняя площадь раневой поверхности составляла 5,35±0,82 см2. При микробиологическом исследовании установлен смешанный характер инфекции с высокой степенью обсемененности мягких тканей. В структуре идентифицированной микрофлоры доминирующие позиции занимали грамположительные аэробные бактерии. Культура St. aureus выделена из раневого экссудата у 68,8% больных (n=106). Доля MRSA составила 14,2% (n=15). При тяжелых формах инфекции определялись неферментирующие гра-мотрицательные бактерии: Ps. aeruginosa (n=48) — 31,7% и Acinetobacter spp. (n=27) — 17,5%, а также грибы рода Candida (n=11) — 7,1 %.
В группе больных НИФСДС по результатам дуплексного сканирования и рентгеноконтрастной ангиографии зарегистрирован дистальный тип поражения магистральных сосудов нижних конечностей с преимущественной локализацией окклюзионно-стенотических изменений в артериях подколенноберцового сегмента и тыльной поверхности стопы. Значение лодыжечно-плечевого индекса составляло 0,74±0,05. Тяжесть хронической ишемии конечности у пациентов НИФСДС соответствовала IIа-IIб степени по классификации А. В. Покровского — Fontein, 1979 [3]. У больных НПФСДС показатель лодыжечноплечевого индекса составлял 1,14±0,02.
Всем пациентам, включенным в исследование, проводилась комплексная медикаментозная терапия под контролем специалистов центра «Диабетическая стопа» ГУЗ «Областная клиническая больница». Мультидисциплинарный подход в лечении больных СДС реализовался в своевременной компенсации углеводного обмена, назначении системной антибактериальной терапии, применении антикоагулянтных и дезагрегантных препаратов, симптоматической терапии с учетом сопутствующих заболеваний, разгрузке пораженной конечности и местном медикаментозном воздействии на гнойно-некротические очаги в зависимости от фазы раневого процесса.
По характеру проводимой местной терапии раневой инфекции все пациенты разделены на две группы. Основную группу составили 110 (71,5%) пациентов, при лечении которых применялись перевязочные материалы компании «Paul Hartmann», Германия. В группу сравнения вошли 44 (28,5%) пациента, которым проводилась традиционная терапия с использованием повязок с мазью Левомеколь в фазу воспаления и аппликации 10% Метилурациловой мази во вторую и третью фазу раневого процесса.
Выбор интерактивной повязки основывался на объективных критериях оценки фазы раневого процесса. В фазу воспаления при наличии в раневых дефектах обширных зон сухих некрозов предпочтение отдавалось повязкам TenderWet 24. Перевязочный материал Sorbalgon использовался у больных с послеоперационными гнойно-некротическими ранами и трофическими язвами при высоком уровне бактериальной обсемененности, наличии зон вторичных некрозов и умеренно выраженных процессах экссудации. В фазу регенерации применялись повязки Hydrocoll, Atrauman Ag и PermaFoam. В условиях активного инфекционного процесса, обусловленного грамположительными и грамотрицательными бактериями, включая MRSA, назначались повязки Atrauman Ag. Гидроколлоидные повязки Hydrocoll и губчатые перевязочные материалы PermaFoam обеспечивали поглощение избыточного количества экссудата и поддерживали влажную среду в фазу регенерации. Атравматичные повязки Hydrotul, Branolind N, Grassolind neutral использовались на завершающей стадии лечения для стимуляции краевой эпите-лизации.
Оценка результатов лечения раневой инфекции у больных СДС производилась комплексно по нескольким направлениям:
-
1) темпы купирования микроциркуляторных нарушений в мягких тканях пораженной конечности;
-
2) динамика регенераторно-репаративных процессов в ранах;
-
3) длительность стационарного этапа лечения.
Первым проявлением положительной динамики раневого процесса у больных СДС являлось уменьшение отека конечности. Для объективной оценки состояния микроциркуляторного русла и степени ее нарушения в мягких тканях нижних конечностей применялось вычисление динамического показателя отека (метод Ураткова Е. Ф., 1983) на протяжении первых семи дней нахождения больного в стационаре.
Полученные результаты ранжировались на 3 группы по темпам спадения отека до восстановления объема контрлатеральной здоровой конечности: быстрый — до трех суток, средний — до пяти дней, медленный — более шести суток.
Динамика регенераторно-репаративных процессов в обеих группах больных оценивалась комплексно на 3, 5, 7, 10, 15 и 21-е сутки с момента начала стационарного этапа лечения больного. Объективными критериями эффективности проводимой местной медикаментозной терапии раневой инфекции служили данные бактериологического и цитологического исследований раневого экссудата (Штейнберг Д. М., 1948), показатели планиметрии раны и скорость эпи-телизации (тест Поповой Л. Н., 1942) [4].
Статистический анализ полученных данных производился с использованием программы Statistica 8.0 StatSoft Inc., США. Распределение значений категориальных переменных определяли абсолютными и относительными частотами объектов исследования. Применяли методы описательной статистики, формат данных представлен M±m, различия считали достоверными при 95%-ном пороге вероятности.
Результаты. Оптимальные результаты лечения раневой инфекции получены в основной группе больных НПФСДС. В течение первых четырех дней стационарного лечения пациентов этой группы отмечен активный темп уменьшения отека мягких тканей пораженной конечности. На 4-е сутки от начала местной медикаментозной терапии (рис. 1) величина динамического показателя отека cнижалась на 10,2±0,9% (p<0,05) от первоначальной величины. У 82,3% больных НПФСДС основной группы (n=51) зарегистрирован быстрый темп спадения отека до восстановления объема здоровой контрлатеральной конечности.
Активизация микроциркуляторных процессов у пациентов НПФСДС, включенных в группу сравнения, происходила на 4–5-е сутки с момента начала стационарного этапа лечения. Пик снижения динамического показателя отека до величины 5,2±0,5% (p<0,05) приходился на 5-й день с момента назначения традиционной схемы местной медикаментозной терапии раневой инфекции. В группе сравнения у 65,2% (n=15) больных НПФСДС установлен медленный темп уменьшения отека пораженной конечности в контролируемые сроки измерения.
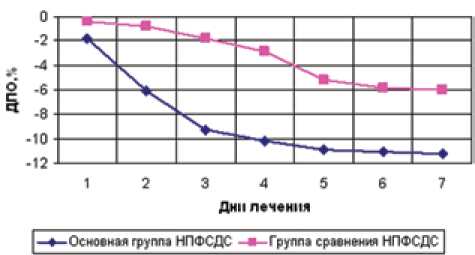
Рис. 1. Динамический показатель отека конечности в группах больных НПФ СДС
В начале стационарного этапа лечения у 81,2% больных НПФСДС (n=69) установлен воспалительный тип цитограммы. При цитологическом исследовании мазков отпечатков ран у 18,8% пациентов НПФСДС (n=16) диагностированы воспалительнонекротические изменения (рис. 2). При проведении местной медикаментозной терапии положительная динамика регенераторно-репаративных процессов отмечена у всех пациентов обеих групп наблюдения.
Очищение раневых дефектов от гноя и некротических масс и появление признаков воспалительного типа цитограммы у больных НПФСДС основной группы наступало на 5,7±0,6-е сут. (p<0,05) с момента начала использования современных перевязочных материалов (рис. 3). При использовании традиционных средств местной медикаментозной терапии некро-
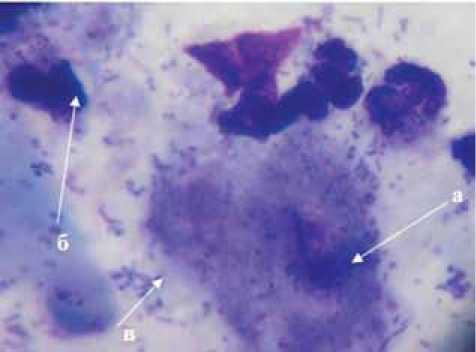
Рис. 2. Воспалительно-некротический тип цитограммы у больного НПФСДС основной группы (начало лечения): а — детрит; б — разрушенные нейтрофилы; в — внеклеточная микрофлора. ×1000. Окраска «Лейкодиф», краситель — азур-эозин
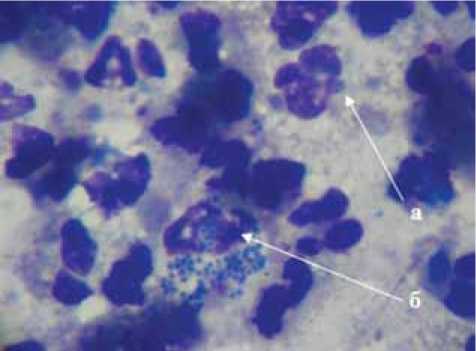
Рис. 3. Воспалительный тип цитограммы у больного НПФСДС (5-е сутки местного лечения с использованием современных повязок): а — нейтрофил; б — нейтрофил с признаками завершенного фагоцитоза. ×1000. Окраска — «Лейкодиф», краситель — азур-эозин литические процессы протекали медленнее. У пациентов группы сравнения воспалительный тип цитограммы регистрировался на 7,2±0,8 сутки (p<0,05) стационарного лечения.
Во вторую фазу раневого процесса современные повязки Hydrocoll, Atrauman Ag и PermaFoam обеспечивают постоянное поддержание умеренно влажной среды. В результате появление грануляционной ткани в раневых дефектах у больных основной группы НПФСДС достоверно отмечено на 9,8±0,8-е сутки (p<0,001) лечения.
Использование 10% Метилурациловой мази в фазу регенерации у пациентов группы сравнения вызывало задержку экссудата на раневой поверхности. Повышение концентрации цитотоксических факторов приводило к задержке сроков формирования грануляционной ткани до 13,2±1,2 суток (p<0,01).
Применение атравматичных повязок в третьей фазе раневого процесса, в основной группе больных, стимулировало процессы краевой эпителиза-ции, способствуя формированию регенераторно-вос- палительного типа цитограмм (рис.4). Показатель суточного уменьшения площади раны у пациентов основной группы составил 2,87±0,82%.
Скорость эпителизации ран у больных основной группы имела тенденцию к ускорению, однако статистически достоверного уменьшения площади ран, 1,72±0,51% (p>0,05), в сравнении с показателями контрольной группы не достигнуто.
Раневой процесс у больных НИФСДС имел тор-пидный характер течения. Показатели скорости уменьшения отека конечности значительно отставали от значений, полученных при лечении пациентов НПФСДС. В основной группе больных НИФСДС только к 6-м суткам стационарного лечения динамический показатель отека достигал значения 5,5±0,6% (p<0,05) от первоначальной величины (рис. 5).
Купирование микроциркуляторных расстройств за время наблюдения отмечено у 60,4% пациентов основной группы (n=29). Среди этой когорты больных НИФСДС у 20,7% пациентов (n=6) зарегистрированы средние показатели и у 79,3% больных (n=23) медленные темпы спадения отека до восстановления объема контрлатеральной конечности.
В контрольной группе больных НИФСДС восстановление микроциркуляторных нарушений в мягких тканях нижних конечностей отмечено только у 23,8% пациентов (n=5) с медленным темпом спадения отека конечности.
В начале стационарного этапа лечения при микроскопии мазков-отпечатков ран у 84,1% больных НИФСДС (n=58) установлены признаки дегенеративно-воспалительного типа цитограммы. Полное очищение раневых дефектов от гноя и некротических масс с появлением признаков воспалительного типа цитограммы у основной группы больных НИФСДС наступило на 12,6±0,6-е сутки (p<0,05). В группе сравнения за время исследования некролитические процессы зарегистрированы у 80,9% пациентов (n=17) на 13,4±1,2-е сутки (p>0,01) нахождения в стационаре.
Появление грануляционной ткани во вторую фазу раневого процесса при использовании современных перевязочных материалов отмечено на 16,2±1,1-е сут. (p<0,01). В группе сравнения репаративные процессы активизировались на 17,3±1,9-е сутки (p<0,05) от начала лечения. Процессы эпителизации раневых дефектов наблюдались только у 39,6% больных основной группы (n=19). Показатель суточного уменьшения площади раны составил 1,09±0,18%.
Таким образом, наличие ишемического компонента у больных НИФСДС являлось определяющим фактором, пролонгирующим течение раневого процесса на всех его фазах.
Обсуждение. Лечение раневой инфекции у больных СДС требовало комплексного подхода, с возможностью активного воздействия на различные звенья раневого процесса. Основополагающими факторами, определяющими прогноз эпителизации хронических ран у больных СД, являлись распространенность поражения тканей стопы и степень нарушения артериального кровообращения в нижних конечностях.
У больных НПФСДС темпы регенераторно-репаративных процессов заметно опережали показатели, полученные в группе больных с ишемией мягких тканей конечности. В условиях ишемии конечности раневой процесс носил торпидный характер, в связи с чем медикаментозная терапия не обеспечивала стимуляцию репаративных процессов.
Современные перевязочные материалы активизировали регенераторно-репаративные процессы у
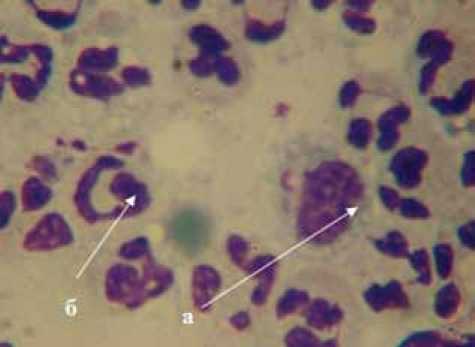
Рис. 4. Регенераторно-воспалительный тип цитограммы у больного НПФСДС (15-е сутки местной терапии современными повязками): а — гистиоцит; б — нейтрофил. × 1000.
Окраска — «Лейкодиф», краситель — азур-эозин
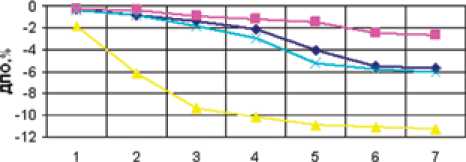
Дни леммам
—а-Осноана* группа НИФСДС -«-Группа сраелени* НИФСДС Ослоаиа» группа НПФСДС ---Группа сраалаииа НПФСДС
Рис. 5. Динамический показатель отека конечности в группах больных НИФ СДС в сравнении с больными НПФ СДС больных с инфекционными осложнениями СД, что позволяло улучшить результаты лечения и сохранить опорную функцию конечности. Выбор повязки основывался на объективных критериях оценки фазы раневого процесса. Стандартная схема местной медикаментозной терапии не обеспечивала индивидуального подхода к лечению раневой инфекции и, по мнению большинства специалистов [3, 4], могла быть использована у ограниченного круга больных с НПФСДС.
Длительность стационарного этапа лечения у больных НПФСДС составила 15,1±1,4 дня. В группе больных с НИФСДС — 22,6±2,9 (р<0,005) дня, что связано с необходимостью проведения длительной вазоактивной терапии и выполнением многоэтапных некрэктомий. Частота ампутаций сегментов конечностей в группе НИФСДС составила 15,9% (n=11), летальность 2,9% (n=2). В группе пациентов с НПФСДС ампутаций и летальных исходов заболевания не наблюдалось.
Выводы:
-
1. Концентрация больных СДС в специализированном центре при многопрофильном стационаре позволяет осуществлять мультидисциплинарный подход в лечении гнойно-септических осложнений СД.
-
2. Течение раневого процесса у пациентов НИФСДС определяется степенью ишемии мягких тканей конечности и возможностью ее компенсации медикаментозными и хирургическими методами.
-
3. Современные интерактивные перевязочные материалы позволяют активно вмешиваться в течение всех фаз раневого процесса у больных с гнойнонекротическими осложнениями СД.
-
4. Традиционная схема местной медикаментозной терапии хронических ран может быть использована у ограниченного контингента больных НПФСДС.
Список литературы Местная медикаментозная терапия раневой инфекции у больных с синдромом диабетической стопы
- Diabetes Atlas. International Diabetes Federation. 3d ed. Brussels, 2007. 381 p.
- Эпидемиология сахарного диабета и прогноз его распространения в Российской Федерации/Ю.И. Сунцов, Л. Л. Болотская, О. В. Маслова, И. В. Казаков//Сахарный диабет. 2011. №1 (50). С. 15-19.
- International Consensus on the Diabetic Foot and Practical Guidelines on the Management and Prevention of the Diabetic Foot. Noordwijkerhout, 2007. 181 p.
- Раны и раневая инфекция: руководство для врачей/под ред. М.И. Кузина, Б.М. Костюченок. М.: Медицина, 1990. 592 с.
- Современный взгляд на патофизиологию и лечение гнойных ран/О.Э. Луцевич [и др.]//Хирургия. 2011. № 5. С. 72-77.
- Lobmann R., Schultz R., Lechnert H. Proteases and the diabetic foot syndrome: mechanisms and therapeutic implications//Diabetes Care. 2005. Vol. 28. P. 461-471.
- Cellular dysfunction in the diabetic fibroblast impairment in migration, vascular endothelial growth factor production and response to hypoxia/O.Z. Lerman [et al.]//Amer.J. Pathol. 2003. Vol. 162. P. 303-312.
- Wound healing and TIME new concepts and scientific applications/G. Schultz [et al.]//Wound Rep. Reg. 2005. Vol. 13. P. 1-11.
- Biofilms in chronic diabetic foot ulcers -a study of 2 cases/D. Neut [et al.]//Acta Orthop. 2011. Vol. 82. P. 383-385.
- Fonseca A. P. Biofilms in wounds: An unsolved problem?//EWMA Journal. 2011. Vol. 11. P. 10-23.


