Место роботической хирургии в лечении рака ротоглотки. Клиническое наблюдение
Автор: Саприна О.А., Кропотов М.А., Занозина Е.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 5 т.22, 2023 года.
Бесплатный доступ
Актуальность. Заболеваемость плоскоклеточным раком ротоглотки растет, и связано это с увеличением частоты инфицирования вирусом папилломы человека (ВПЧ). Учитывая лучший прогноз у пациентов с ВПЧ-позитивным раком по сравнению с ВПЧ-негативным, предприняты попытки уменьшить терапевтическое воздействие с целью улучшения качества жизни у пациентов с ранними стадиями. При ранних стадиях рака ротоглотки возможно применение как лучевого, так и хирургического методов лечения в самостоятельном варианте или в комбинации. На современном этапе понятие «трансоральная хирургия» включает в себя как трансоральную лазерную микрохирургию, так и робот-ассистированные операции (da Vinci, medrobotic Flex system). Описание клинического случая. В статье представлен один из клинических случаев использования робот-ассистированной системы da Vinci в комбинированном лечении рака ротоглотки. После операции пациент получил адъювантное химиолучевое лечение. Срок наблюдения за пациентом составил 10 мес. При контрольном обследовании - без признаков рецидива заболевания. Жалоб со стороны органов полости рта, ротоглотки не предъявляет, глотание любой пищи безболезненное.
Рак ротоглотки, впч-позитивный рак, трансоральная хирургия, роботическая хирургия
Короткий адрес: https://sciup.org/140302491
IDR: 140302491 | УДК: 616.31+616.321]-006.6-089 | DOI: 10.21294/1814-4861-2023-22-5-190-196
Текст научной статьи Место роботической хирургии в лечении рака ротоглотки. Клиническое наблюдение
В 2021 г. в России зарегистрировано 5 604 случая злокачественных новообразований ротоглотки, при этом стандартизованный показатель заболеваемости среди мужчин составил 6,9 случая на 100 тыс. населения, среди женщин – 1,19 случая на 100 тыс. населения. Наиболее часто заболевание выявляют в возрасте от 40 до 54 лет [1].
Основными этиологическими факторами рака ротоглотки считаются курение, особенно в сочетании с употреблением крепкого алкоголя, жевание различных смесей, а также вирус папилломы человека (ВПЧ), особенно его 16-й и 18-й типы [2, 3]. Рак ротоглотки, ассоциированный с вирусом папилломы человека, представляет особый клинический интерес, что связано с лучшим прогнозом и, соответственно, с возможностью уменьшить терапевтическое воздействия с целью улучшения качества жизни.
ВПЧ-позитивный рак преимущественно возникает у пациентов молодого возраста без вредных привычек [4]. Несмотря на низкую степень дифференцировки опухоли и наличие в большинстве случаев регионарных метастазов, выживаемость в этой группе пациентов в 2 раза выше, чем у ВПЧ-негативных больных [5].
В настоящее время продолжаются исследования относительно деинтенсификации лечения. Основными стратегиями деэскалации лучевой терапии являются уменьшение токсичности лекарственной терапии во время лучевой терапии за счет сокращения или замены цитотоксических препаратов, уменьшения дозы и объемов лучевой терапии, немаловажная роль в деэскалации лучевой терапии принадлежит малоинвазивной хирургии (трансоральной лазерной микрохирургии и роботической хирургии).
Конечно, преимущество трансоральной хирургии в качестве применения одной модальности неоспоримо. Однако дооперационные данные не всегда коррелируют с результатами патологоанатомического исследования как первичной опухоли, так и регионарных лимфатических узлов, зачастую диагноз меняется в сторону увеличения стадии, что требует изменения намеченного плана лечения. Следовательно, добавление лучевой или химиолучевой терапии к хирургическому методу не приводит к улучшению качества жизни, и выигрыш пациента сомнителен. Данный факт зачастую вынуждает онкологов не выполнять оперативное вмешательство с учетом сопоставимых показателей выживаемости.
Несмотря на необходимость адъювантной хи-миолучевой терапии у 80 % пациентов, сторонники хирургического лечения предлагают выполнять трансоральные резекции для точного стадирования и, соответственно, для реализации оптимального плана лечения. В опубликованном анализе R.V. Smith et al. послеоперационное стадирование заболевания не соответствовало клиническому у 43 % пациентов и у 21 % потребовало изменения тактики [6]. При этом показатели 2-летней безре-цидивной выживаемости составили 94 %, 5-летней общей выживаемости – 78 % [5, 7–9]. Показатели локального контроля увеличивались с 80 до 91 % при использовании послеоперационного химиолу-чевого лечения [10].
С учетом точного стадирования после хирургического лечения, выполненного на первом этапе, возможна стратификация риска при деинтенсификации. Учитывая небольшой опыт робот-ассистированных вмешательств на органах ротоглотки в Российской Федерации, публикация каждого клинического наблюдения представляет интерес.
Клиническое наблюдение
Больной Ч., 62 года, обратился в поликлинику НМИЦ онкологии им. Н.Н. Блохина с жалобами на узловое образование на шее слева, под углом нижней челюсти, размером до 5 см. Данное образование пациент заметил 2 мес назад, оно медленно увеличивалось в размерах. При осмотре отмечалась деформация шеи за счет припухлости в верхнем отделе шеи слева (рис. 1). Пальпатор-но на шее справа в верхней трети определялось плотно-эластическое образование, ограниченно смещаемое, безболезненное, размером до 5 см. При осмотре полости рта, глотки, непрямой ларингоскопии патологии не выявлено.
По данным УЗИ на шее слева в верхней трети выявлялись 3 сливающихся лимфатических узла солидно-кистозной структуры, размерами 3,5, 2,4 и 1,6 см. Другие лимфатические узлы на шее не изменены. Для определения природы выявленных изменений произведена пункция узлового образования. Цитологическое заключение: клетки плоскоклеточного рака. Эндоскопическое исследование верхних дыхательных и пищеварительных путей не выявило патологических изменений.
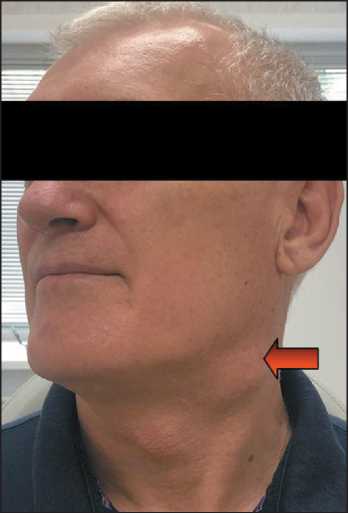
Рис. 1. Внешний вид больного. В верхней трети шеи слева определяется подкожно расположенное узловое образование, округлой формы, размерами до 5 см. Примечание: фото выполнено авторами
Fig. 1. Patient’s appearance. In the upper third of the neck on the left, a subcutaneous round-shape nodule measuring up to 5 cm is visualized.
Note: created by the authors
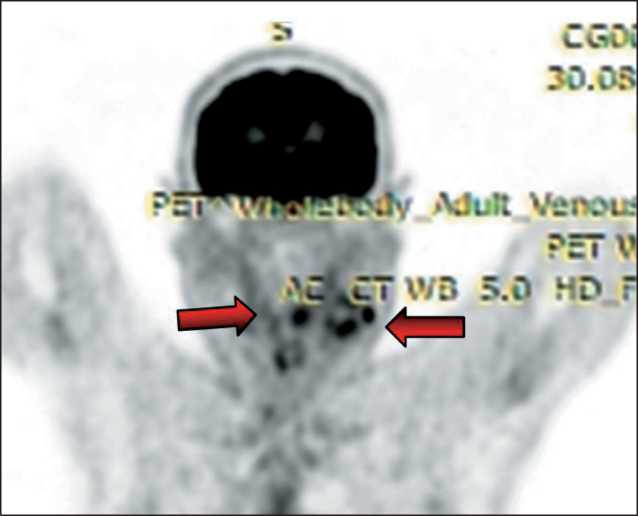
Рис. 2. ПЭТ КТ. Накопление РФП в лимфоузлах шеи справа (SUV – 7,4) и области корня языка слева (SUV – 5,3). Примечание: изображение выполнено авторами
Fig. 2. PET CT. Accumulation of radiopharmaceutical in the lymph nodes of the neck on the right (SUV – 7.4) and the region of the root of tongue on the left (SUV – 5.3). Note: created by the authors
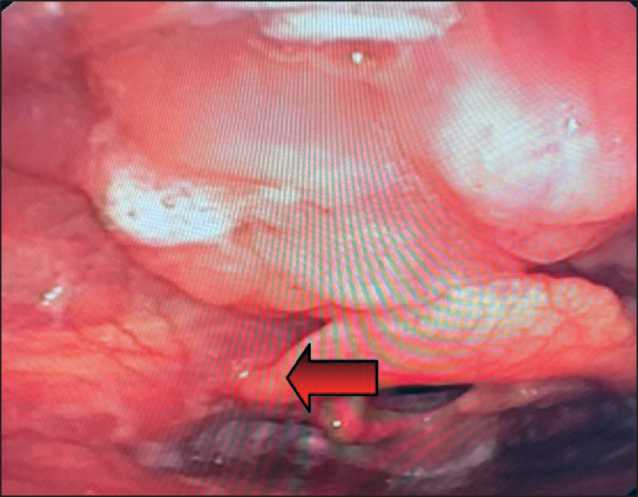
Рис. 3. Эндофото. В области корня языка слева определяется мелкобугристое образование, выбухающее над поверхностью слизистой оболочки, с неровными контурами, диаметром до 1,3 см. Примечание: фото выполнено авторами
Fig. 3. Endophoto. In the area of the root of the tongue on the left, a small-bumpy lesion protruding above the mucous membrane, with irregular contours up to 1.3 cm in diameter, is identified.
Note: created by the authors
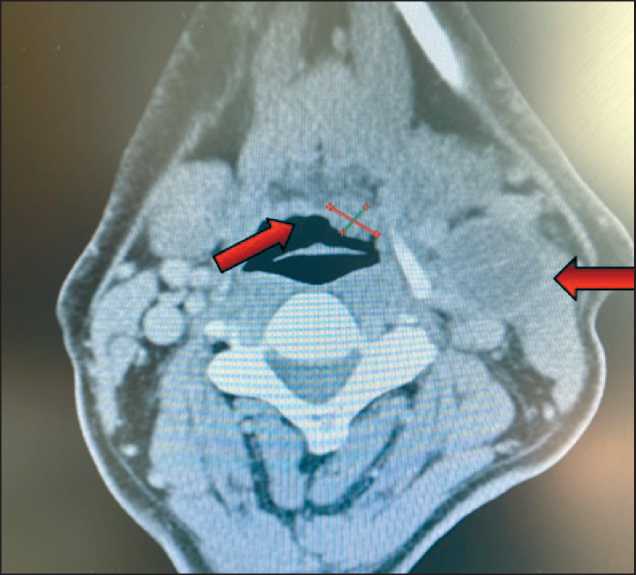
Рис. 4. Компьютерная томография с внутривенным контрастированием. Аксиальная проекция. Слева на шее определяется кистозно измененный увеличенный лимфатический узел, размером до 3,5 см, сдавливающий внутреннюю яремную вену.
В области корня языка имеется дополнительное образование, размером до 1,5 см, интенсивно накапливающее контраст. Примечание: изображение выполнено авторами
Fig. 4. CT with contrast. Axial projection. A cystic enlarged lymph node on the left side of the neck, measuring up to 3.5 cm and compressing the internal jugular vein, is visualized. In the area of the root of the tongue, an additional lesion measuring up to 1.5 cm, intensively accumulating contrast, is seen. Note: created by the authors
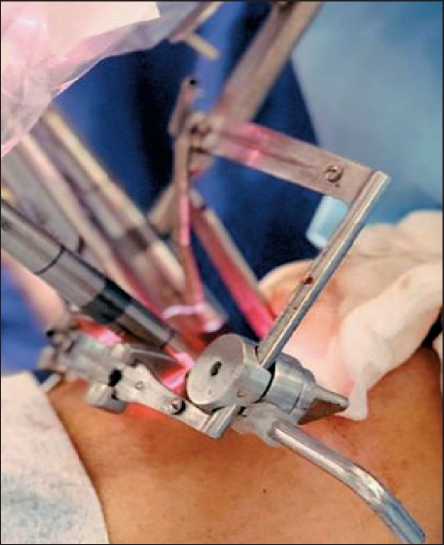
Рис. 5. Этап операции. Установлен роторасширитель типа Dingman. Камера и рабочие инструменты робота Da Vinci через рот подведены к области корня языка для резекции. Примечание: фото выполнено авторами
Fig. 5. Robotic-assisted surgery. The Dingman mouth gag has been installed. The camera and robotic instruments of the Da Vinci robot are guided through the mouth to the region of the root of the tongue for resection. Note: created by the authors
На основании этих данных установлен первоначальный диагноз: Метастазы рака в лимфатические узлы шеи справа из первично не выявленного очага. Для поиска первичного очага выполнена ПЭТ-КТ всего тела с 18-фтордезоксиглюкозой, при которой выявлено патологическое накопление радиофармпрепарата (SUV – 7,4) в 3 лимфатических узлах шеи справа, общим размером до 4,5 см, и в области корня языка слева (SUV – 5,3), размером до 1,3 см (рис. 2). При повторном эндоскопическом исследовании прицельно области корня языка в левой его половине определялось мелкобугристое образование, выбухающее над уровнем слизистой оболочки, с нечеткими контурами, с патологически измененной сосудистой сетью в подслизистом слое в режиме NBI, размером до 1,3 см (рис. 3). Морфологическое исследование биопсийного материала показало наличие плоскоклеточного неороговевающего рака.
Для уточнения распространенности опухолевого процесса выполнена КТ органов головы и шеи с внутривенным контрастированием: на шее слева в верхней трети, в зоне IIa–IIb определялись узловые, кистозно измененные лимфатические узлы (в количестве 3) с накоплением контраста по периферии, размерами 3,6, 2,3, 1,7 см. Отмечалась асимметрия корня языка, за счет участка накопления контраста в левой половине без четких границ, размерами до 1,5 см (рис. 4).
Проведенное обследование позволило уточнить диагноз: Рак ротоглотки Т1N2bM0. В такой клинической ситуации в настоящее время существуют 2 подхода в лечении, равнозначных по своей онкологической эффективности: лучевая терапия на область корня языка и на шейнонадключичные зоны с возможным проведением конкурентной химиотерапии цисплатином либо выполнение хирургического вмешательства в объеме резекции органа, где локализован первичный очаг, радикальной модифицированной шейной лимфодиссекции с последующим морфологическим исследованием, определением факторов прогноза и решением вопроса о необходимости адъювантного лучевого или химиолучевого лечения. Но, учитывая локализацию первичной опухоли в такой труднодоступной зоне, как корень языка, ее трансоральное удаление представляет серьезные технические сложности, а выполнение хирургического доступа в виде надподъязычной фаринготомии либо срединной мандибулотомии создает дополнительную хирургическую травму окружающих органов и тканей и имеет определенный спектр осложнений и побочных эффектов. В связи с этим для опухолей такой труднодоступной локализации разработаны методики трансорального удаления в виде трансоральной лазерной микрохирургии и трансоральной робот-ассистированной хирургии (TLM/TORS). Учитывая распространенность и локализацию опухоли, решено выполнить операцию в объеме трансоральной робот-ассистированной резекции корня языка и радикальной модифицированной шейной лимфодиссекции слева.
Операция начиналась с радикальной модифицированной шейной лимфодиссекции через поперечный разрез (удалена клетчатка 1–4-го уровня) с установкой в конце операции дренажа через боковой треугольник шеи. После ушивания раны на шее выполнялась обработка полости рта антисептиками, на кончик языка накладывались лигатуры для его мобилизации, далее устанавливался роторасширитель Dingman с фиксацией на фронтальные зубы верхней челюсти и подвижную часть языка и частично корень языка до уровня переднего края опухолевого инфильтрата. Затем наружная часть роторасширителя фиксировалась к специальной подставке (рис. 5). Таким образом, пациент как бы «подвешивается» на роторасширителе, что создает условия для максимального разведения верхней и нижней челюсти, отведения подвижной части языка и щек. После этого рабочая станция робота Da Vinci перемещается к операционному столу и устанавливается сбоку от больного таким образом, что камера и 2 рабочих инструмента робота по направлению от головы к ногам вводятся через полость рта к ротоглотке. Хирург на экране видит рабочие части инструментов и границу опухоли, концами ножниц или зажима «Meriland» сначала намечаются границы резекции с использованием электроножа в режиме резки, отступая от границ опухолевого поражения минимум на 5 мм. Далее после фиксации препарата за край слизистой оболочки производится его последовательная мобилизация посредством резекции слизистой оболочки и мышц корня языка. Коагуляция кровоточащих участков производится в ходе операции. Хорошая визуализация за счет увеличения и 3-мерного изображения позволяет точно определять границы поражения и выполнять удаление в едином блоке в пределах здоровых тканей. Значительная подвижность рабочих инструментов Da Vinci, превышающая возможности рук человека, позволяет выполнять резекцию органа в труднодоступной зоне и в ограниченном пространстве. В конце операции устанавливается носопищеводный зонд для питания на 3 дня. Ушивания раны в области корня языка не требуется – заживление идет за счет гранулирования и эпителизирования раневой поверхности в течение 3–4 нед.
Однократно на 3-и сут больному выполнено эндоскопическое исследование для контроля заживления раны в области корня языка. Выписка из стационара осуществлена на 4-е сут после операции. На момент выписки больной отмечал умеренную болезненность при глотании в области корня языка, которая сохранялась в течение 3 нед.
Морфологическое исследование удаленного препарата показало разрастание плоскоклеточного
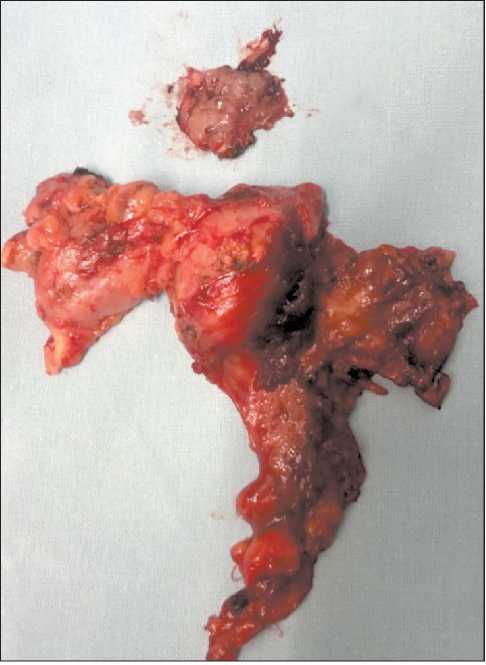
Рис. 6. Макропрепарат. Фрагмент слизистой оболочки с мышцами корня языка с опухолью. Удаленная клетчатка шеи слева (I–IV уровни) с метастатическими лимфоузлами. Примечание: фото выполнено авторами
Fig. 6. Macrospecimen. A fragment of the mucous membrane with the muscles of the root of the tongue with a tumor. Removed tissue of the neck on the left (I–IV levels) with metastatic lymph nodes. Note: created by the authors
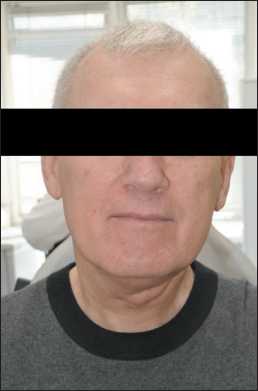
Рис. 7. Внешний вид больного через 10 мес поcле лечения.
Примечание: фото выполнено авторами Fig. 7. Patient’s appearance 10 months after completing treatment.
Note: created by the authors
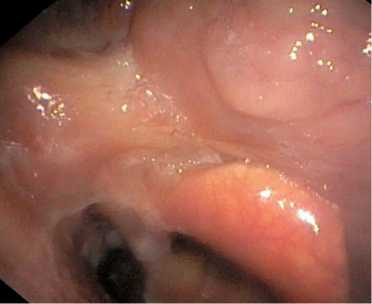
Рис. 8. Эндофото. Послеоперационная деформация левой половины корня языка без изменений слизистой оболочки, без рецидива. Примечание: эндофото выполнено авторами Fig. 8. Endoscopy image. Postoperative deformation on the left half of the tongue root without changes in the mucous membrane, without recurrence. Note: created by the authors
рака на участке до 12 мм, глубиной поражения до 6 мм. Край резекции отстоял от края опухоли на 3 мм. Среди 18 удаленных лимфатических узлов в 3 выявлены метастазы плоскоклеточного рака, в одном из них – транскапсулярная инвазия опухоли с распространением в жировую клетчатку шеи (рис. 6).
Учитывая данные морфологического исследования, больному проведено послеоперационное химиолучевое лечение: лучевая терапия на область корня языка до суммарной дозы 60 Гр и шейно-надключичную область до 66 Гр, на фоне 2-кратного введения цисплатина в дозе 100 мг/м2. Пациент удовлетворительно перенес химиолуче-вое лечение, на дозе 26 Гр в области ротоглотки отмечался эпителиит средней степени тяжести, на этом фоне в течение 10 дней больной принимал жидкую пищу. Через 2 мес химиолучевые реакции были купированы.
Срок наблюдения после операции составил 10 мес. При контрольном обследовании – без признаков рецидива заболевания (рис. 7, 8). Жалоб со стороны органов полости рта, ротоглотки не предъявляет, глотание любой пищи безболезненное.
Таким образом, робот-ассистированная операция в такой труднодоступной зоне, как корень языка, позволяет выполнить резекцию в пределах здоровых тканей без функциональных и эстетических нарушений с последующим морфологическим исследованием операционного материала, определением неблагоприятных факторов прогноза и назначением оптимального адъювантного лечения.
Заключение
Визуализация тканей при робот-ассистирован-ных вмешательствах на органах ротоглотки позволяет выполнять прецизионную диссекцию благодаря лучшему обзору под разными углами операционного поля, а также большей степени свободы движений двух манипуляторов, с возможностью вращения на 360°. Необходим тщательный отбор пациентов для трансоральной хирургии с целью использования одной модальности лечения для сохранения качества жизни.
Список литературы Место роботической хирургии в лечении рака ротоглотки. Клиническое наблюдение
- Злокачественные новообразования в России в 2021 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М., 2022. 252 с.
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Cancer of the Oropharynx. Version 2.2018.
- Ragin C.C., Taioli E. Survival of squamous cell carcinoma of the head and neck in relation to human papillomavirus infection: review and meta-analysis.Int J Cancer. 2007; 121(8): 1813-20. 10.1002/ ijc.22851. DOI: 10.1002/ijc.22851
- Allen C.T., Lewis J.S., El-Mofty S.K., Haughey B.H., Nussenbaum B. Human papillomavirus and oropharynx cancer: biology, detection and clinical implications. Laryngoscope. 2010; 120(9): 1756-72. 10.1002/ lary.20936. DOI: 10.1002/lary.20936 EDN: NAJOWB
- Moore E.J., Olsen S.M., Laborde R.R., García J.J., Walsh F.J., Price D.L., Janus J.R., Kasperbauer J.L., Olsen K.D. Long-term functional and oncologic results of transoral robotic surgery for oropharyngeal squamous cell carcinoma. Mayo Clin Proc. 2012; 87(3): 219-25. DOI: 10.1016/j.mayocp.2011.10.007
- Grant D.G., Hinni M.L., Salassa J.R., Perry W.C., Hayden R.E., Casler J.D. Oropharyngeal cancer: a case for single modality treatment with transoral laser microsurgery. Arch Otolaryngol Head Neck Surg. 2009; 135(12): 1225-30. DOI: 10.1001/archoto.2009.185
- Haughey B.H., Hinni M.L., Salassa J.R., Hayden R.E., Grant D.G., Rich J.T., Milov S., Lewis J.S., Krishna M. Transoral laser microsurgery as primary treatment for advanced-stage oropharyngeal cancer: a United States multicenter study. Head Neck. 2011; 33(12): 1683-94. 10.1002/ hed.21669. DOI: 10.1002/hed.21669
- Smith R.V., Schiff B.A., Garg M., Haigentz M. The impact of transoral robotic surgery on the overall treatment of oropharyngeal cancer patients. Laryngoscope. 2015; 125(s10): 610-5. DOI: 10.1002/lary.25534
- Steiner W., Fierek O., Ambrosch P., Hommerich C.P., Kron M. Transoral laser microsurgery for squamous cell carcinoma of the base of the tongue. Arch Otolaryngol Head Neck Surg. 2003; 129(1): 36-43. DOI: 10.1001/archotol.129.1.36
- Mirghani H., Blanchard P. Treatment de-escalation for HPV-driven oropharyngeal cancer: Where do we stand? Clin Transl Radiat Oncol. 2017; 8: 4-11. DOI: 10.1016/j.ctro.2017.10.005 EDN: DIGQHF


