Метаболические нарушения костной ткани у пациентов с переломами длинных костей, осложнённых хроническим остеомиелитом
Автор: Цискарашвили Арчил Важаевич, Родионова Светлана Семновна, Миронов Сергей Павлович, Бухтин Кирилл Михайлович, Горбатюк Дмитрий Сергеевич, Тараскин Александр Юрьевич
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 2, 2019 года.
Бесплатный доступ
Введение. В статье рассматривается актуальная проблема ортопедии - влияние нарушений метаболизма костной ткани на исходы лечения переломов длинных костей, осложненных хроническим остеомиелитом. Цель. Обоснование целесообразности терапии, направленной на коррекцию метаболических нарушений в костной ткани у пациентов с переломами длинных костей, осложнённых хроническим остеомиелитом. Материалы и методы. Дана оценка метаболических нарушений костной ткани при переломах длинных костей, осложненных хроническим остеомиелитом, и эффективности лечения с включением в комплексную терапию кроме хирургического, антибактериального и противовоспалительного лечения, медикаментозной коррекции указанных нарушений метаболизма. Проводилось ретроспективное исследование со стратифицированной рандомизацией групп сравнения. Результаты. Выявлены специфические для указанной группы пациентов изменения ремоделирования костной ткани с усилением интенсивности резорбции. Кроме того, у пациентов с данной патологией отмечена высокая частота вторичного гиперпаратиреоза и нарушений метаболизма D-гормона...
Хронический остеомиелит, остеопороз, замедленная консолидация, антирезорбтивная терапия, чрескостный остеосинтез
Короткий адрес: https://sciup.org/142221011
IDR: 142221011 | УДК: [616.71-007.234-089.227.84:616.71-018.46-002.2]-085 | DOI: 10.18019/1028-4427-2019-25-2-149-155
Текст научной статьи Метаболические нарушения костной ткани у пациентов с переломами длинных костей, осложнённых хроническим остеомиелитом
В настоящее время частота посттравматического остеомиелита, в зависимости от локализации и типа перелома, колеблется от 5 до 10 % [1]. Среди главных проблем лечения пациентов с хроническим остеомиелитом остаются:
-
• длительная консолидация (в среднем на 4–6 месяцев дольше в сравнении с переломами, не осложненными посттравматическим хроническим остеомиелитом) [2–4].
-
• рецидивы воспалительного процесса после хирургического вмешательства у 15–30 % пациентов [5].
-
• высокая частота инвалидизации пациентов (50– 90 %) [6].
Одной из причин замедленной консолидации или формирования ложных суставов, даже при условии адекватного хирургического вмешательства, у таких пациентов может быть нарушенное ремоделирование костной ткани вследствие воздействия провоспалитель-ных цитокинов [7]. По крайней мере, известно, что золотистый стафилококк, помимо давно исследуемой способности к инвазии, обладает выраженным негативным действием на равновесие костеобразования и резорбции, а также на отдельные звенья данных механизмов, а именно, остеобласты (костеобразующее звено) и остеокласты (костеразрушающее звено) [7–9]. Кроме того, микробные возбудители способны изменять и извращать иммунный ответ, воздействуя на баланс интерлейкинов [10]. Отклонения в течении иммунных процессов, в свою очередь, усугубляют нарушения метаболизма костной ткани. Очевидно, что в условиях воспалительного процесса для оптимизации лечебного процесса не-
обходимы не только полноценная хирургическая санация, стабилизация повреждённого сегмента, адекватная антибактериальная и противовоспалительная терапия, но и дополнительное лечение, направленное на коррекцию нарушенного метаболизма костной ткани.
Уровень доказательности исследования: II.
Цель . Обосновать целесообразность терапии, направленной на коррекцию метаболических нарушений костной ткани у пациентов с переломами длинных костей, осложнённых хроническим остеомиелитом.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование – ретроспективное со стратифицированной рандомизацией групп сравнения. В работу включены результаты лечения 112 пациентов с переломами длинных костей, осложнённых хроническим остеомиелитом (средняя продолжительность воспалительного процесса 37 месяцев). Сравнивались две группы пациентов: основная и контрольная.
В основной группе комплексное лечение включало оперативный этап, антибактериальную, противовоспалительную терапию и медикаментозную коррекцию метаболических нарушений костной ткани.
В контрольной группе выполнялся оперативный этап, антибактериальное и противовоспалительное лечение.
Стратифицированная рандомизация проводилась путем случайного отбора в указанные группы пациентов, проходивших лечение в условиях отделения последствий травм и гнойных осложнений опорно-двигательной системы НМИЦ ТО им. Н.Н. Приорова в период с июля 2017 по август 2018 года. В связи с малым числом наблюдаемых пациентов с нарушениями консолидации плечевой кости в основной группе (6 пациентов) рандомизация исходной совокупности проводилась только для формирования соответствующей контрольной груп- пы с такой же итоговой численностью.
В основную группу вошло 56 пациентов в возрасте от 27 до 77 лет (в среднем 47 ± 13 лет), среди них 25 женщин (45 %) и 31 мужчина (55 %).
В контрольную группу включено 56 пациентов в возрасте от 29 до 75 лет (в среднем 53 ± 12 лет). Из них 26 женщин (46 %) и 30 мужчин (54 %). Внутри каждой группы распределение пациентов в соответствии с поврежденным сегментом составило: плечевая кость – 6 пациентов, бедренная – 25, большеберцовая – 25 человек (табл. 1).
Преобладающим диагнозом как в основной, так и в контрольной группе являлся ложный сустав, осложненный хроническим остеомиелитом. Распределение по нозологии показано в таблице 2.
До поступления пациентам в других лечебных учреждениях выполнялись следующие операции: в основной группе: остеосинтез пластиной – 25 пациентам (45 %), интрамедуллярным штифтом – 15 (27 %), аппарат внешней фиксации применен в 16 случаях (28 %); в контрольной группе: остеосинтез пластиной – 30 пациентам (54 %), интрамедуллярным штифтом – 12 (21 %), аппаратом внешней фиксации – 14 (25 %).
Таблица 1
Распределение повреждений по сегментам
|
Основная группа |
% |
Контрольная группа |
% |
|
|
Плечевая кость |
6 |
10,72 |
6 |
10,72 |
|
Бедренная кость |
25 |
44,64 |
25 |
44,64 |
|
Большеберцовая кость |
25 |
44,64 |
25 |
44,64 |
|
Всего |
56 |
100,0 |
56 |
100,0 |
Таблица 2
Распределение пациентов по нозологическим критериям в сравниваемых группах после включения в исследование и их ортопедический статус
|
Диагноз |
Основная группа |
Контрольная группа |
||
|
N |
%* |
N |
%* |
|
|
КК СДО С |
КК СДО С |
|||
|
Ложный сустав, осложненный хроническим остеомиелитом |
33 |
58,93 |
32 |
57,14 |
|
7 20 6# |
9 17 6# |
|||
|
Открытый инфицированный перелом, осложнённый хроническим остеомиелитом |
5 |
8,93 |
4 |
7,14 |
|
23– |
22– |
|||
|
Несросшийся перелом, осложненный хроническим остеомиелитом |
5 |
8,93 |
10 |
17,85 |
|
14– |
37– |
|||
|
Замедленно срастающийся перелом, осложненный хроническим остеомиелитом |
6 |
10,71 |
5 |
8,92 |
|
24– |
23– |
|||
|
Неправильно срастающийся перелом, осложненный хроническим остеомиелитом |
4 |
7,14 |
3 |
5,35 |
|
13– |
21– |
|||
|
Консолидирующийся перелом, осложненный хроническим остеомиелитом |
2 |
3,57 |
2 |
3,57 |
|
–2– |
11– |
|||
|
Застарелый перелом, осложненный хроническим остеомиелитом |
1 |
1,79 |
– |
– |
|
–1– |
||||
|
Всего |
56 |
100,00 |
56 |
100,00 |
Обозначения: КК – пациент передвигается на кресле-каталке; СДО – пациент передвигается с помощью средств дополнительной опоры; С – пациент передвигается самостоятельно; *– процент от общего числа (без учета ортопедического статуса) пациентов в каждой подгруппе; # – пациенты с переломами плечевой кости
При поступлении пациентам обеих групп проведено оперативное лечение, включающее следующие этапы:
-
1) удаление металлоконструкции или демонтаж аппарата внешней фиксации;
-
2) радикальная фистулсеквестрнекрэктомия / сек-вестрнекрэктомия, резекция зоны ложного сустава с реканализацией костномозгового канала;
-
3) биомеханически обоснованный реостеосинтез с учётом рычаговых свойств костных отломков и механических (прочность и жесткость) свойств аппаратов внешней фиксации [11, 12].
Перед операцией у пациентов обеих групп оценивался метаболизм костной ткани. Исследовались показатели гомеостаза кальция (в крови – кальций общий ( Са ), кальций ионизированный ( Са++ ), фосфор ( Р ), кальцийрегули-рующий гормон (паратгормон), 25(ОН)D3 – транспортная форма D-гормона, а также маркеры костеобразования (щелочная фосфатаза ( ЩФ ), остеокальцин ( Оc ) и маркеры резорбции (C-концевой телопептид коллагена первого типа ( β -Cross Laps )).
В моче определяли кальций и фосфор суточной мочи и маркер резорбции ДПИД (как соотношение де- зоксипиридинолина мочи к креатинину). Полученные данные в основной группе служили основанием для выбора терапии, направленной на коррекцию нарушенного метаболизма, и контроля влияния терапии на динамику этих нарушений.
Статистический анализ проводился на программном обеспечении IBM SPSS Statistics 22. Для всех статистических расчетов пороговый уровень значимости был принят как р = 0,05.
Оценка динамики маркеров метаболизма костной ткани в основной группе проводилась при помощи W-критерия рангов Вилкоксона; показатели до операции сравнивались с таковыми на сроках в 3 месяца.
Для сравнения сроков лечения в аппарате внешней фиксации использовался U-критерий Манна-Уитни, при этом отдельно сравнивалась длительность чре-скостного остеосинтеза в двух группах (основная и контрольная) с одинаковыми сегментами (плечевая кость, бедренная кость, большеберцовая кость). Основным исследуемым параметром являлся срок фиксации поражённого сегмента в аппарате.
РЕЗУЛЬТАТЫ
Среди полученных показателей, отражающих метаболизм костной ткани, обращал на себя внимание уровень витамина 25(ОН)D3, в среднем составляющий 17,79 нг/мл. Этот показатель был почти 2 раза меньше нижней границы нормы (N = 30–100 нг/мл), что, в свою очередь, свидетельствовало о D-недостаточности (11 пациентов – 20 %) или D-дефиците (38 пациентов – 68 %). Уровень ДПИД (11,637 нмоль/ммоль в среднем) в итоговом значении в 2 раза превышал нормальные показатели (N = 2,3–5,4) у мужчин и в 1,5 раза у женщин (N = 3–7,4). Это повышение свидетельствовало об увеличении интенсивности резорбции костной ткани
Средний уровень кальция крови был близок к нижней границе нормы – 2,29 ммоль/л (N = 2,10–2,55), ионизированного кальция (Са++) - 1,12 ммоль/л (N = 1,03–1,23). Средний уровень кальция суточной мочи составил 3,1 ммоль/сут (N = 2,5–7,0), паратгормона – 12,47 пм/л (N = 1,7–6,4), что превышало норму и отражало реакцию организма на дефицит или недостаточность D-гормона. Диагноз вторичного гиперпаратиреоза выявлен у трети пациентов. Полностью результаты оценки отклонений гомеостаза кальция и маркеров ремоделирования приведены в таблице 3.
В послеоперационном периоде в основной группе была назначена терапия, направленная на коррекцию выявленных нарушений метаболизма костной ткани, включающая препараты кальция (карбонат кальция, оссеин-гидроксиапатитный комплекс) и активный метаболит витамина D (альфакальцидол) для коррекции D-недостаточности и вторичного гиперепаратиреоза. Доза этих препаратов подбиралась индивидуально в зависимости от исходного уровня кальция крови (Патент РФ на изобретение № 2176519 от 10.12.2001 г.) [13].
Кроме того, во всех случаях назначалась антире-зорбтивная терапия, направленная на снижение интенсивности резорбции костной ткани. В качестве анти-резорбтивного препарата использовали бисфосфонат (БФ) – ибандроновая кислота в дозе 3 мг/3 мл один раз в 3 месяца.
Таблица 3
Результаты лабораторного исследования на маркеры нарушения метаболических процессов в костной ткани (основная группа, расчет с помощью ПО IBM SPSS Statistics 22)
|
Параметр |
||||||
|
минимум |
максимум |
среднее значение (М) |
станд. отклонение ( σ ) |
нормальные значения |
ед. изм. |
|
|
ДПИД / Креатинин |
5 |
38,38 |
11,6367 |
6,44523 |
2,3-5,4 |
Нмоль/ммоль креатинина |
|
Фосфор суточной мочи |
10,5 |
42,45 |
24,0079 |
9,55659 |
12,9-42,0 |
ммоль/сут |
|
Кальций суточной мочи |
1 |
6,34 |
3,6632 |
1,53267 |
2,5-7,0 |
ммоль/сут |
|
25(ОН)D3 |
6,6 |
40 |
17,79 |
10,2238 |
30-10 |
Нг/мл |
|
Паратиреоидный гормон |
1,77 |
60 |
12,4647 |
15,5422 |
1,7-6,4 |
пмоль/л |
|
Остеокальцин |
2 |
46 |
22,5509 |
11,0964 |
< 46 |
нг/мл |
|
β-cross-laps |
0,086 |
1,14 |
0,63271 |
0,26686 |
< 0,704 |
нг/мл |
|
Щелочная фосфатаза |
60,29 |
373 |
123,451 |
65,6687 |
53-128 |
ед/л |
|
Фосфор крови |
0,72 |
1,56 |
1,1861 |
0,19647 |
0,78-1,42 |
ммоль/л |
|
Кальций ионизированный (Са++) |
0,96 |
2,2 |
1,2207 |
0,19725 |
1,03-1,23 |
ммоль/л |
|
Кальций крови (Са) |
2,1 |
2,71 |
2,425 |
0,13485 |
2,10-2,55 |
ммоль/л |
Через 3 месяца оценка показателей гомеостаза кальция и интенсивности резорбции проведена у 18 из 56 больных основной группы. Во всех случаях отмечено снижение уровня ДПИД в пределах 30 % от исходной величины, что свидетельствовало о наличии антире-зорбтивного эффекта.
До назначения терапии, направленной на коррекцию нарушений метаболизма костной ткани, различия между группами по лабораторным показателям не определялись (р >> 0,05). При сравнении лабораторных данных в основной группе через 3 месяца выявлены статистически значимые различия (р < 0,05) по следующим параметрам:
-
• остеокальцин (р = 0,043);
-
• паратиреоидный гормон (p = 0,043);
-
• соотношение ДПИД / креатинин (p = 0,041).
Полные статистические данные приведены в таблице 4.
Фармакотерапия у пациентов основной группы продолжалась до формирования полноценной костной мозоли.
По итогам сравнения длительности лечения в аппаратах внешней фиксации у пациентов двух групп с одинаковыми сегментами (статистические данные приведены в таблице 5 и рисунке 1) выявлены статистически значимые различия (во всех случаях р < 0,05): в основной группе срок консолидации был достоверно короче.
Таблица 4
|
Показатель |
Значение, M ± σ |
Диапазон |
Ед. изм. |
Значение р при сравнении1 |
Пороговое значение р |
|
Са – 0 мес. |
2,425 ± 0,135 |
2,1 – 2,71 |
ммоль/л |
0,172 |
0,05 |
|
Са – 3 мес. |
2,46 ± 0,62 |
2,38 – 2,63 |
|||
|
Са2+ - 0 мес. |
1,221 ± 0,198 |
0,96 – 2,2 |
ммоль/л |
0,807 |
|
|
Са2+ - 3 мес. |
1,189 ± 0,051 |
1,11 – 1,33 |
|||
|
Р – 0 мес. |
1,186 ± 0,196 |
0,72 – 1,56 |
ммоль/л |
0,18 |
|
|
Р – 3 мес. |
1,232 ± 0,147 |
1,03 – 1,39 |
|||
|
ЩФ – 0 мес. |
123,45 ± 65,67 |
60,29 – 373 |
Ед/л |
0,893 |
|
|
ЩФ – 3 мес. |
113,67 ± 24,32 |
90,00 148 |
|||
|
b-cross-laps – 0 мес. |
0,633 ± 0,267 |
0,086 – 1,14 |
нг/мл |
0,18 |
|
|
b-cross-laps – 3 мес. |
0,65 ± 0,298 |
0,18 – 0,99 |
|||
|
Остеокальцин – 0 мес. |
22,55 ± 11,096 |
2,00 – 46,00 |
нг/мл |
0,043 |
|
|
Остеокальцин – 3 мес. |
24,917 ± 11,465 |
11,5 – 39,0 |
|||
|
ПТГ – 0 мес. |
12,465 ± 15,542 |
1,77 – 60,00 |
пмоль/л |
0,043 |
|
|
ПТГ – 3 мес. |
2,562 ± 1,032 |
1,01 – 4,15 |
|||
|
25-ОН-D3 – 0 мес. |
17,79 ± 10,224 |
6,6 – 40,0 |
нг/мл |
0,715 |
|
|
25-ОН-D3 – 3 мес. |
18,96 ± 10,78 |
5,0 – 33,0 |
|||
|
Са сут. мочи – 0 мес. |
3,663 ± 1,533 |
1,00 – 6,34 |
ммоль/сут |
0,18 |
|
|
Са сут. мочи – 3 мес. |
2,483 ± 0,819 |
1,40 – 3,60 |
|||
|
Р сут. мочи – 0 мес. |
24,008 ± 9,557 |
10,50 – 42,45 |
ммоль/сут |
0,18 |
|
|
Р сут. мочи – 3 мес. |
9,878 ± 5,3 |
3,46 – 17,10 |
|||
|
ДПИД / креатинин – 0 мес. |
11,637 ± 6,445 |
5,00 – 38,38 |
нмоль/ммоль креатинина |
0,041 |
|
|
ДПИД / креатинин – 3 мес. |
8,596 ± 3,254 |
3,50 – 17,50 |
Обозначения:1 - W-критерий Уилкоксона; 0 мес. - показатель до оперативного лечения; 3 мес. - показатель спустя 3 месяца после оперативного лечения. Жирным шрифтом выделены статистически достоверные значения p
Таблица 5
|
Сегмент |
Группа |
Сроки консолидации, дни, M ± σ |
Диапазон, дни |
Значение р при сравнении* |
Пороговое значение р |
|
Плечевая кость |
основная |
199,834 ± 31,626 |
147 – 243 |
0,041 |
0,05 |
|
Плечевая кость |
контрольная |
254,167 ± 45,124 |
196 – 321 |
||
|
Бедренная кость |
основная |
266,84 ± 52,647 |
190 – 399 |
0,009 |
|
|
Бедренная кость |
контрольная |
338,00 ± 107,173 |
197 – 559 |
||
|
Большеберцовая кость |
основная |
235,04 ± 49,308 |
154 – 351 |
0,041 |
|
|
Большеберцовая кость |
контрольная |
270,08 ± 61,110 |
189 – 427 |
– U-критерий Манна-Уитни
Сводные статистические данные по динамике лабораторных показателей в основной группе
Сводные статистические данные по срокам консолидации в основной и контрольной группах
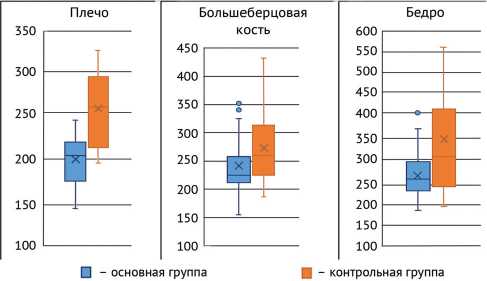
Рис. 1. Интерпретация полученных результатов из таблицы 4 в формате диаграммы «ящики и усы»
Таким образом, использование в послеоперационном периоде у пациентов с переломами длинных костей, осложнённых хроническим остеомиелитом, комбинации кальцийсодержащих препаратов альфа- кальцидола и ибандроновой кислоты нормализует нарушенное ремоделирование костной ткани и сокращает, по сравнению с контрольной группой, срок консолидации.
ОБСУЖДЕНИЕ
Картина метаболических сдвигов на фоне хронического остеомиелита у исследуемых больных характеризуется выраженным изменением лабораторных показателей. Ключевыми из них являются следующие:
– щелочная фосфатаза (ЩФ) – активность фермента коррелирует с уровнем образования костной ткани (низкий уровень отражает слабую активность остеобластов, высокий уровень отражает нарушение минерализации кости, в том числе и при переходе ремоделирования на высокий уровень при усилении резорбции);
– β -Cross Laps – продукт деградации коллагена 1 типа, который составляет более 90 % органического матрикса кости;
– остеокальцин – один из наиболее информативных маркеров костеобразования. Является основным неколлагеновым белком кости, включенным в связывание кальция и гидроксиапатита. Синтезируется остеобластами (высокий уровень может свидетельствовать о повышенной резорбции костной ткани);
– ДПИД (утренней мочи) является основным материалом поперечных связей коллагена в костях. Отражает интенсивность резорбции костной ткани.
У наблюдаемых пациентов выявлено повышение уровня щелочной фосфатазы (123,45 ± 65,67 при N = 53–128), β -Cross Laps (0,63271 ± 0,267 при N < 0,704), а также соотношения ДПИД/креатинин (11,6367 ± 6,445 при N = 2,3–5,4 у мужчин и 3–7,4 у женщин). Данные изменения указывают на усиление интенсивности ремоделирования костной ткани, схожее с изменениями при высокооборотном типе остеопороза. По нашему мнению, это может объясняться, в том числе, и компенсаторной реакцией костной ткани, возникающей в ответ на ее разрушение возбудителями хронического остеомиелита. Согласно ряду исследований [7], золотистый стафилококк (обнаруживается в ходе микробиологического исследования в 35,51–59,1 % случаев) [14–16] индуцирует гибель остеобластов за счёт вырабатываемых токсинов, таких как фенолрастворимые модулины (PSM α , PSM β ) и δ -токсин. Также воспалительные цитокины (интерлейкин (IL–1 β ), фактор некроза опухоли (TNF- α ) и др.), образующиеся в результате длительного воспалительного процесса, запускают каскад биохимических реакций, приводящих к активации процессов некроза или апоптоза в остеобластах.
С другой стороны, известно о стимулирующем влиянии золотистого стафилококка на остеокластоге-нез посредством усиления продукции мембрансвязан-ных RANK-L, sRANK-L (растворимых) и малых форм RANK-L. Эти лиганды активируют специфический рецептор RANK, который расположен на остеокластах и дендритных клетках. RANK-L является основным стимулирующим фактором в образовании зрелых остеокластов. При этом в условиях хронической инфекции снижается продукция остеопротегеринов – остеокластингибирую-щего (остеокластсвязывающего) фактора, который является ключевым звеном ингибирования дифференциации и активации остеокластов. Указанные факторы в совокупности приводят к усиленному остеокластогенезу, и, как следствие, к повышению резорбции костной ткани без ее адекватного замещения [7]. В ходе каскада данных биохимических реакций нарушаются процессы минерализации кости [8–9]. Вынужденная гиподинамия и длительное отсутствие осевых нагрузок на поражённую конечность приводят к дополнительному снижению минеральной плотности костной ткани. Выраженная остеопения пораженного сегмента скелета отмечена у всех пациентов основной и контрольной группы.
Низкий уровень витамина 25(ОН)D3 (17,79 ± 10,223 при N = 30–100), отмеченный у наблюдаемых пациентов, может быть связан с климатическими факторами, а именно, проживанием пациентов в условиях средней полосы России [17], а также с отсутствием в России официальной программы по обогащению продуктов витамином D, кроме продуктов детского питания [18].
Коррекцию выявленных метаболических нарушений, согласно данным исследований [19–20], предпочтительнее осуществлять комплексом препаратов (оссеин-ги-дроксиапатитный комплекс и активные метаболиты витамина D). В настоящее время также установлено, что при высоких показателях резорбции костной ткани и отсутствии ответа на комбинацию указанных препаратов рационально включить в план лечения препараты из группы бисфосфонатов, что позволяет за счёт снижения интенсивности резорбции увеличить минеральную плотность костной ткани и эффективность лечения в целом [21–22]. Среди препаратов данной группы была выбрана ибандро-новая кислота, механизм действия которой заключается в ингибировании фарнизил-дифосфатсинтазы (FDPS) по мевалонатному пути, что тормозит образование внутриклеточных сигнальных молекул остеокластов и нарушает их жизнедеятельность вплоть до апоптоза. Преимущества ибандроновой кислоты перед алендроновой заключаются в длительном персистировании препарата в костной ткани, что позволяет увеличить интервал между инъекциями до 3-х месяцев [23]. Ее эффективность в комбинации с альфакальцидолом при повышенной интенсивности резорбции показана ранее при высокооборотном системном остеопорозе [22].
На основе полученных нами данных можно сделать вывод о том, что применённая комплексная терапия статистически достоверно (для плечевой и большеберцовой костей p = 0,009, для бедренной кости p = 0,041) нормализует процесс консолидации и сокращает срок лечения в аппарате внешней фиксации у пациентов с переломами длинных костей конечностей, осложнённых хроническим остеомиелитом.
Согласно полученным предварительным результатам, терапия, направленная на коррекцию нарушений метаболизма костной ткани, уже через 3 месяца позволяет достичь улучшения некоторых лабораторных показателей в сравнении с изначальными значениями, а именно, уровней остеокальцина и паратиреоидного гормона (р = 0,043) и соотношения ДПИД / креатинин (р = 0,041), что позитивно влияет на механизмы ремоделирования костной ткани Для формирования выводов в отношении прочих показателей, по нашему мнению, требуется долгосрочное (более 3 мес.) наблюдение динамики показателей метаболизма костной ткани.
ВЫВОДЫ
-
1. Изменения метаболизма в костной ткани, осложняющие течение хронического остеомиелита, у большинства пациентов характеризуются повышением интенсивности ремоделирования, что, с одной стороны, является свидетельством компенсаторной реакции на процессы, протекающие в воспалительном очаге, с другой, нарушает процесс консолидации перелома.
-
2. Назначение в послеоперационном периоде, дополнительно к адекватному хирургическому вмешательству, терапии, направленной на коррекцию метаболизма костной ткани, позволяет добиться нормализации сроков консолидации.
-
3. Для получения оптимального результата следует проводить комплексное лечение, а именно, сочетать хирургический компонент, антибактериальную и противовоспалительную терапию с медикаментозной коррекцией нарушенного гомеостаза кальция, D-недостаточности или D-дефицита и нарушений интенсивности резорбции.
-
4. Необходимо дальнейшее изучение влияния метаболических нарушений костной ткани у пациентов с хроническим остеомиелитом на результаты лечения методом чрескостного остеосинтеза, включая поиск новых компоновок, обеспечивающих стабильную фиксацию поврежденных сегментов и функциональность конечности.
Список литературы Метаболические нарушения костной ткани у пациентов с переломами длинных костей, осложнённых хроническим остеомиелитом
- Infection in Orthopaedics/G.E. Cook, D.C. Markel, W. Ren, L.X. Webb, M.D. McKee, E.H. Schemitsch//J. Orthop. Trauma. 2015. Vol. 29, No Suppl. 12. P. S19-S23 DOI: 10.1097/BOT.0000000000000461
- Травматология: нац. рук./гл. ред.: Г.П. Котельников, С.П. Миронов. М.: ГЭОТАР-Медиа, 2008. 808 с.
- Леонова С.Н., Рехов А.В., Камека А.Л. Традиционное хирургическое лечение пациентов с переломами костей голени, осложненными хроническим травматическим остеомиелитом//Бюллетень ВСНЦ СО РАМН. 2013. № 2-1 (90). С. 45-48.
- Леонова С.Н., Рехов А.В., Камека А.Л. Лечение переломов, осложненных гнойной инфекцией//Сибирский медицинский журнал. 2013. Т. 120, № 5. С. 141-143.
- Хронический посттравматический остеомиелит плеча: экономические аспекты лечения методом чрескостного остеосинтеза аппаратом Илизарова/Д.С. Леончук, Н.В. Сазонова, Е.В. Ширяева, Н.М. Клюшин//Гений ортопедии. 2017. Т. 23, № 1. С. 74-79.
- Микулич Е.В. Современные принципы лечения хронического остеомиелита//Вестник новых медицинских технологий. 2012. Т. 19, № 2. С. 180-184.
- Josse J., Velard F., Gangloff S.C. Staphylococcus aureus vs osteoblast: relationship and consequences in osteomyelitis//Front. Cell Infect. Microbiol. 2015. Vol. 5. P. 85
- DOI: 10.3389/fcimb.2015.00085
- Thwaites G.E., Gant V. Are bloodstream leukocytes Trojan Horses for the metastasis of Staphylococcus aureus?//Nat. Rev. Microbiol. 2011. Vol. 9, No 3. P. 215-222
- DOI: 10.1038/nrmicro2508
- Staphylococcus aureus protein A binds to osteoblasts and triggers signals that weaken bone in osteomyelitis/T. Claro, A. Widaa, M. O’Seaghdha, H. Miajlovic, T.J. Foster, F.J. O'Brien, S.W. Kerrigan//PLoS One. 2011. Vol. 6, No 4. P. e18748
- DOI: 10.1371/journal.pone.0018748
- Critical role for inflammasome-independent IL-1ß production in osteomyelitis/J.R. Lukens, J.M. Gross, C. Calabrese, Y. Iwakura, M. Lamkanfi, P. Vogel, T.D. Kanneganti//Proc. Natl. Acad. Sci. U.S.A. 2014. Vol. 111, No 3. P. 1066-1071
- DOI: 10.1073/pnas.1318688111
- Цискарашвили А.В. Лечение больных с переломами длинных костей, осложненных гнойной инфекцией, с учетом биомеханической концепции фиксации отломков: автореф. дис. … канд. мед. наук: 14.00.22. М., 2009. 34 с.
- Пичхадзе И.М. Атлас переломов костей конечностей и таза. Лондон; М., 2002. 176 с.
- Способ профилактики потери костной ткани вокруг имплантатов при эндопротезировании: пат. 2176519 Рос. Федерация/Родионова С.С., Попова Т.П., Балберкин А.В., Колондаев А.Ф., Клюшниченко И.В. № 2001102307/14; заявл. 29.01.2001; опубл. 10.12.2001, Бюл. № 34.
- Trends in the epidemiology of osteomyelitis: a population-based study, 1969 to 2009/H.M. Kremers, M.E. Nwojo, J.E. Ransom, C.M. Wood-Wentz, L.J. Melton 3rd, P.M. Huddleston 3rd//J. Bone Joint Surg. Am. 2015. Vol. 97, No 10. P. 837-845
- DOI: 10.2106/JBJS.N.01350
- Epidemiology, microbiology and therapeutic consequences of chronic osteomyelitis in northern China: A retrospective analysis of 255 patients/X. Ma, S. Han, J. Ma, X. Chen, W. Bai, W. Yan, K. Wang//Sci. Rep. 2018. Vol. 8, No 1. P. 14895
- DOI: 10.1038/s41598-018-33106-6
- Розова Л.В., Годовых Н.В. Микробиологическое исследование гнойного очага воспаления у больных хроническим остеомиелитом длинных трубчатых костей//Клиническая лабораторная диагностика. 2016. Т. 61, № 10. С. 727-730
- DOI: 10.18821/0869-2084-2016-61-10-727-730
- Плещева А.В., Пигарова Е.А., Дзеранова Л.К. Витамин D и метаболизм: факты, мифы и предубеждения//Ожирение и метаболизм. 2012. Т. 9, № 2. С. 33-42.
- Клинические рекомендации Российской ассоциации эндокринологов по диагностике, лечению и профилактике дефицита витамина D у взрослых/Е.А. Пигарова, Л.Я. Рожинская, Ж.Е. Белая, Л.К. Дзеранова, Т.Л. Каронова, А.В. Ильин, Г.А. Мельниченко, И.И. Дедов//Проблемы эндокринологии. 2016. Т. 62, № 4. С. 60-84
- DOI: 10.14341/probl201662460-84
- Родионова С.С., Хакимов У.Р. Влияние пятилетнего использования альфакальцидола в комбинации с карбонатом кальция на минеральную плотность ткани при первичных формах системного остеопороза у мужчин//Остеопороз и остеопатии. 2016. Т. 19, № 1. С. 22-27.
- Родионова С.С. Консервативная терапия как часть комплексного лечения пациентов с переломами и нарушенным метаболизмом костной ткани//Эффективная фармакотерапия. 2017. № 12. С. 52-54.
- Alfacalcidol increases the therapeutic effifacy of ibandronate on bone mineral density in Japanese women with primary osteoporosis/Y. Nakamura, T. Suzuki, M. Kamimura, S. Ikegami, S. Uchiyama, H. Kato//Tohoku J. Exp. Med. 2017. Vol. 241, No 4. P. 319-326
- DOI: 10.1620/tjem.241.319
- Родионова С.С., Еловой-Вронский А.А., Бернакевич А.И. Альфакальцидол или колекальциферол в комбинации с ибандроновой кислотой при лечении постменопаузального системного остеопороза//Остеопороз и остеопатии. 2014. Т. 17, № 1. С. 21-24.
- Osteoporosis treatment: why ibandronic acid?/M. Rossini, G. Orsolini, S. Adami, V. Kunnathully, D. Gatti//Expert. Opin. Pharmacother. 2013. Vol. 14, No 10. P. 1371-1381
- DOI: 10.1517/14656566.2013.795949


