Метаболические нарушения у высокопродуктивных коров
Автор: Конвай В.Д., Заболотных М.В.
Журнал: Вестник Омского государственного аграрного университета @vestnik-omgau
Рубрика: Ветеринарные науки
Статья в выпуске: 3 (27), 2017 года.
Бесплатный доступ
В природе за миллионы лет эволюции организм коров приспособился к использованию в качестве основного источника энергии и пластических веществ целлюлозы. Сегодня для получения достаточно высоких надоев молока их вынуждены кормить высоко концентратными кормами. Это приводит к нарушению обмена веществ с последующим прогрессирующим снижением продуктивности, развитием полиорганной недостаточности, приводящими к их преждевременной выбраковке. Метаболические нарушения у высокопродуктивных коров начинаются с торможения другими микроорганизмами микрофлоры, расщепляющей целлюлозу до пропионовой кислоты и одновременно вырабатывающей кобаламин (для ее превращения в сукцинил-КоА, окисляемой в цикле Кребса). Вследствие этого нарушается утилизация в последнем кетоновых тел, приводя к закислению ими тканей. В этих условиях усиливается катаболизм пуриновых мононуклеотидов, сопряженный с чрезмерной продукцией ксантиноксидазой активных кислородных метаболитов, повреждающих мембранные структуры клеток, и способствующий развитию полиорганной недостаточности. Дефицит кобаламина и фолата тормозит также регенерацию метионина, образование из него холина, необходимого для выведения из печени накапливающихся в ней ацилглицеролов, с последующим развитием жировой инфильтрации этого органа. Полиорганная недостаточность проявляется также частым развитием у высокопродуктивных коров родовой слабости, способствующей развитию послеродовых осложнений. Ей способствует и то, что в условиях многократного увеличения энергетических затрат во время родов в мышечной оболочке матки тормозится реакция переноса энергии, запасенной в макроэргических связях АТФ, от митохондрий, где синтезируется это вещество, к месту его потребления - нитям актина и миозина. Она протекает с участием креатина. Биосинтез последнего тормозится вследствие дефицита S-аденозилметионина, развивающегося в условиях недостаточной обеспеченности организма коферментными формами кобаламина, генерируемыми микроорганизмами рубца.
Метаболические нарушения, полиорганная недостаточность, высокопродуктивные коровы
Короткий адрес: https://sciup.org/142199358
IDR: 142199358 | УДК: 619:616:577:636.2
Текст научной статьи Метаболические нарушения у высокопродуктивных коров
Современное молочное производство может быть рентабельным лишь при использовании высокотехнологических приемов и сбалансированных концентратных рационов. Организм жвачных животных за миллионы лет эволюции приспособился к кормлению другим доступным для него источником энергии и пластических веществ – целлюлозой. При переводе коров на высококонцентратные рационы их системы поддержания жизнедеятельности не всегда готовы к адаптации в изменившихся условиях, это приводит к нарушению метаболизма в различных органах и системах, к преждевременным снижениям продуктивности, продолжительности эксплуатации, в конечном
итоге, к большим экономическим потерям. Проблему не удается решить, используя самые современные технологии кормления [5]. Разработку эффективных лечебнопрофилактических мероприятий лимитирует недостаточная изученность механизмов развития метаболических нарушений, развивающихся у высокопродуктивных коров.
В статье на основании литературных данных и результатов собственных исследований предпринята попытка выявления наиболее уязвимых звеньев метаболизма, подвергающихся повреждению в условиях содержания коров в современных животноводческих комплексах, и возможных путей его предупреждения и коррекции.
Объекты и методы
Проанализированы литературные данные о механизмах развития нарушений обмена веществ у высокопродуктивных коров, предшествующих формированию полиор-ганной недостаточности. Они сопоставлены с результатами собственных исследований патогенеза, нарушения функции ряда жизненно важных органов, развившихся у экспериментальных животных, подвергшихся воздействию тяжелой гипоксии, и приведшему к чрезмерному катаболизму пуриновых нуклеотидов с последующим усилением липо-пероксидации фосфолипидов мембранных структур клеток (рис. 2). Обосновано положение о том, что по подобному механизму развивается полиорганная недостаточность при кетоацидозе у высокопродуктивных жвачных животных.
Результаты исследования
Витамин B12---
СН} * HS-KoA СН3 СН2
/ I I | 5-ДАКоб |
Целлю- Микро- СН2 Ацил-КоА-синт-за СН2+СО2 Пр-КоА-карб-за СН-СН3 ММ-КоА- СН; ^ Цикл лоза орг. > I * I о * I мутоза * I о кРебса
Спи АТФ АМФ* С АТФ АДФ+Ф. С
Ф0Ф Чкм Чкод S-код
Пропионат Пропионил-Ко А Метилмалонил- Сукцинил-
‘ (Про-КоА) КоА (ММ-КоА) КоА
Под действием этого фермента ММ-КоА превращается в сукцинил-КоА (активную форму янтарной кислоты). Последняя включается в реакции второй части цикла
Кребса, где окисляется с образованием одной молекулы макроэргического соединения гуанозинтрифосфата, ФАДН 2 и НАДН+Н+ . Эти коферменты переносят ионы водорода в дыхательную цепь митохондрий, где вырабатывается большая часть необходимого организму АТФ. Кроме того, у жвачных животных сукцинил-КоА необходим для постоянного «подпитывания» реакций цикла Кребса, обеспечивая безотказное окисление в нем кетоновых тел (ацетоуксусной и β-гидроксимасляной кислот), генерируемых в печени из ацетил-КоА, образовавшегося при β-окислении жирных кислот (как и целлюлоза, они являются важным энергетическим источником организма) [5].
Это приводит не только к снижению эффективности генерации АТФ из пропионовой кислоты, но и к торможению окисления в цикле Кребса ацетил-КоА, образовавшегося из доставленных из печени в другие органы кетоновых тел. В результате не только еще больше снижается выработка АТФ (гипоэргоз), но и происходит увеличение концентрации кетоновых тел в тканях, особенно в крови (гиперкетонемия), появление их в моче (кетонурия). По мере увеличения уровня ацетоуксусной и β-гидрокси-масляной кислот истощаются буферные системы крови (карбонатной, фосфатной, белковой и гемоглобиновой) с последующим снижением уровня рН крови (декомпенсированный кетоацидоз). Усугубляет это состояние недостаточное обеспечение тканей кислородом (гипоксия), приводящее к увеличению в тканях уровня молочной кислоты (лактоацидоз). Последствиями закисления тканей является снижение продуктивности и последующее развитие полиорганной недостаточности [2].
Механизмы развития этих явлений сложны и до конца не изучены. Существенный вклад в развитие полиорганной недостаточности вносит, по всей вероятности, нарушение метаболизма пуриновых мононуклеотидов, описанное нами на модели клинической смерти и реанимации (рис. 2) [3]. Начинается оно со снижения напряжения кислорода в клетках, приводящего к торможению генерации АТФ в митохондриях. В этих условиях они пытаются восполнить энергетический дефицит за счет энергии, запасенной в мак-роэргических связях АДФ за счет кратковременной реакции
АДФ + АДФ Аденилаткиназа АТФ + АМФ.
В результате увеличивается уровень АМФ, стимулятора реакций анаэробного гликолиза. Их усиление позволяет на некоторое время отсрочить снижение уровня АТФ, но приводит к увеличению содержания в тканях содержания молочной кислоты (лактоацидозу). Это усугубляет закисление тканей, вызванное накоплением в них кето- новых тел. В физиологических условиях молочная кислота током крови переносится в печень, почки и слизистую оболочку кишечника, где она в реакциях глюконеогенеза обратно регенерируется в глюкозу. Для интенсификации этих реакций необходима экскреция корковым слоем надпочечников достаточного количества глюкокортикоидов, активатора ключевых ферментов глюконеогенеза: пируваткабоксилазы, фосфоенолпи-руваткарбоксикиназы, фруктозо-1,6-бисфосфатазы и глюкозо-6-фосфатазы. В условиях прогрессирующей полиорганной недостаточности функция коркового слоя надпочечников тормозится, явления лактоацидоза усиливаются, способствуя усилению дальнейшего катаболизма АМФ.
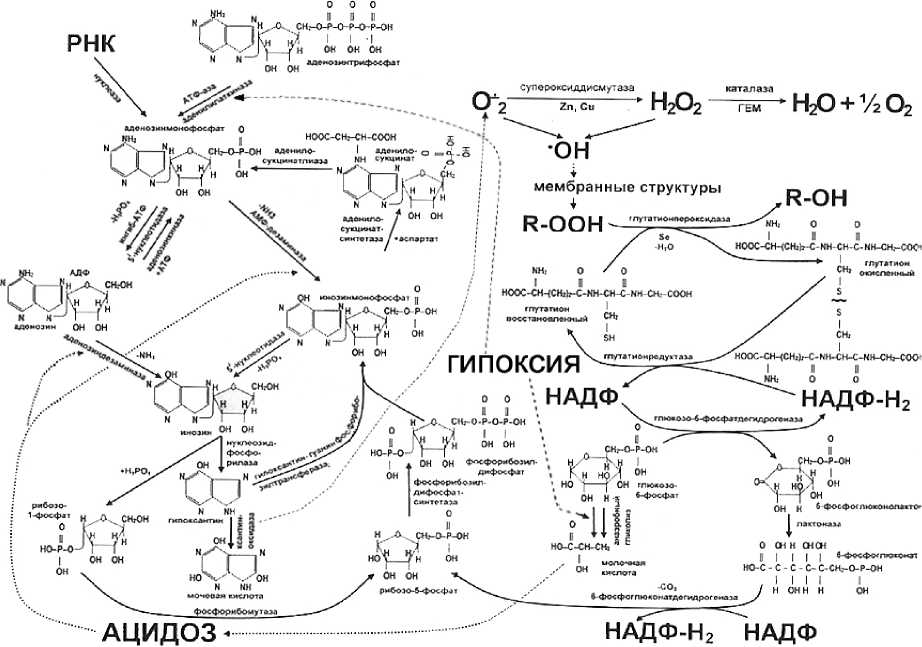
Рис. 2. Метаболизм пуриновых мононуклеотидов в условиях закисления тканей молочной кислотой или кетоновыми телами
Увеличение уровня последнего на фоне закисления тканей приводит к повышению активности аденилатдезаминазы и аденозиндезаминазы, активируемых сдвигом рН в кислую сторону [3]. Эти ферменты совместно с 5i-нуклеотидазой катализируют реакции расщепления АМФ до инозина. От него отщепляется остаток рибозы и образуется гипоксантин. Дальнейшее окисление этого вещества в результате реакции, катализируемой ксантиноксидазой, сопряжено с выработкой данным энзимом активных кислородных метаболитов: супероксидных радикалов и перекиси водорода. При их взаимодействии образуются гидроксильные радикалы, повреждающие их ненасыщенные жирные кислоты фосфолипидов мембранных структур. Параллельно происходит инактивация компонентов неферментативного и ферментативного звеньев систем антиоксидантной и антиперекисной защиты. Все это на фоне недостаточно эффективной регене- рации мембранных структур, вызванной дефицитом метильных групп, приводит к по-лиорганной недостаточности.
Метионин – незаменимая аминокислота организма. Он необходим не только для биосинтеза собственных белков организма, но и для белков молока у лактирующих животных. В естественных условиях для этого метионина вырабатывается достаточно. Кроме того, данная аминокислота является донором метильных групп и для ряда других жизненно важных процессов, в частности, для биосинтеза фосфатидилхолина (лецитина; ФХ).
Кофермент-
Mem .аденозил-^ тросферозо '
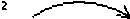
АТФ Ф-О-Ф-О-ф
SH метилкобаламин s-CH3
CHi CH2
I * Метилтронсф-зо i
CH2 --^^ ^ > CH2
CH-NH-. el CH-NH
ІЧП2 51-МетТГФ ТГФ .
COOH COOH
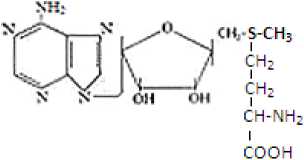
Гомоцис- Метионин S-аденозипметионин теин (ГЦ) (Мет) і'3-AM'l
Рис. 3. Реакции образования метионина и S-аденозилметионина
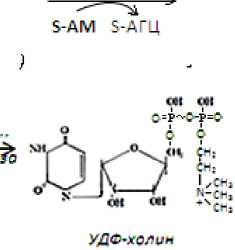
Перед этим метионин превращается в S-аденозилметионин (SАМ), универсальный источник СН 3 -групп в многих реакциях метилирования. SАМ передает метильную группу этаноламину, образуется холин. Последний фосфорилируется холинкиназой в ФХ, который, присоединяя остаток уридиндифосфата, превращается в УДФ-холин. Он, в свою очередь, отщепляя УДФ, присоединяется к радикалу фосфата фосфатидной кислоты и образуется ФХ.
HO-CH2-CH2-NH2
Уридинтрифосфот
5-АМ:ЭА -метил- +/СНз трансфераза^ НО-СН2- СН2- N-СН3 хсн3
Этанолсгмим (ЗА)
ФХ УДФ.холин-^ф тронсфе- -2Н5РО4
СН2 -О-РО$Н2
Холин (X)
+/СН3
Холинкинозо^ Н2О3Р.О- НО-СН2- CH2-N-CH3
-—хсн3
АТФ АДФ
Фосфохолин (ФХ)
f Hj -О-А^н» х Фосо-т-^ СН2-О- А:,н„ СН-О-С*0- С15Н3. тронсф-зс^СН - О -C^Ci»H5I
Фосфотидот (Фосф-т)
СН}
СН2-О- РО2Н-О- СН2- CH2-N-CH3 ^СҢз Фосфо тидилхолин (♦Х)
Рис. 4. Реакции образования холина, фосфохолина и фосфатидилхолина
Биологическая роль образовавшегося ФХ обусловлена не только тем, что он компонент биологических мембран и необходим для образования и регенерации клеток, но и участием в процессе освобождения клеток печени от накапливающихся в ней эндогенных ацилглицеролов (АГл; нейтральных жиров). Последние, прежде чем покинуть гепатоцит, должны войти в состав липопротеинов (ЛПр), которые переносят их током крови в другие органы, где ацилглицеролы гидролизуются и окисляются. ЛПр состоят из капли нейтральных жиров, окруженной одинарным слоем фосфолипидов (ФЛ), к нему прикрепляется слой белков-апопротеинов. В состав ФЛ обязательно должен входить ФХ [4]. При недостаточной выработке этого вещества в организме высокопродуктивных коров из-за описанных выше метаболических нарушений выведение АГл из печени нарушается и развивается жировая инфильтрация этого органа [2].
|
nh2 |
н |
||||
|
С=МН |
ГАТ |
nh2 |
мн2 |
^ РО3Н |
|
|
nh\ |
- х^ -Сриитин |
С = МН |
5-АМ:ГА- |
С = МН КрК |
> С = мн' |
|
(СН2)з |
nh2 |
NH J |
метилтронс. |
м -СН3 |
N -СН3 _ |
|
сн-мн2 |
сн2 |
сн2 |
S-АМ ^АГЦ |
СН2 АТФ |
АДФ Сн2 |
|
соон |
соон |
соон |
СН3 |
соон |
СООН |
|
Аргинин |
Глицин |
Гуанидин |
Креатин |
Креатин- |
|
Н3РО4
ацетат (ГА)
фосфат (КФ)
Рис. 5. Реакции биосинтеза креатина и креатинина
н
N---
С = МН
N-СНз
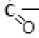
Креатинин
Одно из последствий недостаточной обеспеченности организма SАМ-ом – нарушение биосинтеза креатина. Начинается процесс в почках с глицинамидинотрансфе-разной реакции, в результате которой передается амидная группа от аргинина на глицин. Образуется гуанидинацетат (ГА), к нему в печени присоединяется СН 3 -группа, отщепляемая от SАМа. Образовавшийся креатинин является переносчиком остатка фосфата с макроэргической связью от АТФ, выработанного в митохондриях, расположенных на периферии клеток, к месту его потребления – мышечным волокнам (прямая креатинкиназная (КрК) реакция). Прямо передаваться АТФ не может, так как «по пути» может расщепиться ферментами.
Образовавшийся креатинфосфат доставляется к мышечным волокнам, где обратно передает остаток фосфата с макроэргической связью на АДФ (обратная креатинкиназная реакция), а АТФ используется для мышечного сокращения [1].
Эти реакции резко усиливаются в миометрии во время родов, когда во много раз возрастает выработка и потребление АТФ. Передача его в результате креатинкиназной реакции может нарушиться вследствие снижения уровня креатина, обусловленного недостаточной обеспеченностью организма SАМ-ом. Выработка креатина протекает с напряжением для организма даже в физиологических условиях, поскольку часть молекул креатинфосфата отщепляют остатки фосфата и превращаются в креатинин, выделяемый почками с мочой. Дефицит креатина, на наш взгляд, – один из факторов, способствующих развитию родовой слабости и последующих послеродовых осложнений. Также это одна из причин преждевременной выбраковки высокопродуктивных коров.
Расшифровка механизмов развития структурных и функциональных нарушений у высокопродуктивных жвачных животных с учетом литературных данных, результатов собственных, уже проведенных и намеченных к проведению в будущем исследований позволяет сегодня разработать методы своевременного распознавания, вмешательства в их течение, оценки эффективности проводимых лечебно-профилактических мероприятий, их перспективности. Они будут подвергнуты дальнейшему анализу, патентованию полученных результатов и опубликованию в наших работах. Приглашаем к сотрудничеству работников заинтересованных предприятий, в том числе зарубежных.
V.D. Konvai, M.V. Zabolotnykh
Omsk State Agrarian University named after P.A. Stolypin, Omsk
Metabolic disorders in high yielding cows
Список литературы Метаболические нарушения у высокопродуктивных коров
- Биохимия человека: в 2 т./Р. Марри . -М.: Мир, 1993. -Т. 1. -382 с.; Т. 2. -414 с.
- Конвай В.Д. Роль острого нарушения энергетического обмена в развитии постреанимационной патологии печени/В.Д. Конвай, П.П. Золин//Ом. науч. вестн, 2003. -№ 3 (24). -С. 48-52.
- Маршал В.Дж. Клиническая биохимия/В.Дж. Маршал, С.К. Бангерт. -Изд. 6-е, перераб. и доп. -М.: Бином, 2015. -408 с.
- Механизмы развития метаболических нарушений у высокопродуктивных коров/В.Д. Конвай //Вестн. Ом. гос. аграр. ун-та. -2013. -№ 1 (9). -С. 59-63.
- Патологическая биохимия/А.Д. Таганович . -М.: Бином, 2015. -448 с.


