Метаболомное исследование гликоалкалоидов методом тандемной масс-спектрометрии в восьми сортах цветного картофеля Solanum tuberosum L
Автор: Разгонова Майя Петровна, Куликова Валентина Ивановна, Ходаева Вера Петровна, Захаренко Александр Михайлович, Голохваст Кирилл Сергеевич
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Агрономия
Статья в выпуске: 2, 2023 года.
Бесплатный доступ
Цель - метаболомное исследование гликоалкалоидов методом тандемной масс-спектрометрии в восьми сортах цветного картофеля. В данной работе исследуются экстракты цветного картофеля, селекционные образцы которого получены из Сибирского федерального научного центра агробиотехнологий РАН, на предмет присутствия разнообразия гликоалкалоидов. Использовано восемь сортообразцов: Тулеевский, Кузнечанка, Памяти Антошкиной, Томичка, Гибрид 15/F-2-13, Гибрид 22103-10, Гибрид 17-5/6-11, Синильга. Гликоалкалоиды представляют собой растительные метаболиты, содержащие олигосахарид, стероид С27 и гетероциклический компонент азота. Первоначальный скрининг методом ВЭЖХ-МС показал, что среди сотен соединений, обнаруженных в клубнях, состав гликоалкалоидов был особенно разнообразным. Картофельные гликоалкалоиды можно разделить на два основных класса: соланидановые или спиросолановые агликоны. Считается, что соланин и чаконин составляют более 90 % от общего количества гликоалкалоидов одомашненного картофеля, при этом чаконина часто больше, чем соланина. Методом тандемной масс-спектрометрии (высокоэффективная жидкостная экстракция и ионная ловушка BRUKER DALTONIKS) проанализированы экстракты данных сортообразцов на присутствие в них соединений из семейства гликоалкалоидов. Результаты исследования показали присутствие 22 гликоалкалоидов в предложенных сортообразцах, некоторые из выявленных гликоалкалоидов пока не описаны в мировой научной литературе.
Вэжх-mс/mс, тандемная масс-спектрометрия, картофель, гликоалкалоиды
Короткий адрес: https://sciup.org/140297966
IDR: 140297966 | УДК: 633.491:631.53 | DOI: 10.36718/1819-4036-2023-2-81-87
Текст научной статьи Метаболомное исследование гликоалкалоидов методом тандемной масс-спектрометрии в восьми сортах цветного картофеля Solanum tuberosum L
Acknowledgments : the work has been carried out according to the research plan of the FSBRI Federal Research Center N.I. Vavilov All-Russian Institute of Plant Genetic Resources according to R&D (RK) Collection of vegetatively propagated crops (potatoes, fruits, berries, grapes) and their wild relatives VIR – study and rational use No. 0662-2019-0004".
Введение. Зародышевая плазма картофеля характеризуется обширным генетическим разнообразием, включающим около 200 диких видов, обитающих в чрезвычайно разнообразных местообитаниях по всей Америке [1]. Однако лишь небольшая часть этого генетического разнообразия была включена в выведение современных сортов картофеля, что привело к очень узкому генетическому коридору. Следовательно, дикие виды представляют собой в значительной степени неиспользованный ресурс, который, вероятно, содержит много новых генов, полезных для улучшения свойств одомашненного картофеля. Относительно мало известно о степени разнообразия метаболитов, присутствующих в зародышевой плазме картофеля. Методы метаболомного исследования дают возможность понять изобилие и разнообразие по-лифенольного состава и соединений других классов в растениях. Было показано, что методы метаболомного исследования нескольких сортов картофеля с помощью ГХ-МС и ВЭЖХ-МС/МС являются эффективным инструментом исследования [2, 3].
Предварительный анализ семи генотипов в исследовании [4] показал, что гликоалкалоиды являются большим источником разнообразия метаболитов. Гликоалкалоиды представляют собой растительные метаболиты, содержащие олигосахарид, стероид С27 и гетероциклический компонент азота. Считается, что соланин и чако-нин составляют более 90 % от общего количества гликоалкалоидов одомашненного картофеля, при этом чаконина часто больше, чем соланина.
Пути биосинтеза гликоалкалоидов не полностью очерчены, даже для основных гликоалкалоидов картофеля, соланина и чаконина. Гликоалкалоиды, полученные из мевалонатного пути через холестерин, встречаются по всему клубню, но в основном синтезируются в феллодерме [5]. На удивление мало известно о генах и энзимологии, участвующих в превращении холестерина в различные гликоалкалоиды. Идентификация генов биосинтеза гликоалкалоидов позволила использовать трансгенные подходы к снижению содержания гликоалкалоидов в картофеле, поскольку гликоалкалоиды обычно считаются антипитательными соединениями [6]. Карто- фель со сверхэкспрессией стеролметилтранс-феразы сои показал снижение количества как холестерина, так и гликоалкалоидов [7].
Первоначальный скрининг методом ВЭЖХ-МС показал, что среди сотен соединений, обнаруженных в клубнях, состав гликоалкалоидов был особенно разнообразным. Картофельные гликоалкалоиды можно разделить на два основных класса: соланидановые или спиросола-новые агликоны, в связи с этим исследование [8] было сосредоточено на соланидиновых или соланиданоподобных гликоалкалоидах.
В данном исследовании был использован метод тандемной масс-спектрометрии для определения метаболомного профиля присутствующих гликоалкалоидов в восьми сортах цветного картофеля, выращенного Сибирским федеральным научным центром агробиотехнологий (Краснообск Новосибирской области) Российской академии наук. Внешний вид сортов цветного картофеля Гибрид 15/F-2-13 и Синиль-га из Сибирского федерального научного центра агробиотехнологий представлен на рисунке 1.

А B
Рис.1. Внешний вид сортов цветного картофеля: A – Гибрид 15/F-2-13; B – Синильга
Цель исследования – метаболомное исследование гликоалкалоидов методом тандемной масс-спектрометрии в восьми сортах цветного картофеля Solanum Tuberosum L.
Объекты и методы. Объектом исследования являлись восемь сортов сибирского цветного картофеля S. tuberosum, полученные методом селекционного отбора из Сибирского федерального научного центра агробиотехнологий Россий- ской академии наук. Это сорта: Тулеевский, Куз-нечанка, Памяти Антошкиной, Томичка, Гибрид 15/F-2-13, Гибрид 22103-10, Гибрид 17-5/6-11, Синильга. Картофель был собран на полях Сибирского федерального научного центра агробиотехнологий РАН в конце сентября 2020 г.
Для получения высококонцентрированных экстрактов применяли фракционную мацерацию. При этом общее количество экстрагента (спирт метиловый ХЧ) делили на 3 части и последовательно настаивали на картофеле первую часть, затем вторую и третью. Время настаивания каждой части экстрагента составило 7 сут.
Для выполнения разделения многокомпонентных смесей использовался жидкостный хроматограф высокого давления Shimadzu LC-20 Prominence HPLC (Shimadzu, Япония), оборудованный UV-детектором и обратнофазной колонкой Shodex ODP-40 4E. Программа элюции градиента следующая: 0,0 – 4 мин, 100 % CH 3 CN; 4 – 60 мин, 100 % – 25 % CH 3 CN; 60 – 75 мин, 25 % – 0 % CH 3 CN; контрольная промывка 75– 120 мин 0 % CH 3 CN. Весь ВЭЖХ-анализ сделан с UV-VIS-детектором SPD-20A (Kanda-Nishikicho 1-chrome, Shimadzu, Chiyoda-ku, Токио, Япония) при длинах волн 230 и 330 r/м ; температура 17 °С. Объем впрыска составлял 1 мл.
Масс-спектрометрические данные получены с помощью ионной ловушки amaZon SL (производство фирмы «BRUKER DALTONIKS», Германия), оснащенной источником ионизации электрораспылением ESI в режимах отрицательных и положительных ионов. Оптимизированные параметры получены следующим образом: температура источника ионизации – 70 °С, поток газа – 4 л/мин, газ-небилайзер (распылитель) – 7,3 psi; капиллярное напряжение – 4500 V; напряжение на изгибе торцевой пластины – 1500 V; фрагментатор – 280 V; энергия столкновения – 60 eV. Масс-спектрометр использовался в диапазоне сканирования m/z 100 – 1,700 для MС и МС/МС.
Результаты и их обсуждение. Для экспериментальных исследований были отобраны восемь наиболее эффективных сортов, полученных методом селекционного отбора из Сибирского федерального научного центра агробиотехнологий Российской академии наук. Это сорта: Тулеевский, Кузнечанка, Памяти Антошкиной, Томичка, Гибрид 15/F-2-13, Гибрид 22103-10, Гибрид 17-5/6-11, Синильга. Картофель был собран на полях в конце сентября 2020 г.
Данные масс-спектрометрии высокой точности регистрировали на ионной ловушке amaZon SL BRUKER DALTONIKS, оснащенной источником ESI в режиме отрицательных и положительных ионов. Реализован четырехступенчатый режим разделения ионов (режим МС/МС). Все химические профили образцов были получены методом ВЭЖХ – ESI – MS/MS. Сочетание обоих режимов ионизации (положительного и отрицательного) в режиме полного сканирования МС дает дополнительную достоверность определения молекулярной массы (рис. 2.). Данное сочетание режимов ионизации обеспечивает самую высокую чувствительность и приводит к ограниченной фрагментации, что делает этот метод наиболее подходящим для определения молекулярной массы разделяемых гликоалкалоидов, особенно в случаях, когда концентрация низкая. Идентификация производилась путем сравнения значений m/z, RT и моделей фрагментации со спектральными данными MS2, взятыми из научной литературы, или путем поиска в базах данных (MS2T, MassBank, HMDB).
Полученные масс-спектрометрические данные позволяют составить подробную таблицу присутствия и относительной скорости ионизации идентифицированных соединений у разных сортов сибирского картофеля S. tuberosum (табл.). Примененный в жидкостной хроматографии градиент замещения ацетонитрила водой позволил расщепить все стероидные алка-лоиды-гликозиды за достаточно короткое время.
I $2
ф
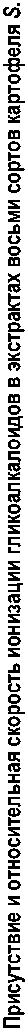
|
2 о 1— |
О co 05 OO О LO CO OO т— |
OO о CXI LO |
OO 3 LO CO CD CXI |
CXI 05 LO CD 05 CD |
CXI CXI LO 05 CD CO т— |
CD CD CD CXI |
||||||||||||||||
|
LO Cl KO 1_______ |
CXI LO 05 CD CO CO OO |
CO LO 05 CO 05 CXI т— |
CO LO 05 CO 05 CXI т— |
CO LO 05 CO 05 CXI т— |
CO LO 05 CO 05 CXI т— |
CD CD CD 05 CD т— |
||||||||||||||||
|
о о CXI CXI Cl x KO x 1_______ |
LO СО CXI LO CO о co |
СХ| т— СО LO СО со |
т— CXI о ? OO |
CO 05 CO LO CO 3 co |
T- 3 OO т— LO т— |
OO OO co CD CD т— |
OO OO co CD CD т— |
OO OO co CD CD т— |
CD т— CO 05 LO |
05 CXI CO OO т— |
CO 05 3 |
CO LO CO |
CD 3 |
|||||||||
|
co ^ LO Cl x KO |
о о о Т- со LO |
О О О СО СХ| ОО |
co 05 О CXI CXI co CXI |
co LO CXI co т— CO 05 |
CO LO CO LO CXI |
CO LO CO LO CXI |
CD CD CD CD LO |
|||||||||||||||
|
2 q x о |
LO со со СХ| 3 |
о co о о T- CXI |
CO LO CO OO о |
CXI LO CD CXI CO LO LO |
LO CD т— 05 CD CO |
LO CD т— 05 CD CO |
co 05 CXI т— CO LO CXI |
CO 05 CXI т— CO LO CXI |
CO 05 CXI т— CO LO CXI |
OO co co CXI |
CXI 3 co CXI LO |
cxi 05 co 05 T- |
||||||||||
|
2 (U CD X co ^ |
со LO о о ОО о LO Т- |
со 05 05 СО LO т— |
CXI LO CXI LO OO LO О CXI |
CXI LO LO OO 05 LO CO |
OO CXI 05 CD CXI CD N т— |
LO CO CXI co co |
OO CXI 05 CD CXI CD N т— |
CD CD CD CXI т— |
CD CD CD OO |
CD CD CD 05 |
||||||||||||
|
О X X £ s < |
со LO о LO 05 |
о о CXI 05 О CO |
OO 05 OO |
05 CXI CD 05 CO |
OO CXI LO CO OO co |
3 LO CD т— |
CXI OO co CD CXI LO |
CD CD CD т— |
т— CXI CD |
co CD CO CD CO CXI |
||||||||||||
|
CD CD |
о со 05 о Т- |
СО ОО со |
CO LO OO LO о co T- CXI |
T- 3 LO co |
т— О о CXI о co |
CO LO LO 05 CXI |
CO LO CD т— 3 3 T- |
CO LO CD т— 3 3 T- |
CO co co CXI co OO co |
|||||||||||||
|
DC О 5. ¥ s s Э |
о т (XI о |
о Z т см о |
ОО о Z £ см о |
о co ZE СП о |
о co ZE CO о |
о z ZE co cJ |
О ZE LO cJ |
LO о z ZE LO cJ |
LO О z ZE LO cJ |
LO О z ZE LO cJ |
LO О ZE LO cJ |
LO о ZE LO cJ |
LO О ZE LO cJ |
LO о ZE LO cJ |
co о z ZE LO cJ |
co о ZE LO cJ |
co о ZE LO cJ |
co о z LO ZE LO cJ |
co о z ZE LO cJ |
co о z LO ZE CO cJ |
о z co ZE LO cJ |
OO о z CO ZE CO cJ |
|
CD Cl CD О О О 05 5 |
CD С Ъ с 05 О О |
"о "со Е о 1— |
СЕ X О 2 05 g Е >х X 1— CD CD m CO X CD ZE |
CD C c о CD 05 CD -2 о СП |
Cl X О 2 05 2 E >x X 1— CD CD m CO X CD ZE |
CD C c о CD 05 CD 2 "O X CD Q |
CD C c о CD 05 X CD 05 X CD. < |
CD CD О "о CD 05 xz CD "o 2 TD 05 C 05 О GO |
CD CD О О CD CD 2 Ъ 05 C 05 О GO |
CD CD О "о CD 05 CD CD C О CD c 05 О GO |
CD C c 05 О CD 05 xz CD < |
CD C c Q CD _l |
CD CD О "о CD 05 xz CD "o cz CD 'cz 05 О CD |
CD CD О О CD CD CZ 2 Ъ 05 'cz 05 О CD |
CD CD О О CD "о CZ 2 Ъ 05 'cz 05 О CD |
CD C c Q. CD _l |
CD CD О О CD "о CZ CD 'cz 05 О CD |
СЕ s о 2 05 g s E >x X 1— CD CD m CO s CD ZE |
er s о 2 05 2 s E >x X 1— CD CD m CO s CD ZE |
d s о 2 05 2 s E >x X 1— CD CD m CO s CD ZE |
CE s о 2 05 2 s E >x X 1— CD CD m CO s CD ZE |
CE s о 2 05 2 s E >x X 1— CD CD m CO s CD ZE |
Разрешение отдельных пиков стероидных алкалоидных гликозидов в применяемом градиенте жидкостной хроматографии было удовлетворительным, и идентификация соединений на основе зарегистрированных масс-спектров была од- нозначной. В экстрактах в качестве основных гликоалкалоидных компонентов идентифицированы α-чаконин и α-соланин, их пики легко распознавались в суммарном ионном токе (рис. 2, 3).
Intens. x10 7
x10 07
x10 05
x10 05
0.5
0.0
1+ 868.41
PotatoTuleevsky MeOH #2_-1_01_849.d: +MS, 32.1min #1195
1+ 2+
297.40 445.67
1+ 398.26
1+ 706.32
1+ 560.33
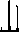
1+ 851.39
PotatoTuleevsky MeOH #2_-1_01_849.d: +MS2(868.41), 32.1min #1196
PotatoTuleevsky MeOH #2_-1_01_849.d: +MS3(868.41->398.26), 32.2min #1200
15 1 7 + .04 1+
253.19
327.22 о

312.27
706.40
PotatoTuleevsky MeOH #2_-1_01_849.d: +MS4(868.41->398.26->327.22), 32.3min #1204
150.13
204.13
1400 1600
1800 m/z
Рис. 2. Масс-спектр α -соланина из экстракта S. Tuberosum (сорт Тулеевский), m/z 868.41
Intens. x108
0.5
x100.07
x1007
1.0
0.5
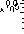
ОАА
^™
PotatoTuleevsky MeOH #2_-1_01_849.d: +MS, 32.6min #1217
PotatoTuleevsky MeOH #2_-1_01_849.d: +MS2(852.41), 32.7min #1219
PotatoTuleevsky MeOH #2_-1_01_849.d: +MS3(852.41->706.40), 32.8min #1223
PotatoTuleevsky MeOH #2_-1_01_849.d: +MS4(852.41->706.40->560.32), 32.9min #1227
л ДАА
.ААА
Рис. 3. Масс-спектр α -чаконина из экстракта of S. Tuberosum (сорт Тулеевский), m/z 852.41
Заключение. Научные исследования, представленные в данной работе, показали присутствие большой разновариантности гликоалкалоидов в сортах сибирского цветного картофеля S. tuberosum L. Это сорта: Тулеевский, Кузнечан-ка, Памяти Антошкиной, Томичка, Гибрид 15/F-2-13, Гибрид 22103-10, Гибрид 17-5/6-11, Синильга. Все селекционные образцы получены в Сибирском федеральном научном центре агробиотехнологий Российской академии наук. Для идентифицирования целевых аналитов из экстрактов картофеля была использована тандемная масс-спектрометрия (высокоэффективная жидкостная экстракция в соединении с ионной ловушкой BRUKER DALTONIKS). Данный метод позволил идентифицировать 22 соединения, относящихся к группе гликоалкалоидов.
Список литературы Метаболомное исследование гликоалкалоидов методом тандемной масс-спектрометрии в восьми сортах цветного картофеля Solanum tuberosum L
- Spooner D.M., Hijmans R.J. Potato systematics and germplasm collecting, 1989-2000 // Am. J. Potato Res. 2001. T. 78. P. 237-268.
- Roessner U., Willmitzer L., Fernie A.R. High-resolution metabolic phenotyping of genetically and environmentally diverse potato tuber systems. Identification of phenocopies // Plant Physiol. 2001. T. 127. P. 749-764.
- Monitoring changes in anthocyanin and steroid alkaloid glycoside content in lines of transgenic potato plants using liquid chromatography/mass spectrometry / M. Stobiecki [et al.] // Phytochem. 2003. T. 62. P. 959-969.
- Griffiths D.W., Bain H., Dale M.F.B. The effect of low-temperature storage on the glycoalkaloid content of potato (Solanum tuberosum) tubers // J. Sci. Food Agric. 1997. T. 74. P. 301-307.
- Krits P., Fogelman E., Ginzberg I. Potato steroidal glycoalkaloid levels and the expression of key isoprenoid metabolic genes // Planta. 2007. T. 227. P. 143-150.
- Shakya R., Navarre D.A. LC-MS Analysis of Solanidane Glycoalkaloid Diversity among Tubers of Four Wild Potato Species and Three Cultivars (Solanum tuberosum) // J. Agric. Food Chem. 2008. T. 56. P. 6949-6958.
- Reduction of cholesterol and glycoalkaloid levels in transgenic potato plants by overexpression of a type 1 sterol methyltransferase cDNA / L. Arnqvist [et al.] // Plant Physiol. 2003. T. 131. P. 1792-1799.
- Friedman M., McDonald G.M. Potato glycoalkaloids: chemistry, analysis, safety, and plant physiology. Crit. ReV // Plant Sci. 1997. T. 16. P. 55-132.


