Металл-аффинная хроматография. Основы и применение
Автор: Кельциева Ольга Александровна, Гладилович В.Д., Подольская Е.П.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Хроматография, ПЦР-, ДНК-анализ
Статья в выпуске: 1 т.23, 2013 года.
Бесплатный доступ
В обзоре рассмотрен принцип действия и основные возможности применения металл-аффинной хроматографии, которые включают в себя очистку гистидин-меченных белков, металл-связывающих белков, нуклеотидов и антител. Описаны преимущества и недостатки как самого метода, так и различных сорбентов.
Металл-аффинная хроматография, металл-аффинные сорбенты, очистка белков, фосфопротеомика
Короткий адрес: https://sciup.org/14264847
IDR: 14264847 | УДК: 543.544.414
Текст обзорной статьи Металл-аффинная хроматография. Основы и применение
В последние годы активное развитие получают высокоспецифичные и высокоселективные методы выделения органических и биоорганических соединений из биологических образцов и объектов окружающей среды. В первую очередь к таким методам можно отнести металл-аффинную хроматографию (МАХ, IMAC — immobilized-metal affinity chromatography). В научной литературе на русском языке используют также названия: металлхе-латная, или лигандобменная хроматография. В основе этого хроматографического метода лежит различное сродство органических соединений к ионам некоторых металлов. Ионы, в большинстве случаев это — ионы металлов, хелатируют поли-дентантными лигандами, иммобилизованными на вспомогательной подложке (силикагель, агароза, сефароза, сшитый сополимер полистирола и диви-нилбензола).
Концепция металл-аффинной хроматографии была впервые сформулирована и представлена Поратом [1]. Она была основана на известном сродстве ионов переходных металлов, таких как Zn2+, Cu2+, Ni2+ и Co2+ к гистидину и цистеину в водных растворах. Впоследствии появилась идея использовать прочно зафиксированные ионы металлов для фракционирования белков. Реакция образования комплекса иона металла и некоторых функциональных групп (например, фосфатных групп) органических молекул, как правило, обратима. Следовательно, иммобилизованные ионы металлов можно использовать как сорбент. Взаимодействие между сорбентом и аналитом pH-зависимое, поэтому связанные вещества можно элюировать, изменяя рН, уменьшая ионную силу буфера или используя другие хелатирующие агенты, такие как ЭДТА или имидазол.
Одним из самых известных приложений МАХ является очистка гистидин-меченных белков(His).
В последнее время наблюдается увеличение применения МАХ при проведении предварительной обработки образца для обнаружения наркотиков, таких как тетрациклины, фторхинолоны, макролиды, β-лактамы, аминогликозиды [2]; при пробо-подготовке для выявления биомаркеров в сыворотке крови, моче и тканях для диагностики заболеваний с последующим применением методов масс-спектрометрии [3, 4].
ПРИНЦИП ДЕЙСТВИЯ МЕТОДА МЕТАЛЛ-АФФИННОЙ ХРОМАТОГРАФИИ
Ионы металлов чаще всего классифицируются согласно теории ЖКМО (Жестких кислот мягких оснований) Пирсона [5]. Жесткие кислоты (например, ионы Fe3+, Ca2+, Al3+) легче всего координируют кислород и фтор функциональных групп, мягкие кислоты (ионы Cu+, Hg+, Ag+) — серу. Промежуточные по жесткости (Cu2+, Ni2+, Zn2+, Co2+) — азот, кислород и серу. Селективность жестких и промежуточных ионов различна: при оптимальном для их связывания рН (кислом и нейтральном соответственно) они координируются с разными функциональными группами. Такие группы могут содержаться в белках и нуклеиновых кислотах. "Мишенями" жестких кислот могут являться аспарагиновая и глутаминовая кислоты, тирозин или фосфорилированные серин, треонин или тирозин.
Адсорбция белков и пептидов методом МАХ основана на обратимом взаимодействии между аминокислотами, выступающими в качестве доноров электронов, и ионами металла, хелатированными лигандами, которые иммобилизованы на поверхности твердого носителя [5]. Несмотря на значительное количество аминокислот, которые могут участвовать в процессе связывания (в том числе глицин, аргинин, лизин, тирозин, гистидин, цистеин, аспарагиновая кислота), фактически сорбция белка определяется наличием гистидина.
Наиболее часто используемыми при приготовлении металл-аффинных сорбентов являются ионы переходных металлов. Электрон-доноры (N, S и O) в хелатирующих соединениях могут координировать ионы металлов с получением металл-хелатов в диапазоне от бидентатных до пентаден-татных соединений в зависимости от числа занятых координационных связей.
Были разработаны различные подложки для МАХ. Традиционно в качестве подложки использовался мягкий гель, такой как агароза. Полисаха- риды, например целлюлоза, обладают преимуществом из-за хорошей биологической совместимости. Но они демонстрируют низкую механическую прочность и, следовательно, не могут быть использованы в системах высокого давления. Напротив, неорганическая матрица, такая как диоксид кремния, обладает превосходными механическими свойствами, но имеет недостаток в виде необратимой неспецифической сорбции белков [6].
Основной механизм взаимодействия His-меченных белков с иммобилизованным ионом металла представлен на рисунке.
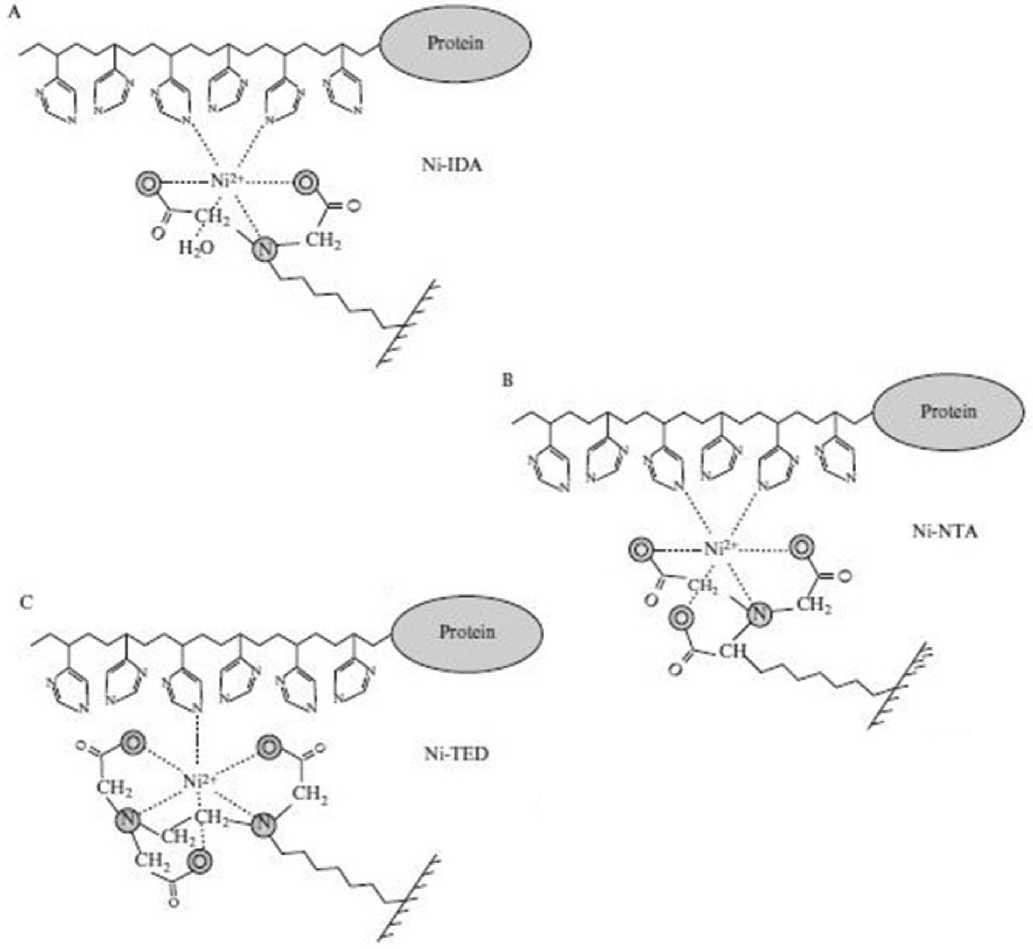
Модель взаимодействия между остатками гистидина и ионами металлов в три-(IDA), тетра-(NTA) и пентадентатных IMAC лигандах (TED) [5]
Такой лиганд, как нитрилотриуксусная кислота (nitrilotriacetic acid, NTA), удерживает ион Ni2+ четырьмя валентностями (рис., В), и две валентности иона металла доступны для взаимодействия с кольцами имидазола гистидиновых остатков. Это соотношение оказалось наиболее эффективным для очистки гистидин-меченных белков. Другой тетрадентатный лиганд — карбоксиметиласпартат [7], имеющийся в продаже как кобальтсодержащая смола Talon [http://www.clontech. com/]. В отличие от тетрадентатных лигандов иминодиуксусная кислота (iminodiacetic acid, IDA) координирует двухвалентные ионы тремя валентностями (рис., A), оставляя третью валентность иона металла свободной для взаимодействия с кольцом имидазола, хотя неясно, будет ли имидазол иметь пространственную возможность участвовать во взаимодействии.
По всей видимости, координационное число играет важную роль в отношении качества очищения белковых фракций. Степень очистки белка с применением IDA и NTA-матриц, как правило, дает различный результат, поскольку часто наблюдается сильное выщелачивание ионов металлов из IDA-лигандов по сравнению с NTA [5]. Самое низкое выщелачивание металлов показано при использовании пентадентатного лиганда, который координирует ионы особенно сильно (рис., С).
Как было указано выше, выбор металла для МАХ зависит от структуры анализируемых соединений. Наряду с тем что трехвалентные катионы, такие как Al3+, Ga3+ и Fe3+ [8, 9], или четырехвалентный Zr4+ предпочтительны для сорбции фосфорсодержащих белков и пептидов, двухвалентные ионы Cu2+, Ni2+, Zn2+ и Co2+ используют для очистки гистидин-меченных белков. Комбинация тетрадентатного лиганда, который обеспечивает сильное связывание, и иона металла, который оставляет два координационных сайта свободными для взаимодействия с биополимерами (Ni2+, Co2+), получила наиболее широкое признание и приводит к высокой степени извлечения и чистоте выделенного белка.
Металл-аффинные сорбенты могут быть как на основе хелатированных лигандами ионов металлов, так и нанесены на функциональные поверхности, например чипы, в методе SELDI (активированная поверхностью лазерная десорбция / ионизация). Методы на основе чипов (например, поверхностный плазмонный резонанс (SPR)) позволяют иммобилизовать His-меченные белки (белки, меченные гистидиновым остатком-тэгом) для количественных и кинетических исследований. Кроме того, МАХ была использована на этапе ингибитора истощения до ПЦР-амплификации нуклеиновых кислот из сложных образцов, таких как кровь, в технологии, названной Chelex [1]. Были предложены и методы МАХ для профилирования протеома на основе чипов [10], и эти методы используют в качестве инструмента в клинической практике обследования на наличие фосфатных групп и гистидин-содержащих белков и пептидов (SELDI).
Наиболее важные из многочисленных приложений металл-аффинной хроматографии будут рассмотрены далее.
ПРИМЕНЕНИЕ МЕТАЛЛ-АФФИННОЙ ХРОМАТОГРАФИИ ДЛЯ ОЧИСТКИ БЕЛКОВ
Изначально разработанная для очистки нативных белков [1] МАХ оказалась технологией с очень широким спектром применения, в том числе в случае хроматографического очищения: возможность метода позволяет очищать наиболее распространенные металлопротеины, антитела, фосфорилированные и рекомбинантные His-меченные белки. В попытке использовать специфичность и высокое сродство His-меченных белков к иммобилизованным ионам металлов металл-аффинные лиганды были применены для изучения белок-белковых взаимодействий, где белки должны быть стабильно иммобилизованы на поверхности. В качестве примера приведем ниже два приложения этого подхода: ELISA (иммунофермент-ный анализ) — в качестве диагностического инструмента, и технологии на основе чипов для функциональных исследований.
Одной из наиболее важных областей применения МАХ является очистка рекомбинантных белков вследствие относительно высокого сродства и специфичности некоторых металлов к эпитопу, содержащему шесть или более остатков гистидина. Даже один шаг очистки в большинстве случаев приводит к той степени чистоты препарата белка, которая достаточна для решения наиболее распространенных задач в биохимии. Структура меченного конца, т. е. его положение, последовательность и длина, может влиять на процесс производства белка на нескольких стадиях: скорость экспрессии, доступность для привязки к металл-аффиному сорбенту, образование трехмерной белковой структуры, формирование белковых кристаллов и в меньшей степени на растворимость и активность. Наиболее распространенная форма His-конца состоит из шести последовательных остатков гистидина (Н 6 ), которые связываются с металлами достаточно хорошо, чтобы сместить равновесие ассоциации / диссоциации больше в сторону ассоциации, ведущей к стабильному связыванию в большинстве случаев [11].
Есть несколько преимуществ применения ме-талл-аффинной хроматографии для очистки His-меченных белков по сравнению с другими видами аффинной хроматографии [12]. Кроме простоты и низкой стоимости использования наиболее поразительной особенностью является надежность МАХ:
-
• метод работает как в нативных, так и денатурирующих условиях, таких как 8 М мочевина или 6 М гуанидингидрохлорид [13], и позволяет осуществлять последовательный рефолдинг на колонке [14];
-
• метод работает в окислительно-восстановительных условиях;
-
• связанные с сорбентом белки способны выдерживать воздействие широкого спектра различных химических веществ;
-
• относительно высокое сродство и специфичность позволяют обеспечивать высокую эффективность сорбции даже при наличии высоких титров белка;
-
• процедуры очистки масштабируемы.
Несмотря на такие преимущества, МАХ имеет свои ограничения. Очевидно, что использования хелатообразователей в анализируемом образце следует избегать, что может быть недостатком, поскольку, например, ЭДТА — мощный ингибитор металлопротеаз — может быть применена только в низких концентрациях. Следует также проявлять осторожность при использовании других потенциально хелатных групп, таких как Трис, соли аммония и некоторые аминокислоты.
До недавнего времени использование сильных восстановителей, таких как дитиотреитол (ДТТ), в металл-аффинном анализе считалось проблематичным из-за вымывания никеля из сорбента, и как следствие подозревалось увеличение концентрации никеля в белковых препаратах. Тем не менее было обнаружено, что умеренные концентрации ДТТ полностью совместимы с очисткой на Ni-NTA [5]. Даже если ДТТ может восстановить ионы никеля, это приведет к изменению цвета смолы, а не к вымыванию лигандов, и смолы, обрабатываемые в восстановительных условиях, могут быть регенерированы и повторно использованы. Эти результаты показывают, что, несмотря на изменение цвета вследствие восстановления никеля ДТТ, сорбент по-прежнему функционирует.
Для того чтобы МАХ приводила к высокой степени очистки за один этап, требуется высокая корреляция количества гистидин-меченного белка-рекомбинанта в образце с количеством металл-аффинного сорбента [15]. Стоит отметить, что существуют белки, проявляющие поверхностные свойства, подходящие для взаимодействия с иммобилизованными ионами металлов, которые могут образовывать связи с сорбентом, хотя их сродство к сорбенту ниже, чем у гистидин-меченных белков. Соответственно избыток сорбента может привести к тому, что препарат будет загрязнен такими белками. Более того, существуют некоторые белки, в которых локальная плотность хелатирующих аминокислот, таких как гистидин, настолько велика, что они практически неизбежно будут связываться с ионами иммобилизованных металлов. Для избавления от соэлюирую-щихся белков или предотвращения их адсорбции существуют несколько процедур:
-
• проводить дополнительные этапы очистки перед МАХ;
-
• подбирать соотношение гистидин-мечен-ного белка и сорбента;
-
• использовать альтернативную подложку;
-
• дополнительно очищать целевой белок после МАХ методом обращенно-фазовой хроматографии.
Дополнительная очистка перед стадией МАХ возможна методами ион-обменной (ИОX) или эксклюзионной хроматографии (ЭХ). ИОХ имеет лучшие возможности разделения, но ЭХ не только способна разделять молекулы по их размерам и помогает отделить совокупность молекул с высокой молекулярной массой, но и может быть использована для обессоливания препарата [16]. Хотя ЭХ-МАХ (в отличие от ИОХ-МАХ) может быть представлена как стандартизованная процедура без учета биохимических свойств белка, таких как диапазон разделения и pI, для ее проведения необходим набор различных ЭХ-колонок. Кроме того, чтобы использовать все возможности этих технологий, требуется дорогостоящее оборудование, в частности автоматизированная хроматографическая система, что часто существенно снижает скорость проведения большого количества параллельных измерений. Аффинную очистку методом МАХ обычно выполняют в режиме связывание— промывка—элюирование. Это позволяет легко ввести второй сорбент в процедуру двухэтапной очистки, приводящей к получению высокоочи-щенного белкового препарата [17].
Повысить чистоту белков при проведении МАХ возможно использованием в качестве матрицы для сорбента покрытых декстраном гранул агарозы, которые составляют материал большинства хроматографических носителей (Sepharoses, Superflow, Agaroses), что предотвращает соэлю-цию белков с выраженной аффинностью к перечисленным матрицам [18]. К недостаткам метода можно отнести коммерческую недоступность дек-стран-покрытых гранул и как следствие необходимость в приготовлении металл-аффинного сорбента в лабораторных условиях. Подложки на основе силикагеля также предотвращают адсорбцию белков с аффинностью к агарозе и, кроме того, обладают хорошей устойчивостью к давлению, что делает их походящими для применения в ВЭЖХ, но силикагелевые смолы часто страдают от низкой связывающей способности и ограниченной устойчивости к высоким значениям рН, что критично при проведении МАХ.
Недавно был разработан новый подход, позволяющий избегать использования твердых хроматографических носителей, получивший название "аффинное осаждение", и было показано, что МАХ также может быть проведена этим методом [19]. Хелатирующий лиганд химически связывается с полимером, который после сорбции гисти-дин-меченного белка агрегирует при изменении внешних условий (рН, температура), после чего вместе с белком может быть осажден центрифугированием. Протокол его использования все еще относительно сложен, но со временем, возможно, данный метод будет широко использован при очищении белков методом МАХ.
МЕТАЛЛ-АФФИННАЯ ХРОМАТОГРАФИЯ В ИММУНОХИМИИ
Сорбент Ni(II)-NTA, лиганды которого иммобилизованы на поверхности луночных планшетов, используют для задерживания His-меченных антигенов в их растворяемой и структурно не поврежденной форме при серологических исследованиях. Иммобилизация с помощью гистидиновых остатков может быть выгодна и удобна для стандартной процедуры иммуноферментного анализа ELISA. В стандартной методике белки-антигены адсорбируются на пластиковых поверхностях планшета случайно, часть активных сайтов присоединения антител (эпитопов белка) маскируется. ELISA с применением металл-аффинного подхода позволяет отбирать конформационно-зависимые моноклональные антитела [20] и проводить иммуносорбцию с повышенной чувствительностью [21].
Иммобилизация His-меченных белков на поверхности чипа для исследования взаимодействия с другими молекулами, например, в методе SPR является широко используемым методом характеризации белка или межбелковых взаимодействий. Фактор устойчивого заякоривания и стабильности на поверхности чипа для плазмонного резонанса может быть важен для снижения утечки молекул белка с поверхности [11, 22]. Существенные улучшения в стабильности функциональной иммобилизации His-меченных белков на стеклянных поверхностях даже при низкой концентрации были достигнуты в соответствии с концепцией мультивалентных хелатирующих головок, где одна молекула лиганда несет три фрагмента NTA (tris-NTA) [23, 24]. Эта разработка позволяет использовать His-меченные белки без маркировки биотином после очистки.
Металл-аффинные лиганды также успешно используют в качестве детектирующего соединения в методе иммуноблоттинга, заменяя дорогостоящие антитела. His-меченные белки, перемещенные в нитроцеллюлозную мембрану, могут быть обнаружены с помощью Ni-NTA, сопряженной со щелочной фосфатазой или с особыми указывающими ферментами [25] по хромогенной или хемилюминесцентной реакции или с квантовыми точками для флуоресцентной детекции [26]. Такой подход представляет собой быструю и экономически выгодную альтернативу реакции обнаружения на основе антител в случаях, когда высокая специфичность антител не требуется. Специфичность обнаружения при использовании сопряженной NTA была увеличена на порядок при использовании tris-NTA [27, 28].
ИСПОЛЬЗОВАНИЕ МЕТАЛЛ-АФФИННОЙ ХРОМАТОГРАФИИ В ПРОТЕОМНЫХ ИССЛЕДОВАНИЯХ
Как было описано выше, МАХ первоначально была разработана как метод разделения металл- и гистидин-содержащих белков [1], но сегодня эти возможности используют и в других протеомных исследованиях, в которых снижение сложности (компонентности) системы является необходимым условием при анализе и идентификации малораспространенных белков. МАХ прочно заняла свое место среди других методов предварительного разделения сложных смесей, таких как жидкостная обращенно-фазовая, ионообменная, аффинная хроматографии и гель-электрофорез [29, 30]. В зависимости от целей и задач в процессе пробо-подготовки МАХ комбинируют с двухмерным гель-электрофорезом при анализе белков или с обращенно-фазовой хроматографией для дополнительного разделения пептидов.
Таким образом, в протеомике металл-аффин-ную хроматографию используют в исследованиях, где фракции клеточного белкового пула обогащают для дальнейшего анализа. Так, например, белки со сродством к металлам могут быть обогащены либо с учетом их способности связываться с определенным иммобилизованным ионом металла (например, Me2+-NTA), либо путем связывания иона металла с белком (Ме2+-белок) на незаряженном металл-аффинном лиганде (например, NTA) [31, 32]. В качестве ионов, пригодных для металл-аффинного анализа металло-протеома, чаще всего используют Cu2+, Ni2+, Zn2+.
Также этот метод может быть использован для связывания и разделения моно- и динуклеотидов за счет сложного явления, объясняемого дифференциальным взаимодействием потенциальных сайтов связывания — кислорода в фосфатной группе, азота и кислорода на азотистых основаниях, гидроксильных групп в рибозе с иммобилизованным металлом [33].
Совершенно иным представляется применение МАХ для очищения антител, основанное на сродстве последних к ионам металлов. Молекулярные основы такого взаимодействия металл-содержащих сайтов на тяжелой цепи были рассмотрены авторами [34]. Об адсорбции иммуноглобулинов из различных образцов на металл-аффинных сорбентах сообщалось многими авторами (humanized murine IgG [34], человеческий IgG [35], козий IgG [36]). Очистка антител успешно осуществляется с помощью различных форматов МАХ, включая гели [34, 37], полиметакрилат [38] и мембранные полые волокна (Cu2+, Ni2+, Zn2+, Co2+) [39]. Мягкий способ элюирования белка солями, низкая стоимость и высокая надежность металл-аффинных сорбентов определенно способствовали увеличению популярности этого метода по сравнению с традиционными подходами [39].
Однако на сегодняшний день основным приложением МАХ является фосфопротеомика [31]. Обратимое фосфорилирование белков по остаткам серина, треонина и тирозина имеет важное биологическое значение. Как правило, ферментативное фосфорилирование /дефосфорилирование клеточных белков контролирует ключевые внутриклеточные процессы, связанные с делением, дифференцировкой или гибелью клеток. Направление протеомики, которое занимается анализом таких посттрансляционных модификаций белков, как фосфорилирование, получило название "фосфопротеомика". Активно развиваемая отрасль подобных исследований — изучение пула модифицированных белков при различных клеточных состояниях и в различных субклеточных компарт-ментах позволяет вычленять ключевое событие в каскаде фосфорилирований /дефосфорилирований.
Металл-аффинная хроматография была предложена как простой, экономичный и универсальный метод выделения различных типов фосфорилированных пептидов [23, 41, 42] и быстро нашла свое применение в исследованиях фосфопротеома [43, 44]. Как было указано выше, самыми распространенными хелатирующими лигандами в ме-талл-аффинных сорбентах являются нитрилотри-уксусная (NTA) и иминодиуксусная (IDA) кислоты. Эти кислоты хелатируют ионы Ni2+, Zn2+, Fe3+, Ga3+ и др. [41, 45–47], при этом свободные орбитали атомов металлов способны участвовать в координационном взаимодействии с отрицательно заряженными пептидами, в частности с фосфорилированными пептидами. Было отмечено, что сорбент на основе Fe3+-NTA показывает более высокую селективность к фосфопептидам по сравнению с Fe3+-IDA [42]. Однако серьезным недостат- ком метода МАХ является неспецифичное связывание с сорбентом таких кислых аминокислот, как глутаминовая кислота, аспарагиновая кислота, гистидин и цистеин, и других отрицательно заряженных соединений. На протяжении последних десятилетий предпринимаются попытки уменьшить неспецифическую сорбцию различными способами [49]. Так, можно варьировать рН раствора, в котором происходит связывание (связывающий буфер) [41, 45], или рН промывочного раствора [46, 47]. Несмотря на успешное применение этого подхода на стандартных белках, при переходе на уровень протеома селективность метода снижается до 60–70 %, что приводит к недостаточно эффективной идентификации фосфорилированных белков. Альтернативно возможно использование реакции этерификации для получения метиловых эфиров пептидов, что позволяет определять большее число сайтов фосфорилирования в сложных биологических смесях [46, 48–50]. Однако введение дополнительной реакции может привести к большим потерям в образце [51, 52].
Недавно были разработаны методики предварительной очистки образцов катион- или анион-обменной хроматографией [53, 54]. Такой подход позволил увеличить селективность МАХ до 75 %. Однако к недостаткам такого метода можно отнести возможность слишком сильного удерживания неполностью ферментативно гидролизованных пептидов, а также значительное удерживание других модифицированных пептидов, например N-ацетилированных пептидов и гликопептидов. Кроме того, было показано, что нормальнофазовая хроматография в качестве предварительного этапа пробоподготовки может быть эффективна при фосфопротеомной идентификации [55]. Поскольку фосфатная группа является сильно гидрофильной, фосфорилированные пептиды слабо удерживаются на нормальной фазе, что приводит после металл-аффинного обогащения к 99 % селективности.
На сегодняшний день наиболее успешной оказалась разработка так называемого метода металлооксидной аффинной хроматографии (МОАХ) на основе оксида титана TiO2 [56]. При использовании предколонки с TiO2, соединенной с обращен-нофазовой капиллярной колонкой, авторами [56] была показана возможность извлечения фосфорилированных пептидов казеина из гидролизата суммарного белка молока коровы. Однако селективность этого метода была снижена из-за неспецифического связывания кислых нефосфорилиро-ванных пептидов. В работе [57] авторы использовали 2,5-дигидроксибензойную кислоту (2,5-dihydroxybenzoicacid, DHB) для удаления неспецифично связавшихся пептидов, что повысило селективность и чувствительность метода. В работе [58] была впервые показана возможность приме- нения оксида циркония при МОАХ, причем ZrO2 имеет большую селективность к монофосфорили-рованным пептидам, тогда как TiO2 — к мульти-фосфорилированным. Был сделан вывод, что комбинация двух сорбентов имеет потенциал для исчерпывающего профилирования фосфопротеома [59]. При добавлении в связывающий и промывочный буферы молочной кислоты в элюате после МОАХ на TiO2 содержится, как правило, более 90 % фосфорилированных пептидов; для ZrO2 это значение ниже [60].
Сорбенты на основе оксидов металлов могут быть использованы в различном аппаратурном исполнении. Наиболее распространен "офф-лайн" вариант, обеспечивающий гибкость в подборе растворителей и масштабируемости эксперимента. Частицы оксидов металлов могут быть упакованы в носики для автоматических пипеток (сорбция достигается путем многократного пропускания образца через сорбент) [61] либо помещены в спиновые колонки (образец пропускают через сорбент с помощью центрифуги). Альтернативно возможен batch-вариант, в котором сорбент помещен в микропробирку, что позволяет веществу дольше взаимодействовать с ним. В "он-лайн"-режиме оксиды металлов помещают в предколонки для ВЭЖХ-систем [62].
Недавно появились разработки наночастиц на основе оксидов металлов, в которых на нанораз-мерные магнитные шарики или на полимерную подложку наносят тонкий слой оксида [63, 64]. Такая структура обладает большой удельной поверхностью и повышенной сорбционной емкостью по сравнению с традиционными металл-аффин-ными сорбентами, однако есть сомнения по поводу воспроизводимости таких структур. Также имеются сведения о создании модифицированных сорбентов мишеней для MALDI-масс-спектрометрии [65, 66].
Сравнение методов МАХ и МОАХ вызывает все больший интерес. Так, было показано [60], что оксид титана более устойчив к влиянию солей, детергентов и малых молекул, чем классические металл-аффинные сорбенты. Добавление детергента в связывающий буфер может увеличить производительность МАХ из-за уменьшения адгезии на поверхности микропробирок и, более того, благоприятствовать обогащению мультифосфори-лированных пептидов по сравнению с TiO2. Авторы [67] показали новый подход — последовательное элюирование с сорбента для разделения моно-и мультифосфорилированных пептидов при варьировании элюентов. По сравнению с проточным вариантом МОАХ batch-анализ (в пробирке) продемонстрировал прекрасную степень извлечения и моно-, и мультифосфорилированных пептидов. Таким образом, экспериментальные условия силь- но влияют на производительность и селективность МАХ. Масштабное сравнение МАХ и МОАХ TiO2 при профилировании фосфопротеома клеток Drosophila melanogaster Kc167 было проведено авторами [68]. МАХ с предварительным метилированием пептидной смеси продемонстрировала 80 % селективность, так же как и МОАХ. Особенно важно небольшое перекрывание результатов идентификации фосфорилированных белков (35 %), что говорит о возможности комбинирования двух методов для более полного профилирования. Авторы работы [69] использовали последовательное элюирование 5 % водным аммиаком, 5 % пиперидином и 5 % пирролидином, что существенно увеличило число идентифицированных фосфорилированных белков в клеточной линии HeLa.
К настоящему времени известно об использовании в качестве металл-аффинных сорбентов оксидов многих металлов. Самым распространенным является TiO 2 , которому посвящено большое число работ по оптимизации условий проведения анализа [70–73], также много внимания уделено ZrO 2 [74, 75]. Были предприняты успешные попытки использовать в качестве сорбента для обогащения фосфорилированных пептидов гидроксид алюминия Al(OH) 3 [76], оксид галлия Ga 2 O 3 [77], оксид ниобия Nb 2 O 5 [78], оксид олова SnO 2 , который показал более низкий уровень неспецифического связывания по сравнению с TiO 2 [79], оксид тантала Ta 2 O 5 [80]. Также перспективным следует признать использование оксида железа как в варианте магнитных шариков Fe3O4 [81], так и микрораз-мерного Fe 2 O 3 [82]. Метод МОАХ имеет большое значение в фосфопротеомных исследованиях для выделения фосфорсодержащих пептидов без дополнительных процедур пробоподготовки, таких как этерификация и ионообменная хроматография [83].
Широкое развитие хромато-масс-спектрометрических методов в фосфопротеомике привело к возможности изучения и решения таких фундаментальных задач в биологии, как передача сигналов в клетках и их механизм регулирования, а также исследование различных заболеваний, при которых меняется качественный и количественный состав фосфорилированных белков, и других биохимических задач. Обратимый процесс фосфорилирования / дефосфорилирования белков чрезвычайно важен для проведения межклеточных сигналов. Нарушение сигнальных систем приводит к таким тяжелым заболеваниям, как диабет [84, 85], рак [86], болезнь Альцгеймера [86, 87], сердечная недостаточность [87], и многим другим.
Поскольку клеточные сигнальные системы, в которых большую роль играют фосфобелки, существуют практически во всех живых системах, включая высокоразвитые организмы, фосфопроте- омные исследования таких систем имеют огромное значение. Немаловажное место среди методов пробоподготовки занимает металл-аффинная хроматография. Например, применение МОАХ TiO2 для обогащения фосфопептидов позволило установить типы киназ, задействованных в развитии эмбрионов рыбы данио-рерио [88].
Фосфорилирование белков в тканях мышей (мозг, сердце, печень и пр.) было изучено с применением металл-аффинного сорбента, содержащего железо (идентифицировано 12000 белков и 36000 сайтов фосфорилирования), и позволило, во-первых, установить специфичность фосфорилирования в различных тканях, во-вторых, определить активность нескольких киназ, что позволило авторам в конечном итоге создать атлас фосфобелков мыши [89].
Важной областью биомедицины, в которой задействована фосфопротеомика, является изучение стволовых клеток, а именно понимание сигнальных механизмов в них. В работе [90] рассмотрены протеомный и фосфопротеомный (с использованием комбинации ион-обменной хроматографии и МОАХ TiO 2 ) ответ стволовых клеток человеческих эмбрионов при дифференцировании. А в работе [91] приведены данные о 10 844 сайтах фосфорилирования белков стволовых клеток. Эти данные помогают установить природу уникальности стволовых клеток.
В последние годы активно развивается направление, связанное с анализом посттрансляционных модификаций белков различными токсикантами и ксенобиотиками, которое получило собственное название — "аддуктомика", в рамках которого методы МАХ и МОАХ также нашли свое применение.
Особое внимание уделяется аддуктам бутирил-холинэстеразы (БХЭ) с фофсфорсодержащими соединениями, в том числе и с ОВ, такими как зарин и зоман [92, 93]. Было показано, что специфичное выделение аддукта БХЭ с остатком 3- орто -крезил фосфата из образца плазмы или сыворотки крови на TiO 2 возможно даже в случае ингибирования 0.05 % БХЭ [92].
Кроме БХЭ мишенью присоединения фосфорорганических соединений является сывороточный альбумин. Причем зачастую можно обнаружить несколько сайтов модификации альбумина фосфорорганическими соединениями. Возможность обогащения образцов аддуктами пептидов сывороточного альбумина методом МАХ на сорбенте с иммобилизироваными ионами железа (III) была показана на примере параоксона [93]. Авторы работы [94] успешно идентифицировали пептиды сывороточного альбумина человека, модифицированные зарином и зоманом, после их выделения из образца с помощью TiO 2 .
Кроме того, авторами [95] была показана принципиальная возможность применения металл-аффинной хроматографии для специфичной сорбции алкилированных аддуктов сернистого иприта с глобином на сорбенте, содержащем ионы Cu2+.
ЗАКЛЮЧЕНИЕ
Таким образом, металл-аффинная хроматография является специфичным, надежным и воспроизводимым методом. Несмотря на относительно недолгую историю существования, метод получил быстрое развитие во многих направлениях биоор-ганического анализа, и последние годы круг задач, решаемых с помощью МАХ и МОАХ, стремительно расширяется. В ближайших перспективах можно ожидать, что метод будет широко использоваться в ретроспективном токсикологическом анализе, для разработки новых методов диагностики различных заболеваний, производстве новых лекарственных препаратов. В то же время появление современных высокотехнологичных материалов и нанотехнологий позволяет надеяться, что будут разрабатываться и производиться новые эффективные металл-аффинные сорбенты.


