Металлсодержащие наночастицы как факторы риска патоморфологических изменений в тканях внутренних органов в эксперименте
Автор: Зайцева Н.В., Землянова М.А., Игнатова А.М., Степанков М.С., Кольдибекова Ю.В.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Медико-биологические аспекты оценки воздействия факторов риска
Статья в выпуске: 2 (34), 2021 года.
Бесплатный доступ
Оценка и прогнозирование изменений тканей внутренних органов при воздействии металлсодержащих наночастиц, являющихся факторами риска развития негативных эффектов со стороны критических органов и систем, представляются актуальными. Это диктует необходимость выявления объективных методов количественной оценки риска развития патологических изменений тканей, имеющих в настоящее время только качественные характеристики. Осуществлена количественная оценка риска развития заболеваний легких крыс при экспозиции металлсодержащих наночастиц (на примере наноразмерного оксида меди (CuO)) с использованием методов анализа изображений. Исследования токсического действия выполнены на примере нанодисперсного CuO (45,86 нм) в условиях ингаляционной (однократно и в течение 14 дней) и пероральной (в течение 20 дней) экспозиции на крысах-самцах линии Wistar (60 особей). Животных для экспозиции разделили на пять групп по 12 особей (группа № 1 - ингаляционно однократно; группа № 2 - ингаляционно многократно; группа № 3 - перорально многократно; группы № 4 и № 5 - бидистиллированная вода аналогичными путями). При анализе ткани методами анализа изображений оценивали элементы первого, второго, третьего порядков. Статистическую значимость различий оценивали методом определения U-критерия Манна - Уитни. Количественную оценку риска (R) проводили с учетом вероятности (p) и тяжести (q) развития патоморфологических нарушений в ткани. Установлена вероятность развития патоморфологических нарушений в ткани легких с учетом идентификации всех элементов изображений во всех экспериментальных группах, которая составила от 0,16 до 1,2. Суммарный уровень риска развития заболеваний легких при однократном ингаляционном воздействии в концентрации 0,001СL50 составил 1,0·10-3 (средний риск), при многократном ингаляционном воздействии - 8,1·10-3 (высокий риск), при пероральном воздействии в дозе 0,1LD50 - 2,5·10-2 (высокий риск). Таким образом, в условиях воздействия металлсодержащих наночастиц применение методов анализа изображений позволяет выполнить количественную оценку риска развития заболеваний со стороны критических органов и систем.
Металлсодержащие наночастицы, факторы риска здоровью, оксид меди, ингаляционная экспозиция, органы-мишени, альвеолярный рисунок, дендритная геометрия, повреждения легких, микроскопия, анализ изображений
Короткий адрес: https://sciup.org/142229587
IDR: 142229587 | УДК: 615.9 | DOI: 10.21668/health.risk/2021.2.11
Текст научной статьи Металлсодержащие наночастицы как факторы риска патоморфологических изменений в тканях внутренних органов в эксперименте
Широкое применение наноматериалов в большом спектре технологий и отраслей промышленности мирового и национального производства оказывает значительное влияние на различные сферы хозяйственной деятельности человека, способствующее их развитию и совершенствованию [1]. Значительная востребованность наноматериалов, в состав которых входят в том числе металлы, связана с уникальными физико-химическими свойствами частиц, обусловленными малым размером, высокой площадью поверхности, формой, поверхностным зарядом и др. В то же время присущие наноматериалам свойства обусловливают их высокую проникающую способность, следствием чего может являться увеличение токсических свойств при поступлении в организм человека на всех этапах производства и потребления продукции [2]. Возрастающее применение металлсодержащих наночастиц обусловливает их активное поступление в объекты окружающей среды и, следовательно, приводит к увеличению риска здоровью населения.
Одним из таких распространенных металлсодержащих наноматериалов является наноразмер-ный оксид меди (наноCuO), широко используемый в производстве продукции различных отраслей народного хозяйства: в качестве компонентов сенсоров (49 %), катализаторов (20 %), поверхностноактивных веществ (6 %), антимикробных средств (4 %), специальных красок (21 %) и других видов продукции [3–8]. В исследованиях [9] доказано, что наноразмерные частицы оксида меди поступают в организм человека преимущественно ингаляционным и пероральным (с питьевой водой) путями. Негативные эффекты со стороны критических органов и систем, вызванные воздействием частиц оксида меди ультрамалых размеров, описаны в исследованиях [10–14]. Представленные данные содержат результаты, которые свидетельствуют, что воздействие наноразмерных частиц оксида меди приводит к токсическим и генотоксическим эффектам как при острой однократной, так и при многократной экспозиции. При этом значительные изменения наблюдаются в тканях легких как при ингаляционном, так и пероральном путях поступления [15]. По степени опасности для человека [13] мик-роразмерные частицы оксида меди относят к умеренно токсичным веществам (3-й класс опасности), что обеспечивает представление о максимально допустимых недействующих значениях концентрации при экспозиции, но этого недостаточно для прогнозирования риска морфофункциональных нарушений со стороны критических органов и систем, в первую очередь легких.
Оценка риска развития морфофункциональных изменений со стороны критических органов в условиях экспозиции металлсодержащими наночастицами проводится в экспериментах с лабораторными животными, используемыми в качестве биологических моделей. Изменения со стороны тканей по гистологическим препаратам классическими методиками в таких экспериментах сопровождаются субъективностью и отсутствием количественных параметров оценки, что осложняет прогнозирование и классифицирование уровней риска развития патоморфологических нарушений. Группа методов, позволяющих наиболее объективно количественно оценить изменения тканей с использованием компьютерного зрения, носит общее название «анализ изображений».
В связи с этим разработка подходов к количественной оценке риска развития негативных эффектов, возникающих со стороны тканей органов-мишеней, в частности легких, при различных путях поступления и кратности воздействия наноразмер-ных частиц с обоснованием наиболее эффективных методов анализа изображений является актуальной.
Цель исследования заключается в выявлении и количественной оценке риска развития заболеваний легких крыс при экспозиции металлсодержащих наночастиц (на примере наноразмерного CuO) с использованием методов анализа изображений.
Материалы и методы. Исследования по выявлению и количественной оценке риска морфофункциональных изменений тканей легких при ингаляционной и пероральной экспозиции металлсодержащими наночастицами выполнены на примере нанодисперсного оксида меди (наноCuO). Использовали порошок нанодисперсного оксида меди II (CAS 1317-38-0) со средним размером частиц 45,86 нм и коэффициентом округлости (сферичности) частиц 0,59 (Sigma-Aldrich, США). Состав и морфометрические характеристики частиц установлены методами растровой электронной микроскопии на сканирующем микроскопе высокого разрешения S-3400N (HITACHI, Япония) и рентгеноспектрального мик-розондового анализа (Bruker, Германия).
Исследование токсического действия нано-размерного оксида меди проводили в условиях ингаляционной (однократно и в течение 14 дней) и пероральной (в течение 20 дней) экспозиции в соответствии с методическими рекомендациями и указаниями1. Для введения использовали водные суспензии, приготовленные на основе бидистилли-рованной воды (ТУ 6-09-2502-77). Перед проведением экспозиции осуществляли предварительную гомогенизацию на ультразвуковой установке
Sonopuls Hd 3200 (Bandelin, Германия) при комнатной температуре в течение 2 мин в режиме непрерывной пульсации с частотой 20 кГц.
Экспериментальной экспозиции подвергали крыс-самцов линии Wistar (всего 60 особей) в возрасте восьми недель массой 180–250 г с соблюдением требований Европейской конвенции по защите позвоночных животных, используемых для экспериментальных или в иных научных целях (ETS № 123) и этического комитета ФБУН «ФНЦ медико-профилактических технологий управления рисками здоровью населения». Между экспозициями животных содержали в соответствии с требованиями СП 2.2.1.3218-142 в полиэтиленовых клетках при температуре 22 °С, относительной влажности воздуха 55 % с 12/12-часовым циклом свет/темнота в виварном помещении. На протяжении эксперимента крыс обеспечили стандартным полнорационным кормом в виде твердых экструдированных гранул и чистой водой.
Для проведения экспериментальных исследований животные были разделены на пять групп по 12 особей в каждой: опытная группа № 1 – экспозиция на-норазмерным оксидом меди ингаляционно однократно; опытная группа № 2 – экспозиция наноразмерным оксидом меди ингаляционно многократно; опытная группа № 3 – экспозиция наноразмерным оксидом меди перорально многократно; группы контроля № 4 и № 5 – экспозиция бидистиллированной водой инга-ляционно и перорально соответственно.
Однократное и многократное ингаляционное воздействие тестируемым материалом проводили в затравочной камере для всего тела (TSE Systems GmbH, Германия) в соответствии с ГОСТ 32646-20143. Объем затравочной камеры составлял 0,1 м3. Подачу суспензии в концентрации 1,25 мг/м3 в форме аэрозоля в камеру осуществляли в обоих случаях методом механической инжекции при помощи форсунки. На протяжении каждой экспозиции в ингаляционной камере поддерживали постоянный приток воздуха со скоростью 10 дм3/мин (концентрация кислорода не менее 19 %, углекислого газа не менее 1 %); скорость подачи водной суспензий наноCuO составила 0,4 см3/мин; отток воздуха – 10 дм3/мин; колебания давления внутри камеры – 0,4 миллибара; температура в камере – 22–25 °С. Фактическая концентрация наноCuO в камере составила 1,17 ± 0,18 мг/м3 (0,001СL50). Длительность однократной экспозиции – 4 ч. Многократную ингаляционную экспозицию осуществляли ежедневно по 6 ч в сутки в течение 14 дней. Многократную пероральную экс- позицию проводили по методу исследования кумуляции по Лиму [16] (ежедневно однократно в течение 20 дней). Начальная доза вводимого вещества согласно методике составила 250 мг/кг веса тела в сутки (0,1 LD50). Последующую дозу каждые пять дней увеличивали в 1,5 раза. Суммарная доза за 20 дней перорального введения составила 1275 мг/кг веса тела в сутки (0,5 LD50). На период экспозиции животные корм и воду не получали.
По завершению экспериментов осуществляли отбор легких в ходе выполнения полной эвисцера-ции по Шору. Легкие после отбора фиксировали в 10%-ном водном нейтральном растворе формалина, после обезвоживали в спиртах восходящей концентрации, затем пропитывали хлороформом и парафином и заливали гомогенизированной парафиновой средой Histomix. Срезы толщиной 4 мкм получали на санном микротоме модели JUNG SM 2000R (Leica, Германия), окрашивали гематоксилином Эрлиха и эозином. Осмотр и получение фотоматериалов проводили на светооптическом микроскопе Ax-iostar (Carl Zeiss, Германия).
Для выявления и количественной оценки морфологических изменений в тканях легких применяли методы анализа изображений на основе компьютерного зрения с использованием универсального программного обеспечения ImageJ-FiJi (ПО с открытым кодом, разработчик Wayne Rasband, National Institutes of Health, USA).
Частоту патоморфологических изменений, не имеющие явных специфических размерных признаков или исчисляемых параметров, оценивали количественно c использованием методов математического анализа. Для этого в ткани легких определяли наличие основных компонентов гистологических изображений:
– элементы первого порядка: негативное пространство, то есть то пространство, которое не заполнено тканевой составляющей, позволяющее оценить размеры и морфологию альвеолярных пространств; морфологические параметры альвеолярных пространств могут длительно не изменяться, а при начальном развитии патоморфологических изменений альвеолярные пространства только сокращаются в размере с сохранением признаков геометрического рисунка [17, 18];
– элементы второго порядка: тканевая масса, которую описывали через плоские фигуры, формирующие альвеолярный рисунок, оцениваемые с позиции дендритной геометрии с помощью следую- щих показателей: отношение средней длины ветви к длине наиболее протяженной ветви, отношение количества пересечений к количеству ветвей и процентная доля тройных и четвертных пересечений по отношению к общему количеству пересечений. Предварительно изображения обрабатывали методами бинаризации и скелетонизации [19, 20];
– элементы третьего порядка: ядра клеток, по расположению которых относительно друг друга можно судить о том, насколько равномерно клетки располагаются в структуре ткани, то есть чем больше патологических изменений, тем больше участков флуктуации, в которых ядра клеток расположены максимально близко друг к другу.
Оценку статистической значимости различий между групповыми показателями проводили методом определения U -критерия Манна – Уитни при заданном уровне значимости 0,05, поскольку данные, получаемые при использовании обозначенных методов анализа изображений, не соответствуют нормальному распределению и могут быть интерпретированы только методами непараметрической статистики. Для проведения статистической оценки применяли программу BioStat 7.0 (Analyst Soft Inc.).
Количественную оценку риска (R) проводили с учетом вероятности (p) и тяжести (q) развития пато- морфологических нарушений в ткани по формуле: R = p·q. Тяжесть нарушений оценивали по средне-взешенному показателю в диапазоне от 0 до 1. Полученные значения риска на уровне до 1·10-6 оценивали как пренебрежимо малый риск, от 1·10-6 до 1·10-4 – низкий риск, от 1·10-4 до 1·10-3 – средний риск, более 1·10-3 – высокий риск4. Оценку проводили по элементам всех перечисленных порядков для всех групп. Риск характеризовали по наибольшему показателю, установленному для каждой экспериментальной группы по анализируемым элементам первого, второго и третьего порядка.
Результаты и их обсуждение . В результате выполненных экспериментальных исследований ингаляционной и пероральной экспозиции наноCuO получены гистологические изображения тканей легких крыс. Примеры изображений легких крыс опытной и контрольной групп представлены на рисунке.
Согласно классической патоморфологической оценке (табл. 1) образцы тканей легких животных из групп контроля № 4 и 5 патологических изменений не имеют. Патоморфологические изменения тканей легких установлены у животных из групп однократного и многократного ингаляционного воздействия (группы № 1 и 2) и группы при пероральном поступлении (группа № 3). В тканях легких животных всех опытных групп, кроме контрольных (№ 4 и 5),
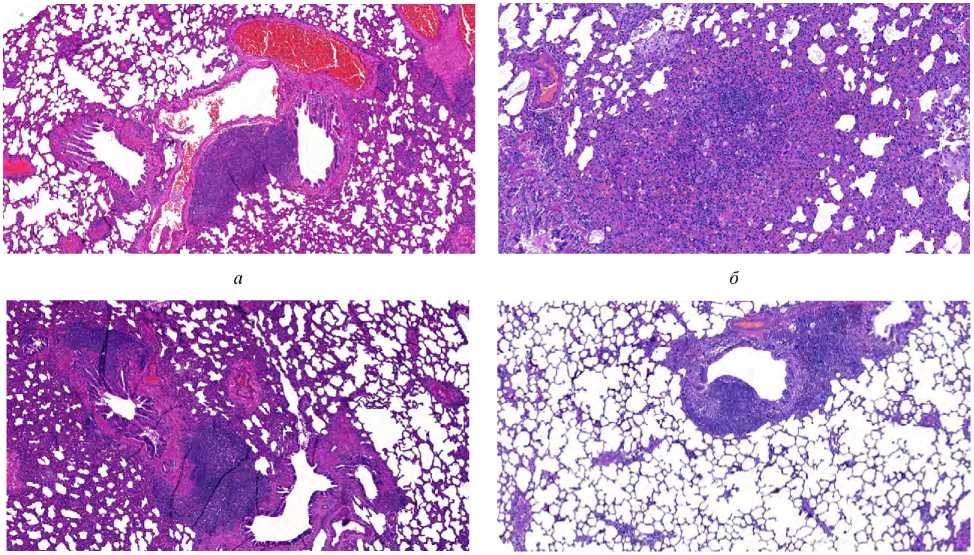
в г
Рис. Ткани легких крыс при экспозиции наноразмерных частиц оксида меди, х 100: а - группа № 1 (ингаляционно однократно); б – группа № 2 (ингаляционно многократно); в – группа № 3 (перорально многократно), г – группа № 4 и 5 (контроль)
Таблица 1
Результаты патоморфологического анализа состояния тканей легких крыс линии Wistar в экспериментах по исследованию воздействия наноCuO
Результаты использования анализа изображений тканей легких при оценке элементов изображений первого порядка представлены в табл. 2.
Результаты исследований наличия в ткани легких элементов изображения первого порядка позволили установить, что показатели групп № 2 и 3, то есть групп многократного ингаляционного и перорального воздействия, статистически достоверно отличаются от соответствующих данных групп контроля № 4 и 5. При этом показатели у животных группы № 1 не отличаются от параметров групп контроля.
Суммарный коэффициент элементов первого порядка (интегральный показатель) в группах многократного ингаляционного и перорального воздействия составил 0,47 ± 0,04 и 0,17 ± 0,08 соответственно, что ниже контрольного показателя в 3,3–9,2
раза. Выявленная тенденция указывает, что частота регистрации и степень выраженности повреждения тканей легких при пероральном поступлении данного вещества выше в 2,0 и в 2,8 раза соответственно, чем при ингаляционном воздействии. Риск развития заболеваний при нарушениях в ткани легких, установленных методом анализа изображений, при ингаляционном воздействии составил в группах 8·10–5 и 2,5·10–4, что характеризуется как низкий и средний риск соответственно, при пероральном воздействии – 5·10–4 (средний уровень риска).
Результаты использования анализа изображений тканей легких при оценке элементов изображений второго порядка представлены в табл. 3.
Использование компьютерного зрения в анализе ткани легких и регистрация элементов изображения второго порядка позволили установить, что показатели отношения общего количества пересечений к общему количеству ветвей и отношения средней длины ветви к длине максимальной в группах № 1, 2 и 3 отличаются от показателей контрольных групп № 4 и 5, но не отличаются между собой. Доли тройных и четвертных пересечений ветвей в 1,8 раза ниже показателей контроля только в группах ингаляционного
Таблица 2
Результаты использования компьютерного зрения в анализе изображений ткани легких крыс линии Wistar при экспозиции наноCuO по элементам первого порядка (уровень значимости 0,05, сравнение по методу Манна – Уитни, U кр ≤ 9)
|
Оцениваемый показатель |
Группа животных |
|||
|
1 |
2 |
3 |
4 и 5 |
|
|
Площадь негативного пространства ( S NS ), % |
49,97 ± 7,55 U = 12,5; p = 0,001 *** U = 4; p = 0,01 |
27,62 ± 7,86 * U = 3; p = 0,007 **** U = 6; р = 0,02 |
15,54 ± 2,48 * U = 1; p = 0,009 ** U = 1; p = 0,011 |
56 ± 5,33 |
|
Площадь тканевой составляющей (100 – S NS ), % |
50,03 ± 12,3 |
72,38 ± 5,59 |
85,46 ± 5,55 |
63,06 ± 10,93 |
|
Суммарный коэффициент элементов первого порядка S NS/ (100 – S NS) |
1,39 ± 0,22 |
*0,47 ± 0,04 р = 0,02 |
*0,17 ± 0,08 p = 0,009 |
1,55 ± 0,13 |
|
Вероятность развития патоморфологиче-ских нарушений в ткани р |
0,08 |
0,25 |
0,50 |
– |
|
Риск развития заболевания R |
8 · 10-5 |
2,5 · 10-4 |
5 · 10-4 |
– |
П р и м е ч а н и е : * – достоверное отличие от показателя группы контроля; ** – достоверное отличие от группы № 1; *** – достоверное отличие от группы № 2; **** – достоверное отличие от группы № 3.
Таблица 3
Результаты использования компьютерного зрения в анализе изображений ткани легких крыс линии Wistar при экспозиции наноCuO по элементам второго порядка (уровень значимости 0,05, сравнение по методу Манна – Уитни, U кр = 9)
|
Оцениваемый показатель |
Группа животных |
|||
|
1 |
2 |
3 |
4 и 5 |
|
|
Отношение общего количества пересечений к общему количеству ветвей |
0,49 ± 0,09 * U = 7; p = 0,002 |
0,48 ± 0,05 * U = 7; p = 0,003 |
0,54 ± 0,03 * U = 8; p = 0,006 |
0,38 ± 0,08 |
|
Отношение средней длины ветви к максимальной длине |
0,19 ± 0,08 * U = 1; p = 0,003 |
0,25 ± 0,09 * U = 2; p = 0,001 |
0,16 ± 0,04 * U = 1; p = 0,001 |
0,54 ± 0,01 |
|
Доля тройных пересечений ветвей, % |
25,56 ± 5,23 * U = 5; p = 0,009 |
23,42 ± 6,27 * U = 5; p = 0,004 |
61,60 ± 5,74 |
48,92 ± 3,47 |
|
Доля четвертных пересечений ветвей, % |
8,56 ± 6,11 * U = 4; p = 0,003 |
10,5 ± 7,43 * U = 4; p = 0,006 |
18,08 ± 4,26 |
14,00 ± 5,86 |
|
Вероятность развития патоморфологиче-ских нарушений в ткани р |
0,08 |
0,66 |
– |
– |
|
Риск развития заболеваний R |
8,0 · 10–4 |
6,6 · 10–3 |
– |
– |
П р и м е ч а н и е : * – достоверное отличие от показателя группы контроля; ** – достоверное отличие от группы № 1; *** – достоверное отличие от группы № 2; **** – достоверное отличие от группы № 3.
Таблица 4
Результаты использования компьютерного зрения в анализе изображений ткани легких при экспозиции наноCuO по элементам третьего порядка (уровень значимости 0,05, сравнение по методу Манна – Уитни, U кр ≤ 236)
|
Оцениваемый показатель |
Группа животных |
|||
|
1 |
2 |
3 |
4 и 5 |
|
|
Среднее количество соседствующих клеток, ед/клетка |
9,6 ± 1,43 U = 368; p = 0,11 |
19,0 ± 2,75 * U = 117; p = 0,099 |
17,0 ± 2,98 * U = 107,5; p = 0,087 *** U = 128; p = 0,088 |
11,66 ± 2,18 |
|
Вероятность развития патоморфологи-ческих нарушений в ткани р |
– |
0,25 |
0,5 |
– |
|
Риск развития заболевания R |
– |
1,2 · 10–2 |
2,5 · 10–2 |
– |
П р и м е ч а н и е : * – достоверное отличие от показателя группы контроля; ** – достоверное отличие от группы № 1; *** – достоверное отличие от группы № 2; **** – достоверное отличие от группы № 3.
воздействия № 1 и 2. При этом между собой значения этих показателей не отличаются, но частота регистрации измененных показателей в два раза выше при многократном воздействии относительно однократного ингаляционного воздействия. Риск развития заболеваний при нарушениях в ткани легких, установленных методом анализа изображений, при ингаляционном воздействии составил в группах № 1 и 2 от 8,0·10–4 до 6,6·10–3, что характеризуется как средний и высокий уровень риска соответственно.
Результаты использования анализа изображений тканей легких при оценке элементов изображений третьего порядка представлены в табл. 4.
Использование компьютерного зрения для идентификации в ткани легких элементов изображения третьего порядка позволило установить, что показатель числа соседствующих клеток в группах № 2 и 3 достоверно отличается от данных контрольных групп № 4 и 5. При этом в группе № 3 с многократным пероральным воздействием тестируемого вещества показатель числа соседствующих клеток в 1,5 раза выше аналогичного показателя контрольной группы, а при ингаляционном воздействии – в 1,7 раза выше. Частота регистрации развития нарушений в ткани в группе при многократном пероральном воздействии в два раза выше показателя в группе при многократном ингаляционном воздействии.
Применение методов анализа изображений для идентификации элементов изображений первого, второго и третьего порядков показало, что имеется вероятность развития патоморфологических нарушений в ткани легких во всех экспериментальных группах, но частота регистрации выявленных нарушений при ингаляционном и пероральном воздействии различна. Так, повреждения ткани легких при пероральном поступлении наноCuO регистрируется в 1,2 раза чаще, чем при многократном ингаляционном воздействии. В совокупности при многократном ингаляционном воздействии нарушения в ткани легких регистрируются в 7,2 раза чаще, чем при однократном воздействии. В результате вероятность развития нарушений с учетом идентификации всех элементов изображений составила от 0,16 до 1,2. Суммарный уровень риска развития заболеваний легких с учетом тяжести идентифицируемых элементов изображения составил при однократном ингаляционном воздействии 1,0·10–3 (средний риск), при многократном ингаляционном воздействии 8,1·10–3 (высокий риск). При многократном пероральном воздействии 2,5·10–2 (высокий риск).
Сопоставительный анализ результатов исследований морфофункциональных изменений в ткани легких и риска развития заболеваний, полученных при использовании методов анализа изображений и классической патоморфологической оценке тканей легких при воздействии наноCuO, показал, что однократное ингаляционное воздействие соответствует среднему уровню риска развития заболеваний легких, что соответствует патоморфологической характеристике изменений в ткани: гиперплазия лимфоидной ткани в стенке бронхов с эозинофилией. Многократное ингаляционное и пероральное воздействие обусловливает высокий уровень риска развития заболеваний, но уровень риска при пероральном воздействии в три раза выше, чем при ингаляционном. Это корреспондируется с патоморфологическими нарушениями в ткани, характеризующими при многократном ингаляционном воздействии очаговое интерстициальное воспаление и альвеолит, а при пероральном воздействии – очаговый гнойно-деструктивный процесс.
Выводы . В условиях воздействия металлсодержащих наночастиц применение методов анализа изображений позволяет по идентификации порядка элементов изображений морфофункциональных изменений в тканях выполнить количественную оценку риска развития заболеваний со стороны критических органов и систем. Количественная оценка риска развития заболеваний, осуществленная с применением методов анализа изображений легких при различной экспозиции как по длительности, так и путям поступления металлсодержащих наночастиц (на примере наноразмерного CuO) позволила установить, что однократное ингаляционное воздействие в концентрации 1,2 мг/м3 (0,001СL50) обусловливает средний риск развития заболеваний легких, а многократное ингаляционное воздействие в течение 14 дней в аналогичной концентрации – высокий риск. Пероральное воздействие в дозе 250 мг/кг веса тела (0,1 LD50) в течение 20 дней обусловливает также высокий риск развития заболеваний легких, но уровень риска при этом в 3,1 раза выше, чем при многократном ингаляционном воздействии.
Финансирование. Исследование не имело спонсорской поддержки.
Список литературы Металлсодержащие наночастицы как факторы риска патоморфологических изменений в тканях внутренних органов в эксперименте
- Benefits and Applications [Электронный ресурс] // Official website of the United States National Nanotechnology Initiative. - URL: https: //www.nano.gov/you/nanotechnology-benefits_(дата обращения: 21.05.2021).
- Dependence of Nanoparticle Toxicity on Their Physical and Chemical Properties / A. Sukhanova, S. Bozrova, P. Sokolov, M. Berestovoy, A. Karaulov, I. Nabiev // Nanoscale Research Letters. - 2018. - Vol. 13, № 44. - 21 p. DOI: 10.1186/s11671-018-2457-x
- An ecological perspective on nanomaterial impacts in the environment / E.S. Bernhardt, B.P. Colman, M.F. Hochella, B.J. Cardinale, R.M. Nisbet, C.J. Richardson, L. Yin // Journal of Environmental Quality. - 2010. - Vol. 39, № 6. - P. 54-65. DOI: 10.2134/jeq2009.0479
- Effects of copper, cadmium, and zinc on the hatching success of brine shrimp (Artemia franciscana) / K.V. Brix, R.M. Gerdes, W.J. Adams, M. Grosell // Archives of Environmental Contamination and Toxicology. - 2006. - Vol. 51, № 4. -P. 580-583. DOI: 10.1007/s00244-005-0244-z
- Failla M.L. Trace elements and host defense: recent advances and continuing challenges // Journal of Nutrition. -2003. - Vol. 133, № 5 (1). - P. 1443S-1447S. DOI: 10.1093/jn/133.5.1443S
- Ameh T., Sayes C.M. The potential exposure and hazards of copper nanoparticles: A review // Environmental Toxicology and Pharmacology. - 2019. - № 71. - P. 103220. DOI: 10.1016/j.etap.2019.103220
- Сутункова М.П. Экспериментальное изучение токсического действия металлосодержащих наночастиц на предприятиях черной и цветной металлургии и оценка риска для здоровья работающих // Гигиена и санитария. - 2017. -Т. 96, № 12. - С. 1182-1187.
- О влиянии наночастиц оксидов металлов на физиологию живых организмов / О.А. Зейналов, С.П. Комбарова, Д.В. Багров, М.А. Петросян, Г.Х. Толибова, А.В. Феофанов, К.В. Шайтан // Обзоры по клинической фармакологии и лекарственной терапии. - 2016. - № 3. - С. 24-33.
- An exposure-response curve for copper excess and deficiency / A. Chambers, D. Krewski, N. Birkett, L. Plunkett, R. Hertzberg, R. Danzeisen, P.J. Aggett, T.B. Starr [et al.] // Journal of Toxicology and Environmental Health Part B. - 2010. -Vol. 13, № 7-8. - P. 546-578. DOI: 10.1080/10937404.2010.538657
- Copper and human health: biochemistry, genetics, and strategies for modeling dose-response relationships / B.R. Stern, M. Solioz, D. Krewski, P. Aggett, T.-C. Aw, S. Baker, K. Crump, M. Dourson [et al.] // Journal of Toxicology and Environmental Health Part B. - 2007. - Vol. 10, № 3. - P. 157-222. DOI: 10.1080/10937400600755911
- Копытенкова О.И., Леванчук А.В., Турсунов З.Ш. Оценка риска для здоровья при воздействии мелкодисперсной пыли в производственных условиях // Медицина труда и промышленная экология. - 2019. - Т. 59, № 8. - С. 458-462.
- Материалы, производимые по нанотехнологиям: потенциальный риск при получении и использовании / Г.Б. Андреев, В.М. Минашкин, И.А. Невский, А.В. Путилов // Российский химический журнал. - 2008. - Т. 52, № 5. - С. 32-38.
- Каркищенко Н.Н. Нанобезопасность: новые подходы к оценке рисков и токсичности наноматериалов // Биомедицина. - 2009. - № 1. - С. 5-27.
- Токсикологическое исследование металлических и металлооксидных наночастиц / И.И. Томилина, В.А. Гре-мячих, Л.П. Гребенюк, Е.И. Головкина, Т.Р. Клевлеева // Труды Института биологии внутренних вод РАН. - 2017. -№ 77 (80). - C. 45-57.
- Copper oxide nanoparticles aggravate airway inflammation and mucus production in asthmatic mice via MAPK signaling / J.W. Park, I.-C. Lee, N.-R. Shin, C.-M. Jeon, O.-K. Kwon, J.-W. Ko, J.-C. Kim, S.-R. Oh // Nanotoxicology. - 2016. -№ 10. - P. 445-452. DOI: 10.3109/17435390.2015.1078851
- Kevin H., Stewart W. Acute, Sub-Acute, Sub-Chronic and Chronic General Toxicity Testing for Preclinical Drug Development // A Comprehensive Guide to Toxicology in Preclinical Drug Development. - 2013. - Chapter 5. - P. 87-105.
- Morphological changes in lung tissues of mice caused by exposure to nano-sized particles of nickel oxide / N.V. Zait-seva, M.A. Zemlyanova, A.M. Ignatova, M.S. Stepankov // Nanotechnologies in Russia. - 2018. - № 7-8. - P. 393-399. DOI: 10.1134/S199507801804016X
- Великородная Ю.И., Почепцов А.Я. Наночастицы как потенциальный источник неблагоприятного воздействия на окружающую среду // Медицина экстремальных ситуаций. - 2015. - Т. 53, № 3. - С. 73-77.
- Ashburner J. A fast-diffeomorphic image registration algorithm // Neuroimage. - 2007. - Vol. 5, № 38 (1). - P. 95-113. DOI: 10.1016/j.neuroimage.2007.07.007
- Roto-translation covariant convolutional networks for medical image analysis / E.J. Bekkers, M.W. Lafarge, M. Veta, K.A. Eppenhof, J.P. Pluim, R. Duits // Medical Image Computing and Computer Assisted Intervention. - 2018. - № 1. - P. 440-448.


