Метастазирование аденокарциномы желудка в тело и шейку матки. Клинический случай
Автор: Протасова А.Э., Семенова И.В., Раскин Г.А., Мухина М.С., Кузьмина Н.С., Орлова Р.В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Клинический случай
Статья в выпуске: 1 т.8, 2018 года.
Бесплатный доступ
Комплексный подход и качественный морфологический анализ являются важными условиями своевременной постановки диагноза и выработки тактики патогенетического лечения онкологических больных. Данный клинический случай демонстрирует мультимодальный подход к дифференциальной диагностике метастатического опухолевого процесса. Благодаря онкологической настороженности, клиническим данным, качественному морфологическому исследованию и тесному взаимодействию всех участников мультидисциплинарной команды был диагностирован метастаз перстневидно-клеточного рака желудка в шейку матки, что позволило оптимизировать лечение больной.
Рак желудка, тело и шейка матки, метастазирование аденокарциномы в шейку матки, гистологическое исследование, иммуногистохимический анализ
Короткий адрес: https://sciup.org/140243781
IDR: 140243781 | DOI: 10.18027
Текст научной статьи Метастазирование аденокарциномы желудка в тело и шейку матки. Клинический случай
В России на долю РЖ среди всех злокачественных опухолей приходится 6,4%, а ежегодно регистрируют около 39 тыс. новых случаев и более 34 тыс. смертей от данного заболевания.
РЖ характеризуется плохим прогнозом. Показатели общей 5-летней выживаемости не превышают 20%, что связано не только с патогенетическими характеристиками опухоли, но и с поздней диагностикой. Показатель несвоевременной диагностики РЖ в нашей стране составляет 40,4%.
Женщины болеют реже. Стандартизованные показатели заболеваемости РЖ среди женского населения в мире – 10 случаев на 100 000 человек в год. В структуре общей онкологической заболеваемости женского населения на РЖ приходится 5,2% случаев. Средний возраст женщин, заболевших РЖ, составляет 69,1 лет. Пик заболеваемости регистрируется в возрастных группах 60–70 лет. В группах 30–59 лет удельный вес РЖ составляет чуть больше 5% (5,2%).
По гистологическому строению в 90% случаев РЖ представлен аденокарциномой, подразделяющейся на кишечный (дифференцированный) и диффузный (недифференцированный) гистологические подтипы (классификация (Lauren, 1965)). Выделяют: папиллярную, тубулярную, муцинозную, перстневидно-клеточную гистологические формы. Перстневидноклеточная опухоль является редким морфологическим типом РЖ. Она отличается агрессивностью, склонностью к диффузному росту и плохим ответом на лечение.
В диагностике РЖ основным методом является видеоэзофагогастродуоденоскопия (ВЭФГДС), позволяющая непосредственно визуализировать опухоль, определить ее размеры, локализацию и выполнить биопсию с последующей морфологической верификацией. Чувствительность и специфичность ВЭФГДС при РЖ превышает 90%.
В случаях диффузно-инфильтративной формы РЖ по-липозиционное рентгеноконтрастное исследование позволяет определить локализацию и протяженность опухолевого поражения, выявить распространение на пищевод и двенадцатиперстную кишку, оценить выраженность стеноза. Рентгенологическое исследование обладает высокой чувствительностью и специфичностью, когда из-за подслизистого роста опухоли результаты ВЭФГДС и биопсии могут быть отрицательными.
Одним из основных показателей, определяющих прогноз РЖ, как и большинства других злокачественных опухолей, является степень распространенности заболевания на момент диагностики.
Наиболее часто метастазирование РЖ происходит в печень, по ходу воротной вены. Возможны метастазы в легкие и другие органы (почки, кости, головной мозг, реже в надпочечники и поджелудочную железу) – гематогенным путем.
При лимфогенном пути метастазы РЖ обнаруживаются в регионарных лимфатических узлах: по ходу левой
Выделяют специфические формы лимфогенного метастазирования: Метастазы Вирхова («Вирховские узлы») – поражение лимфатических узлов левой надключичной области, между ножками грудино-ключично-сосцевидной мышцы; Метастазы Шницлера – в параректальные лимфоузлы; Метастазы Айриша – в подмышечные лимфоузлы; Метастаз сестры Марии Джозеф – в пупок по ходу круглой связки печени; Метастазы Крукенберга – в яичники.
В данном клиническом примере описано метастазирование перстневидно-клеточного РЖ в шейку матки, что является казуистическим случаем и требует онкологической настороженности и мультидисциплинарного подхода в диагностическом поиске и основных методах обследования больных.
Клинический пример
Пациентка А. 42 лет, обратилась к гинекологу в апреле 2017 г. с жалобами на тянущие боли в нижних отделах живота и подъем температуры тела до 38 °С.
Гинекологический анамнез: менархе с 14 лет. Менструальный цикл регулярный по 29 дней, продолжительность 5–7 дней. Всего беременностей – три. Роды – одни (срочные в 1995 г.). Аборт – один в 1998 г., без видимых осложнений. Выкидыш – один, на сроке беременности 9/10 недель в 2001 г., причина не установлена. Гинекологические заболевания: эктропион шейки матки; лейомиома матки, соответствующая 5/6 неделям беременности с 2004 г. без тенденции к росту. Однако по данным УЗИ органов малого таза, выполненном при обращении пациентки, отмечено значительное увеличение размеров матки до 86 x 116 x 91 мм, что соответствует 11-12 неделям беременности.
По данным клинико-лабораторного обследования отмечено увеличение уровня онкомаркеров СА-125 до 128,3 ЕД/мл (референсные значения 0–35 ЕД/мл); НЕ 4–25,2 пмоль/л (норма для возрастной группы 40– 49 лет – до 76,2 пмоль/л). Клинический анализ крови – без признаков анемии: гемоглобин – 127 г/л; СОЭ – 27 мм/ч.
При гинекологическом осмотре, помимо размеров матки (до 12 недель беременности), обращала на себя внимание бочкообразная форма шейки матки, ее плотная консистенция и увеличение в верхней трети. Своды свободные. Паховые лимфатические узлы не увеличены. Цитологическое исследование экто- и эндоцервикса методом жидкостной цитологии не выявило клеточной атипии и соответствовало возрастной норме и секреторной фазе менструального цикла.
Установлен диагноз: многоузловая лейомиома матки (рост узла). Новообразование шейки матки?
Пациентка проконсультирована онкогинекологом, рекомендована магниторезонансная томография (МРТ) органов малого таза, что и было произведено и получено заключение о наличие только признаков лейомиомы матки без патологического изменения структуры шейки матки.
Выполнена диагностическая гистероскопия, фракционный кюретаж, биопсия шейки матки с целью верификации диагноза.
Гистологическое исследование биоптата шейки матки: полиповидный фрагмент фиброзной ткани, покрытый многослойным плоским эпителием типового строения, в строме которого единичные комплексы железистого рака (метастаз?).
При пересмотре гистологических препаратов в онкологической патологоанатомической лаборатории и выполнении иммуногистохимического исследования установлено, что иммунофенотип опухоли и гистоструктура соответствуют метастазу аденокарциномы желудочного типа в тело матки и шейку матки (рис. 1а), так как опухоль экспрессировала cd x 2 (рис. 1б) и была негативна на рецепторы к эстрогенам (рис. 1в).
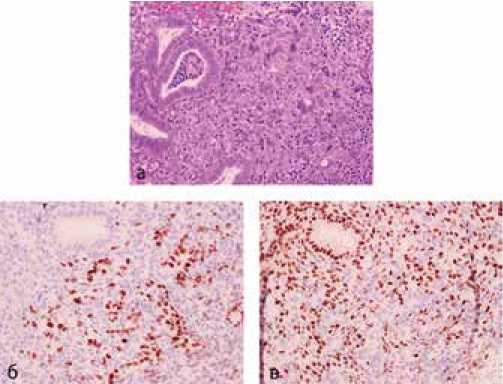
Рисунок 1. Метастаз аденокарциномы желудочного типа в эндометрий: видны атипичные, плохо сформированные железы аденокарциномы (а), позитивные на cd x 2 (б - коричневое окрашивание ядер опухоли и негативные синие ядра стромы и желез эндометрия), негативные на рецепторы к эстрогенам (в – негативная реакция в опухоли, коричневое окрашивание стромы и желез эндометрия), Х 400
По результатам дополнительных методов обследования – компьютерная томография органов грудной клетки и органов брюшной полости, МРТ голоного мозга – других очагов отдаленного метастазирования выявлено не было.
По решению онкологической комиссии, пациентке назначена паллиативная химиотерапия по схеме Доцетаксел 50 мг/м2; Оксалиплатин 85 мг/м2; Фторурацил 2 600 мг/м2. Проведено четыре цикла полихимиотерапии с эффектом частичного регресса. Больная продолжает лечение.
Заключение
Данный клинический случай представлен с целью повышения онкологической настороженности врачей смежных специальностей и необходимости мультидисципли-нарного подхода к обследованию пациентов, проведения морфологической верификации диагноза, оценки распространенности опухолевого процесса и последующем выборе тактики лечения.
Список литературы Метастазирование аденокарциномы желудка в тело и шейку матки. Клинический случай
- Бесова Н. С., Бяхов М. Ю., Горбунова В. А. и др. Клинические рекомендации по диагностике и лечению больных раком желудка. Москва, 2014. 22 с.
- Besova N. S., Byakhov M. Yu., Gorbunova V. A. et al. Klinicheskie rekomendatsii po diagnostike i lecheniyu bol’nykh rakom zheludka. Moscow, 2014. 22 p. (In Russ.)
- Barber M., Fitzgerald R. C., Caldas C. Familial gastric cancer aetiology and pathogenesis. Best Pract. Res. Clin. Gastroen. terol. 2006. P. 721734.
- Bernstein C., Bernstein H., Payne C. M., Dvorak K., Garewal H. Field defects in progression to gastrointestinal tract cancers. Cancer Lett. 2008. Vol. 260. P. 110.
- Состояние онкологической помощи населению России в 2015 году/под редакцией А. Д. Карпина, В. В. Старинского, Г. В. Петровой. М.: МНИОИ им. П. А. Герцена -филиал ФГБУ «НМИРЦ» Минздрава России, 2016. 236 с.
- Sostoyanie onkologicheskoy pomoshchi naseleniyu Rossii v 2015 godu. Eds. A. D. Karpin, V. V. Starinskiy, G. V. Petrova. Moscow: P. A. Hertsen Moscow Oncology Research Center, 2016. 236 p. (In Rus.)
- Parkin D. M. International variation. Oncogene. 2004. Vol. 23. P. 63296340.
- Parkin D. M., Bray F., Ferlay J., Pisani P. Global cancer statistics, 2002. CA Cancer J. Clin. 2005. Vol. 55 (2). P. 74-108.
- Имянитов Е. И. Эпидемиология и биология рака желудка. Практическая онкология. 2009. Т. 10. № 1. С. 1-7.
- Imyanitov E. I. Epidemiologiya i biologiya raka zheludka. Prakticheskaya onkologiya. 2009. Vol. 10. No. 1. P. 1-7. (In Russ.)
- Злокачественные новообразования в России в 2015 году (заболеваемость и смертность)/под ред. А. Д. Карпина, В. В. Старинского, Г. В. Петровой. М.: МНИОИ им. П. А. Герцена -филиал ФГБУ «НМИРЦ» Минздрава России, 2016. 250 с.
- Zlokachestvennye novoobrazovaniya v Rossii v 2015 godu (zabolevaemost’ i smertnost’) Eds. A. D. Karpin, V. V. Starinskiy, G. V. Petrova. Moscow: P. A. Hertsen Moscow Oncology Research Center, 2016. 250 p. (In Rus.)
- Park D. I., Yun J. W., Park J. H., Oh S. J., Kim H. J., Cho Y. K., Sohn C. I., Jeon W. K., Kim B. I., Yoo C. H., Son B. H., Cho E. Y., Chae S. W., Kim E. J., Sohn J. H., Ryu S. H., Sepulveda A. R. HER2/neu amplification is an independent prognostic factor in gastric cance. Dig. Dis. Sci. 2006. Vol. 51. P. 1371-1379.
- Smyth E. C., Verheij M., Allum W., Cunningham D., Cervantes A., Arnold D. Gastric cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology. 2016. Vol. 27. Suppl. 5. P. v38 -v49. doi
- DOI: :10.1093/annonc/mdw350
- Практические рекомендации по лекарственному лечению злокачественных опухолей (RUSSCO)/под ред. В. М. Моисеенко. М.: Общероссийская общественная организация «Российское общество клинической онкологии», 2015. 456 с.
- Prakticheskie rekomendatsii po lekarstvennomu lecheniyu zlokachestvennykh opukholey (RUSSCO). Ed. V. M. Moiseenko. Moscow: Obshcherossiyskaya obshchestvennaya organizatsiya "Rossiyskoe obshchestvo klinicheskoy onkologii", 2015. 456 p. (In Russ.)
- He X.-K., Sun L.-M. The increasing trend in the incidence of gastric cancer in the young population, not only in young Hispanic men. Gastric Cancer. 2017. Vol. 20. P. 1010.
- Cavallo J. Classifying Gastric Cancers by Subtype May Provide Tailored Treatment Options. ASCO-POST. Last updated 27.07.2017.
- Huang Q., Shi J., Feng A. et al. Gastric cardiac carcinomas involving the esophagus are more adequately staged as gastric cancers by the 7th edition of the American Joint Commission on Cancer Staging System. Mod Patho. 2011. Vol. 24. P. 138-146.
- Sano T., Coit D. G., Kim H. H. et al. Gastric Cancer. 2017. Vol. 20. P. 217. https://doi.org/10.1007/s10120-016-0601-9.


