Метод буккальных цитограмм для задач выделения групп риска развития миомы матки у работниц медеплавильного производства
Автор: Сахаутдинова Рената Рашидовна, Бушуева Татьяна Викторовна, Панов Владимир Григорьевич, Адриановский Вадим Иннович, Гурвич Владимир Борисович
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Медико-биологические аспекты оценки воздействия факторов риска
Статья в выпуске: 3 (47), 2024 года.
Бесплатный доступ
Воздействие факторов производственной среды повышает риск развития заболеваний репродуктивной системы. Многолетние исследования показали высокую распространенность миомы матки у женщин, подвергающихся воздействию неблагоприятных факторов на производстве. Появление миомы приводит к снижению работоспособности и качества жизни, осложняясь меноррагиями, болями в области малого таза, бесплодием. При воздействии аэрозолей, содержащих металлы, обладающих мутагенным и канцерогенным эффектами, повышается риск инициации генетических изменений в клетках, играющих ключевую роль в развитии миомы. В качестве объективного индикатора генетического риска может быть применен метод цитологии буккального эпителия. Разработана прогностическая модель оценки риска развития миомы матки у работниц медеплавильного производства, подвергающихся воздействию металлсодержащих аэрозолей, с применением метода буккальных цитограмм. Обследовано 47 работниц медеплавильного предприятия, из них 39 женщин вошли в основную группу. В основной группе миома матки выявлялась чаще, чем в контрольной (25,6 против 0,0 %, р ≤ 0,05). В основной группе достоверно повышены генотоксические показатели: протрузии и микроядра, показатели цитотоксичности (вакуолизация ядра и вакуолизация цитоплазмы увеличены в 1,6 раза, кариолизис - в 1,8 раза, по сравнению с контрольными данными, р ≤ 0,05). Для оценки риска развития миомы матки разработаны две математические модели (М). Первая (М1) включает переменные без ограничений характеристик: микроядра, перинуклеарные вакуоли, вакуолизацию цитоплазмы (AUROC - 0,940); вторая (М2) - обязательно включает генотоксические параметры: микроядра, протрузии (AUROC - 0,883). Наибольшей значимостью обладает 4-членная модель (М1 + М2), включающая как генотоксические показатели: микроядра, протрузии, так и цитотоксические: двухъядерные клетки, вакуолизация цитоплазмы (AUROC - 0,998). Результаты свидетельствуют о реализации генетического и цитотоксического механизма развития миомы у работниц, подвергающихся воздействию промышленных аэрозолей, содержащих токсические металлы. Наибольшей прогнозной значимостью обладают модели, одновременно включающие два показателя генотоксичности (микроядра и протрузии) и 1-2 показателя цитотоксичности.
Буккальный эпителий, цитология, миома матки, микроядерный тест, цитогенетический индекс, генотоксичность, цитотоксичность, протрузии
Короткий адрес: https://sciup.org/142242523
IDR: 142242523 | УДК: 613.60-055.2: | DOI: 10.21668/health.risk/2024.3.11
Текст научной статьи Метод буккальных цитограмм для задач выделения групп риска развития миомы матки у работниц медеплавильного производства
Сахаутдинова Рената Рашидовна – кандидат медицинских наук, заведующий ДЛО НПО лабораторно-диагностических технологий (e-mail: ; тел.: 8 (343) 253-14-58; ORCID: .
Бушуева Татьяна Викторовна – кандидат медицинских наук, старший научный сотрудник, заведующий НПО лабораторно-диагностических технологий (e-mail: ; тел.: 8 (343) 253-14-58; ORCID: .
Панов Владимир Григорьевич – кандидат физико-математических наук, ведущий научный сотрудник (e-mail: ; тел.: 8 (343) 362-35-14; ORCID: .
Адриановский Вадим Иннович – кандидат медицинских наук, старший научный сотрудник лаборатории эпидемиологии и профилактики рака отдела медицины труда (е-mail: ; тел.: 8 (343) 253-14-56; ORCID: .
Гурвич Владимир Борисович – доктор медицинских наук, научный руководитель (e-mail: ; тел.: 8 (343) 253-87-54; ORCID: .
Сохранение репродуктивного здоровья работающих женщин является одной из приоритетных задач. Воздействие промышленных токсикантов относят к экзогенным факторам риска развития заболеваний репродуктивной системы, особенно при нарушении гормонального баланса, ожирении, хронических воспалительных заболеваниях гениталий и низком паритете [1, 2]. Миома диагностируется в 60–70 % случаев всех патологий матки. У женщин трудоспособного возраста регистрируется наиболее высокий уровень заболеваемости и максимальная частота гистерэктомий [3]. По данным литературы, миома матки имеет тенденцию к «омоложению» [4]. Эпидемиология заболевания сильно недооценена, поскольку высокий процент случаев имеет бессимптомную стадию течения. Большое внимание при изучении рисков для репродуктивной системы уделяется механизмам репротоксичности меди и свинца [5]. Продолжает активно изучаться патогенетическая роль промышленных токсикантов, оказывающих мутагенный и канцерогенный эффекты, в развитии новообразований репродуктивной системы, так как хромосомные и генные мутации выявляются в 90 % случаев [6, 7]. Хромосомные нарушения коррелируют с фенотипом опухоли. В настоящее время при скрининговых обследованиях как в гигиенической практике, так и при проведении экспериментальных работ используют неинвазивные краткосрочные тесты, обладающие достаточной информативностью. Цитологическое состояние буккального эпителия является биологическим индикатором состояния организма, который изменяется при неблагоприятных воздействиях химической и биологической природы в условиях производства [8–14]. Известно, что функциональные патологические изменения буккального эпителия коррелируют с показателями нарушения гомеостаза организма, а также могут выступать в качестве маркеров предопухолевого состояния. С 2007 г. создан и действует проект HUMNxL по применению микроядерного теста на эксфолиативных клетках [15]. Метод буккальных цитограмм доступен для прижизненного гистологического исследования, может служить источником важной диагностической и прогностической информации о состоянии здоровья, стрессовых воздействиях, влиянии факторов производственной среды, а также в области онкологии, стоматологии и фармакологии [16, 17]. По данным литературы, метод исследования буккальных цитограмм широко используется для оценки микроядер у рабочих, профессионально подвергающихся воздействию потенциально канцерогенных агентов [18–21]. Согласно последним данным о ведущей роли генетического механизма развития миомы матки, обоснование диагностических критериев на основе цитогенетических изменений может быть полезным для ранней диагностики заболевания у женщин, контактирующих с промышленными токсикантами.
Цель исследования – разработать прогностическую модель оценки риска развития миомы матки у работниц медеплавильного производства, подвергающихся воздействию металлсодержащих аэрозолей, с применением метода буккальных цитограмм.
Материалы и методы. Обследовано 47 работниц медеплавильного предприятия. Сформировано две группы. Основная группа – 39 человек (возраст – 48,7 ± 1,7 г., стаж 14,8 ± 0,5 г.), работают в контакте с вредными факторами, ведущим из которых является промышленный аэрозоль сложного химического состава, состоящий из меди, свинца, никеля, железа, кремния диоксида, мышьяка и др. Представлены профессии: машинист крана, аппаратчик гидрометаллургии, аппаратчик в производстве редких металлов. По данным специальной оценки условий труда (СОУТ), машинист крана отделения анодов медеплавильного производства контактирует с аэрозолем, содержащим медь, фактический уровень фактора (1,58 мг/м3) в 3 раза превышает ПДК (0,5 мг/м3, класс условий труда (КУТ) 3.2), никель и его оксиды (0,058 мг/м3) в 1,16 раза выше ПДК (0,05 мг/м3, КУТ 3.1), кремния диоксид (уровень не превышает ПДК, КУТ 2.0). Аппаратчики гидрометаллурги купоросного цеха медного отделения подвергаются воздействию солей никеля в виде гидроаэрозоля (фактический уровень – 0,006 мг/м3, КУТ 3.2), меди и серной кислоты (фактический уровень не превышает ПДК, КУТ 2), аппаратчики участка переработки шламов в производстве редких металлов химикометаллургического отделения контактируют с никелем и его оксидами, свинцом и его неорганическими соединениями, кадмием и его неорганическими соединениями (фактический уровень не превышает ПДК, КУТ 2; уровень серной кислоты (1,8 мг/м3) в 1,8 раза превышает среднесменную ПДК (1,0 мг/м3), КУТ 3.1). Вышеперечисленные промышленные токсиканты обладают доказанным канцерогенным действием (кадмий, свинец, никель, серная кислота) и могут оказывать неблагоприятное влияние на репродуктивную систему (медь, свинец). Группа контроля – 8 человек, сотрудницы административного аппарата (возраст – 40,1 ± 0,92 г., стаж – 9,25 ± 0,64 г.), не подвергающиеся воздействию химических токсикантов.
Соскоб клеток буккального эпителия осуществляли с внутренней поверхности щеки. Материал с цитощетки равномерным слоем переносили на предметное стекло, высушивали естественным путем, окрашивали по Паппенгейму. Анализ препаратов осуществляли под микроскопом Primo Star (Carl Zeiss) при увеличениях 16×40 и 16×100. Подсчет проводили на 1000 клеток. Оценивались показатели: цитогенетические, пролиферации и деструкции ядра. Результат выражали в промилле (‰) [22]. Для оценки риска возникновения цитогенетических аномалий в клетках буккального эпителия в группах рассчитан индекс накопления цитогенетических нарушений (Iac – index of accumulation of cytogenetic damage) по формуле, представляющей собой произведение интегрального показателя цитогенетических нарушений (Ic – cytogenetic index) и интегрального показателя пролиферации (Ip – index of proliferation), деленное на апоптотический индекс (Iapop – apoptotic index):
Iac = ( Ic · Ip / Iapop ) · 100, (1)
где Ic – сумма клеток с микроядрами и протрузиями; Ip – сумма клеток с двумя и более ядрами; Iapop – сумма всех клеток в апоптозе (конденсация хроматина, кариопикноз, кариорексис, кариолизис, апоптотиче-ские тела). На основании индекса накопления цитогенетических нарушений группы риска классифицируют следующим образом: Iac ≤ 2 – низкий, 2 < Iac < 4 – умеренный, Iac ≥ 4 – высокий уровень риска [15].
При статистическом анализе использовали пакет Statistica 6.0. Достоверность различий оценивали с помощью непараметрического критерия Манна – Уитни. Для выявления цитологических признаков, имеющих диагностическую ценность, использовали ROC-анализ.
Для решения вопроса влияния накопленных цитогенетических нарушений на риск развития миомы матки у женщин, работающих в условиях воздействия металлсодержащих аэрозолей, разработана прогностическая модель бинарной классификации, включающая логистическую регрессию с линейной зависимостью от заданных переменных (формула (2)) или с линейной зависимостью с добавлением перекрестных членов (формула (3)):
y = exp ( b 0 + b l x 1 + + b n x n )
1 + exP ( Ь 0 + b 1 x l + ■ + b„ x „ ) ’
exP ( b 0 + b1 x 1 + ■ + ЬЛ + b 12 x l x 2 + b13 x l x 3 + ■ b n - 1 . x . - 1 x . ) , (3)
-
1 + exP ( b 0 + b 1 x l + ■ + b . x . + b 12 x l x 2 + b 13 x l x 3 + ■ b. - 1 n x . - 1 x . )
где y – индикаторная переменная, показывающая вероятность наличия ( у = 1) или отсутствия ( у = 0) миомы матки; x1 , x2 ,…, xn – независимые переменные – цитогенетические показатели; b 0 , b 1 … b n – теоретические коэффициенты.
При этом рассматривались модели от трех и четырех переменных, поскольку при одинаковом качестве моделей следует предпочесть модель с меньшим числом переменных. Критерием качества модели (2) или (3) выбран показатель отношения правдоподобий McFadden’a (или коэффициент псев-до-R2 McFadden’a). Ниже он будет обозначаться pR2. Для этого показателя модели со значениями pR2 = 0,2–0,4 считаются уже эффективными. Обязательным условием выбора эффективной модели являлось включение цитогенетических показателей – микроядра и протрузии, не исключая введения в расчеты цитотоксических аномалий.
Результаты и их обсуждение. В основной группе миома матки выявлялась достоверно чаще, чем в контрольной (25,6 % против 0, р ≤ 0,05). Учитывая тот факт, что миома – это полиэтиологиче-ское заболевание и роль генетического фактора на современном этапе точно не установлена, актуальным является выбор показателей цитограммы, которые, в первую очередь, свидетельствуют о генетическом риске. На первом этапе анализа полученных результатов проведено сравнение изменений цитогенетического статуса у всех работниц. Как видно из табл. 1, у женщин, контактирующих с вредными факторами, выявлено увеличение генотоксических показателей: микроядра (в 2,2 раза) и протрузии (в 1,8 раза) ( р < 0,05). Получено увеличение двуядерных клеток в 1,3 раза в препаратах буккальных цитограмм в основной группе ( р < 0,05). У всех обследованных женщин в основной группе получены изменения ранней и поздней деструкции ядра и цитоплазмы по сравнению с группой контроля. Выявлено увеличение показателей вакуолизации ядра и вакуолизации цитоплазмы в 1,6 раза, а кариолизис – в 1,8 раза. Показатель конденсации ядра в 1,3 раза выше в сравнении с группой контроля. Полученные данные свидетельствуют о цитотоксическом эффекте.
Индекс накопления цитогенетических нарушений в основной группе составил 3,3, что соответствует группе умеренного риска (2 < Iac < 4), по сравнению с контролем – 1,7.
Для оценки генотоксического риска развития миомы матки была выбрана прогностическая модель на основе выявленных цитогенетических аномалий.
Таблица 1
Цитограмма буккального эпителия у женщин, работающих при воздействии вредных факторов производства, и группы контроля без воздействия (‰)
|
Показатель |
Группа контроля, n = 8 |
Основная группа, n = 39 |
|
Микроядра |
1,88 ± 0,23 |
4,00 ± 0,12 * |
|
Протрузии |
3,13 ± 0,44 |
5,72 ± 0,20 * |
|
Двуядерные клетки |
2,63 ± 0,26 |
3,67 ± 0,15 * |
|
Перинуклеарная вакуоль |
1,25 ± 0,16 |
1,56 ± 0,09 |
|
Конденсация ядра |
3,88 ± 0,30 |
5,21 ± 0,20 * |
|
Вакуолизация ядра |
3,88 ± 0,40 |
6,59 ± 0,19 * |
|
Вакуолизация цитоплазмы |
4,50 ± 0,33 |
7,59 ± 0,20 * |
|
Кариолизис |
2,75 ± 0,25 |
4,97 ± 0,19 * |
Примечание: * – отмечены величины, статистически значимо отличающиеся от контрольной группы ( p < 0,05).
Таблица 2
Показатели качества бинарного классификатора на основе логистической регрессии от трех переменных при выборе наилучшей модели на основе показателя pR 2 без ограничения переменных (модель М1) и с участием переменных «Микроядра» и «Протрузии» (модель М 2 )
|
Характеристика |
Лучший набор |
|
|
M 1 |
M 2 |
|
|
микроядра, перенуклеарная вакуоль, вакуолизация цитоплазмы |
микроядра, протрузии, двухъядерные клетки |
|
|
pR 2 |
0,570 |
0,383 |
|
AUROC |
0,940 |
0,883 |
|
Чувствительность (TPR) |
0,900 |
0,800 |
|
Специфичность (TNR) |
0,828 |
0,759 |
|
Корреляция Мэтьюса |
0,662 |
0,501 |
|
Диагностическое отношение шансов |
43,200 |
12,571 |
|
Индекс Юдена |
0,728 |
0,559 |
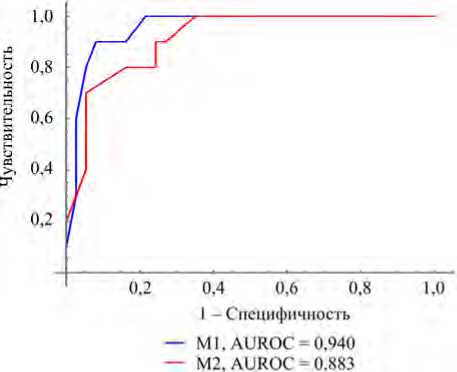
Рис. 1. ROC-кривые для моделей М1 и М2 из табл. 2
При сравнительном анализе двух моделей на основе логистической регрессии от трех переменных, сводные характеристики которых приведены в табл. 2, наилучшая модель без выбора ограничений переменных имеет значение коэффициента детерминации McFadden’a 0,570, а для наборов с участием переменных «микроядра» и «протрузии» pR 2 = 0,383. При этом площадь под ROC-кривой соответственно равна 0,940 и 0,883 (рис. 1).
Несмотря на различия коэффициентов детерминации, характеристики моделей, включающие и не включающие генотоксические показатели, достаточно близки. Что можно рассматривать как целесообразность обязательного включения специфических показателей генотоксического действия в модель определения риска развития миомы матки у изучаемого контингента.
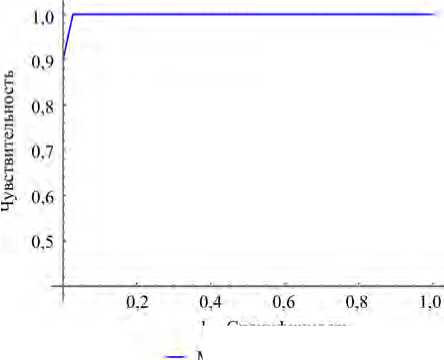
При включении в модель четырех переменных коэффициент детерминации обладает небольшой значимостью (для наилучшей модели pR2 = 0,105), а при включении двух показателей генотоксичности и двух показателей цитотоксичности коэффициент детерминации значительно улучшается (для наилучшей модели от четырех переменных, выбираемых из всех предикторов, pR2 = 0,938). Таким обра- зом, данная модель обладает наибольшей диагностической ценностью (рис. 2). Характеристика модели представлена в табл. 3.
Таблица 3
Показатели качества бинарного классификатора на основе логистической регрессии от четырех переменных при выборе наилучшей модели на основе показателя pR 2 без ограничения переменных (модель М 1 ) и с участием переменных «Микроядра» и «Протрузии» (модель М 2 )
|
Характеристика |
Лучший набор |
|
M1 = M2 |
|
|
микроядра, протрузии, двухъядерные клетки, вакуолизация цитоплазмы |
|
|
pR 2 |
0,938 |
|
AUROC |
0,998 |
|
Чувствительность (TPR) |
1,000 |
|
Специфичность (TNR) |
0,966 |
|
Корреляция Мэтьюса |
0,937 |
|
Диагностическое отношение шансов |
+ ∞ |
|
Индекс Юдена |
0,966 |
I Специфичность
Ml. AUROC =0.998
Рис. 2. ROC-кривая для модели М1 = М2 из табл. 3
Одним из факторов риска для репродуктивного здоровья женщин на медеплавильном производстве является аэрозоль сложного химического состава. Известно, что свинец, никель и кадмий, входящие в состав аэрозоля, имеют как мутагенные, так и репро-токсикантные свойства, вызывая индукцию хромосомных аберраций в соматических и половых клетках [23]. По данным литературы, воздействие высокими концентрациями меди вызывает увеличение частоты аберраций митоза в клетках. Повышенные экспозиции соединений никеля, обладающие еще и кластогенным действием, приводят к образованию микроядер. Механизм действия основан на разрыве ДНК и образовании ДНК-белковых связей. Также отмечаются увеличение частоты обмена сестринских хроматид и хромосомные аберрации. Кадмий и его соединения вызывают повышение частоты микроядер и хромосомных аберраций. К некоторым механизмам воздействия относят ингибирование ДНК-репарационных систем, влияние на клеточную пролиферацию и на функции супрессоров опухолей. При воздействии серной кислоты происходит связывание с молекулами ДНК, что приводит к нарушению деления цепей ДНК. Так как миома матки является полиэтиологич-ным заболеванием, одним из механизмов в развитии которой является молекулярно-генетический, актуальным остается изучение генотоксических свойств вышеперечисленных химических токсикантов на клетки миометрия и эндометрия. По данным зарубежных авторов, медь и свинец оказывают негативное влияние на функциональность эндометрия, ставя под угрозу процесс децидуализации и нарушая регенерацию эндометрия и адгезию эмбрионов, повышают риск развития рака эндометрия [24]. Также доказана взаимосвязь между объемами миоматозных узлов и концентрацией кадмия и его соединений в крови [25]. Никель и его соединения оказывают влияние на клетки эндометрия, повышая риск развития эндометриоза. В данном аспекте стоит акцентировать внимание на том, что микроядерный тест буккального эпителия выявляет микроядра в клетках, которые образуются непосредственно при повреждении ДНК при контакте с промышленными химическими токсикантами. Известно, что существует два типа микроядер по механизму образования: первый – в результате повреждения ДНК (представляет фрагмент хромосомы), второй – результат повреждения веретена деления в виде одной и более целой хромосомы, что может свидетельствовать как о генных, так и о геномных нарушениях. Полученные нами результаты, указывающие на увеличение числа цитогенетических нарушений, таких как микроядра и протрузии у работниц медеплавильного производства, не противоречат данным, описанным в ранее проведенных исследованиях, и еще раз подтверждают генотоксические свойства промышленных токсикантов, что может быть фактором риска развития миомы матки. Увеличение частоты двуядерных клеток у работниц также связано с токсическим воздействием химиче- ских соединений. Также известно, что образование двуядерных клеток происходит в результате деления ядра без деления цитоплазмы, при этом увеличивается их плоидность. Частота двуядерных клеток является индикатором пролиферативной активности [26]. Таким образом, заложенные в модель прогноза переменные, такие как микроядра и протрузии, могут играть ведущую роль в выявлении факторов риска развития миомы матки. Однако экспозиция химическими промышленными токсикантами способна формировать как приобретенные цитотоксические эффекты, так и приводить к реализации врожденных генотоксических эффектов. Полученные нами данные по увеличению клеток с ранней и поздней деструкцией позволяют дополнительно использовать эти переменные для оценки риска развития патологии эндометрия. В связи с тем что миома матки является мультифакторным заболеванием, роль эндокринной системы в механизмах ее развития одна из ведущих. Тяжелые металлы, входящие в состав промышленного аэрозоля, оказывают токсическое воздействие на гипоталамо-гипофизарную систему организма. Однако механизмы гено- и цитотоксического действия аэрозолей тяжелых металлов окончательно не изучены [27]. Таким образом, результаты исследования могут быть использованы для задач выделения групп риска развития миомы матки работниц, контактирующих с вредными химическими факторами на производстве. Представленная методология использования буккальных цитограмм для задач выделения групп риска развития миомы матки у работниц медеплавильного производства, а также полученные в настоящем исследовании результаты подтверждают выдвинутое нами в качестве гипотезы предположение, что гено- и цитотоксичность вредных производственных факторов в отношении клеток буккального эпителия представляет собой близкие по механизму эффекты развивающихся патологических процессов в тканях миометрия, что позволяет их экстраполировать. Включение данных цитогенетического и гормонального статуса в разработанную модель прогноза риска развития миомы матки является актуальным и значимым для задач формирования групп риска развития нарушений здоровья у работниц, подвергающихся воздействию аэрозолей, содержащих мутагенные и репротоксичные элементы.
Выводы:
-
1. Генотоксические и цитотоксические показатели в цитограмме буккального эпителия встречаются достоверно чаще у женщин, подвергающихся воздействию промышленных аэрозолей, содержащих мутагенные и репротоксичные элементы, по сравнению с контролем.
-
2. Риск развития миомы матки может быть рассчитан с применением математической модели, включающей генотоксические и цитотоксические показатели.
-
3. Расчет параметров модели, включающей генотоксические показатели прогноза и, прежде всего,
-
4. Целесообразно продолжить исследование в данном направлении с введением в модели показателей гормонального статуса.
-
5. Данные модели актуальны для задач формирования групп риска развития нарушений здоровья
такие переменные, как микроядра и протрузии, играет решающую роль в идентификации факторов риска развития миомы матки.
у работниц, подвергающихся воздействию аэрозолей, содержащих мутагенные и репротоксичные элементы.
Финансирование. Исследование не имело спонсорской поддержки.
Список литературы Метод буккальных цитограмм для задач выделения групп риска развития миомы матки у работниц медеплавильного производства
- Этиология, патогенез и морфологические варианты миомы матки (обзор литературы) / Н.С. Аверкин, М.Г. Федорова, Ж.С. Вишнякова, О.П. Евсеева, Т.В. Пряженцева // Известия высших учебных заведений. Поволжский регион. Медицинские науки. - 2023. - № 3 (67). - С. 172-187. DOI: 10.21685/2072-3032-2023-3-17
- The adverse role of endocrine disrupting chemicals in the reproductive system / J. Pan, P. Liu, X. Yu, Z. Zhang, J. Liu // Front. Endocrinol. - 2024. - Vol. 14. - P. 1324993. DOI: 10.3389/fendo.2023.1324993
- Доброхотова Ю.Э., Ильина И.Ю. Миома матки у пациенток пременопаузального периода // Медицинский совет. - 2019. - № 13. - С. 123-128. DOI: 10.21518/2079-701X-2019-13-123-128
- Кудрина Е.А., Бабурин Д.В. Миома матки: современные аспекты патогенеза и лечения (клиническая лекция) // Архив акушерства и гинекологии им. В.Ф. Снегирева. - 2016. - Т. 3, № 1. - С. 4-10. DOI: 10.18821/2313-8726-2016-3-1-4-10
- Нарицына Ю.Н., Липатов Г.Я., Адриановский В.И. К вопросу о распространенности предопухолевых заболеваний и опухолей половой сферы среди женщин, занятых на разных этапах получения рафинированной меди // Фундаментальные исследования. - 2006. - № 12. - С. 85-86.
- Миома матки: взгляд на проблему / Р.А. Карамян, И.М. Ордиянц, В.А. Хорольский, Д.Р. Асатрян // Медицинский вестник Юга России. - 2022. - Т. 13, № 2. - С. 18-25. DOI: 10.21886/2219-8075-2022-13-2-18-25
- Machado-Lopez A., Simón C., Mas A. Molecular and cellular insights into the development of uterine fibroids // Int. J. Mol. Sci. - 2021. - Vol. 22, № 16. - P. 8483. DOI: 10.3390/ijms22168483
- Цитогенетические маркеры и гигиенические критерии хромосомных нарушений у населения и работников в условиях воздействия химических факторов с мутагенной активностью (на примере металлов, ароматических углеводородов, формальдегида) / Н.В. Зайцева, М.А. Землянова, В.Б. Алексеев, С.Г. Щербина. - Пермь: Книжный формат, 2013. - 222 с.
- Цитоморфологический анализ эксфолиативных клеток буккального эпителия у работников, имеющих контакт с пестицидами / Н.А. Илюшина, Ю.В. Демидова, М.А. Макарова, А.Г. Илюшин, О.В. Егорова, И.В. Березняк, Ю.А. Ре-вазова // Токсикологический вестник. - 2021. - Т. 29, № 4. - С. 22-29. DOI: 10.36946/0869-7922-2021-29-4-22-29
- The micronucleus test for the oral mucosa: Global trends and new questions / M. Benvindo-Souza, R.A. Assis, E.A. Santos Oliveira, R.E. Borges, L.R. de Souza Santos // Environ. Sci. Pollut. Res. Int. - 2017. - Vol. 24, № 36. - P. 27724-27730. DOI: 10.1007/s11356-017-0727-2
- Is micronucleus assay in oral exfoliated cells a suitable tool for biomonitoring children exposed to environmental pollutants? A systematic review / I.T. Malacarne, D.V. De Souza, M.E. Suarez Alpire, A.C.F. Souza, A.C.M. Renno, D.A. Ribeiro // Environ. Sci. Pollut. Res. Int. - 2021. - Vol. 28, № 46. - P. 65083-65093. DOI: 10.1007/s11356-021-16810-1
- Ермолаева С.В., Иванов Е.О. Анализ цитогенетического статуса детей и подростков, проживающих на территориях с разной экологической обстановкой // Теоретическая и прикладная экология. - 2022. - № 2. - С. 234-240. DOI: 10.25750/1995-4301-2022-2-234-240
- Lung cancer risk among bricklayers in a pooled analysis of case-control studies / D. Consonni, S. De Matteis, A.C. Pesa-tori, P.A. Bertazzi, A.C. Olsson, H. Kromhout, S. Peters, R.C.H. Vermeulen [et al.] // Int. J. Cancer. - 2015. - Vol. 136, № 2. -P. 360-371. DOI: 10.1002/ijc.28986
- The HUman MicroNucleus project on eXfoLiated buccal cells (HUMN (XL)): The role of life-style, host factors, occupational exposures, health status, and assay protocol / S. Bonassi, E. Coskun, M. Ceppi, C. Lando, C. Bolognesi, S. Burgaz, N. Holland, M. Kirsh-Volders [et al.] // Mutat. Res. - 2011. - Vol. 728, № 3. - P. 88-97. DOI: 10.1016/j.mrrev.2011.06.005
- Сычева Л.П. Цитогенетический мониторинг для оценки безопасности среды обитания человека // Гигиена и санитария. - 2012. - № 6. - С. 68-72.
- Буккальный эпителий как отражение физиологических и патофизиологических процессов / А.Г. Прошин, Н.А. Дурнова, В.Н. Сальников, М.Н. Курчатова, Н.В. Сальников // Вестник медицинского института «Реавиз»: реабилитация, врач и здоровье. - 2019. - № 1 (37). - С. 74-78.
- Возрастные особенности буккального эпителия практически здоровых людей / В.В. Базарный, Ю.В. Мандра, А.П. Сиденкова, Л.Г. Полушина, А.Ю. Максимова, Е.А. Семенцова, Е.Н. Светлакова, Н.Ю. Насретдинова, А.Ю. Котикова // Клиническая лабораторная диагностика. - 2022. - Т. 67, № 6. - C. 345-349. DOI: 10.51620/0869-2084-2022-67-6-345-349
- Micronucleus assay in exfoliated buccal epithelial cells using liquid based cytology preparations in building construction workers / P. Arul, S. Smitha, S. Masilamani, S. Akshatha // Iran J. Pathol. - 2018. - Vol. 13, № 1. - P. 30-37.
- Buccal micronucleus assay in human populations from Sicily (Italy) exposed to petrochemical industry pollutants / S. Federico, V. Vitale, N. La Porta, S. Saccone // Environ. Sci. Pollut. Res. Int. - 2019. - Vol. 26, № 7. - P. 7048-7054. DOI: 10.1007/s11356-019-04193-3
- Evaluation of micronucleus in exfoliated buccal epithelial cells using liquid-based cytology preparation in petrol station workers / P. Arul, S. Shetty, S. Masilamani, C. Akshatha, B.J.N. Kumar // J. Indian J. Med. Paediatr. Oncol. - 2017. -Vol. 38, № 3. - P. 273-276. DOI: 10.4103/ijmpo.ijmpo_26_16
- Early genotoxic damage through micronucleus test in exfoliated buccal cells and occupational dust exposure in construction workers: A cross-sectional study in L'Aquila, Italy / S. Leonardi, A.M. Poma, S. Colafarina, F. D'Aloisio, M. Scatigna, O. Zarivi, R. Mastrantonio, L. Tobia, L. Fabiani // Ecotoxicol. Environ. Saf. - 2020. - Vol. 203. - P. 110989. DOI: 10.1016/j.ecoenv.2020.110989
- Калаев В.Н, Артюхов В. Г., Нечаева М.С. Частота встречаемости клеток с морфологически аномальными ядрами в буккальном эпителии человека при разных способах окрашивания // Цитология. - 2012. - Т. 54, № 1. - С. 78-84.
- Metals exposures and DNA methylation: Current evidence and future directions / E.R. Elkin, C. Higgins, M.T. Aung, K.M, Bakulski // Curr. Environ. Health Rep. - 2022. - Vol. 9, № 4. - P. 673-696. DOI: 10.1007/s40572-022-00382-4
- Copper and lead exposures disturb reproductive features of primary endometrial stromal and epithelial cells / S. Pérez-Debén, R. Gonzalez-Martin, A. Palomar, A. Quiñonero, S. Salsano, F. Domínguez // Reprod. Toxicol. - 2020. -Vol. 93. - P. 106-117. DOI: 10.1016/j.reprotox.2020.01.008
- Blood cadmium and volume of uterine fibroids in premenopausal women / S. Ye, H.W. Chung, K. Jeong, Y.-A. Sung, H. Lee, S.Y. Park, H. Kim, E.-H. Ha // Ann. Occup. Environ. Med. - 2017. - Vol. 29. - P. 22. DOI: 10.1186/s40557-017-0178-8
- Петрашова Д.А. Цитогенетические особенности буккального эпителия у школьников старшего возраста, проживающих в высоких и средних широтах // Клиническая лабораторная диагностика. - 2019. - Т. 64, № 4. - С. 229-233. DOI: 10.18821/0869-2084-2019-64-4-229-233
- Effects of endocrine-disrupting heavy metals on human health / D. Liu, Q. Shi, C. Liu, Q. Sun, X. Zeng // Toxics. -2023. - Vol. 11, № 4. - P. 322. DOI: 10.3390/toxics11040322


