Метод диагностики рака легкого человека с помощью одноцепочечных ДНК-олигонуклеотидов
Автор: Замай Татьяна Николаевна, Замай Галина Сергеевна, Замай Анна Сергеевна, Коловская Ольга Сергеевна, Малышева Елена Александровна, Савицкая Анна Геннадьевна, Крат Алексей Васильевич, Бельтюков Виктор Константинович, Модестов Андрей Арсеньевич, Попов Дмитрий Владимирович, Петрова Людмила Львовна, Труфанова Людмила Васильевна, Зубкова Ольга Александровна, Спивак Екатерина Александровна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Влияние экологии на внутренние болезни
Статья в выпуске: 5-2 т.14, 2012 года.
Бесплатный доступ
Работа посвящена описанию метода диагностики рака легкого человека с помощью одноцепочечных ДНК-олигонуклеотидов, специфичных к опухолевой ткани легкого человека, полученных методом технологии cell-SELEX. Исследования показали, что короткие однонитевые ДНК способны выявлять в плазме крови онкобольных продукты распада опухолевой ткани и могут быть использованы для диагностики рака легкого человека.
Диагностика, рак легкого, днк-олигонуклеотиды
Короткий адрес: https://sciup.org/148201521
IDR: 148201521 | УДК: 577.29
Текст научной статьи Метод диагностики рака легкого человека с помощью одноцепочечных ДНК-олигонуклеотидов
рака [4]. Относительная пятилетняя выживаемость пациентов при раке легкого очень низка, она составляет 13-15% для развитых стран [6] и 9% для развивающихся [3]. Однако, несмотря на разнообразие существующих методов диагностики, выявляемость больных с I-II стадиями рака легкого составляет около 27%, а больных с III-IV стадиями – 66% [2]. При этом 5-летняя выживаемость после лечения I стадии РЛ соответствует 70%, а IV стадии – только 5% [2]. Таким образом, снижение смертности от рака легкого человека невозможно без ранней диагностики этого заболевания.
За последние годы произошел значительный прогресс в области фармакологии. В медицинскую практику стали внедряться новые диагностические и лекарственные средства, полученные с помощью современных биотехнологий, перечень которых достаточно широк и включает белки (гормоны, цитокины, факторы свертывания крови, моноклональные антитела, ферменты, колониестимулирующие факторы, вакцины и препараты, созданные на базе клеток и тканей), полученные с помощью генноинженерных и гибридомных технологий. В то же время все чаще начали применяться диагностические и лекарственные препараты на основе аптамеров – искусственных антител, которые по своей природе являются олигонуклеотидами. Чувствительность диагностических систем на основе аптамеров очень высока и зависит от типа мишени. В частности, аптамеры к небольшим молекулам имеют чувствительность на микро-молярном уровне, а к белкам проявляют чувствительность на наномолярном и даже на субна-номолярном уровнях.
Цель работы: описание нового метода диагностики рака легкого человека на основе одноцепочечных ДНК-олигонуклеотидов (аптамеров).
Материалы и методы исследований. Для селекции искусственных антител к опухолевой ткани легкого человека использовали послеоперационный материал опухолевой ткани легкого человека, предоставленный Красноярским краевым клиническим онкодиспансером. Для селекции использовали послеоперационный материал трех гистологических типов рака легкого (плоскоклеточный ороговевающий, плоскоклеточный железистый и мелкоклеточный), взятый от пациентов в возрасте 50-70 лет. Гистологический тип рака легкого при отборе искусственных антител не учитывался. Работа с биологическим материалом осуществлялась с разрешения Локального этического комитета Красноярского государственного медицинского университета имени профессора В.Ф. Войно-Ясенецкого» и Красноярского краевого клинического онкологического диспансера. Получение аптамеров к опухолевой ткани легкого человека проводили методом чередования позитивной и негативной селекции одноцепочечных ДНК-аптамеров из ДНК-библиотек N80 методом систематической эволюции лигандов экспоненциальным обогащением (SELEX) [5]. Полученный пул аптамеров клонировали. Отдельные клоны, обладающие наибольшей специфичностью к опухолевой ткани, секвенировали. В результате были получены искусственные антитела (аптамеры) к опухолевой ткани легкого человека с флуоресцентной меткой Alexa-488, которые использовали для определения продуктов распада опухолевой ткани легкого человека в плазме крови. Для этого плазму крови инкубировали в течение 30 мин с маскирующей ДНК (0,1 мг/мл) для закрытия неспецифических сайтов связывания, а затем в течение следующих 30 мин – с аптамерами, связанными с биотином, и магнитными частицами, связанными со стрептавидином. Полученные комплексы концентрировали с помощью магнита на стенке пробирки, а надосадочную жидкость удаляли, затем комплексы, содержащие онкомаркеры, аптамеры и магнитные частицы, дважды отмывали фосфатным буфером с Са2+ и Mg2+ (рН 7,4) и разводили в 15 мкл буфера. После этого к исследуемому образцу добавляли аптамеры, меченые флуоресцентной меткой, и трижды отмывали фосфатным буфером с Са2+ и Mg2+ (рН 7,4). Подготовленный образец исследовали с помощью люминесцентной микроскопии на наличие флуоресцентной метки, свидетельствующей о присутствии в сыворотке крови белков опухолевой ткани.
Результаты и обсуждение. Селекцию аптамеров к опухолевой ткани легкого человека осуществляли путем чередования позитивной и негативной технологии cell-SELEX, поскольку она позволяет выбрать наиболее специфичные для опухолевой ткани аптамеры и исключить олигонуклеотиды, способные связаться со здоровой тканью легкого. Оценку специфичности аптамеров к ткани рака легкого осуществляли с помощью люминесцентной микроскопии. После инкубации аптамеров с опухолевой тканью легкого человека появлялась флуоресценция, свидетельствовавшая о ее связывании с аптамерами, в то время как эти аптамеры не связывались со здоровой тканью, вследствие чего флуоресценции не наблюдалось (рис. 1).
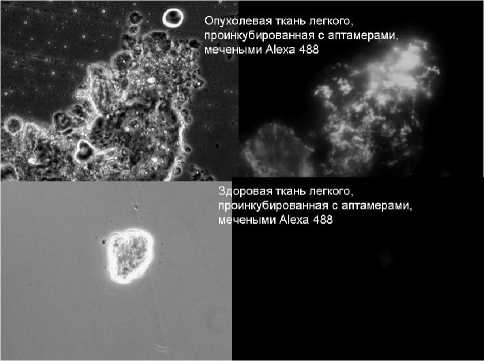
Рис. 1. Микроскопия опухолевой и здоровой тканей легкого человека: слева – световая микроскопия, справа – люминесцентная микроскопия
Для разделения полученного пула аптамеров на отдельные виды осуществляли процесс клонирования, в результате которого получали клоны аптамеров, подходящие для секвенирования. В результате было получено 25 уникальных последовательностей олигонуклеотидов, обладающих высокой степенью аффинности к опухолевой ткани. На основе полученных нуклеотидных последовательностей аптамеры были искусственно синтезированы. Примеры вторичных структур двух аптамеров представлены на рис. 2.

Ctcctctgactgtaaccacgactcatgaggtgtctcactttcattacgatcgtttaacgcgcataggtagtccagaagcc Ctcctctgactgtaaccacgcttttgtctttagccgaattttactaagccgggctgatcagcataggtagtccagaagcc
Рис. 2. Примеры вторичной конформации 17 и 19 клонов аптамеров к опухолевой ткани легкого человека
Наиболее специфичные клоны аптамеров были использованы для выявления в плазме онкобольных продуктов распада опухолевой ткани. Белки, выделенные из сыворотки крови онкобольных с помощью аптамеров и магнитных частиц, флуоресцировали в зеленом диапазоне. Аналогично проведенные процедуры с кровью здоровых людей не выявляли флуоресцирующих белков в сыворотке (рис. 3).
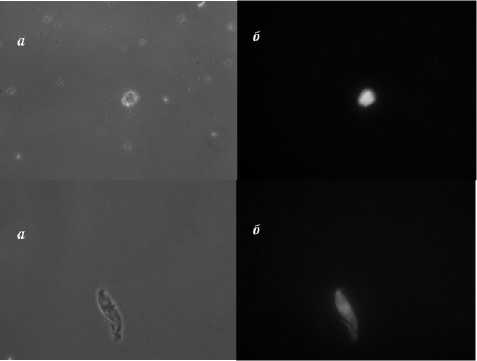
Рис. 3. Микроскопия плазмы крови больных раком легкого: а – световая микроскопия, б – флуоресцентная микроскопия
Выводы: проведенные исследования подтвердили возможность использования аптамеров к раку легкого человека для выявления продуктов распада опухоли в плазме крови онкобольных, а, следовательно, и возможность их применения для диагностики рака легкого человека.
Работа выполнена при поддержке Министерства образования и науки Российской Федерации в рамках федеральной целевой программы «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 20072012 годы» (Государственный контракт № 16.512.11.2090) и КГАУ «Красноярский краевой фонд поддержки научной и научно-технической деятельности».
Список литературы Метод диагностики рака легкого человека с помощью одноцепочечных ДНК-олигонуклеотидов
- Артамонова, Е.В. Основные достижения в биологии, скрининге, диагностике и лечении немелкоклеточного рака легкого (НМРЛ)//Практическая онкология. 2011. №1. С. 26-35.
- Левченко, Е.В. Скрининг рака легкого//Практическая онкология. 2010. №2. С. 88-95.
- Шевченко, В.E. Профилирование низкомолекулярного протеома плазмы крови для обнаружения потенциальных маркеров рака легкого/В.Е. Шевченко, Н.Е. Арноцкая, О.П. Трифонова и др.//Масс-спектрометрия. 2007. №4. С. 245-253.
- Arya, S.K. Lung Cancer and Its Early Detection Using Biomarker-Based Biosensors/S.K. Arya, S. Bhansali//Chem. Rev. 2011. 111. Р. 6783-6809.
- Berezovsky, M. Aptamer-Facilitated Biomarker Discovery (AptaBID)/M. Berezovsky, M. Lechmann, M. Musheev et al.//J. Am. Chem. Soc. 2008. 130. P. 9137-9143.
- Fiorentino, F.P. CTCF and BORIS Regulate Rb2/p130 Gene Transcription: A Novel Mechanism and a New Paradigm for Understanding the Biology of Lung Cancer/F.P. Fiorentino, M. Macaluso, F. Miranda//Molecular cancer research. 2011. №9. Р. 225-233.


