Метод лапароскопии для прижизненной диагностики Т-2 токсикоза у кроликов
Автор: Хайруллин Д.Д., Валиуллин Л.Р., Идиятов И.И., Бирюля В.В., Иванов В.В., Трифонов А.Ю., Тремасов М.Я.
Статья в выпуске: 1 т.233, 2018 года.
Бесплатный доступ
В связи с высокой распространённостью микроскопических грибов, их метаболиты вызывают при этом тяжелые патологические процессы в организме животных. В наших исследованиях была изучена прижизненная диагностика токсического воздействия Т-2 токсина на кроликах методом лапароскопии брюшной полости. Для проведения видеолапароскопических исследований брюшной полости и для прижизненной биопсии печени при Т-2 токсикозе пользовались однопрокольной методикой. В качестве параметров контроля течения токсикоза служили клинические признаки и гистологические исследования. Исследуемые показатели сравнивали с контрольными данными. В результате проведенных исследований видно, что при лапароскопии возможно определить не только прижизненное морфологию внутренних органов животных, но и проводить биопсию печени для последующих гистологических исследований с целью выявления отрицательного воздействия различных препаратов на живой организм.
Лапароскопическая хирургия, диагностика отравлений, яды природного происхождения
Короткий адрес: https://sciup.org/142213005
IDR: 142213005 | УДК: 619:615.9;
Текст научной статьи Метод лапароскопии для прижизненной диагностики Т-2 токсикоза у кроликов
Одним из основных загрязнителей продовольственного сырья токсичными веществами биологического происхождения являются вторичные метаболиты микроскопических грибов (микотоксины) которые представляют большую угрозу для животных и человека.
В связи с высокой распространенность микроскопических грибов рода Fusarium в средней широтах (Франция, Германия, Канада, Российская Федерация, серверная часть США, и др. страны) часто встречающимися микотоксинами являются фузариотоксины (дизоксиневаленол (ДОН), фумонизины, зеараленон, Т-2 токсин). Они очень часто встречаются в продовольственном сырье (овощах, фруктах, мясе, молоке и молочных продуктах, орехах, вине и др.) и кормах (сено, силос, фуражное зерно и др,) в сочетании друг с другом на уровне или не превышающие ПДК [3, 6], Трихоте ценовые микотоксины могут вызывать подавление иммунитета, повреждение митохондрий за счет уменьшения митохондриального мембранного потенциала и индуцировать апоптоз путем повышающей регуляции генов, связанных с апоптозом [5, 8]. Зеараленон вызывает эмбриотоксический, тератогенный эффект, а в сочетании с трихотеценовыми микотоксинами может вызывать синергетическое воздействие даже при дозах ниже ПДК. Который приводит к дегенеративным и некротическим изменениям в печени, почках, иммунокомпетентных органов животных и человека [4, 7]. Однако, не смотря па широкую распространённость фузариотоксинов и высокие токсические свойства на организм животных и человека ранняя диагностика отравления микотоксина является мало изученной и весьма актуальной проблемой как для микотоксикологии так и для эпидемиологии. В связи с этим целью наших исследований была прижизненная диагностика токсического воздействия микотоксина Т-2 токсина на кроликов.
Материалы и методы исследований. Опыты по изучению хронического воздействия Т-2 токсина были проведены на 6 кроликах в течение 14 суток. Животные первой группы служили биологиче ским контролем. Животные второй группы получали Т-2 токсин в виде 5% спиртового раствора внутрижелудочно, (1/10 ДД50). Для эксперимента микотоксины были синтезированы в ФГБНУ ФЦТРБ-ВНИВИ, которые по физико-химическим параметрам и токсическим свойствам не отличались от существующих стандартов. В качестве продуцента микотоксинов использовали F. sporotrichiella 2 м 15, предоставленный Котиком А.Н. Для проведения видеолапароскопических исследований брюшной полости и для прижизненной биопсии печени при Т-2 токсикозе пользовались классической мегодикой (контроль) и новой одноирокольной методикой (опыт) представленной в монографии [1, 2]. Гистологическое исследование проводились согласно методической рекомендации по изучению микрокартины внутренних органов [9, 10). В качестве параметров контроля течения токсикоза служили клинические признаки и гистологические исследования. Исследуемые показатели сравнивали с контрольными данными.
Результаты исследований. Клинические признаки отравления начали проявляться у животных получавших Т-2 токсин, и характеризовались угнетением, снижением аппетита, взъерошенностью шёрстного покрова шаткостью походки, диареей. К концу опыта, получавших Т-2 токсин, к окончанию эксперимента отмечались эрозии и некрозы кожи губ и слизистых оболочек ротовой полости.
Подготовка для введения хирургических инструментов в классическом и опытном варианте лапароскопии в брюшную полость, что для лапароскопии делаются маленькие разрезы 4 мм в брюшной стенке (два при классической методике, или один в новой, однопрокольной методике), для троакаров, через которые в брюшную полость вводятся видеолапароскоп и манипуляторы (биопсийные зажимы). Введение в брюшную полость двух троакаров, первый для камеры и инсуффляции газа в брюшную полость, второй для манипулятора для биопсии печени представлены на рисунке 1.
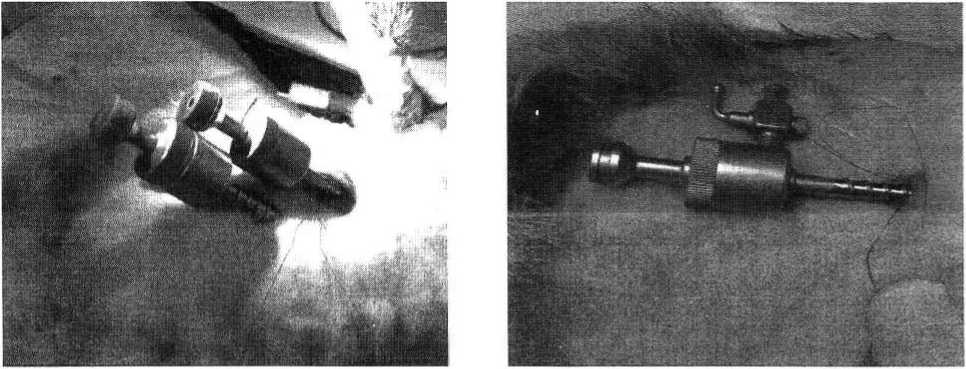
Рисунок 1 - Введение в брюшную полость двух зондов с лева на право, первый троакар для лапароскопаи инсуффляции газа в брюшную полость, а второй троакар для пункций печени.
В новой методике биопсийные зажимы вводятся через один порт (в щель между корпусом троакара и корпусом лапароскопа). Пункция печени были отобраны для гистологических исследований у животных получавших Т-2 токсина в дозах 1/10 ЛДзо. При диффузном поражении паренхиматозного органа биопсию в опытной и контрольной методике проводили с краевых участков печени, где риск биопсийных осложнений наименьший. Для гемостаза участков биопсий проводиться электрокоагуляция места пункции печени тем же манипулятором, которым проводили биопсию.
Гепатоциты печени у кролика контрольной и исследуемой группы имеют обычное строение, по линии соединяющей центральные вены наблюдается не значительный визуализирующийся стеаТоз.' В микрофотографии видно, что печень ' кролика получавших Т-2 токсин в дозе 1/10 ЛД50, определяется капельный стеатоз.
Заключение. В результате проведенных исследований видно, что при лапароскопии методом одного прокола брюшной полостикролика возможно определить не только прижизненное морфологию внутренних органов животных, по и проводить биопсию печени для последующих гистологических исследований с целью выявления отрицательного воздействия различных препаратов на живой организм. Работа выполнена за счет гранта Российского научного фонда (проект №16-15-00141).
Резюме
В связи с высокой распространённостью микроскопических грибов, их метаболиты вызывают при этом тяжелые патологические процессы в организме животных. В наших исследованиях была изучена прижизненная диагностика токсического воздействия Т-2 токсина на кроликах методом лапароскопии брюшной полости.
Для проведения видеолапароскопических исследований брюшной полости и для прижизненной биопсии печени при Т-2 токсикозе пользовались однопрокольной методикой. В качестве параметров контроля течения токсикоза служили клинические признаки и гистологические исследования. Исследуемые показатели сравнивали с контрольными данными.
В результате проведенных исследований видно, что при лапароскопии возможно определить не только прижизненное морфологию внутренних органов животных, но и проводить биопсию печени для последующих гистологических исследований с целью выявления отрицательного воздействия различных препаратов на живой организм.
METHOD OF LAPAROSCOPY FOR INJECTED DIAGNOSIS OF T-2 TOXICOSIS
Список литературы Метод лапароскопии для прижизненной диагностики Т-2 токсикоза у кроликов
- Валиуллин, Л.Р. Комбинированное воздействие микотоксинов на физиологические показатели крыс/Валиуллин Л.Р., Хайруллин Д.Д., Семенов Э.И., Егоров В.И., Шуралев Э.А., Рагинов И.С.//Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. -2015. -Т. 221. №1. -С. 45-48.
- Иванов В.В., Равилов Р.Х., Папуниди К.Х. Эндоскопическая хирургия мелких домашних животных. -Казань, 2016.-164 с.
- Тремасов, М.Я. Проблемы ветеринарной экотоксикологии/М.Я. Тремасов//Материалы международной конференции ветеринарных фармакологов и токсикологов, посвящённой 125-летию H.A. Сошественского. -Казань, 2001. -С. 10-14.
- Хайруллин, Д.Д. Идентификация кормового антибиотика цинкбацитрацина методом ВЭЖХ/Хайруллин Д.Д., Галяутдинова Г.Г., Босяков В.И., Шангараев Н.Г., Егоров В.И.//Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. Казань, 2017. -Т. 232 (4). С. -147-150.
- Banati H. Determination of mycotoxinproduction of Fusariumspecies in genetically modified by quantitative flow immunocytometry/Banati H., Darvas В., Feher-Toth S., Czeh A., Szekacs A. Toxins (Basel). -2017. -Feb 22; 9(2).
- Deng, C. Deoxynivalenol inhibits proliferation andinduces apoptosis in human umbilicalvein endothelial cells/Deng С, Ji С, Qin W, Cao X, et. al.//Environ Toxicol Pharmacol. -2016 Mar 26.
- Marie-Caroline. S. Natural Co-Occurrence of Mycotoxins in Foods and Feeds and Their in vitro Combined Toxicological Effects/Marie-Caroline S., Stephanie M., Emmanuel C. Nolwenn H.//Toxins (Basel). -2016 Mar 26. -8(4). pii: E94. doi: 10. 3390.
- Zhu, C.C. Toxic effects of IIT-2 toxin on mouse oocytes and its possible mechanisms/Zhu C.C., Zhang Y., Duan X, Han J., Sun S.C.//Arch Toxicol-2016 Jun; 90(6).
- Raginov L.S. Morphofunctional analysis of experimental model of esophageal achalasia in rats/Sabirov A.G., Burmistrov M.Y., Chelyshev Y.A., Khasanov R.Sh., Moroshek A.A., Grigoriev P.N., Zciirov A.L., Mukhamedyarov M.A.//Bull Exp Biol Med. -2010 Oct; 149(4):466-70.
- Elder, E. Atlas and synopsis levers of histopathology of the Skin/E. Elder, R. Elenitsas, A. Rubin et. al.//Skin Diseases. -2013.


