Метод определения вида взаимодействия молочнокислых микроорганизмов при их совместном культивировании
Автор: Кондратенко В.В., Посокина Н.Е., Лялина О.Ю., Грачева А.Ю., Семенова Ж.А., Терешонок В.И.
Журнал: Овощи России @vegetables
Рубрика: Агрохимия
Статья в выпуске: 5 (43), 2018 года.
Бесплатный доступ
Процессы ферментации, сопровождаемые ростом и развитием нескольких видов микроорганизмов, зачастую сопровождаются сменой одних видов микроорганизмов другими, такое сложное «поведение» микроорганизмов при ферментации нуждается в глубоком изучении. Используемые ранее подходы оценки вида взаимодействия отдельных монокультур в консорциумах позволяют получить только качественные результаты (синергетическое, антагонистическое, аддитивное взаимодействие) в целом, без учёта изменения этого взаимодействия в процессе культивирования. Целью исследований являлась разработка нового подхода количественного определения показателя взаимодействия микроорганизмов одного вида с другим видом, выражаемого в виде непрерывной функции, определяемой на всем периоде ферментации. В процессе работ для анализа вида взаимодействия был выбран двухкомпонентный консорциум молочнокислых микроорганизмов Lactobacillus brevis и Lactobacillus plantarum, культивированный на двух разных модельных средах в рамках исследования направленного ферментирования овощной продукции...
Консорциум, монокультура, молочнокислые микроорганизмы, ферментация, белокочанная капуста, синергетическое, антагонистическое, аддитивное взаимодействие, функциональная зависимость
Короткий адрес: https://sciup.org/140238410
IDR: 140238410 | УДК: 579.67: | DOI: 10.18619/2072-9146-2018-5-90-94
Текст научной статьи Метод определения вида взаимодействия молочнокислых микроорганизмов при их совместном культивировании
Ф ерментированные овощи и фрукты (продукты) получают несколькими способами: 1) благодаря активности сбраживающих микроорганизмов, присутствующих на поверхности сырья (эпифитная микрофлора); 2) используя заквасочные культуры (комплексные закваски, консорциумы или стартерные активаторы) [1].
Процессы ферментации, происходящие естественным путем, сложно контролируемые, что неприемлемо для крупных заводов и предприятий. Поэтому для повышения надежности, обеспечения стабильного качества и улучшения интенсивности технологического процесса зачастую применяют бактериальные заквасочные культуры (комплексные закваски, консорциумы или стартерные активаторы), которые должны обладать соответствующими (заданными) свойствами и доминировать над нативными молочнокислыми бактериями. Выбор заквасочной культуры (одно- или мно-гоштаммовой) определяется свойствами субстрата, ожиданиями потребителей и техническими требованиями [2].
Ферментация овощей и фруктов зависит не от одного микроорганизма, а от пула бактерий (заквасочных культур) разных родов и видов. Заквасочные культуры могут быть чистыми или смешанными. При ферментации пищевых продуктов под влиянием динамично меняющихся условий среды происходит сложная смена пулов микроорганизмов. Определенный микроорганизм (или группа микроорганизмов) начинает размножаться и через некоторое время становится доминирующим. В результате накопления соединений-ингибиторов роста развитие микроорганизма замедляется, и начинают размножаться другие виды, менее чувствительные к ингибирующим факторам [3].
При ферментации овощной продукции применяют лишь несколько стартерных культур (штаммов молочнокислых микроорганизмов) и основной закваской при квашении капусты является культура Leuconostoc mesenteroides . Основным видом бактерий, которые размножаются на первом гетеро-ферментативном этапе при производстве квашеной капусты или в процессе ферментации, являются молочнокислые микроорганизмы L.
mesenteroides (они размножаются в течение ~6 дней), они продуцируют молочную и уксусную кислоты, а также углекислый газ, на втором этапе происходит рост Lactobacillus brevis и третий этап характеризуется размножением Lactobacillus plantarum , который также продуцируют молочную кислоту, снижая значение рН ниже 4,0. Это обеспечивает длительный срок хранения квашеной капусты в анаэробных условиях при соблюдении правильных температурных режимов [1].
Подбор консорциума является сложной задачей, в связи с тем, что в процессе культивирования различные виды микроорганизмов могут вступать друг с другом в один из трёх вариантов взаимодействия: синергетическое – взаимное усиление зависимого положительного фактора, учитываемого в процессе культивирования; антагонистическое – взаимное ослабление зависимого положительного фактора; аддитивное – взаимодействие, при котором консорциум ведёт себя таким образом, как будто каждая из входящих в него культур культивируется без взаимодействия друг с другом.
Имеющиеся подходы оценки вариантов взаимодействия отдельных монокультур в консорциумах позволяют получить только качественные результаты (синергетическое, антагонистическое, аддитивное взаимодействие) без учёта изменения этого взаимодействия в процессе культивирования. В связи с этим разработка нового подхода количественного определения данного показателя в виде непрерывной функции, определяемой на всем периоде культивирования, является актуальной.
Цели и задачи
Целью исследований являлась разработка нового оригинального подхода количественного определения показателя вида взаимодействия молочнокислых микроорганизмов в консорциуме.
Для выполнения поставленной цели необходимо было решить несколько задач:
-
1) изучить и проанализировать существующие подходы оценки типов взаимодействия отдельных монокультур в консорциумах,
-
2) разработать новый подход
количественного определения показателя вида взаимодействия, который выражается в виде непрерывной функции, определяемой на всем периоде культивирования. Этот подход основан на сравнении скорости нарастания биомассы микроорганизмов консорциума с рассчитанной аддитивной динамикой, этому предшествовало определение концентраций микроорганизмов в 1 г субстрата (титров) не только при ферментации изучаемого консорциума, но также и при ферментации отдельно одной монокультуры и отдельно второй.
Материалы и методы
В качестве объектов исследования использовали микроорганизмы рода Lactobacillus видов L. brevis и L. plantarum , предоставленные ФГУП ГосНИИгенетика, и двухкомпонентный консорциум этих микроорганизмов.
Как монокультуры, так и консорциум культивировали на двух модельных питательных средах. В качестве основы модельных сред использовали отличающиеся по химическому составу сорта белокочанной капусты Слава и Парус урожая 2015 года, предоставленные ФГБНУ ФНЦО. Модельные среды готовили в соответствии с [4].
Регенерацию и культивирование монокультур и консорциума в модельных средах проводили по [5], активную фазу ферментирования осуществляли в течение 3-х суток при температуре +23...25 ° С, далее весь остальной период ферментирования образцы выдерживали при температуре -1...+4 ° С. Определение скорости культивирования микроорганизмов проводили путём выборочного контроля титра в модельной среде по прошествии 0, 1, 3, 10, 30, 60 и 90 суток культивирования. Получение экспериментальных данных проводили путём определения титра молочнокислых микроорганизмов на различных стадиях культивирования монокультур, а также консорциума по [6].
Обработку результатов микробиологических исследований проводили в несколько этапов: 1) проведение первичной статистической обработки экспериментальных данных (Microsoft Excel); 2) определение функциональных зависимостей, адекватно аппроксимирующих экс-
Таблица 1. Характеристики функций динамики нарастания биомассы по вариантам исследований Table 1. The characteristics of the functions of the dynamics of biomass growth for all study variants
|
Сорт белокочанной капусты (модельная среда) |
Культура |
Коэффициенты |
||||
|
a |
b |
c |
d |
f |
||
|
L. brevis |
7,739 |
0,218 |
5,757 |
-0,00061 |
-0,048 |
|
|
Слава |
L. plantarum |
8,191 |
0,151 |
4,028 |
0,001 |
0,023 |
|
Consortium |
8,132 |
0,151 |
4,318 |
0,0009 |
-0,011 |
|
|
Парус |
L. brevis |
9,242 |
-0,044 |
0,757 |
0,004 |
0,043 |
|
L. plantarum |
9,883 |
0,681 |
16,767 |
0,001 |
-0,062 |
|
|
Consortium |
9,797 |
-0,041 |
0,411 |
0,003 |
0,033 |
|
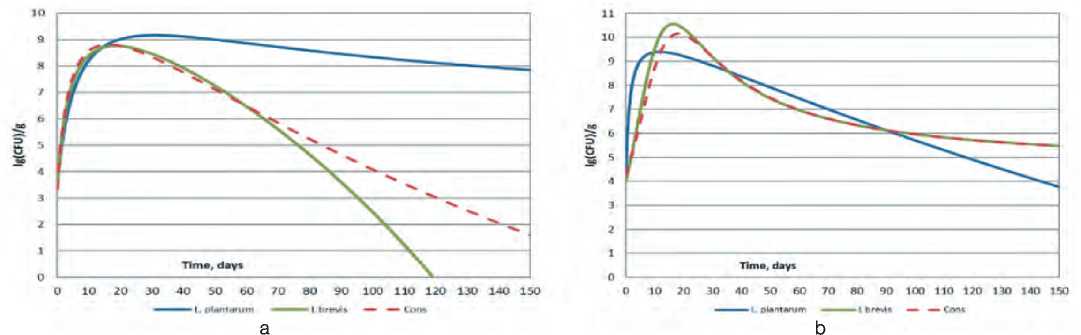
Рис. 1. Динамика нарастания титра монокультур L. plantarum и L. brevis и их консорциума (Cons) на модельных средах на основе капусты белокочанной сортов Слава (а) и Парус (b)
Fig.1. Dynamics of increase of the titer of monocultures of L. plantarum and L. brevis and consortium (Cons) on model media based on white cabbage of varieties "Slava" (a) and "Parus" (b)
периментальные данные (SYSTAT TableCurve 2D); 3) аналитический расчёт функций скоростей нарастания микробиальной биомассы в процессе ферментации для монокультур и консорциумов (Microsoft Excel); 4) аналитический расчёт аддитивных функций скоростей нарастания микробиальной микрофлоры для консорциумов (Microsoft Excel); 5) аналитический расчёт показателей взаимодействия монокультур в консорциумах в процессе культивирования (Microsoft Excel).
Результаты
Анализ экспериментальных данных показал, что функциональная зависимость, наиболее адекватно аппроксимирующая экспериментальные данные для всех вариантов исследования, имеет вид:
Т ( Т )=e
(a+c r +f r2 )/(1+b r +d т2')')
где a – константа; b, c, d и f – коэффициенты; e – основание натурального логарифма; τ – продолжительность культивирования.
Данные по функциям, которые наиболее адекватно аппроксимируют экспериментальные данные, для каждого варианта исследований представлены в таблице 1.
Кривые нарастания микрофлоры представлены на рисунке 1.
Анализ экспериментальных данных показывает, что в зависимости от вида сырья одни и те же виды микроорганизмов проявляют различную динамику нарастания титра. Также предварительно можно судить о том, что вид сырья оказывает влияние на взаимодействие между видами микроорганизмов в консорциуме. Так, при культивировании на модельной среде на основе капусты белокочанной сорта Слава титр консорциума достигал максимума раньше, чем титр отдельно входящих в него микроорганизмов. При культивировании этих же микроорганизмов в модельной среде на основе капусты сорта
Парус подобного вывода сделать не представляется возможным. В связи с этим в качестве первого шага к определению типов взаимодействия определяли скорости нарастания титра в виде функции
υ ( τ )= T '( τ ),
где υ ( τ ) – скорость нарастания титра в 1 г модельной среды, КОЕ/г · сут; T '( τ ) – первая производная функциональной зависимости титра от продолжительности культивирования, КОЕ/г · сут.
Кривые полученных функций имели две выраженные зоны: первая, – для которой υ ( τ ) ≥ 0 , и вторая, для которой υ ( τ ) < 0 . Для удобства представления логики дальнейших рассуждений, кривые (функции) были преобразованы следующим образом:
υ ( τ ), υ ( τ ) ≥ 0
V( τ )= { , (3)
| υ ( τ )|, υ ( τ ) < 0
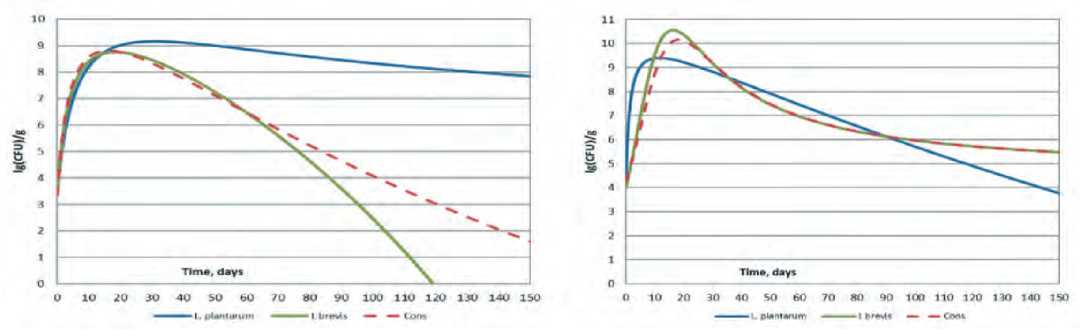
b
Рис. 2. Экспериментальные и аддитивные динамики скоростей нарастания (сплошная линия) и убывания (пунктирная линия) титра консорциума L. brevis и L.plantarum на модельных средах на основе капусты белокочанной сортов Слава (а) и Парус (b) Cons_up и Add_up – экспериментальная и аддитивная, динамики скоростей нарастания титра; Cons_down и Add_down – экспериментальная и аддитивная, динамики скоростей убывания титра.
Fig. 2. Experimental and additive dynamics of rates of growth (continuous line) and rates of decrease (dotted line) of L. brevis and L. plantarum consortium titers on model media based on white cabbage varieties "Slava" (a) and "Parus" (b) Cons_up and Add_up experimental and additive dynamics of the titer growth rates; Cons_down and Add_down experimental and additive dynamics of the rates of decrease of titer.
Для получения представления о типах взаимодействия между микроорганизмами в консорциуме необходимо в каждый момент культивирования сравнить кривую скорости нарастания титра с расчётной кривой, соответствующей скорости нарастания титра в консорциуме при аддитивном взаимоотношении между видами микроорганизмов, которая может быть рассчитана по формуле:
T i
cons
T i
cons
n
υ аdd =
∑ n υ i ( τ ) · T i ( τ ) ·q i –— i — =1 ———–—––
∑ n i=1 T i ( τ ) ·q i
для которой примем, что
q i =
T i
cons
T i ( 0 )
и, в свою очередь,
где:
υаdd – аддитивная скорость нарастания титра в консорциуме, КОЕ/г · сут;
u i ( т ) - скорость нарастания титра i-й культуры в монокультуре, КОЕ/г · сут;
T i ( т ) - титр i -й культуры при её культивировании в монокультуре, КОЕ/г;
qi – пересчётный коэффициент;
Т /” "5 ( 0 ) - титр i-й культуры в консорциуме в начальный момент времени, КОЕ/г;
Тi(0) – титр i-й культуры в начальный момент времени при её культивировании в монокультуре, КОЕ/г;
Т™"8 (0) — титр консорциума в начальный момент времени, КОЕ/г;
n – количество видов микроорганизмов в консорциуме,
Поскольку uadd ( T ) может принимать на разных этапах как положительные, так и отрицательные значения, для удобства представления дальнейшей логики рассуждений функция скорости была преобразована в соответствии с формулой (3).
Рассчитанные кривые, преобразованные в соответствии с формулой (3), представлены на рисунке 2.
Анализ расчётных данных показывает, что возможны 4 варианта развития событий:
-
1) v адд ( τ ) < 0 и v эксп ( τ ) < 0 ;
-
2) v адд ( τ ) < 0 и v эксп ( τ ) ≥0 ;
-
3) v адд ( τ ) >0 и v эксп ( τ ) >0 ;
-
4) v адд ( τ ) ≥0 и v эксп ( τ ) < 0 .
Как в случае использования модельной среды на основе капусты сорта Слава, так и в случае использования сорта Парус, на графиках можно различить три зоны: первая
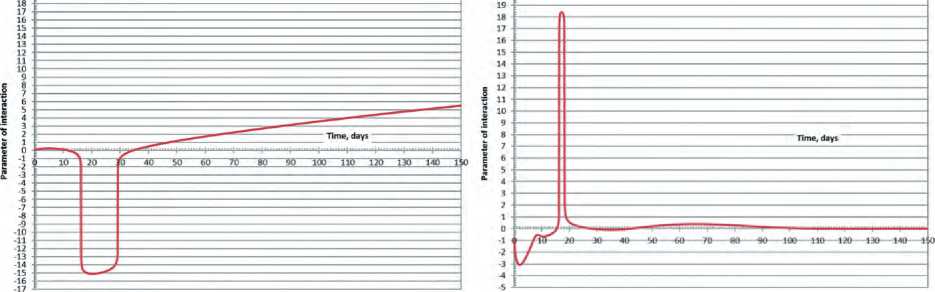
ab
Рис.3. Динамика показателя взаимодействия консорциума L. Plantarum и L. brevis на модельных средах на основе капусты белокочанной сортов Слава (а) и Парус (b). Fig.3. the Dynamics of the parameter of interaction of L. plantarum and L. brevis consortium on model media based on white cabbage varieties "Slava" (a) and "Parus" (b).
зона – вид взаимодействия при обоюдном нарастании титра, вторая зона – вид взаимодействия при разновектор-ности скоростей нарастания титра консорциума и расчётного титра аддитивного взаимодействия, третья зона – вид взаимодействия при обоюдной убывающей скорости (рис. 2).
Для оценки типов взаимодействия предлагаем ввести показатель взаимодействия микроорганизмов в консорциуме k( τ ), который для каждого из перечисленных случаев может быть рассчитан следующим образом.
Следует отметить, что по своей
’ |«(^;). u.ddM2 0ilu„p(t)>0
Мф 1*(^).».аа(г)< Ониксе lg(lu«dd(Ol • »«₽ W) ■ u.dd W <0 И и„р(т) > О
. 'eLMmini)- u*“(t)2 0 н *WT) < ° природе данный показатель принимает значение больше нуля, если взаимодействие синергическое, меньше нуля, если антагонистическое, и становится равным нулю при аддитивном.
Расчётные кривые показателей взаимодействия по вариантам исследования представлены на рисунке 3.
В зависимости от целей, стоящих перед культивированием, необходимо анализировать либо весь период культивирования, либо один или несколько его отдельных зон с расчётом соответствующих границ, что можно сделать графически, аналитически или численными методами, в зависимости от требуемой точности. Например, как видно из рисунка 3 динамики показателя взаимодействия в процессе культивирования исследованного консорциума одних и тех же микроорганизмов на разных модельных средах фактически зеркальны друг другу по отношению к оси х и отличаются нюансами в каждой из описанных выше зон. Так, в первой зоне процесс культивирования на модельной среде на основе капусты белокочанной сорта Парус провоцировал формирование антагонизма между микроорганизмами до 10 суток культивирования. При этом антагонизм сходил на нет на 10-е сутки, после чего, по прошествии 7 суток выраженного синергизма микроорганизмы разных видов в консорциуме практически переставали оказывать друг на друга сколько-нибудь значимое влияние. При культивировании на модельной среде на основе капусты сорта Слава, наоборот, до 13 суток культивирования имеет место слабый синергизм взаимодействия, переходящий в выраженный антагонизм в течение следующих 20 суток, с возвратом к синергетическому взаимодействию на 33 сутки культивирования с последующим его практически линейным усилением.
Выводы
Предложен оригинальный подход, основанный на сравнении скорости нарастания титра микроорганизмов с рассчитанной аддитивной кривой. Данный подход представляет собой сравнительно удобный инструмент выявления комплексной закономерности изменения типов взаимоотношения между микроорганизмами в консорциуме в виде непрерывной функции, определяемой в течение всего периода культивирования. Предложенный подход является следующим этапом в анализе взаимодействия видов микроорганизмов в составе консорциума и является, по сути, совершенствованием существующей методологии.
Дальнейший более глубокий анализ полученных данных, подкреплённый результатами динамиками химического состава сырья, предположительно, позволит детализировано выявить причины подобного поведения микроорганизмов, являющегося по сути суперпозицией конкуренции за пищевые ресурсы, факторы дыхания, ингибирования вегетативной и генеративной функции микроорганизмов.
С точки зрения синергизма входящих в изучаемый консорциум видов микроорганизмов в активной фазе ферментирования сорт Слава оказался более выгодным по сравнению с сортом Парус.
Список литературы Метод определения вида взаимодействия молочнокислых микроорганизмов при их совместном культивировании
- Настольная книга производителя и переработчика плодоовощной продукции. Под редакцией Н.К. Синха, И.Г. Хью. Перевод с англ. яз. -СПб.: Профессия, 2014. -С. 467-485.
- Josephsen J., Jespersen L. Fermented foods and starter cultures//Handbook of Food Science, Technology and Engineering/Hui Y. H. (ed.). -Boca Raton, FL: CRC Press, 2006. -P. 177-1 -177-20.
- Hutkins R.W. Microbiology and technology of fermented foods. IFT Press Blackwell Publishing, 2006. -473.
- Посокина Н.Е., Лялина О.Ю., Тырина Е.С./Управляемое ферментирование как фактор формирования стабильного качества отдельных видов овощной продукции //Научное обеспечение инновационных технологий производства и хранения сельскохозяйственной и пищевой продукции: сб. матер. III Всерос. научн.-практ. конф. молодых ученых и аспирантов (4-25 апреля 2016 г., г. Краснодар) -С. 1.-530. URL: http://vniitti.ru/conf/conf2016/sbornik_conf_2016.pdf.
- Кондратенко В.В., Посокина Н.Е., Лялина О.Ю., Грачева А.Ю., Захарова А.И., Терешонок В.И. НОВЫЙ ПОДХОД В СОВЕРШЕНСТВОВАНИИ МЕТОДОЛОГИИ ВЫЯВЛЕНИЯ ВИДА ВЗАИМОДЕЙСТВИЯ МОЛОЧНОКИСЛЫХ МИКРООРГАНИЗМОВ В КОНСОРЦИУМАХ НА РАЗНЫХ ЭТАПАХ КУЛЬТИВИРОВАНИЯ. Овощи России. 2017;(1): 71-75. https://doi.org/10.18619/2072-9146-2017-1-71-75
- ГОСТ 10444.11-2013 «Микробиология пищевых продуктов и кормов для животных. Методы выявления и подсчета количества мезофильных молочнокислых микроорганизмов».


