Методические и практические аспекты определения общей ртути в образцах цельной крови, мочи и волос методом масс-спектрометрии с индуктивно связанной плазмой
Автор: Уланова Т.С., Стенно Е.В., Вейхман Г.А., Недошитова А.В.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Экспериментальные модели и инструментальные исследования для оценки риска в гигиене и эпидемиологии
Статья в выпуске: 2 (22), 2018 года.
Бесплатный доступ
Точный, селективный и достаточный по чувствительности количественный метод определения химических веществ в объектах окружающей среды и организме человека зачастую является залогом корректной оценки рисков для здоровья. Оптимизированы условия проведения анализа образцов цельной крови, мочи и волос при определении содержания общей ртути методом масс-спектрометрии с индуктивно связанной плазмой (условия отбора и хранения проб, схема подготовки к анализу, параметры инструментальных настроек прибора, условия анализа). Количественное определение ртути в пробах крови, мочи и волос осуществлялось на масс-спектрометре Agilent 7500cx с октопольной реакционной/столкновительной ячейкой (Agilent Technologies, USA). Для подготовки к анализу образцов цельной крови использовали метод кислотного растворения в концентрированной азотной кислоте с последующим центрифугированием. Образцы мочи напрямую проанализированы после разведения 1/10 (V/V) 1 % раствором азотной кислоты. Предложенные условия рутинного анализа биосред при определении содержания общей ртути методом ИСП-МС позволяют выполнять определение элемента в крови в диапазоне концентраций 0,5-100 мкг/л при погрешности измерений 29,4 %, в моче 0,4-100 мкг/ л при погрешности измерений 24,2 %, в волосах 0,001-100 мкг/г при погрешности измерений 22,4 %. При валидации методики установлены пределы обнаружения (LOD) для крови 0,0015 мкг/л, для мочи 0,012 мкг/л, для волос 0,003 мкг/г. Правильность результатов подтверждена исследованием стандартных образцов крови SERONORM (Sero AS, Norway) blood L1 (LOT 1103128), L2 (LOT 1103129), L3 (LOT 1112691), мочи SeronormTM (Sero AS, Norway) urine (LOT 0511545) и волос Reference Material in Human Hair (IAEA-086,Vienna, Austria). Содержание общей ртути в крови детей определено в диапазоне 0,02-1,2 мкг/л, в моче 0,45-0,8 мкг/л. В моче экспонированных взрослых найдено 0,65-8,2 мкг/л, в волосах 0,29-0,49 мкг/г.
Ртуть, количественное определение, масс-спектрометрия, индуктивно связанная плазма, цельная кровь, моча, волосы, кислотное растворение
Короткий адрес: https://sciup.org/142212869
IDR: 142212869 | УДК: 543.064:616-074 | DOI: 10.21668/health.risk/2018.2.14
Текст научной статьи Методические и практические аспекты определения общей ртути в образцах цельной крови, мочи и волос методом масс-спектрометрии с индуктивно связанной плазмой
века связана с агглютинацией эритроцитов, ингибированием ферментов и нарушением белкового обмена. Ртуть попадает в организм ингаляционным, пероральным, трансдермальным путями и обнаруживается во всех органах и тканях человека [2–4]. По содержанию ртути в крови можно судить о недавнем или текущем заражении всеми формами ртути, по содержанию в моче – оценить текущее, недавнее заражение элементарной и неорганической ртутью, анализ волос позволяет определить поступление элемента в различные периоды времени [1, 5].
Референтные уровни содержания ртути в различных биосредах по данным научных изданий приведены в табл. 1.
Таблица 1
Референтные уровни содержания ртути в крови, моче (мкг/л) и волосах (мкг/г)
|
Автор (метод анализа) |
Кровь, мкг/л |
Моча, мкг/л |
Волосы, мкг/г |
|
ВОЗ, 2010 [5] |
5–10 |
5,6 (<10) |
<10 |
|
Н.У. Тиц (AAС) [3] |
0,6–59 |
<20 |
<15 |
|
Н.И. Калетина [4] |
3–11 |
2 |
0,5–1,5 |
|
А.В. Скальный [2] |
– |
0,1–2,0 |
0,05–2,0 |
|
C. Schulz (ИСП-МС) [6] |
0,8–1,0 |
0,4–0,7 |
– |
|
ALS Scandinavia (ИСП-МС) [7] |
0,46–7,5 |
0,14–4,2 |
0,05–0,93 |
|
J.P. Goulle (ИСП-МС) [8] |
0,94–8,13 |
0,14–2,22 |
0,31–1,66 |
По мнению исследователей Л.М. Каримовой, Т.К. Ларионовой и Г.Р. Башаровой [9], максимальный уровень содержания ртути в крови, при котором не наблюдаются сдвиги в гематологических, биохимических и иммунологических показателях, составляет 1 мкг/л. В методических рекомендациях по ранней диагностике токсического действия ртути в дозах малой интенсивности у детей (МР 2000/140), утвержденных Минздравом РФ, приводится фоновое содержание ртути в утренней моче детей
0,56 ± 0,07 мкг/л (диапазон 0,3–0,9 мкг/л)1. Комиссией по БМЧ Федерального агентства по окружающей среде Германии предложены референтные значения БМЧ-1 и БМЧ-2, составляющие для ртути в крови 5 и 15 мкг/л, а в моче – 7 и 25 мкг/л [1]. БМЧ-1 представляет собой концентрацию в биологическом материале, ниже которой нет риска для здоровья. При достижении концентрации уровня БМЧ-2 существует повышенный риск неблагоприятного воздействия, требующего устранения токсического воздействия. Очевидно, что значительные отличия в приведенных значениях и данных табл. 1 связаны не только с особенностями обследуемых популяций, но и с использованием различных методов анализа.
Для определения ртути в биосредах необходимы высокочувствительные и высокоэффективные методы анализа. К таким методам, в первую очередь, относятся масс-спектрометрия с индуктивно связанной плазмой и атомноабсорбционная спектрометрия с электротермическим вариантом атомизации (ААС-ЭТ)2 [10]. Атомно-абсорбционная спектрометрия при определении ртути обычно применяется в варианте абсорбции холодных паров ртути с использованием специальных ртутно-гидридных приставок (РГП) к атомно-абсорбционным спектрометрам или в ртутных анализаторах [11]. Метод атомной абсорбции холодных паров обладает высокой чувствительностью (пределы обнаружения не уступают ИСП-МС) и селективностью за счет отгонки паров элементной ртути от матрицы пробы. В то же время в работе Н.Б. Иваненко с соавт. [12] указано, что из-за невысокой производительности данные методы уступают место методу ИСП-МС. В РФ в 2003 г. утверждены и введены в действие МУК 4.1.1483-03 по определению содержания химических элементов, в том числе ртути, в биосубстратах методом ИСП-МС3. Диапазоны определения ртути в различных биосредах и БАД составляют: 0,1–10 мкг/л, погрешность оп- ределения 40 %, 10–100 мкг/л, погрешность определения 20 %, ПО 0,01 мкг/л.
Вместе с тем при количественном определении ртути методом ИСП-МС возникают некоторые трудности, обусловленные физико-химическими свойствами элемента. Ртуть представляет собой жидкий металл серебристого цвета, летучий, устойчивый к действию воздуха и воды. Высокая летучесть ртути определяет необходимость консервирования образца на стадии пробоотбора. Ртуть обладает очень высоким потенциалом ионизации 10,44 эВ, что при масс-спектрометрическом анализе существенно ограничивает эффективность ее ионизации в плазме и приводит к низкой чувствительности метода. Кроме того, существенное затруднение вызывает «эффект памяти». Данное мешающее влияние объясняется плохой смываемостью остаточных количеств ртути на подающих путях масс-спектрометра, распылительной камере и горелке, деталях интерфейса [12, 13].
Использование МУК 4.1.1483-033 в клинико-лабораторной практике для определения содержания ртути оказалось затруднительным, так как методика не устанавливает точных параметров подготовки образцов и условий анализа.
Таким образом, актуальность вышесказанного определила цель исследования – оптимизация условий рутинного анализа биосред при определении содержания общей ртути методом масс-спектрометрии с индуктивно связанной плазмой.
Материалы и методы. Количественное определение ртути в пробах крови, мочи и волос осуществляли на масс-спектрометре Agilent 7500cx с октопольной реакционной/столкно-вительной ячейкой (Agilent Technologies, USA) с транзисторным генератором 27,12 мГц. Для введения проб использовали двухканальную распылительную камеру Скотта, которая охлаждалась с помощью элемента Пельтье до 2 ° С. Скорость подачи образца в распылительную камеру составляла 0,4 мл/мин. Масс-спектрометр был оснащен плазменной горелкой Fassel с диаметром инжекторной трубки 2,5 мм. Использовался жидкий аргон высокой чистоты 99,998 % (ТУ-2114-005-00204760-99). Максимальная скорость потока аргона составляла 20 л/мин, давление в канале подводки газа 700 ± 20 кПа, Т плазмы=8000–10000 К. Автоматизация процесса проведения анализа обеспечивалась автосэмплером марки G3160B (Германия).
Для настройки чувствительности прибора использовали раствор 7Li, 59Co, 89Y, и 205Tl в 2 %-ной азотной кислоте с концентрацией 1 мкг/л для каждого элемента (Tuning Solution, USA). В качестве газа-реактанта применялся гелий газообразный высокой чистоты (99,995 %). Для приготовления растворов элементов внутреннего сравнения (IS) использовали комплексный стандартный раствор 209Bi, 73Ge, 115In, 6Li, 45Sc, 159Tb, 89Y с концентрацией 10 мг/л в 5 % водном растворе азотной кислоты (Internal Standard Mix, USA), а также стандартный раствор 103Rh с концентрацией 10 мг/л в 2 % водном растворе соляной кислоты (Rhodium Internal Standard, USA). Использовали кислоту азотную особо чистую с содержанием: As, Cd, Cu, Mn, Pb, Sr, V ≤ ≤ 0,01 мг/кг, Cr, Ni ≤ 0,02 мг/кг, Tl, Zn ≤ 0,05 мг/кг (Nitric acid 69 %, Sigma-Aldrich, США).
Для разбавления применяли деионизованную воду с удельным сопротивлением 18,22 Мом - см, очищенную в системе Milli-Q Integral (Millipore SAS, France). Лабораторную посуду из стекла, тефлона, полипропилена промывали в ультразвуковой мойке Elmasonic S 100H (Germany) при температуре 45-50 ° С: 3-4 раза в дистиллированной воде по 10 мин со сменой воды; затем 30 мин – в азотной кислоте, разбавленной дистиллированной водой 1:5; далее посуду промывали 2–3 % раствором соляной кислоты или раствором 1 %-ной азотной кислоты, содержащим 5 мкг/л хлорида золота.
Важным этапом химико-аналитических исследований является стадия отбора и хранения пробы, особенно при условии летучести исследуемых элементов. Так, для предотвращения потери ртути при хранении и транспортировке пробы необходимо замораживать или вносить раствор хлорида золота (III). При добавлении AuCl 3 в образцы необходимо использовать реакционно/столкновительные ячейки, поскольку ионы хлора ведут к интерференционным наложениям при определении ванадия, мышьяка и селена. Для эффективной ионизации ртути в плазменном потоке, для повышения чувствительности масс-спектрометра важно установить значение мощности частотного генератора 1500–1600 Вт и расстояние от горелки до отбирающего конуса порядка 7,0–7,5 мм. Перед проведением анализа осуществляли настройку прибора в режиме No Gas (без газа-реактанта), проверяли чувствительность, уровень фона, уровень вторичных оксидных и двухзарядных ионов, производили переключение на режим работы с реакционной ячейкой (Reaction mode).
Перед проведением анализа необходимо, чтобы гелий заполнил все подающие пути и реакционную ячейку со скоростью 10 мл/мин, далее прибор оставляли на 30 минут для стабилизации.
Для приготовления градуировочных растворов использовали стандартный раствор ионов ртути с концентрацией 10 мг/л в 5 % растворе азотной кислоты (Calibration Standard 2A – HG, USA).
Одним из способов минимизации «эффекта памяти» является определенный порядок измерения градуировочных растворов и непосредственно самих образцов: в плазму сначала подаются реальные пробы с низким содержанием ртути, а затем растворы для градуировки от самого низкого к более концентрированному. В настоящее время нами при исследовании ртути в образцах верхняя точка градуировочного графика не превышает 1,0 мкг/л, это также минимизирует загрязнение прибора, а следовательно, и «эффект памяти». Построение градуировочного графика проводили по точкам 0,0; 0,1; 0,5; 1,0 мкг/л (рисунок).
Для получения точных и достоверных результатов анализа необходимо, чтобы инструментальный фоновый уровень был минимальный. Из представленного на рисунке градуировочного графика видно, что концентрация, эквивалентная фону (BEC), не вносит вклад в результаты анализа. Коэффициент корреляции r равен 0,9995, а предел инстру- ментального обнаружения (DL) составляет 0,00478 мкг/л.
Одним из инструментальных приемов, позволяющих нивелировать матричное влияние насыщенной структуры матрицы крови, дрейф чувствительности прибора во время анализа, разность плотностей градуировочных и исследуемых растворов, низкую степень ионизации определяемых ионов, является установление оптимального элемента внутреннего сравнения ( IS ). Для этого использовали образцы крови с аттестованным значением содержания ртути и подвергали пробоподготовке с добавлением раствора комплексного внутреннего стандарта. Минимальные погрешности определения ртути в крови в различных диапазонах концентраций установлены при использовании в качестве внутреннего стандарта 159Tb и 103Rh. Немаловажным также является значение холостого опыта, в особенности при определении элемента на уровне нг/л. Так, при использовании159Tb и 103Rh холостая проба составляла порядка 8 мкг/л, при использовании 115In и 209Bi – порядка 18–19 мкг/л.
Кровь. Отбор проб крови производили из локтевой вены в вакуумные пробирки из полипропилена c напылением лития гепарина (PUTH, China). Возможно хранение проб в холодильнике (от 0 ° С до 4 ° С) в герметично закрытой пробирке до трех суток или длительное хранение при замораживании.
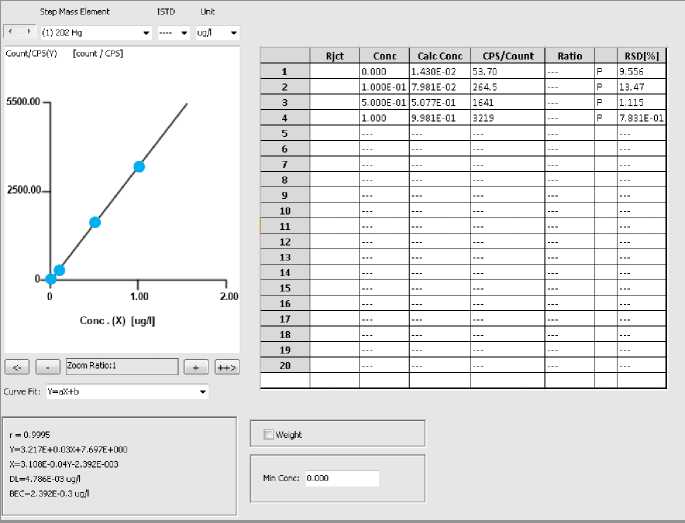
Рис. Градуировочный график для ионов ртути
Таблица 2
Метод «введено/найдено» для проб крови, мочи и волос
|
Образец |
ПО (LOD) в растворе |
В пробе без добавки |
В пробе с добавкой |
Введено/ найдено |
∆ , % |
|
Кровь (№ 1), мкг/л |
0,0015 |
0,012 |
0,03 |
0,02/0,018 |
10 |
|
Кровь (№ 2), мкг/л |
0,0015 |
0,042 |
0,065 |
0,02/0,023 |
15 |
|
Моча (№ 1), мкг/л |
0,012 |
0,080 |
0,19 |
0,1/0,11 |
10 |
|
Моча (№ 2), мкг/л |
0,012 |
0,045 |
1,18 |
1,0/1,14 |
14 |
|
Волосы (№ 1), мкг/г |
0,003 |
0,087 |
0,19 |
0,1/0,103 |
3 |
|
Волосы (№ 2, мкг/г |
0,003 |
0,147 |
0,253 |
0,1/0,105 |
5 |
Для разложения проб крови исследуемый образец объемом 0,1–0,2 мл вносили в конические центрифужные пластиковые пробирки с завинчивающейся крышкой, добавляли 0,2–0,4 мл азотной кислоты (68 %) и 0,1 мл комплексного внутреннего стандарта, далее тщательно перемешивали. Пробирки оставляли на 2–3 часа, далее доводили объем до 10 мл, центрифугировали 10 минут со скоростью 2700–3000 об./мин на центрифуге ЦЛМН–Р10–01– «Элекон» (Россия) и переносили в виалы для последующего масс-спектрометрического анализа. Параллельно для каждой серии проб готовили холостой опыт, который подвергался всем стадиям пробоподго-товки и включал все используемые реактивы, что и анализируемые пробы.
Моча. Отбор проб утренней мочи производили в стерильные полипропиленовые контейнеры на 125 мл с винтовой крышкой (F.L. Medical S.r.l., Torreglia, Italy). Образцы мочи напрямую анализировались после разведения 1/10 1 % раствором азотной кислоты: к 0,5 мл мочи добавляли 4,45 мл 1 % водного раствора HNO 3 и 0,05 мл раствора внутреннего стандарта.
Волосы. Волосы состригали с затылочной части головы на всю длину в количестве, позволяющем получить аналитическую пробу 0,1–0,2 г. Образцы волос хранили в бумажных пакетах. Разложение проб волос осуществляли в открытых пробирках: навеску волос массой 0,1–0,2 г помещали в конические пробирки из полипропилена вместимостью 15 мл, дозатором добавляли 0,1 мл раствора IS, добавляли 1–2 мл концентрированной азотной кислоты плотностью 1,415 г/см3, выдерживали 3–6 часов до растворения, добавляли 1–2 мл концентрированной перекиси водорода. Пробирку с содержимым взбалтывали, выдерживали 3–4 часа, затем доводили до 10 мл деионизованной водой и центрифугировали 10 мин на центрифуге ЦЛМН–Р10–01–«Элекон» (Россия) со скоростью 2700–3000 об./мин.
Контроль правильности результатов анализа образцов крови, мочи и волос проводили методом «введено/найдено» (табл. 2). Добавка вводилась в анализируемый образец перед про-боподготовкой. В табл. 2 приведены пределы обнаружения (LOD), рассчитанные по 3σ-кри-терию. Погрешность определения не превышала 15 %.
Проанализированы стандартные образцы крови SERONORM (Sero AS, Norway) blood L1 (LOT 1103128), L2 (LOT 1103129), L3 (LOT 1112691), мочи SeronormTM (Sero AS, Norway) urine (LOT 0511545) и волос Reference Material in Human Hair (IAEA-086, Vienna, Austria). Перед проведением анализа сертифицированные контрольные материалы подвергались той же процедуре подготовки, что и рабочие пробы. Контрольные образцы анализировались после каждой пятой реальной пробы. Данные табл. 3 свидетельствуют о достоверном совпадении между найденными и аттестованными значениями.
Таблица 3
Аттестованные и найденные средние значения содержания ртути в стандартных образцах крови, мочи и волос
|
Уровень |
Аттестованное значение |
Найденное среднее значение |
∆ , % |
|
SeronormTM urine ( n =5), мкг/л |
39,8 |
39,3 |
1,2 |
|
Seronorm blood L1 ( n =5), мкг/л |
1,5 |
1,71 |
14,0 |
|
Seronormblood L2 ( n =5), мкг/л |
16,0 |
17,3 |
8,1 |
|
Seronorm blood L3 ( n =4), мкг/л |
37,1 |
39,6 |
6,7 |
|
Reference Material in Human Hair ( n =10), мкг/г |
0,573 |
0,635 |
10,8 |
Предложенная методика была апробирована в рамках международной программы испытаний LAMP, организованной Агентством по охране окружающей среды США (CDC, Atlanta, USA). Результаты исследования образцов крови на содержание ртути представлены в табл. 4.
Результаты внешнего контроля качества свидетельствуют об удовлетворительных результатах, что подтверждает приемлемый Z -индекс, значение которого по модулю | Z |≤2.
Проведена метрологическая аттестация предлагаемой методики определения ртути в крови, моче, волосах, выполненная в соответствии с нормативными документами РМГ 61-2010, ГОСТ Р ИСО 5725-1-2002, ГОСТ Р ИСО 57252-2002, ГОСТ Р ИСО 5725-3-2002, ГОСТ Р ИСО 5725-4-2002, ГОСТ Р ИСО 5725-5-2002 и ГОСТ Р ИСО 5725-6-20024.
Методика выполнения измерений ртути в крови, моче и волосах обеспечивает получение результатов измерений с погрешностью, не превышающей значений, приведенных в табл. 5.
Таблица 4
Содержание ртути в образцах крови LAMP (CDC, Atlanta, USA)
|
Раунд/код пробы |
Аттестованное значение, мкг/л |
Найденное значение, мкг/л |
Z -индекс |
|
31/1402 |
3,13 |
3,43 |
0,6 |
|
31/1403 |
8,00 |
8,6 |
0,7 |
|
32/1404 |
4,13 |
4,6 |
0,2 |
|
32/1406 |
2,57 |
3,7 |
–0,4 |
|
33/1407 |
1,68 |
1,38 |
–0,6 |
|
33/1408 |
6,24 |
5,58 |
–0,3 |
|
33/1409 |
10,52 |
9,58 |
–0,2 |
Таблица 5
Метрологические характеристики методики определения ртути в растворе, мкг/л
|
Наименование определяемого компонента и диапазон измерений в растворе |
Показатель повторяемости (относительное среднеквадратическое отклонение повторяемости), σ r , % |
Показатель воспроизводимости (относительное среднеквадратическое отклонение воспроизводимости) σ R , % |
Показатель точности (границы относительной погрешности при вероятности р =0,95), ±δ, % |
|
Кровь, мкг/л, от 0,005 до 1,0 вкл. |
9,19 |
13,23 |
29,42 |
|
Моча, мкг/л, от 0,04 до 1,0 вкл. |
10,36 |
10,42 |
24,25 |
|
Волосы, мкг/г, от 0,1 до 1,0 вкл. |
9,52 |
9,74 |
22,43 |
Таблица 6
Содержание ртути в диагностируемых биосредах
|
Материал |
Группа |
Пермский край |
Канада [16] |
Россия [14] |
Германия [6, 17] |
БМЧ-1 [1, 6] |
|
Кровь, мкг/л |
Взрослые |
– |
0,12–4,7 |
0,89–2,39 |
0,02–16 |
5 |
|
Дети |
0,02–1,2 |
0,27–6,39 |
0,2–0,43 |
0,8–1,0 |
||
|
Моча, мкг/ л |
Взрослые |
0,65–8,2 |
0,2–3,5 |
0,27–0,94 |
– |
7 |
|
Дети |
0,45–0,8 |
0,2–2,82 |
– |
0,4–0,8 |
||
|
Волосы, мкг/г |
Взрослые |
0,29–0,49 |
– |
0,21–0,54 |
– |
1 |
Разработанная методика определения ртути в биосредах на базе метода ИСП-МС позволяет выполнять определение элемента в крови в диапазоне концентраций 0,5 – 100 мкг/л при погрешности измерений 29,4 %, в моче – 0,4 – 100 мкг/л при погрешности измерений 24,2 %, в волосах – 0,001 – 100 мкг/г при погрешности измерений 22,4 %. Установлены ПО (LOD) для крови 0,0015 мкг/л, для мочи 0,012 мкг/л, для волос 0,003 мкг/л.
Результаты и их обсуждение. Апробация предлагаемой методики проведена при обследовании пациентов стационара и поликлиники ФБУН «ФНЦ медико-профилактических технологий управления рисками здоровью населения» (табл. 6). В таблице представлены данные о содержании ртути в биосредах жителей Канады, России и Германии. В обследуемой нами группе детей содержание ртути в крови и моче ниже уровня БМЧ-1. В моче экспонированных взрослых содержание ртути превышает уровень БМЧ-1.Уровни ртути в моче у неэкспонируемых жителей России составляют 0,27–0,94 мкг/л [14], а в группе рабочих промышленного предприятия 0,2–25,3 мкг/л [15].
В группе детей содержание ртути в моче, найденное нами, находится на уровне такового у детей Германии [6].
Найденное нами содержание ртути в волосах взрослых соответствует всем приведенным литературным данным [1, 6].
Выводы:
-
1. На основании проведенных исследований предложены оптимальные условия рутинного анализа биосред при определении содержания общей ртути методом масс-спектрометрии с индуктивно связанной плазмой, позволяющие выполнять определение элемента в крови в диапазоне концентраций 0,5 – 100 мкг/л при погрешности измерений 29,4 %, в моче – 0,4 – 100 мкг/ л при погрешности измерений 24,2 %, в волосах – 0,001 – 100 мкг/г при погрешности измерений 22,4 %.
-
2. Получена высокая сходимость результатов определения ртути в крови при участии в международной программе испытаний LAMP (| Z |≤2).
-
3. Предлагаемая методика определения ртути в крови, моче и волосах методом ИСП-МС апробирована при обследовании детей и экспонированных взрослых. Полученные результаты удовлетворительно корреспондируются с литературными данными.
-
4. Уровни ртути в биосредах неэкспонированных жителей Пермского края не превышают рекомендованных ВОЗ уровней БМЧ-1.
Финансирование. Исследование не имело спонсорской поддержки.
Список литературы Методические и практические аспекты определения общей ртути в образцах цельной крови, мочи и волос методом масс-спектрометрии с индуктивно связанной плазмой
- Биомониторинг человека: факты и цифры . -Копенгаген: Европейское региональное бюро ВОЗ, 2015. -URL: http://www.euro.who.int/ru/health-topics/environment-and-health/health-impact-assessment/publications/2015/human-biomonitoring-facts-and-figures (дата обращения: 18.01.2018).
- Скальный А.В., Рудаков И.А. Биоэлементы в медицине. -М.: Мир, 2004. -272 с.
- Тиц Н.У. Клиническое руководство по лабораторным тестам. -М.: Юнимед-пресс, 2003. -960 с.
- Токсикологическая химия. Метаболизм и анализ токсикантов/под ред. Н.И. Калетиной. -М.: Издательская группа ГЭОТАР-Медиа, 2008. -1016 с.
- Программа Организации Объединенных Наций по окружающей среде. UNEP (DTIE)/Hg/INC.2/6,2/9. 22 October 2010 //DocPlayer.ru. -URL: http://docplayer.ru/72077878-Programma-organizacii-obedinennyh-naciy-po-okruzhayushchey-srede.html (дата обращения: 18.01.2018).
- Revised and new reference values for environmental pollutants in urine or blood of children in Germany derived from the German Environmental Survey on Children 2003-2006 (GerESIV)/Ch. Schulz, J. Angerer, U. Ewers, U. Heudorf, M. Wilhelm//Int. J. Hyg. Environ. Health. -2009. -Vol. 212. -P. 637-647.
- Trace elements in human biological material //ALS Scandinavia. -URL: https://www.alsglobal.se/media-se/pdf/reference_data_biomonitoring_120710.pdf (дата обращения: 18.01.2018).
- Goulle J.P., Mahieu L., Castermant J. Metal and metalloid multi-elementary ICP-MS validation in whole blood, plasma, urine and hair: Reference values//Forensic Science International. -2005. -Vol. 153. -P. 39-44.
- Карамова Л.М., Ларионова Т.К., Башарова Г.Р. Критерии экологической безопасности тяжелых металлов в крови человека//Медицина труда и промышленная экология. -2010. -№ 6. -С. 21-23.
- Иваненко Н.Б., Иваненко А.А., Носова Е.Б. Определение токсических и фоновых содержаний ртути в крови атомно-абсорбционным методом с электротермической атомизацией и Зеемановской модуляционной поляризационной коррекцией фона//Вестник Санкт-Петербургского университета. Физика и химия. -2010. -№ 4. -С. 97-104.
- Использование Зеемановского спектрометра для определения ртути в моче/С.Е. Погарев, В.В. Рыжов, Т.В. Древаль, Н.Р. Машьянов//Экологическая химия. -1994. -Т. 3. -С. 227.
- Иваненко Н.Б., Ганеев А.А., Соловьев Н.Д. Определение микроэлементов в биологических жидкостях (Обзор)//Журнал аналитической химии. -2011. -Т. 66, № 9. -С. 900-915.
- Определение химических форм микроэлементов в биологических объектах/Н.Б. Иваненко, Н.Д. Соловьёв, А.А. Иваненко, Л.Н. Москвин//Аналитика и контроль. -2012. -Т.16, № 2. -С. 108-133.
- Применение стандартизованной методологии биомониторинга человека для оценки пренатальной экспозиции к ртути/А.И. Егоров, И.Н. Ильченко, С.М. Ляпунов, Е.Б. Марочкина, О.И. Окина, Б.В. Ермолаев, Т.В. Карамышева//Гигиена и санитария. -2014. -Т. 93, № 5. -С. 10-18.
- Оценка биомаркеров экспозиции к сварочному аэрозолю/Е.В. Зибарев, М.В. Чащин, С.М. Никонова, З.С. Кусраева, А.В. Кузьмин, D.G. Ellingsen, Y. Thomassen//Медицина труда и промышленная экология. -2010. -№ 4. -С.14-17.
- Results of the Canadian Health Measures Survey Cycle 1 (2007-2009) [Электронный ресурс] // Government of Canada. - URL: https://www.canada.ca/en/health-canada/services/environmental-workplace-health/reports-publications/environmental-contaminants/report-human-biomonitoring-environmental-chemicals-canada-health-canada-2010.html (дата обращения: 18.01.2018).
- Heitland P., Koster H.D. Biomonitoring of 37 trace elements in blood samples from inhabitants of northern Germany by ICP -MS//J. of Trace Elements in Medicine and Biology. -2006. -Vol.20. -P. 253-262.


