Методика моделирования и расчета свойств неравновесных фаз молекулярных систем
Автор: Герман Евгений Иванович, Цыдыпов Шулун Балдоржиевич
Журнал: Вестник Бурятского государственного университета. Математика, информатика @vestnik-bsu-maths
Рубрика: Математическое моделирование и обработка данных
Статья в выпуске: 1, 2017 года.
Бесплатный доступ
Рассмотрены принципы модернизации метода молекулярной динамики для возможности моделирования неравновесных фаз молекулярных систем. Приведены результаты апробации данной методики в компьютерном эксперименте.
Молекулярная динамика, фазовые переходы, неравновесные системы, алгоритм верле
Короткий адрес: https://sciup.org/14835259
IDR: 14835259 | УДК: 519.688+536.4.032.2 | DOI: 10.18101/2304-5728-2017-1-72-77
Текст научной статьи Методика моделирования и расчета свойств неравновесных фаз молекулярных систем
Метод молекулярной динамики (МД) является уникальным инструментом моделирования термодинамических систем, позволяющим прослеживать фазовые траектории вещества. В настоящее время существует ряд программных решений основанных на МД, позволяющих моделировать молекулярные системы в равновесных состояниях. Однако, известные программные продукты (CHARMM, LAMMPS, HOOMD, GROMACS, NAMD) более направлены на моделирование состояний с заданными термодинамическими параметрами (ансамблей) и малопригодны для имитации термодинамических процессов протекающих с большой скоростью (быстрое охлаждение, быстрое прессование), поэтому неравновесное моделирование с помощью вышеуказанных программ сводится к инициализации систем в одних только критических областях и точках фазовых переходов. Наибольший же интерес представляет эволюция молекулярной системы в широком температурном интервале в процессе достаточно быстрого охлаждения. Нами предложена методика моделирования процессов быстрого изохорического и изобарического охлаждения молекуляр- ной системы, а также приемы расчета физических свойств материалов по результатам компьютерного эксперимента.
1. Классический метод молекулярной динамики
Методика МД заключается в решении уравнений движения для системы многих частиц. Так, силу, действующую на i-ю частицу, можно представить в форме суммы векторов d 2 r( t) "-* dФ ( r)
m--= -> ---— dt2 j dr где Ф(г) - потенциал взаимодействия частиц системы, m - масса частицы, r - радиус вектор частицы.
Любой алгоритм, реализующий МД, сводится к наиболее оптимальному по производительности и точности численному интегрированию уравнения (1).Широкое применение имеет алгоритм Верле в скоростной форме, согласно которому координаты и скорости частиц на каждой итерации вычисляются в следующей последовательности:
В отсутствие внешних сил система частиц должна прийти к термодинамическому равновесию с заданными температурой, плотностью и давлением. Проведение эксперимента, моделирующего термодинамические процессы, предполагает модернизацию алгоритма путем введения процедур корректировки скоростей (процесс изменения температуры системы) или размеров ячейки моделирования (процесс изменения плотности системы).
ячейки моделирования и расстояния между частицами для поддержания постоянного давления системы. На практике применяются два основных метода поддержания давления: баростат Андерсена [1] и баростат Бе-рендсена [2]. Метод Андерсена коренным образом меняет алгоритм Верле путем введения обобщенных координат связанных с размерами системы и скоростью изменения этих размеров, этот алгоритм довольно сложно реализуем, а жесткость баростата не позволяет моделировать процессы быстрого изменения температуры. В работе баростата Берендсена необходимо иметь известное значение изотермической сжимаемости для каждой точки фазовой траектории, что для моделирования неравновесных процессов невозможно.
Рапапорт [3] описывает организацию ансамбля с постоянным числом частиц, давлением и температурой. Здесь используется баростат, корректирующий положения частиц и размеры системы на коэффициент д , выведенный из лагранжиана ( NPT) -ансамбля:
„ = 1 +_____ P(V )- P _____, (6)
3 P (V) -V Фjrj|3V i < j где P - заданное давление, P(V) - давление, рассчитанное на данной итерации моделирования. Такой коэффициент пригоден для небольших флуктуаций давления и практически не поддерживает постоянным давление в процессе быстрого охлаждения. Однако, мы применили этот метод в циклической процедуре (рис. 1), позволяющей поддерживать давление с точностью 1% даже в случаях с резким перепадом температуры.
Вход в процедуру
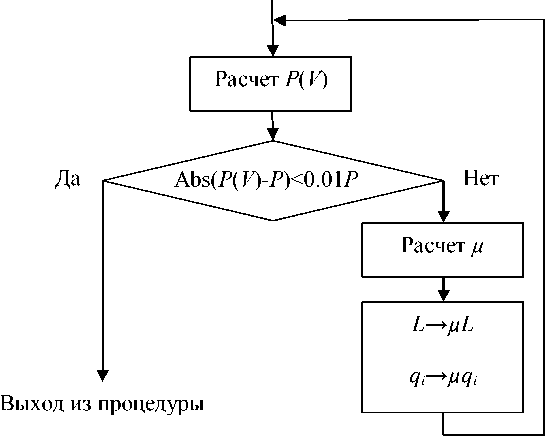
Рис. 1. Процедура баростатирования
Моделирование изобарного охлаждения дает возможность численного определения таких характеристик как изобарная теплоемкость С p и изотермическая сжимаемость β T .
Так, получив в результате компьютерного эксперимента температурную зависимость энтальпии H, можно вычислить изобарическую тепло- емкость:
Cp = [—1 . (7)
p I dT ) P
Для определения сжимаемости необходимо получение двух изобар с близкими значениями давления P1 и P2. По разностям плотностей на фа- зовых кривых изотермическая сжимаемость определяется следующим выражением:
в т = — PP 1 < p > P 1
—
—
pP 1
, P 2
где ρ P1 и ρ P2 – плотности систем под давлением P 1 и P 2 при одинаковых температурах.
-
3. Апробация
На основе описанной методики разработана программа моделирования молекулярных систем MDDX11[4]. С помощью этой программы нами проведен ряд экспериментов, моделирующих процессы равновесного и неравновесного охлаждения системы частиц аргона.
На рис. 2 представлена температурная зависимость теплоемкости C p аргона полученная по результатам моделирования равновесного охлаждения аргона. Для сравнения здесь же представлены литературные данные [5].
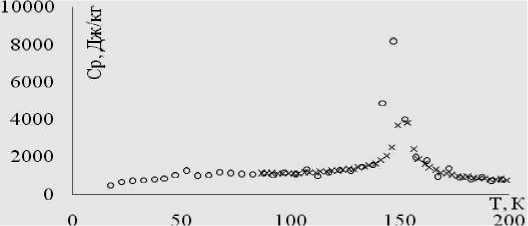
Рис. 2. Изобарическая теплоемкость аргона при давлении 5 МПа: o – результаты нашего компьютерного эксперимента, х – литературные данные [5].
Как видно, результаты хорошо согласуются с литературными данными, в областях фазовых переходов при температурах ~55 и ~155 К прослеживаются характерные изменения в зависимости C p ( T ).
На рис. 3 и 4 представлены результаты расчета сжимаемости по данным моделирования равновесного и неравновесного охлаждения соответственно.
0.5
0.4
0.3
0.2
0.1
о

10 60 110 160 210
Рис. 3. Изотермическая сжимаемость аргона при давлении 4 МПа по данным компьютерных экспериментов, моделирующих охлаждение аргона со скоростью 109 К/с.
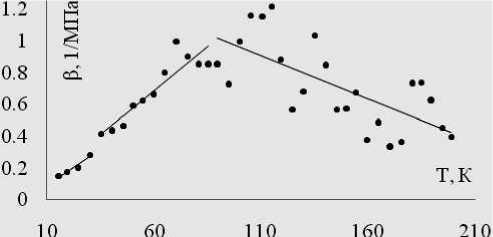
Рис. 4. Изотермическая сжимаемость аргона при давлении 4 МПа по данным компьютерных экспериментов, моделирующих охлаждение аргона со скоростью 1012К/с.
На графике температурной зависимости сжимаемости (рис. 3), полученной по данным эксперимента с равновесным медленным охлаждением, можно разделить газовую, жидкую и кристаллическую фазы.
Для неравновесного процесса охлаждения со скоростью 1012 К/с температурная зависимость сжимаемости (рис. 4) претерпевает резкое изменение в окрестностях точки ~90 К, возможно, это характеризует переход неравновесный газ (перенасыщенный пар) – неравновесная жидкость (смесь газа с кластерами жидкости). Также можно отметить переход в окрестностях ~30 К, вероятно соответствующий переходу нестабильной жидкости в аморфную фазу.
Заключение
Предложена методика моделирования равновесных и неравновесных молекулярных систем, позволяющая рассчитывать изобарическую сжимаемость и изотермическую теплоемкость. Результаты апробации хорошо согласуются с эмпирическими данными и наглядно демонстрируют фазовые закономерности вещества при равновесном и неравновесном охлаждении.
Список литературы Методика моделирования и расчета свойств неравновесных фаз молекулярных систем
- Andersen Н. Molecular dynamics simulations at constant pressure and/or temperature//The Journal of Chemical Physics. -1980. -Vol. 72, No. 4. -P. 2384 -2393.
- Berendsen H. J., Postma J. P. Molecular dynamics with coupling to an external bath//The Journal of Chemical Physics. -1984. -Vol. 81, No. 8. -P. 3684 -3690.
- Rapaport D. C. The Art of Molecular Dynamics Simulation/D.C. Rapaport. -Cambridge: Cambridge University Press, 2004. -564 p.
- Свид. 2016617783 Российская Федерация. Свидетельство об официальной регистрации программы для ЭВМ. Программа моделирования молекулярных систем MDDX11/Е.И. Герман; заявитель и правообладатель Е.И. Герман (RU). -№2016615005; заявл. 20.08.2016; опубл. 14.07.2016, Реестр программ для ЭВМ. -1 с.
- Thermophysical properties of fluid systems . -NIST. -Режим доступа: http://webbook.nist.gov/chemistry/fluid/, свободный. -Загл. с экрана.


