Методология расчета площади локального отека кожи при раке молочной железы
Автор: Амосова В. А., Загаштокова А. К., Карпова М. С., Понедельникова Н. В., Касымова А. А., Трофимова О. П., Фролова М. А., Макаров Е. С., Петровский А. В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 4 т.11, 2021 года.
Бесплатный доступ
Рак молочной железы с вовлечением кожи - одна из наименее изученных и, в то же время, сложно поддающихся лечению форм. Несмотря на достижения современной диагностики, многие вопросы, касающиеся определения степени выраженности отека кожи и количественной оценки динамики на фоне неоадъювантной лекарственной терапии, зачастую вызывают ряд сложностей. В свою очередь, это может привести как к неправильному стадированию и «перелечиванию» пациентов, так и к субъективности в оценке ответа на проводимое лечение. Ранее были предложены различные подходы для расчета степени выраженности отека, однако широкого распространения они не получили. В данной статье представлен разработанный нами метод, позволяющий определить площадь отека кожи, который в дальнейшем позволит индивидуализировать подходы к лечению.
Рак молочной железы, стадирование, поражение кожи, локальный отек
Короткий адрес: https://sciup.org/140290750
IDR: 140290750 | DOI: 10.18027/2224-5057-2021-11-4-14-22
Текст научной статьи Методология расчета площади локального отека кожи при раке молочной железы
Особой разновидностью рака молочной железы (РМЖ) является форма с вовлечением кожи в опухолевый процесс. Согласно международной классификации TNM, под «классической» отечной формой подразумевают два основных подтипа — первичный (inflammatory, воспалительный, T4d) отечно-инфильтративный рак, при котором опухолевый узел отсутствует, и вторичный (узловой, noninflammatory, T4b-c) с наличием опухолевой массы в ткани железы [1]. Первый вариант — один из наиболее агрессивных и, в то же время, редко встречающихся, требующих соответствующих подходов к лечению и отдельного исследования. Второй вариант имеет большую распространенность в клинической практике, в связи с чем является предметом изучения в данной статье.
Характерным отличием отечной формы РМЖ является то, что диагноз выставляется клиницистами, а не патоморфологами, на основании макроскопической картины отека кожи (наличие лимонной корки, утолщения, гиперемии). Никаких других критериев для стадирования данной категории пациентов не существует. При этом правильная оценка вовлечения кожи при РМЖ необходима для своевременного начала комплексного лечения и улучшения его результатов.
В настоящее время основными являются стандартные методы визуализации, такие как маммография (ММГ) и ультразвуковое исследование (УЗИ), а в качестве дополнительного используется магнитно-резонансная томография (МРТ). Еще в 1966 г. Morrish говорил о значимости ММГ для оценки отека (в частности, определения утолщения)
кожи. В своей работе он также подчеркивал, что данный процесс может быть как локальным, так и генерализованным (тотальным) и иметь ряд причин. В первом случае это характерно при травме, воспалении, протоковой эктазии, после биопсии, а также как проявление рака; во втором — после проведенного оперативного вмешательства или как следствие лимфатической обструкции, воспаления, лучевой терапии, а также при отечно-инфильтративной форме рака и т. д. [2].
В целом классические рентгенологические изменения у пациентов с отечной формой РМЖ включают в себя периферическое утолщение кожи, области ареолы, трабекул, локальное или диффузное увеличение плотности паренхимы, наличие объемного новообразования с признаками злокачественности [3–4]. При этом утолщение кожи — наиболее частый рентгенологический признак, являющийся результатом нарушения дренажной функции лимфатических сосудов кожи, которые обтурируются опухолевыми эмболами [5].
Однако существует гипотеза о том, что некоторые поверхностные злокачественные новообразования молочной железы без прямого поражения кожи могут также вызывать локальный отек или воспаление вышележащей кожи, что является вторичным изменением вследствие лимфатической или венозной обструкции. [6]. В этих случаях радиолог должен быть осторожен, чтобы избежать ошибочного диагноза, но зачастую это практически невозможно. Несмотря на комплексное применение различных методов диагностики, по-прежнему существует ряд сложностей в визуализации такого отека (двойной контур за счет выраженного втяжения над опухолевым узлом, проведение маммографии после биопсии, качество изображений и разрешение станций, субъективный анализ полученных данных специалистом и т. д.). Как правило, такие случаи являются предметом споров на консилиумах, а также причиной ошибок в постановке диагноза и задержкой для начала лечения. Основной вопрос в этом случае — должны ли пациенты с локальным и отграниченным утолщением кожи над опухолевым узлом стадироваться как Т4? Как определить и вычислить степень выраженности этого отека? Какой процент отека кожи молочной железы можно действительно считать «локальным» и не требующим неоадъювантного лекарственного лечения? А в случае проведения данной терапии — как проследить и правильно оценить его динамику?
В нескольких небольших ретроспективных исследованиях сообщалось о том, что отек кожи имеет гораздо меньшее прогностическое значение, чем, например, размер опухолевого узла. Этот факт в 1981 г. был подтвержден Zucali с соавт., продемонстрировавшими, что пациенты с Т4 и опухолями <3 см имели лучшую общую выживаемость через 5 лет, чем пациенты с опухолями 3–5 см (71,3% против 34,7%) [7]. В 2005 г. Guth с соавт. отметили, что у 119 пациентов с опухолями ≤5,0 см наличие отека кожи не влияло на результаты раково-специфической выживаемости по сравнению с контрольной группой пациентов, имеющих опухоли аналогичных размеров, но без отека кожи [8]. Год спустя, в многофакторном анализе было доказано, что отек кожи не является значимым предиктором выживаемости. На основании этих данных был сделан вывод о том, что имеющаяся классификация не является подходящей для группы пациентов с Т4 [9–11]. В нескольких других систематических исследованиях также сообщалось о сильно различающихся прогностических и терапевтических последствиях РМЖ с локальным отеком кожи, в результате чего было предложено пересмотреть систему TNM с целью возможного добавления каких-либо характеристик, касающихся степени поражения кожи [12–14].
В 2019 г. было опубликовано наиболее крупное исследование, включившее данные больных National Cancer Data Base с I–III стадией в период с 2004 по 2011 гг. Целью данной работы являлась оценка эффективности лекарственного и лучевого методов лечения у пациентов с отеком кожи — Т4 (включая пациентов с локальным отеком) в зависимости от размера опухолевого узла (в особенности <2 см), и у пациентов с Т1–3. Было продемонстрировано, что при одних и тех же характеристиках частота проведения лучевой и химиотерапии у больных с отеком оказалась выше. Однако авторы данного исследования подчеркнули, что пациенты с размером опухолевого узла менее 2 см, но имеющие локальный отек (классифицируемые как Т4) также получают химиотерапевтический и лучевой виды лечения, что, например, не происходит при опухолях большего размера, но без поражения кожи — т. е. не всегда обоснованно (с воз- можным «перелечиванием» больных). В связи с этим, авторы также обращают внимание на необходимость выработать дополнительные критерии для стадирования (определения степени отека) и лечения данной категории больных [15].
Полученные данные свидетельствуют о том, что поражение кожи при РМЖ является предметом многочисленных споров и различных подходов к стадированию и лечению данных пациентов. Еще в 1984 г. в своем исследовании Pope с соавт. проводили измерение толщины кожи по маммографическим снимкам. Оказалось, что толщина может варьировать в зависимости от локализации квадранта (например, диапазон 0,7–2,3 мм характерен в верхнем квадранте, а 0,7–2,7 мм в нижнем квадранте), тогда как толщина кожи более 2,5 мм свидетельствует о наличии заболевания — рак, инфекция, травма либо следствие лучевой терапии или послеоперационных изменений и пр. [16]. В дальнейшем, для определения степени и выраженности «локальности» отека и точной постановки диагноза неоднократно предпринимались попытки разработки системы количественного определения степени отека кожи (с помощью пликометрии, радиотермометрии и пр.), которые, однако, не получили широкого применения в клинической практике [17–19]. В то же время, описание снимков ММГ или МРТ, а также применение УЗИ молочных желез не всегда позволяет четко сформировать картину о степени поражения кожи, в том числе об изменениях на фоне лекарственной терапии, что, в свою очередь, затрудняет интерпретацию полученных данных и приводит к ошибкам в подходах к лечению.
Безусловно, проводился ряд исследований, в которых оценивался ответ опухоли после проведенного лекарственного лечения с использованием различных методов диагностики [20–29]. Однако основным минусом данных исследований стало то, что, несмотря на оценку различных показателей (изменение размера опухолевого узла, плотность ткани, наличие микрокальцинатов и пр.), практически нигде не было описано изменений, касающихся непосредственно степени вовлечения кожи (например, добавление такого критерия как уменьшение отека/покраснения/утолщения в процентном соотношении по сравнению с исходным и др.).
Сегодня интерес к проблеме отечной формы РМЖ возрастает, в литературе появляется все больше работ по данной теме. В то же время представленные исследования лимитированы небольшим числом больных, короткими сроками наблюдения, многие имеют недостатки в дизайне, что в значительной степени затрудняет объективную оценку результатов. Отсутствие четко определенных критериев включения касательно степени выраженности клинической картины кожных симптомов является фундаментальным недостатком большинства исследований, посвященных изучению выживаемости, прогнозов, определения соответствующей тактики лечения. Все больше клиницистов задаются вопросом правильности стадирования пациентов и оценки динамики опухолевого процесса на фоне неоадъювантного лекарственного лечения, в связи с чем в данной статье нами предложен метод расчета, позволяющий определить площадь локального поражения (отека кожи) и в дальнейшем выработать критерии «локальности» для определения категории сходных по прогнозу пациентов, а также индивидуализации подходов в терапии, что будет способствовать улучшению их качества жизни.
Для наглядности можно рассмотреть следующий пример:
МЕТОД РАСЧЕТА
Концепция данного метода заключается в том, что условно молочную железу можно представить в виде половины сферы. При этом, как известно, полная площадь поверхности сферы рассчитывается по формуле
S = 4πrh r — радиус;
h — высота.
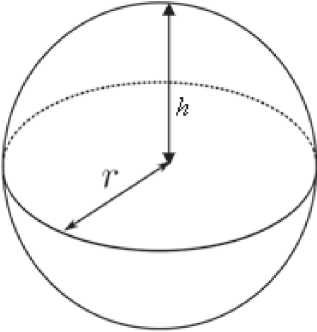
Рисунок 1. Сфера — схема.
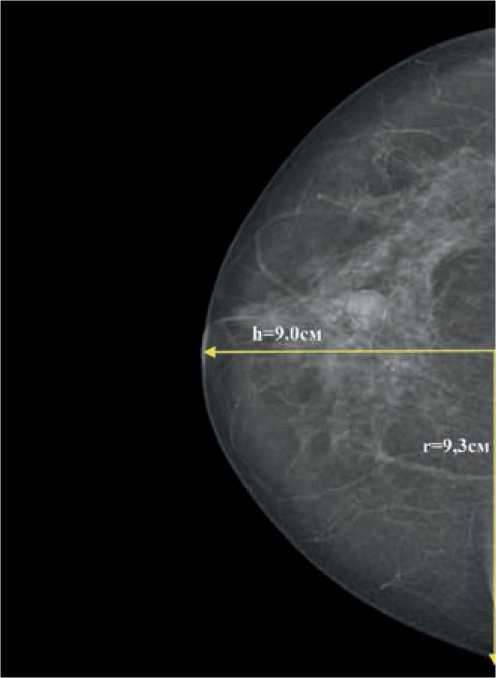
Рисунок 3. Маммограмма — отек кожи всей молочной железы.
Согласно нашей теории, площадь поверхности молочной железы будет равна половине площади поверхности сферы и определяться по формуле
S = 2πrh r — радиус;
h — высота.
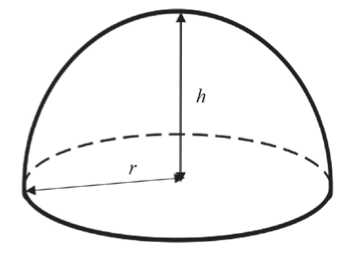
Рисунок 2. Половина сферы — схема.
S = 2πrh = 2 × 3,14 × 9 × 9,3 = 525,6 см2
-
т. е. площадь отека кожи
в данном случае равна 525,6 см2.
Среди всех методов визуализации в диагностике локального (и в целом диффузного) отека кожи маммография характеризуется наиболее высокой эффективностью за счет возможности анализа симметричных зон «суммационного» изображения органа. Создаваемая компрессия позволяет нивелировать разницу в форме молочной железы и стандартизовать расчеты. При этом основным признаком отека кожи является ее утолщение, которое визуализируется в двух проекциях — фронтальной и саггитальной. В случае локального отека данное утолщение можно отграничить отрезком, а к его середине опустить перпендикуляр до пересечения с контуром железы. В том случае, если из данной точки пересечения к концам отрезка достроить две боковые стороны треугольника в каждой из проекций, то площадь локального отека (Sl) кожи молочной железы можно представить как площадь овала:
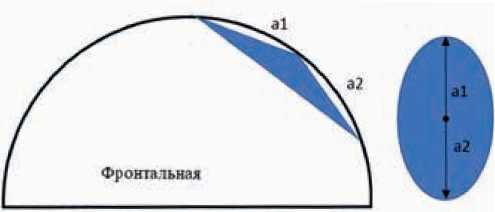
Рисунок 4. Локальный отек кожи молочной железы — схема.
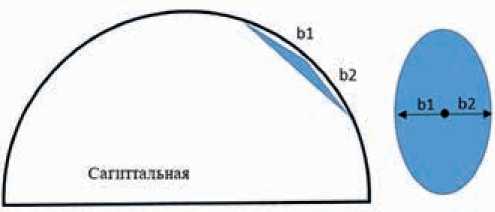
Тогда площадь локального отека можно рассчитать по следующей формуле:
(a1 + a2) × (b1 + b2)Sl = × π
Например (рис. 5):
Площадь локального отека кожи равна:
Sl = (6,0 + 6,1) ×2 ( 7 , 4 + 3 , 5 ) × 3,14 = 207,1 см2
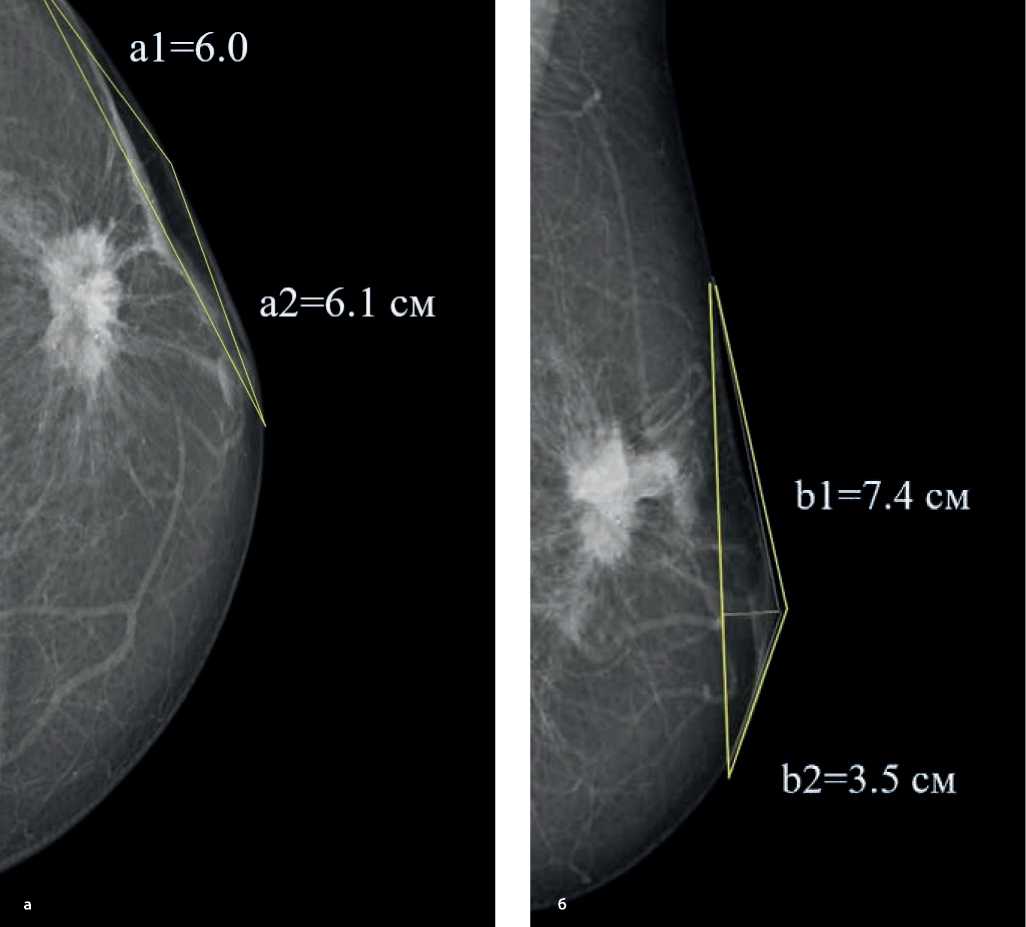
Рисунок 5. Маммограммы в прямой (а) и косой (б) проекциях — локальный отек кожи.
Соответственно, для того чтобы рассчитать процентное соотношение локального поражения (отека) кожи к общей площади поверхности кожи, необходимо использовать следующую формулу:
Sl (%) = SS l × 100 %S (%) = S l × 100 % = 207,1 × 100 % = 39 %l S 52 5,6
Кроме того, с помощью данной формулы также возможна оценка динамики ответа на лекарственную терапию.
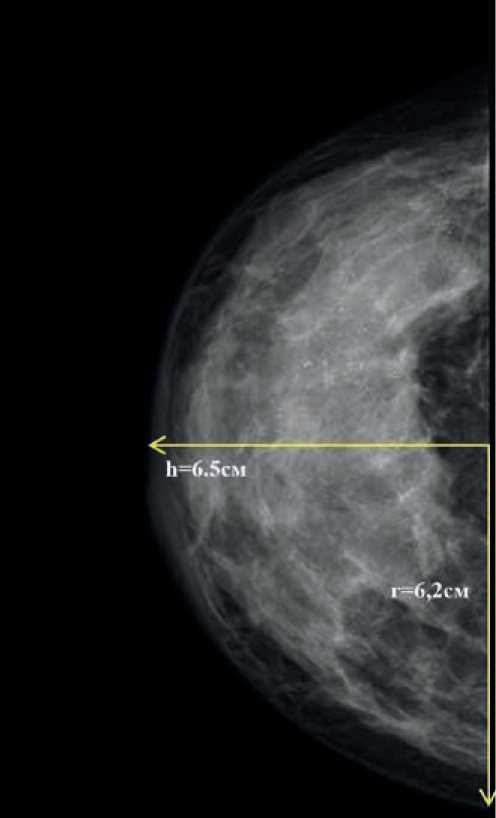
Рисунок 6. Маммограмма — тотальный отек кожи (до проведения неоадъювантного лекарственного лечения).
На первом этапе рассчитываем площадь отека кожи всей молочной железы:
S = 2πrh = 2 × 3,14 × 6,2 × 6,5 = 253,1 см2
На фоне проводимого неоадъювантного лекарственного лечения отек уменьшился и стал локальным. Для расчета производим необходимые замеры и подставляем значения в представленную выше формулу:
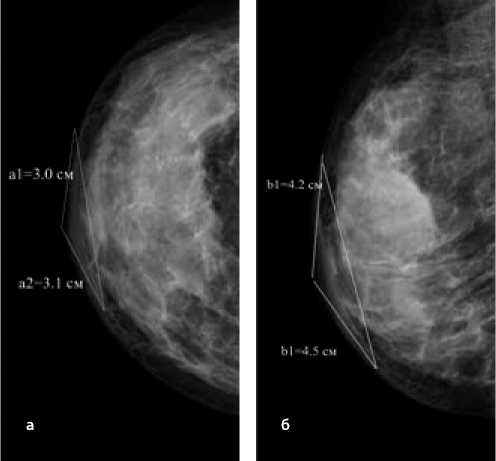
Рисунок 7. Маммограммы во фронтальной (а) и саггитальной (б) проекциях — локальный отек кожи (после проведения неоадъювантного лекарственного лечения).
Sl = (3,0 + 3,1) ×2 ( 4 , 2 + 4 , 5 ) × 3,14 = 83,3 см2
Таким образом, в настоящее время локальный отек составляет 33% от исходного:
S (%) = Sl× 100 % = 83,3 см2× 100 % = 33 %l S 25 3 ,1 см 2
Однако в некоторых случаях на фоне проводимого неоадъювантного лекарственного лечения изменяется не площадь поражения кожи, а толщина. В этих случаях мы предлагаем измерять толщину кожи в трех точках и указывать эти данные в описании ММГ (пример — см. рис. 8):
ДАННЫЕ СОБСТВЕННОГО ИССЛЕДОВАНИЯ
Данный метод расчета использовался в ретроспективном исследовании, проведенном на базе ФГБУ НМИЦ онкологии им. Н.Н. Блохина Минздрава России. В исследование были включены 182 больных местнораспространенным первично не операбельным РМЖ с отеком кожи, получивших на первом этапе неоадъювантную лекарственную терапию. Далее 91 пациентка (I группа) проходила хирургическое лечение с последующей дистанционной лучевой терапией (ДЛТ), 41 — лучевое без последующей операции (II группа), 50 — лучевое
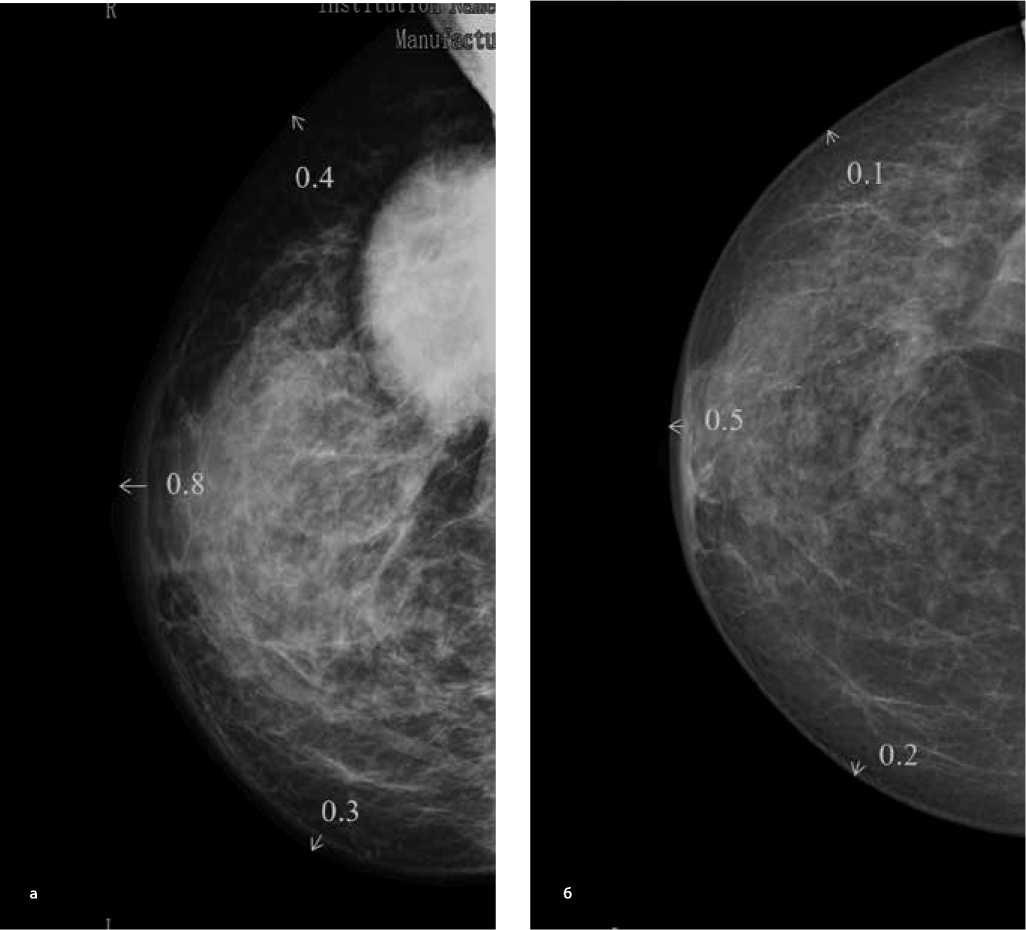
Рисунок 8. Маммограммы во фронтальной (а) и саггитальной (б) проекциях– локальный отек кожи (после проведения неоадъювантного лекарственного лечения).
с последующей операцией (III группа). Измерение проводились по ММГ-снимкам непосредственно до начала и по окончанию лекарственного лечения. Значительных различий в степени выраженности отека выявлено не было. Так, средний процент отека до начала НАЛТ составил 76,3% в I группе, 73,4% — во II группе и 70,1% — в III группе (р=0,675). Проведение лекарственного лечения способствовало уменьшению отека у 38 больных (21 %), из которых 22 (12,2%) были прооперированы, 16 (8,8%) получили ДЛТ +/-операция. Стабилизация отмечалась у 133 (73%) больных (из них 66 (36,3%) — прооперированы, 67 (36,7%) получили ДЛТ +/-операция). Увеличилась площадь отека у 11 больных (6%), из которых 3 (1,6%) все равно прооперировали, остальные (4,4%) получили ДЛТ +/-операция. В результате средний процент отека кожи молочной железы больных, получивших хирургическое лечение перед ДЛТ, составил 62,3%, а у пациентов, получивших ДЛТ после НАЛТ — 65,2% (60,2% — во II группе и 69,1 % — в III группе). Различия оказались недостоверны, р = 0,286.
ВЫВОДЫ
Таким образом, для полноценной диагностики и оценки ответа на проведенное неоадъювантное лекарственное лечение при РМЖ с поражением кожи, использование только диагностических методов исследования (ММГ, УЗИ или МРТ) недостаточно, поэтому мультимодальный подход с применением данных расчетов должен прочно занять свое место в диагностическом алгоритме и помочь рас- считать критерии локальности, необходимые как для установки диагноза, так и своевременного начала лечения. В этой ситуации необходимы дальнейшие исследования, которые позволят определять категории пациентов сходных по прогнозу, а также индивидуализировать подходы к локальному и системному лечению.
Список литературы Методология расчета площади локального отека кожи при раке молочной железы
- NCCN Guidelines Version 2.2021 Breast Cancer
- Morrish HF. The significance and limitations of skin thickening as a diagnostic sign in mammography. Am J Roentgenol Radium Ther Nucl Med. 1966 Apr;96 (4):1041-5.
- Loehberg CR, Lux MP, Ackermann S. Neoadjuvant chemotherapy in breast cancer; which diagnostic procedures can be used? Anticancer Res 2005;25:2519-26.
- Yang W. T., Le-Petross H. T., Macapinlac H. et al. Inflammatory breast cancer: PET/CT, MRI, mammography, and sonography findings. Breast Cancer Res. Treat. 2008; 109: 417-426.
- Gunhan-Bilgen I., Ustun E. E., Memis A. Inflammatory breast carcinoma: mammographic, ultrasonographic, clinical, and pathologic findings in 142 cases. Radiology. 2002; 223: 829-838.
- Kalli S, Freer PE, Rafferty EA. Lesions of the skin and superficial tissue at breast MR imaging. Radiographics 2010;30:1891-1913
- Zucali R, Kenda R. Small Size-T4 Breast-Cancer. Natural History and Prognosis. Tumori. 1981;67 (3):225-30.
- Guth, U., Singer, G., Schotzau, A., Langer, I., Dieterich, H., Rochlitz, C., ... Wight, E. (2005). Scope and significance of non-uniform classification practices in breast cancer with non-inflammatory skin involvement: a clinicopathologic study and an international survey. Annals of Oncology, 16 (10), 1618-1623.
- Guth U, Singer G, Langer I, et al. T4 category revision enhances the accuracy and significance of stage III breast cancer. Cancer 2006;106:2569-2575.
- Guth U, Wight E, Schotzau A, et al. A new approach in breast cancer with non-inflammatory skin involvement. Acta Oncol 2006;45:576-583
- Guth U, Wight E, Singer G. Breast cancer with noninflammatory skin involvement: new data revise the traditional image of a «classical» clinicopathologic entity. Praxis (Bern 1994) 2006;95:1829-1835
- Gueth U, Wight E, Schoetzau A, et al. Non-inflammatory skin involvement in breast cancer, histologically proven but without the clinical and histological T4 category features. J Surg Oncol 2007;95:291-297.
- Wieland AW, Louwman MW, Voogd AC, van Beek MW, Vreugdenhil G, Roumen RM. Determinants of prognosis in breast cancer patients with tumor involvement of the skin (pT4b). Breast J 2004;10:123-128
- Silverman D, Ruth K, Sigurdson ER, Egleston BL, Goldstein LJ, Wong YN, Boraas M, Bleicher RJ. Skin involvement and breast cancer: are T4b lesions of all sizes created equal? J Am Coll Surg. 2014 Sep;219 (3):534-44).
- Mateo AM, Mazor AM, DeMora L, Sigurdson ER, Handorf EA, Daly JM, Aggon AA, Obeid E, Hayes SB, Bleicher RJ. Patterns of Care and Efficacy of Chemotherapy and Radiotherapy in Skin-Involved Breast Cancers of All Sizes. Clin Breast Cancer. 2019 Aug;19 (4):292-303.
- Pope TL Jr, Read ME, Medsker T, Buschi AJ, Brenbridge AN. Breast skin thickness: normal range and causes of thickening shown on film-screen mammography. J Can Assoc Radiol. 1984 Dec;35 (4):365-8.
- Ermakov A. V., Saribekyan E. K., Stepanov S. O., Rubtsova N. A., Kolesnikova E. V. The using of the instrumental methods of skin thickness measurement for the diagnosis of inflammatory breast cancer. Malignant Tumours 2015; 4: 24-27.
- Колесник А. Ю., Шершнева М. А., Меских Е. В., Чхиквадзе В. Д., Нуднов Н. В. Новые подходы к диагностическому алгоритму отечноинфильтративной формы рака молочной железы (обзор литературы). Медицинская визуализация. -2014. - №5 - С. 124-129.
- Бурдина Л. М. и др. Применение радиотермометрии для диагностики рака молочной железы. Маммология. 1998. №2. С. 3-12
- Cheung YC, Chen SC, Su MY, See LC, Hsueh S, Chang HK, Lin YC, Tsai CS. Monitoring the size and response of locally advanced breast cancers to neoadjuvant chemotherapy (weekly paclitaxel and epirubicin) with serial enhanced MRI. Breast Cancer Res Treat. 2003 Mar;78 (1):51-8.
- Londero V, Bazzocchi M, Del Frate C, Puglisi F, Di Loreto C, Francescutti G, Zuiani C. Locally advanced breast cancer: comparison of mammography, sonography and MR imaging in evaluation of residual disease in women receiving neoadjuvant chemotherapy. Eur Radiol. 2004 Aug;14 (8):1371-9.
- Manal Hamisa, Naglaa Dabess, Raghda Yosef, Fatma Zakeria, Qanet Hammed, Role of breast ultrasound, mammography, magnetic resonance imaging and diffusion weighted imaging in predicting pathologic response of breast cancer after neoadjuvant chemotherapy, The Egyptian Journal of Radiology and Nuclear Medicine, 46 (1) 2015, 245-257
- Whitman GJ, Strom EA. Workup and staging of locally advanced breast cancer. Semin Radiat Oncol 2009;19 (4):211
- Gonzalez AM. Breast cancer, neoadjuvant chemotherapy and residual disease. Clin Transl Oncol 2010;12 (7):461-7.
- Rieber A, Brambs H, Gabelmann A. Breast MRI for monitoring response of primary breast cancer to neo-adjuvant chemotherapy. Eur Radiol 2002;12:1711-9.
- Martincich L, Montemurro F, De Rosa G. Monitoring response to primary chemotherapy in breast cancer using dynamic contrast-enhanced magnetic resonance imaging. Breast Cancer Res Treat 2004;83 (1):67-76.
- Shoma A, Moutamed A, Ameen M. Short communication: ultrasound for accurate measurement of invasive breast cancer tumor size. Breast J 2006;12 (3):252-6.
- Wright FC, Zubovits J, Gardner S. Optimal assessment of residual disease after neo-adjuvant therapy for locally advanced and inflammatory breast cancer-clinical examination, mammog- raphy, or magnetic resonance imaging? J Surg Oncol 2010;101 (7): 604-10
- Chen M, Zhan WW, Han BS. Accuracy of physical examination, ultrasonography, and magnetic resonance imaging in predicting response to neo-adjuvant chemotherapy for breast cancer. Chin Med J 2012;125(11):1862-6.


