Методы синтеза сурьмаорганических производных дикарбоновых и гидроксикислот. Молекулярная структура бицинхонината бис(тетрафенилсурьмы)
Автор: Губанова Юлия Олеговна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 1 т.12, 2020 года.
Бесплатный доступ
Реакция пентафенилсурьмы с бицинхониновой кислотой (2:1 мол., толуол) протекает с замещением атомов водорода на фрагмент Ph4Sb и образованием бицинхонината бис (тетрафенилсурьмы) (1). Согласно данным РСА, проведенного на дифрактометре D8 QUEST фирмы Bruker, криталлографические параметры элементарной ячейки соединения: пространственная группа C2/c, а = 25,332(16), b = 18,361(13), c = 15,250(14) Å, α = 90,00°, β = 104,17(4), γ = 90,00°, V = 6877(9) Å3, ρвыч = 1,162 г/см3, Z = 8. Молекула соединения 1 является центросимметричной, атомы сурьмы имеют искаженную тригонально-бипирамидальную координацию. Аксиальный угол OSbC равен 176,49(12)°, сумма углов СSbC в экваториальной плоскости - 356,7(15)°. Аксиальная связь Sb-Cакс длиннее экваториальных и составляет 2,166(3)Å, экваториальные связи Sb-Cэкв - 2,105(4)-2,125(4) Å. Длина связи Sb-O равна 2,269(2) Å, внутримолекулярное расстояние Sb∙∙∙O=С - 3,116(3) Å. По реакции перераспределения лигандов взаимодействием 1 моля пентафенилсурьмы с 1 молем бис (2,6-дигидроксибензоата) трифенилсурьмы в бензоле при комнатной температуре получен 2,6-дигидроксибензоат тетрафенилсурьмы (2). Соединение 2 было выделено с выходом 85 % и представляет собой коричневые кристаллы с т. пл. 215 °С. В ИК-спектре, снятом на ИК-Фурье спектрометре Shimadzu IRAffinity-1S в таблетке KBr в области 4000-400 см-1, имеется полоса поглощения карбонильной группы с частотой 1616 см-1, которая смещена в область низкочастотных колебаний по сравнению с ИК-спектром исходной кислоты, равным 1705 см-1 и совпадает с аналогичной полосой в спектре соединения 2, синтезированного из пентафенилсурьмы и 2,6-дигидроксибензойной кислоты.
Пентафенилсурьма, бицинхониновая кислота, 2, 6-дигидроксибензойна кислота, перераспределение лигандов, дефенилирование
Короткий адрес: https://sciup.org/147233161
IDR: 147233161 | УДК: 546.865 | DOI: 10.14529/chem200110
Текст научной статьи Методы синтеза сурьмаорганических производных дикарбоновых и гидроксикислот. Молекулярная структура бицинхонината бис(тетрафенилсурьмы)
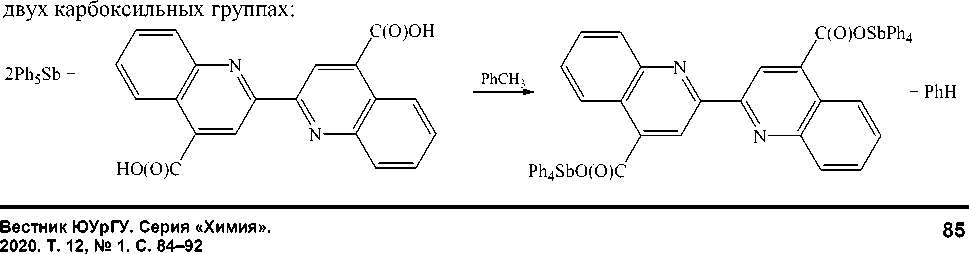
Реакции дефенилирования пентафенилсурьмы дикарбоновыми кислотами являются эффективным методом синтеза соединений состава (Ph 4 Sb) 2 X, где X - остаток дикарбоновой кислоты. Первым сурьмаорганическим производным дикарбоновой кислоты был оксалат бис (тетрафенилсурьмы) [1]. Позже получено несколько карбоксилатов бис (тетрафенилсурьмы) [2–7], в некоторых случаях продуктами реакции были кислые карбоксилаты тетрафенилсурьмы [8–10]. Известны реакции, сопровождающиеся декарбоксилированием одной из карбоксильных групп [4, 7].
Реакция перераспределения лигандов также является эффективным методом синтеза соединений общей формулы Ph 4 SbX, поскольку выход продукта приближается к количественному. Данная реакция с участием органичеких производных пятивалентной сурьмы была открыта впервые в 1996 году на примере галогенидов [11]. По аналогичной реакции получен ряд различных производных сурьмы (V): неорганических кислот [12–15], карбоновых кислот [16–22], фенолов [23–25], сульфокислот [26–30] и оксимов [10, 31–35]. При этом реакции пентаарилсурьмы с дикарбоксилатами триарилсурьмы, в которых карбоксильная группа является остатком полифункциональной карбоновой кислоты, в литературе не описаны.
В продолжение исследования реакций дефенилирования и перераспределения лигандов нами проведена реакция пентафенилсурьмы с бицинхониновой (2-(4-карбоксихинолин-2-ил)хинолин-4-карбоновой) кислотой и бис (2,6-дигидроксибензоатом) трифенилсурьмы, установлено строение продуктов реакции.
Экспериментальная часть
Синтез бицинхонината бис(тетрафенилсурьмы) (1). Смесь 0,25 г (0,5 ммоль ммоль) пентафенилсурьмы и 0,085 г (0,25 ммоль) бицинхониновой кислоты в 5 мл толуола помещали в стеклянную ампулу и запаивали. Смесь нагревали на водяной бане в течение часа. Раствор концентрировали, получили 0,42 г (71 %) бесцветных кристаллов 1 с т. пл. 173 °С. ИК-спектр (υ, см-1): 3053, 2360, 1697, 1635, 1581,1545, 1505, 1480, 1429, 1327, 1285, 1246, 1200, 1152, 1065, 997, 910, 774, 729, 689, 664, 603, 452. Найдено: C 66,93; H 4,35 %. Для C34H25NO2Sb вычислено: C 67,89; H 4,16 %.
Синтез 2,6-дигидроксибензоата тетрафенилсурьмы (2). Смесь 0,13 г (0,25 ммоль) пента-фенилсурьмы и 0,17 г (0,25 ммоль) бис (2,6-дигидроксибензоата) трифенилсурьмы в 5 мл бензола помещали в стеклянную ампулу и запаивали. Смесь выдерживали при комнатной температуре в течение 24 ч. Получили 0,39 г (85 %) коричневых кристаллов 2 с т. пл. 215 °С. ИК-спектр (υ, см-1): 3049, 1616, 1566, 1479, 1462, 1429, 1387, 1276, 1225, 1184, 1153, 1065, 1040, 1020, 997, 822, 741, 731, 461, 447. Найдено: C 63,73; H 4,36 %. Для C 31 H 25 O 4 Sb вычислено: C 63,83; H 4,33 %.
ИК-спектр соединений 1 и 2 записывали на ИК-Фурье спектрометре Shimadzu IRAffinity-1S в таблетке KBr в области 4000–400 см–1.
Рентгеноструктурный анализ (РСА) кристалла соединения 1 осуществлен с использованием автоматического четырехкружного дифрактометра D8 QUEST фирмы Bruker (Mo K α -излучение, λ = 0,71073 Å, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программы SMART SAINT-Plus [36]. Определение и уточнение структуры кристаллов выполнено c помощью программ SHELX/PC [37] и OLEX2 [38]. Структура расшифрована прямым методом и уточнена методом наименьших квадратов вначале в изотропном, затем в анизотропном приближении для неводородных атомов. Атомы водорода помещены в геометрически рассчитанные положения и включены в уточнение по модели наездника .
Кристаллы соединения 1 бесцветные, призматические, триклинные, C34H25NO2Sb, М = 601,30 г/моль; а = 25,332(16), b = 18,361(13), c = 15,250(14) Å, α = 90,00°, β = 104,17(4), γ = 90,00°, V = 6877(9) Å3, ρвыч = 1,162 г/см3, Z = 8, пространственная группа C2/c. Измерено всего 93723 отражений, 10925 независимых отражений, μ = 0,827 мм-1. Окончательные значения факторов расходимости: R1 0,0926 и wR2 0,1554 (по всем рефлексам), R1 0,0498 и wR2 0,1350 (по рефлексам F2> 2σ(F2)). Структура депонирована в Кембриджской базе кристаллоструктурных данных (CCDC 1971843, .
Основные длины связей и валентные углы соединения 1 приведены в таблице.
Основные длины связей ( d ) и валентные углы ( ω ) в структуре соединения 1
|
Связь |
d , Å |
Угол |
ω, град. |
|
Sb(1) – O(1) |
2,269(2) |
C(31)Sb(1)O(1) |
176,49(12) |
|
Sb(1) – C(21) |
2,124(4) |
C(21)Sb(1)C(31) |
95,62(15) |
|
Sb(1) – C(31) |
2,166(3) |
C(21)Sb(1)C(1) |
116,26(15) |
|
Sb(1) – C(1) |
2,125(4) |
C(1)Sb(1)C(31) |
97,02(14) |
|
Sb(1) – C(11) |
2,105(4) |
C(11)Sb(1)C(21) |
128,91(15) |
|
С(50) – O(1) |
1,300(4) |
C(11)Sb(1)C(31) |
95,52(15) |
|
С(50) – О(2) |
1,223(4) |
C(11)Sb(1)C(1) |
111,53(15) |
|
С(46) – N(1) |
1,366(4) |
O(1)C(50)O(2) |
124,3(3) |
|
C(47) – N(1) |
1,328(4) |
Обсуждение результатов
Взаимодействием пентафенилсурьмы с бицинхониновой (2-(4-карбоксихинолин-2-ил) хино-лин-4-карбоновой кислотой, 4,4'-дикарбокси-2,2'-бихинолином) при мольном соотношении 2:1 получен бицинхонинат бис (тетрафенилсурьмы): атом водорода заместился на фрагмент Ph 4 Sb в
По данным РСА, молекула соединения 1 является центросимметричной: центр симметрии лежит на середине связи С(47) - С(47) (см. рисунок). Атомы сурьмы являются структурно эквивалентными. Аксиальный угол O(1)SbC(31) равен 176,49(12)°, сумма углов СSbC в экваториальной плоскости – 356,7(15)° (111,53(15)-128,91(15)°). Атом сурьмы выходит из экваториальной плоскости на 0,221 Å в сторону аксиально расположенного атома углерода. Углы между аксиальной и экваториальными связями Sb-C больше 90° (95,52(15)–97,02(14)°). Аксиальная связь Sb-C(31) (2,166(3)Å) длиннее экваториальных связей Sb-C(1,11,21), значения которых лежат в диапазоне 2,105(4)– 2,125(4) Å. Длина связи Sb–O(1) составляет 2,269(2) Å, внутримолекулярное расстояние Sb∙∙∙O(2) – 3,116(3) Å. В ранее известных центросимметричных карбоксилатах бис (тетрафенилсурьмы) расстояния Sb-O равны 2,245(1) Å и 2,319 (9) Å [2,39], что соизмеримо с аналогичным расстоянием в 1 .
Расстояния О(1)-С(50) и О(2)-С(50) составляют 1,300(4) и 1,223(4) Å соответственно, угол О(1)С(10)О(2) равен 124,3(3)°. Длины связей С(46,47)-N(1) равны 1,366(4) и 1,328(4) Å соответственно, что свидетельствует о наибольшей кратности последней.
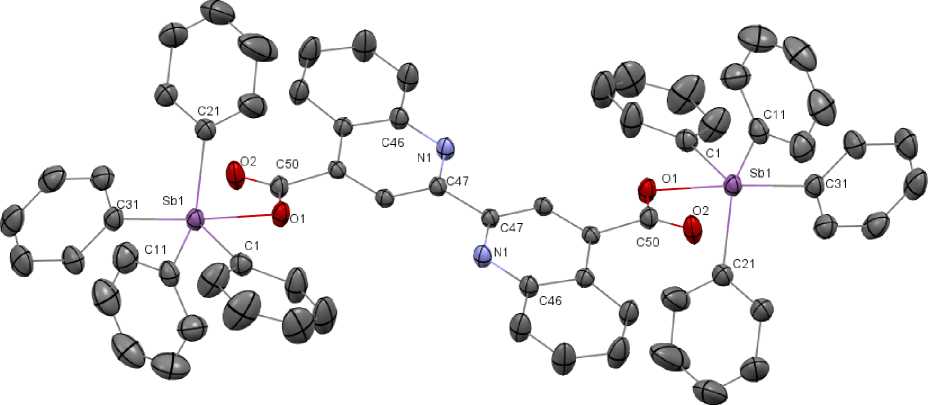
Молекулярная структура соединения 1
Установлено, что реакция пентафенилсурьмы с бис (2,6-дигидроксибензоатом) трифенил-сурьмы, полученным по методике [40], при мольном соотношении 1:1 в бензоле при комнатной температуре протекает с образованием 2,6-дигидроксибензоата тетрафенилсурьмы ( 1 ).
Ph 5 Sb +Ph 3 Sb(O(O)CC 6 H 3 (OH) 2 -2,6) → 2Ph 4 SbO(O)CC 6 H 3 (OH) 2 -2,6
В ИК-спектре соединения 2 полоса поглощения карбонильной группы при 1616 см-1 смещена в область низкочастотных колебаний по сравнению со справочным значением (1700–1680 см-1 [41]) и значением в спектре исходной кислоты (1705 см-1). Соединение 2 было получено ранее взаимодействием пентафенилсурьмы с 2,6-дигидроксибензойной кислотой и охарактеризовано методом рентгеноструктурного анализа [42].
Вывод
Таким образом, реакция между пентафенилсурьмой и бицинхониновой кислотой при мольном соотношении 2:1 в толуоле протекает с образованием бицинхонината бис (тетра-фенилсурьмы). Молекула является центросимметричной, атомы сурьмы имеют искаженную три-гонально-бипирамидальную координацию. При взаимодействии пентафенилсурьмы с бис (2,6-дигидроксибензоатом) трифенилсурьмы происходит перераспределение лигандов и образование 2,6-дигидроксибензоата тетрафенилсурьмы с выходом 85 %.
Выражаю благодарность проф. В.В. Шарутину за проведенные рентгеноструктурные исследования и О.К. Шарутиной за консультации.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 19-33-90061.
Список литературы Методы синтеза сурьмаорганических производных дикарбоновых и гидроксикислот. Молекулярная структура бицинхонината бис(тетрафенилсурьмы)
- Millington, P.L. Phenylantimony (V) Oxalates: Isolation and Crystal Structures of [SbPh4][SbPh2(ox)2], [SbPh3(OMe)]2ox and (SbPh4)2ox / P.L. Millington, D.B. Sowerby // J. Chem. Soc., Dalton Trans. - 1992. - № 7. - P. 1199-1204
- Шарутин, В.В. Синтез и строение сукцината, малата и тартрата бис(тетрафенилсурьмы) / В.В. Шарутин, О.К. Шарутина // Коорд. химия. - 2014. - Т. 40, № 9. - С. 559-563. DOI: 10.1134/S1070328414090073
- Reactions of Pentaphenylantimony with Dycarboxylic Asids / V.V. Sharutin, O.K. Sharutina, A.P. Pakusina et al. // J.Organometal. Chem. - 1997. - V. 536-537, № 1-2. - P. 87-92. DOI: 10.1016/s0022-328x(96)06463-7
- Sharutin, V.V. Interaction of Pentaphenylantimony with Acetylenedicarboxylic Аcid. Molecular Structure of Bis(tetraphenylantimony) Acetylenedicarboxilate / V.V. Sharutin, O.K. Sharutina, Yu.O. Gubanova // Вестник ЮУрГУ. Серия "Химия". - 2015. - Т. 7, № 4. - С. 17-22. DOI: 10.14529/chem150403
- Синтез и строение тетрафторфталата бис(тетрафенилсурьмы) / В.В. Шарутин, О.К. Шарутина, Е.А. Бондарь и др. // Журн. общ. химии. - 2002. - Т. 72, Вып. 2. - С. 2029-2032. DOI: 10.1023/A:1023411228493.
- Шарутин, В.В. Синтез и строение тетрахлорфталата бис(тетрафенилсурьмы) / В.В. Шарутин, O.K. Шарутина // Журн. неорг. химии. - 2015. - Т. 60, № 3. - С. 292-294.
- DOI: 10.1134/S0036023615030171
- Interaction of Pentaphenylantimony with Carboranedicarboxylic Acid / V.V. Sharutin, O.K. Sharutina, Yu.O. Gubanova et al. // J. Organometal. Сhem. - 2015. - V. 798. - P. 41-45.
- DOI: 10.1016/j.jorganchem.2015.09.002
- Шарутин, В.В. Синтез и строение кислого сукцината тетрафенилсурьмы / В.В. Шарутин, О.К. Шарутина, Ю.О. Губанова // Бутлеровские сообщения. - 2014. - Т. 39, № 7. - С. 139-141.
- Синтез и строение кислого фталата тетрафенилсурьмы / В.В. Шарутин, О.К. Шарутина, И.Г. Мельникова и др. // Изв. РАН. Сер. хим. - 1996. - № 8. - С. 2082-2085.
- DOI: 10.1007/bf01457791
- Реакции пентаарил сурьмы с диацилатами триарилсурьмы / В.В. Шарутин, О.К. Шарутина, А.П. Пакусина, В.К. Бельский // Журн. общ. химии. - 1997. - Т. 67, Вып. 9. - С. 1536-1541.
- Способ получения солей тетрафенилстибония общей формулы Ph4SbX [X = Cl, Br, OC(O)Ph, SCN] / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // Журн. общ. химии. - 1996. - Т. 66, вып. 10. - С. 1755-1756.
- Синтез и строение нитрата тетрафенилсурьмы / В.В. Шарутин, О.К. Шарутина, Л.П. Панова и др. // Журн. общ. химии. - 2002. - Т. 72, вып. 1. - С. 45-48. DOI: 10.1023/A:1015376808495.
- Строение галогенидов тетраарилсурьмы и изотиоцианата тетрафенилсурьмы / В.В. Шарутин, О.К. Шарутина, А.П. Пакусина и др. // Коорд. химия. - 2005. - Т. 31, № 2. - С. 117-124.
- DOI: 10.1007/s11173-005-0006-5
- Синтез и строение нитрита тетрафенилсурьмы / В.В. Шарутин, А.П. Пакусина, И.В. Егорова и др. // Коорд. химия. - 2002. - Т. 28, № 12. - С. 883-886. DOI: 10.1023/A:1021691926267.
- Синтез и строение перрената тетрафенилсурьмы и хлората тетрафенилсурьмы / В.В. Шарутин, В.С. Сенчурин, О.А. Фастовец и др. // Журн. неорган. химии. - 2009. - Т. 54, № 3. - С. 436-442.
- DOI: 10.1134/S0036023609030103
- Синтез фторбензоатов тетра- и триарилсурьмы / В.В. Шарутин, О.К. Шарутина, Е.А. Бондарь и др. // Журн. общ. химии. - 2002. - Т. 72, вып. 3. - С. 419-420. DOI: 10.1023/A:1015439500222.
- Синтез и строение пентафторбензоата тетрафенилсурьмы и нитрата тетра-п-толилсурьмы / В.В. Шарутин, О.К. Шарутина, Е.А. Бондарь и др. // Коорд. химия. - 2001. - Т. 27, № 6. - С. 423-427. DOI: 10.1023/A:1011335724711.
- Синтез и строение фторбензоатов тетра- и триарилсурьмы / В.В. Шарутин, О.К. Шарутина, Е.А. Бондарь, А.П. Пакусина и др. // Коорд. химия. - 2002. - Т. 28, № 5. - С. 356-363. DOI: 10.1023/A:1015517216693.
- Синтез и строение бензоата тетрафенилсурьмы / В.В. Шарутин, Г.К. Фукин, Л.Н. Захаров и др. // Журн. общ. химии. - 2000. - Т. 70, вып. 12. - С. 1997-1999.
- Синтез и строение ниацината тетрафенилсурьмы / В.В. Шарутин, А.П. Пакусина, Т.П. Платонова и др. // Журн. общ. химии. - 2004. - Т. 74, вып. 2. - С. 234-237. DOI: 10.1023/B:RUGC.0000025501.29625.ff.
- Синтез и строение феноксиацетата и этилмалоната тетрафенилсурьмы Ph4SbOC(O)R [R = CH2OPh, CH2C(O)OC2H5] / В.В. Шарутин, А.П. Пакусина, О.П. Задачина и др. // Коорд. химия. - 2004. - Т. 30, № 6. - С. 426-431. DOI: 10.1023/B:RUCO.0000030159.74150.a1.
- Синтез и строение 1-адамантанкарбоксилата тетрафенилсурьмы и бис(1-адамантанкарбоксилата) трифенилсурьмы / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // Журн. общ. химии. - 2009. - Т. 79, вып. 10. - С. 1636-1643.
- DOI: 10.1134/S1070363209100107
- Новый метод синтеза арокситетраарильных соединений сурьмы / В.В. Шарутин, О.К. Шарутина, П.Е. Осипов, О.В. Субачева // Журн. общ. химии. - 2001. - Т. 71, вып. 6. - С. 1045-1046. DOI: 10.1023/A:1012368510207.
- Арокситетраарильные соединения сурьмы. Синтез, строение и термическое разложение / В.В. Шарутин, О.К. Шарутина, П.Е. Осипов и др. // Журн. общ. химии. - 2000. - Т. 70, вып. 6. - С. 931-936.
- Сурьмаорганические производные 2,4,6-трибромфенола / В.В. Шарутин, А.П. Пакусина, М.А. Пушилин и др. // Журн. общ. химии. - 2003. - Т. 73, вып. 4. - С. 573-577. DOI: 10.1023/A:1025628217346.
- Сульфонаты тетра- и триарилсурьмы / В.В. Шарутин, О.К. Шарутина, Л.П. Панова, В.К. Бельский // Журн. общ. химии. - 1997. - Т. 67, вып. 9. - С. 1531-1535.
- Синтез и строение 4-метилбензолсульфоната тетра-п-толилсурьмы / В.В. Шарутин, О.К. Шарутина, Т.А. Тарасова и др. // Журн. общ. химии. - 1999. - Т. 69, вып. 12. - С. 1979-1981.
- Синтез и строение органосульфонатов тетра- и трифенилсурьмы / В.В. Шарутин, О.К. Шарутина, А.П. Пакусина и др. // Коорд. химия. - 2004. - Т. 30, № 1. - С. 15-24.
- DOI: 10.1023/B:RUCO.0000011636.28262.d3
- Синтез и строение 2,4-диметилбензолсульфоната тетрафенилсурьмы / В.В. Шарутин, О.К. Шарутина, Т.А. Тарасова и др. // Журн. общ. химии. - 2000. - Т. 70, вып. 8. - С. 1311-1314.
- Синтез и строение сурьма- и висмуторганических производных 4-сульфофенола и 2,4-дисульфофенола / В.В. Шарутин, И.В. Егорова, А.П. Пакусина и др. // Коорд. химия. - 2007. - Т. 33, № 3. - С. 176-183.
- DOI: 10.1134/S1070328407030037
- Синтез и строение оксиматов тетрафенилсурьмы / В.В. Шарутин, О.К. Шарутина, О.В. Молокова и др. // Журн. общ. химии. - 2000. - Т. 70, № 12. - С. 1990-1996.
- Синтез и строение оксиматов тетра- и триарилсурьмы / В.В. Шарутин, О.К. Шарутина, О.В. Молокова и др. // Журн. общ. химии. - 2001. - Т. 71, вып. 8. - С. 1317-1321. DOI: 10.1023/A:1013220911661.
- Синтез и строение оксиматов тетра- и триарилсурьмы / В.В. Шарутин, О.К. Шарутина, О.В. Молокова и др. // Журн. общ. химии. - 2002. - Т. 72, № 6. - С. 956-961. DOI: 10.1023/A:1020474021779.
- Синтез и строение оксиматов тетра- и триарилсурьмы / В.В. Шарутин, О.К. Шарутина, О.В. Молокова и др. // Коорд. химия. - 2002. - Т. 28, № 8. - С. 581-590. DOI: 10.1023/A:1019701511840.
- Шарутин, В.В. Синтез и строение салицилальдоксиматов тетра- и трифенилсурьмы / В.В. Шарутин, О.К. Шарутина, О.В. Молокова // Журн. неорган. химии. - 2012. - Т. 57, № 6. - С. 902-907.
- DOI: 10.1134/S0036023612010226
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures From Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: a Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. - 2009. - V. 42. - P. 339-341.
- DOI: 10.1107/S0021889808042726
- Особенности взаимодействия пентафенилсурьмы с бифункциональными кислотами. Строение глутарата бис(тетрафенилсурьмы), сольвата 1,4-циклогександикарбоксилата бис(тетрафенилсурьмы) с бензолом, сольвата 3-гидроксибензоата тетрафенилсурьмы с диоксаном и аддукта 3-гидроксибензоата тетрафенилсурьмы с 3-тетрафенилстибоксибензоатом тетрафенилсурьмы и толуолом / В.В. Шарутин, О.К. Шарутина, Ю.О. Губанова и др. // Журн. неорган. химии. - 2019. - Т. 64, № 9. - С. 1-8.
- DOI: 10.1134/S0044457X19090198
- Improved Methods for the Sinthesis of Antimony Triacetate, Triphenylantimonyl Diacetate and Pentaphenylantimony / T.C. Thepe, R.J. Garascia, M.A. Selvoski et al. // Ohio J. Sci. - 1977. - V. 77. - N. 3. - P. 134-135.
- Тарасевич, Б.Н. ИК-спектры основных классов органических соединений: справочные материалы / Б.Н. Тарасевич. - М.: МГУ им. М.В. Ломоносова, 2012. - 55 с.
- Dihydroxybenzoic Acids as Polydentate Ligands in Phenylantimony (V) Complexes / V.V. Sharutin, O.K. Sharutina, Yu.O. Gubanova et al. // Inorg. Chim. Acta. - 2019. - V. 494. - P. 211-215.
- DOI: 10.1016/j.ica.2019.05


