Микробиоценоз верхних дыхательных путей у телят с клиническими признаками бронхопневмонии и микрофлора воздуха животноводческих помещений
Автор: Плешакова В.и, Ермакова Т.В., Егорова А.С.
Статья в выпуске: 2 т.210, 2012 года.
Бесплатный доступ
Проведен сравнительный анализ микрофлоры слизистых носовой полости и зева у телят с клиническими признаками бронхопневмонии и воздуха помещений, где содержались телята. Установлено, что доминирующими популяциями на слизистых оболочках верхних дыхательных путей и в воздухе животноводческих помещений является Enterococcus spp. с антибиотико-резистентными свойствами.
Условно-патогенные микроорганизмы, воздух, зев, носовая полость, антибиотико-резистентность
Короткий адрес: https://sciup.org/14287501
IDR: 14287501 | УДК: 619:616-07:636.2.083
Текст научной статьи Микробиоценоз верхних дыхательных путей у телят с клиническими признаками бронхопневмонии и микрофлора воздуха животноводческих помещений
Введение. Бронхопневмонии молодняка крупного рогатого скота являются основной причиной гибели или вынужденного убоя животных и наносят серьезный экономический ущерб при промышленном содержании животных [4, 7].
После рождения открытые полости животных колонизируются широким спектром микроорганизмов, при этом на состав микробных сообществ влияют разнообразные факторы, в т.ч. бактериальное загрязнение воздуха, которое представляет большую опасность для здоровья животных [1, 2]. Возникновению болезней способствуют многие неблагоприятные факторы внешней среды (переохлаждение, нарушение зоогигиенических требований и т.д.), которые ослабляют устойчивость животных и снижают «порог» заражения, в том числе условнопатогенными микроорганизмами [8].
Решающее значение на уровень заболеваемости животных респираторными заболеваниями оказывает микробная загрязненность воздуха профилактория и животноводческих помещений, где содержатся телята с различным иммунным статусом [3].
Применение антибиотиков при промышленном ведении животноводства оказывает значительное влияние на появление устойчивых к лекарственным препаратам бактерий, участвующих в колонизации верхних дыхательных путей животных и являющихся этиологическим фактором болезней дыхательной системы [3].
В ряде хозяйств в воздухе животноводческих помещений обнаруживается Enterococcus spp. и Staphylococcus spp., резистентные к тетрациклинам, макролидам, линкозамидам. Предполагается, что воздух может действовать как фактор передачи этих бактерий [6].
Цель исследования. Изучить микробиоценоз верхних дыхательных путей у телят с клиническими признаками бронхопневмонии и микрофлору воздуха животноводческих помещений.
Материалы и методы исследования. Из пяти хозяйств Омской области было отобрано 32 пробы воздуха, из них 16 получено в помещениях, где телята содержались в отдельных боксах, и 16 при групповом методе выращивания. Для взятия проб воздуха в помещениях телятников применяли аспиратор ПУ-1Б. В воздухе определяли общее микробное число (ОМЧ). На основании «Ветеринарно-санитарных правил для предприятий (комплексов) по производству молока на промышленной основе» допустимая микробная загрязненность воздуха (тыс. микробных тел в 1 м3) в помещении профилактория не более 20, для выращивания телят от 20 до 60 дней не более 40; для доращивания телят от 60 до 120 дней не более 50; для молодняка от 4 до 12 мес. не более 70. В качестве дополнительного санитарного показателя воздуха проводили бактериологические исследования на наличие стафилококков и энтерококков.
Одномоментно исследовали 60 проб из верхних дыхательных путей телят, в т.ч. со слизистых оболочек носовых ходов (n=30) и зева (n=30), из них 20 телят были с клиническими признаками бронхопневмонии. Смывы из носовой полости и зева осуществляли стерильным тупфером. Посев производили на ряд селективных питательных сред: Эндо, солевой агар, Энтерококкагар, Сабуро.
Индикацию, идентификацию микроорганизмов проводили по общепринятой методике [5]. Гемолитические свойства выделенных микроорганизмов изучали на 5%-ном кровяном агаре, антибиотикорезистентные на среде АГВ диско-диффузионным методом.
В хозяйствах ветеринарной службой проводилось лечение животных с клиническими признаками бронхопневмонии антибиотиками широкого спектра действия.
Результаты исследования. При проведении бактериологических исследований проб из носовой полости и зева, выделено 92 культуры микроорганизмов. Из них кокковая микрофлора составила 63%, энтеробактерии 19%, дрожжеподобные грибы 18,4%.
Чаще всего слизистые оболочки носа были колонизированы E. faecalis (23,07%) и E. coli (25,6%). Грамположительные кокки были представлены – S. epidermidis (12,8%), S. saprophyticus (10,2%), E. faecium (15,3%). Так же из проб высевались дрожжеподобные грибы (12,8%).
При анализе полученных результатов было установлено, что только у 8,3% обследованных телят условно-патогенные микроорганизмы со слизистых носа выделяли в монокультуре (Staphylococcus spp. - 60% и Enterococcus spp. – 40%). В основном регистрировали в ассоциации, состоящие из двух микроорганизмов (Escherichia spp., Enterococcus spp.) – 6,6%; из трех (Escherichia spp., Enterococcus spp., Staphylococcus spp.)– 20% и четырех (Escherichia spp., Enterococcus spp., Staphylococcus spp., дрожжеподобные грибы) – 13,3%.
Слизистые оболочки зева были колонизированы E. faecalis (19%) и E. coli (26,9%). Грамположительные кокки были представлены – S. epidermidis (22,2%), S. saprophyticus (12,6%), S. aureus (1,5%), E. faecium (9,5%). У 5% обследованных телят условно-патогенные микроорганизмы со слизистых зева выделяли в монокультуре (Staphylococcus spp.- 53% Enterococcus spp. – 47%). Из данного биотопа выделяли следующие ассоциации: состоящие из двух микроорганизмов (Escherichia spp., Enterococcus spp.) – 26,6%; из трех (Escherichia spp., Enterococcus spp.,
Staphylococcus spp.) – 26,6% и четырех (Escherichia spp., Enterococcus spp., Staphylococcus spp., дрожжеподобные грибы) – 16,6%.
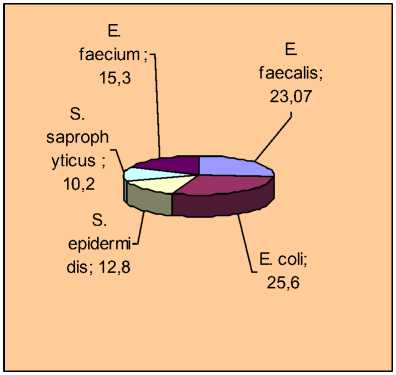
Рис.1. Удельный вес микрофлоры со слизистой носовых полостей телят с
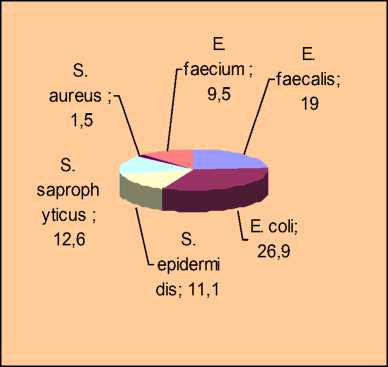
Рис.2. Удельный вес микрофлоры со слизистой оболочки зева телят
клиническими признаками бронхопневмонии.
с клиническими признаками бронхопневмонии.
При сравнении удельного веса отдельных представителей микроорганизмов со слизистых оболочек зева и носовых полостей телят с клиническими признаками бронхопневмонии было установлено, что в зеве преобладают на 4% изоляты Enterococcus faecalis; Escherichia coli на 1,3%; Staphylococcus aureus на 1,5%. В носовой полости чаще изолировали Enterococcus faecium (5,8%) и Staphylococcus epidermidis (1,7%). Культуры Staphylococcus saprophyticus обнаруживали в одинаковом количестве как в зеве, так и в носовой полости.
Изоляты Escherichia coli и Staphylococcus epidermidis выделенные из зева проявляли резистентные свойства к гентамицину и ципрофлоксацину; Enterococcus faecalis, Enterococcus faecium к гентамицину. Из носовой полости были выделены культуры Escherichia coli резистентные к ципрофлоксацину; Staphylococcus epidermidis к эритромицину.
При исследовании проб воздуха животноводческих помещений ОМЧ составляло: – 2,4 ± 1,46·103 КОЕ/м3; стафилококков – 5,58 ± 5,34·103 КОЕ/м3; энтерококков – 1,6 ± 0,8·104 КОЕ/м3.
Из воздуха профилакториев изолировали: S.epidermidis (21,25%); S.aureus (2,5%); S.saprophyticus (64,2%); E.faecalis (35%),большая часть из них обладала (51,4%) с гемолитическими свойствами. Так же выделяли E.faecium (18,75%), из них 20% с гемолитическими свойствами (Рис. 3).
Из проб воздуха телятников так же, как и со слизистых оболочек верхних дыхательных путей в большинстве случаев изолировали Staphylococcus saprophyticus, Enterococcus faecalis, Staphylococcus epidermidis и Enterococcus faecium. Количество изолятов Staphylococcus aureus в пробах воздуха было больше на 1,5%, чем в пробах со слизистых оболочек зева.
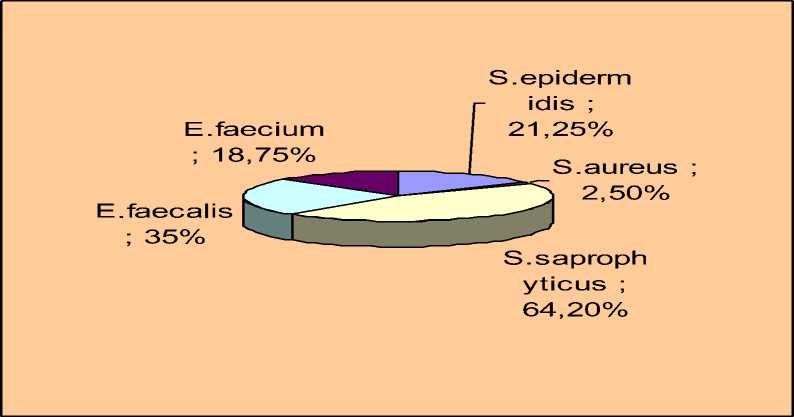
Рис. 3. Удельный вес микрофлоры изолированной из воздуха животноводческих помещений Омской области
Культуры стафилококка из проб воздуха телятников обладали устойчивостью к тетрациклину, эритромицину, линкомицину, бензилпенициллину, ампициллину и оксациллину.
Культуры энтерококка из проб воздуха телятников были резистентны к ванкомицину, ампициллину, гентамицину, эритромицину, цефтриаксону, амикацину и тетрациклину.
Выводы. ОМЧ в помещениях телятников при неудовлетворительных зоогигиенических условиях ниже предельно допустимых показателей.
Представители условно-патогенной микрофлоры, выделенные из верхних дыхательных путей телят с клиническими признаками бронхопневмонии, в основном совпадают с микрофлорой воздуха животноводческих помещений. В воздухе животноводческих помещений преобладали S. saprophyticus и E. faecalis с гемолитическими и антибиотико-резистентными свойствами, а на слизистых оболочках верхних дыхательных путей телят преобладали антибиотико-резистентные культуры: E. coli, E. faecalis и S. saprophyticus. Образование резистентных культур микроорганизмов явилось следствием интенсивного лечения телят антибактериальными препаратами. Можно предположить, что однородность микробного пейзажа связана с пребыванием животных в одном помещении, в результате чего происходит циркуляция резистентных микроорганизмов между животными и внешней средой.
ЛИТЕРАТУРА: 1. Баранников В. Д., Федоров Ю. Н., Волков Г. К // Сб. науч. тр. / Всерос. НИИ вет. санитарии, гигиены и экологии. — 1998. Т.
106.-С. 105-110. 2. Басманов, П. И. «ФП» фильтры Петрянова / П. И. Басманов // Химия и жизнь. - 1977. - №6. - С. 22-27. 3. Дубовой, Б. Л. Обоснование предельно допустимых концентраций условно-патогенной микрофлоры для овцеводческих помещений / Б. Л. Дубовой // Меры борьбы с болезнями сельскохозяйственных животных Сев. Кавказа. 1986. -С. 35-41. 4. Канифова Р. Р. Микробная обсемененность птичников и изыскание средства для дезинфекции помещений в присутствии птицы. Автореф. дис. канд. биол. наук, Казань, 2003. с. 24. 5. Определитель бактерий Берджи: в 2 т. Т. 1. / под ред. Дж. Холта [и др.]. - М. : Мир, 1997. - 432 с. 6. Павлова И. Б. Закономерности развития популяций бактерий вокружающей среде (электронно–микроскопическое исследование): автореф. дисс. на соискание д-ра биол. наук / ВНИИВСГЭ. М., 1999. - 61 с. 7. Попова Н. В. Анализ заболеваемости новорожденных телят в условиях Северного края и коррекция системы противоэпизоотических, лечебных и профилактических мероприятий при переходе к рыночной экономике. автореф. Дис. канд. вет. наук. - С-П, 2000. 8. Gouby, A., M. J. Carles-Nury, N. Bouziges, G. Bourg, R. Mesnard, and P. Bouvet. 1992. Use of pulsed-field gel electrophoresis for investigation of hospital outbreaks of Acinetobacter baumannii. J. Clin. Micro-biol. 30:1588-1591.
МИКРОБИОЦЕНОЗ ВЕРХНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ У ТЕЛЯТ С КЛИНИЧЕСКИМИ ПРИЗНАКАМИ БРОНХОПНЕВМОНИИ И МИКРОФЛОРА ВОЗДУХА ЖИВОТНОВОДЧЕСКИХ ПОМЕЩЕНИЙ
Плешакова В.И, Ермакова Т.В., Егорова А.С.
Резюме
Проведен сравнительный анализ микрофлоры слизистых носовой полости и зева у телят с клиническими признаками бронхопневмонии и воздуха помещений, где содержались телята. Установлено, что доминирующими популяциями на слизистых оболочках верхних дыхательных путей и в воздухе животноводческих помещений является Enterococcus spp. с антибиотико-резистентными свойствами.
MICROBIO CENOSIS OF UPPER AIR PASSAGES IN CALVES WITH CLINICAL SIGNS OF BRONCHOPNEUMONIA AND AIR MICROSCOPIC FLORAI OF STOCKRAISING PREMISES
Pleshakova V.I., Yermakova T.V., Yegorova A.S. Summary
A comparative analysis of the microflora of the mucous nasal cavity and pharynx in calves with clinical signs of pneumonia and indoor air, where they were kept calves. It is established that the dominant populations in the mucous membranes of the upper respiratory tract and in the air livestock buildings is Enterococcus spp. with antibiotic-resistant properties.


