Микробиологические особенности гнойного процесса и его влияние на течение гнойных осложнений открытых повреждений кисти
Автор: Тетюшкин С.Н., Шатохин В.Д.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 2, 2004 года.
Бесплатный доступ
В статье приводятся данные анализа бактериологических исследований, проводимых на этапах лечения различных групп больных, показан состав микрофлоры, ее чувствительность к антибиотикам. Отмечено преимущество методики первичного закрытия ран, определена схема антибиотикотерапии у пациентов с гнойными осложнениями открытых травм кисти.
Микробиологические исследования, кисть, гнойная инфекция, первичный шов, антибиотикотерапия
Короткий адрес: https://sciup.org/142120708
IDR: 142120708
Текст научной статьи Микробиологические особенности гнойного процесса и его влияние на течение гнойных осложнений открытых повреждений кисти
Актуальность проблемы лечения нагноения ран кисти обусловлена большой частотой их возникновения, длительной потерей трудоспособности у наиболее активной части населения и не всегда благоприятными функциональными исходами.
Цель работы: Изучить микробный пейзаж гнойного отделяемого и определить особенности применения антибиотиков при гнойных осложнениях открытых повреждений кисти.
МАТЕРИАЛ И МЕТОДЫ
Нами проведены исследования у 50 больных с открытыми повреждениями кисти, осложненных гнойной инфекцией. Микробиологические исследования проводились путём взятия мазков из ран с последующим посевом на чашки Петри с 5% кровяным агаром и с молочно-желточно-солевым агаром, с последующим определением чувствительности высеянных микробов к антибиотикам.
Посевы выполнялись до операции в двух группах больных: контрольной и опытной. В опытной группе это было единственное микробиологическое исследование, так как во время операции рана закрывалась швами. В контрольной группе, где применялась традиционная методика открытого ведения раны, посевы выполнялись каждые 10 дней до последующего наложения швов или полной эпителизации раны.
РЕЗУЛЬТАТЫ
Микробиологическое исследование отделяемого из ран у пациентов, впервые обратившихся в стационар показало, что в 16 случаях (80%) посевов обнаруживался золотистый стафилок-кок, в 4 (20%) – посевы роста не дали.
У пациентов, получавших лечение до поступления в стационар, до операции и в первые дни после неё, при открытом ведении раны, в 56% случаев (17 человек) высевался стафилококк, который в дальнейшем в 20% случаев (6 человек) сменяла синегнойная палочка, требовавшая назначения аминогликозидов. Кроме этих возбудителей обнаружены в 7% (2 человека) дрожжевые грибки, в 7% (2 человека) – St.epidirmidicis, в 10% (3 чело- века) случаев посевы роста не дали (рис. 2).
Это приводило к удлинению сроков лечения и его удорожанию, а также способствовало развитию и прогрессированию осложнений. При закрытии раны во время первой операции присоединения госпитальной инфекции не наблюдалось. Таким образом, наложение первичного шва на рану, ее закрытие во время операции приводило к закрытию входных ворот для инфекции, поэтому в опытной группе посевы брались лишь до операции, что приводило к значительной экономии средств, затрачиваемых на микробиологические исследования в стационаре.
Анализ клинического течения патологии и результатов микробиологического исследования показал, что при первичном обращении пациентов возбудителем инфекции был золотистый стафилоккок. Синегнойная палочка и другие микроорганизмы высевались у пациентов, полу- чавших амбулаторное или стационарное лечение до обращения в отделение.
Оказалось, что 80% стафилококков чувствительны к цефалоспоринам первого поколения, 40% – к оксациллину, 60% – к линкосаминам (табл. 1).
Не чувствительными к ампициллину оказались 71,4% стафилококков, 8,6% - к оксациллину, 11,4% не чувствительны к цефалоспоринам; 8,6% - к линкосаминам. Ps.aeruginosae оказалась в 54,5% случаев чувствительной к цефалоспоринам третьего поколения, в 45,5% – к амикацину, чувствительность к комбинации этих препаратов достигала 100%. В 100% случаев наблюдалась резистентность синегнойной палочки к пенициллинам, цефалоспоринам первого и второго поколений и аминогликозидам первого и второго поколений (табл. 2).
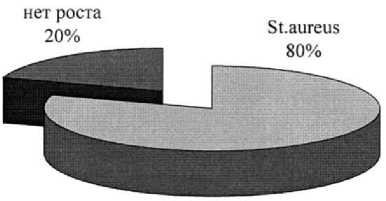
Рис. 1. Результаты посевов из ран у больных, первично поступивших в стационар
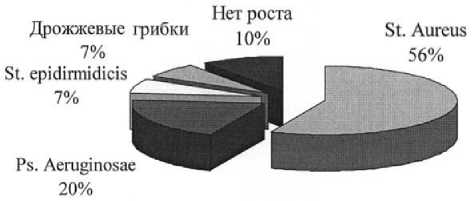
Рис. 2. Результаты посевов из ран у больных, получавших лечение до поступления в стационар
Таблица 1
Чувствительность к антибиотикам высеянных микроорганизмов
|
Ампициллин |
Оксациллин |
Линкоми-цин |
Цефалоспорины 1 и 2 поколений |
Цефалоспорины 3 поколения |
Аминогликозиды l и 2 поколений |
Аминогликози ды 3 поколения |
Цефалоспорин 3 поколения и аминогликозид 3 поколения |
|
|
St.aureus |
28,6% |
40% |
60% |
80% |
100% |
нет |
100% |
|
|
Ps.aeruginosae |
Нет |
нет |
Нет |
Нет |
54,4% |
нет |
45,5% |
100% |
Таблица 2
Резистентность высеянных микроорганизмов к антибиотикам
|
Ампициллин |
Оксациллин |
Линкосамины |
Цефалоспорины 1 и 2 поколений |
Аминогликозиды 1 и 2 поколений |
|
|
St.aureus |
71,4% |
8,6% |
8,6% |
11,4% |
100% |
|
Ps.aeruginosae |
100% |
100% |
100% |
100% |
100% |
ВЫВОДЫ
Таким образом, наши исследования показали, что микробная обсеменённость ран характеризуется микрофлорой, состоящей преимущественно из St.aureus и Ps.aeruginosae. В клинике, при поступлении больных с данной патологией кисти, целесообразно назначение цефалоспоринов первого поколения либо, при их непереносимости, линкосаминов. В случае длительного лечения, при присоединении госпитальной инфекции (Ps.aeruginosae), эффективным является комбинация цефалоспоринов третьего поколения и амикацина. Подобная тактика позволяет проводить длительные курсы антибактериаль- ной терапии, а также дает возможность комбинировать и взаимозаменять препараты.
Несмотря на это, наиболее эффективным и экономически выгодным является первичное закрытие раны и назначение:
-
- у пациентов при первичном обращении – цефалоспоринов первого поколения или линко-саминов;
-
- у пациентов, получавших лечение ранее, до поступления в отделение, – цефалоспоринов третьего поколения и аминогликозидов третьего поколения.
Рукопись поступила 09.03.04.


