Микробная ферментация субпродуктов птицы
Автор: Зинина Оксана Владимировна, Меренкова Светлана Павловна, Князева Александра Сергеевна, Марушкевич Марина Александровна, Гаврилова Карина Сергеевна
Рубрика: Биохимический и пищевой инжиниринг
Статья в выпуске: 4 т.9, 2021 года.
Бесплатный доступ
Цель работы - исследование влияния микробной ферментации субпродуктов птицы на накопление продуктов гидролиза белка и изменение микроструктуры гидролизатов. В качестве объектов исследования выбраны мышечные желудки цыплят-бройлеров и кур родительского стада, которые подвергали микробной ферментации бактериальными концентратами пропионовокислых бактерий и бифидобактерий. Ферментацию проводили при температурах 30, 35 и 40 °С в течение 16 ч. Для анализа степени гидролиза определяли содержание аминного азота через каждые 4 часа ферментации. Отмечено, что под действием ферментов микроорганизмов происходит более глубокий гидролиз молекулы белка с интенсивным накоплением аминного азота. При этом наиболее высокое накопление аминного азота наблюдается при микробной ферментации желудков пропионовокислыми бактериями при температуре 30 °С, а бифидобактериями - при температуре 40 °С. Также о степени гидролиза судили по накоплению свободных аминокислот. Установлено увеличение концентрации свободных аминокислот в контрольных и экспериментальных образцах гидролизатов после 16 часов ферментации. В гидролизатах желудков, ферментированных пропионовокислыми бактериями и бифидобактериями, наблюдалось значительное накопление незаменимых аминокислот. Содержание как незаменимых, так и заменимых аминокислот в гидролизатах субпродуктов цыплят-бройлеров в несколько раз выше, по сравнению с субпродуктами кур маточного стада. Исследования микроструктуры гидролизатов желудков с помощью сканирующей электронной микроскопии показали, что под действием бактерий происходит значительное изменение структуры мышечных и коллагеновых волокон, их диссоциация на многочисленные тонкие фибриллы и формирование ретикулярной структуры в сочетании с глобулярными белками и минеральными компонентами сыворотки. Образцы, обработанные бактериальными ферментами, имели более открытую микроструктуру и большую пористость. В результате проведенных исследований установлено, что микробная ферментация приводит к глубокому гидролизу белков, входящих в состав мышечных желудков птицы. При благоприятных для каждого вида бактерий температурных режимах ферментации гидролиз происходит более интенсивно.
Мышечный желудок, микробная ферментация, бактериальный концентрат, микроструктура, гидролизат
Короткий адрес: https://sciup.org/147236420
IDR: 147236420 | УДК: 637.5.03 | DOI: 10.14529/food210409
Текст научной статьи Микробная ферментация субпродуктов птицы
Актуальность исследований
Во всем мире промышленное птицеводство представляет крупную специализированную отрасль, которая имеет перспективы развития.
В разных странах появляются комплексы различной мощности, оснащенные современными технологическими линиями, где внедряются новые технологии по переработке птицы; расширяется ассортимент выпускаемой продукции [1, 2]. Мясо птицы в настоящее время является наиболее важным источником животного белка во многих странах мира, и эта тенденция подчеркивает важность птицеводческой промышленности и стимулирует ее дальнейший рост [3, 4].
Коллаген, входящий в состав субпродуктов птицы, является потенциальным источником для получения не только животных кормов, но и пищевого белка [9, 10]. Нерациональное использование в полном объеме бе- локсодержащего сырья является причиной существующих экологических проблем предприятий отрасли, а также нехватки продовольственных ресурсов. Расширенное использование коллагенсодержащих продуктов птицеводства в производстве продуктов питания путем изменения их свойств способствует развитию предприятий по переработке птицы и увеличивает их доходность благодаря выпуску продукции с добавленной стоимостью. Ферментативная обработка вторичных продуктов переработки птицы является экологичной альтернативой традиционной кислотной или щелочной модификации сырья [11].
Потенциал субпродуктов птицы отмечен в качестве субстратов для получения белковых гидролизатов с различными функциональными свойствами и биологической активностью [12]. Белки, которые в настоящее время используются в качестве корма для животных, могут быть модифицированы и улучшены для потребления человеком [13]. Гидролиз субпродуктов может происходить разными способами [7]. Ферментативная обработка является более физиологичной, ее можно проводить как с использованием протеолитических ферментов, так и с использованием живых культур бактерий. Микробная ферментация происходит под действием набора ферментов, вырабатываемых микроорганизмами [14]. При выборе способа гидролиза учитываются следующие критерии: простота экстракции и выделение белков; белки предпочтительно должны находиться в неденатуриро-ванном состоянии; отсутствие сопутствующих соединений; высокая растворимость гидролизата в широком диапазоне рН; сбалансированный аминокислотный профиль [13].
Процесс гидролиза белка направлен на разрыв связей между пептидами в полипеп-тидной цепи белка с целью получения низкомолекулярных компонентов и свободных аминокислот, которые способны эффективно усваиваться в организме человека [15]. Биоактивные пептиды образуются при гидролизе белка под действием протеаз, синтезируемых ферментирующими организмами [16]. Биоактивные пептиды, помимо высокой пищевой ценности, обладают антимикробной, антиоксидантной и иммуномодулирующей активностью, способствуют лечению и профилактике значительному перечню заболеваний человека.
Таким образом, целью работы является исследование влияния микробной фермента- ции субпродуктов птицы на накопление продуктов гидролиза белка и изменение микроструктуры гидролизатов.
Материалы и методы
Сырье и материалы
-
– «Пропионикс» – концентрированную микробную массу штамма Propionibacterium freudenreichii subsp. shermanii – КМ 186 с активностью 1010–1011 КОЕ/см3;
-
– бактериальный концентрат Bifidobacterium longum B379M с активностью 1011–1012 КОЕ/см3.
Изготовление опытных образцов гидролизатов
У измельченных субпродуктов определяли физико-химические показатели по стандартным методикам (массовая доля белка, жира, влаги, золы).
Полученные после ферментации гидролизаты фильтровали через мембранные фильтры с диаметром пор 0,45 нм и высушивали методом сублимации. В сухих гидролизатах определяли аминокислотный состав и микроструктуру.
Исследование образцов гидролизатов
Для определения несвязанных аминокислот использовали жидкостный хроматограф Agilent 1260 Infinity LC (США). Для приготовления образцов проводилась жидкостная экстракция. Пять граммов образца гидролизата помещали в эпендорф и добавляли 4 мл 20 % трихлоруксусной кислоты для осаждения белков и пептидов. Объем доводили до 30 мл подкисленным буфером соляной кислоты с pH 2,2 и выдерживали в течение 8 мин, поддерживая гомогенат в условиях охлаждения. Полученную смесь центрифугировали (20 мин, 4 °C, 10000 об/мин) и супернатант пропускали через шприцевой фильтр в виалу. После провели предколоночную дериватиза-цию в автосамплере системы ВЭЖХ с использованием реагентов: ортофталевый альдегид для первичных аминокислот и 9-фторметил-хлорформиат для вторичных аминокислот. Соотношение дериватов к отобранному объему пробы 1:10.
Хроматографическое деление осуществляли на колонке ZORBAX C18 PA, 3,5 мкм, 4,6×150 мм (Agilent, США) в режиме градиентного элюирования в течение 25 мин. Для первичных аминокислот измерения проводили в УФ-детекторе при длине волны λ = 338 нм, для вторичных аминокислот λ = 262 нм. Использовали подвижную фазу А: ацетонитрил: метанол: вода (45:45:10); подвижная фаза B с pH 8,2: Na2HPO4 1,42 г и Na2B4O7 2,1 г pH 8,2. Скорость потока составляла 1 мл/мин. Температура колонки 40 °С. Содержание не- связанных (свободных) аминокислот выражали в мг аминокислот на 100 г жидких гидролизатов.
Каждое измерение проводили трехкратно. Значения вероятности р ≤ 0,05 были взяты для указания статистической значимости. Данные были проанализированы с помощью One-way ANOVA [17].
Результаты исследований и обсуждение
Таблица 1
Примечание: Средние значения в столбце без общего надстрочного индекса имеют достоверные различия (p < 0,05) при анализе с помощью однофакторного дисперсионного анализа и TUKEY-теста.
представленных Abdullah и др. (2016): содержание белка – 17,34 %, содержание жира – 0,76 %, содержание влаги – 78,60 %, зола – 0,97 % [19].
При гидролизе белков мяса образуются полипептиды, которые в дальнейшем могут расщепляться на более мелкие пептиды и свободные аминокислоты [20, 21]. Как отмечено некоторыми авторами, такая деградация может быть вызвана эндогенными и микробными ферментами [22, 23]. El. Adab и др. (2015) показали, что в колбасах, ферментированных S. xylosus и L. plantarum , в результате протеолиза содержание свободных аминокислот увеличилось с 2059,82 мг / кг до 3461,07 мг / кг. Эту разницу в общем накоплении свободных аминокислот авторы связывают с протеолитической активностью микробных ферментов [24]. Таким образом, по накоплению аминного азота и свободных аминокислот в субстрате можно судить об интенсивности гидролиза белка [12].
Для оценки степени гидролиза белка определяют содержание не только структурных, но и свободных аминокислот в субстрате.
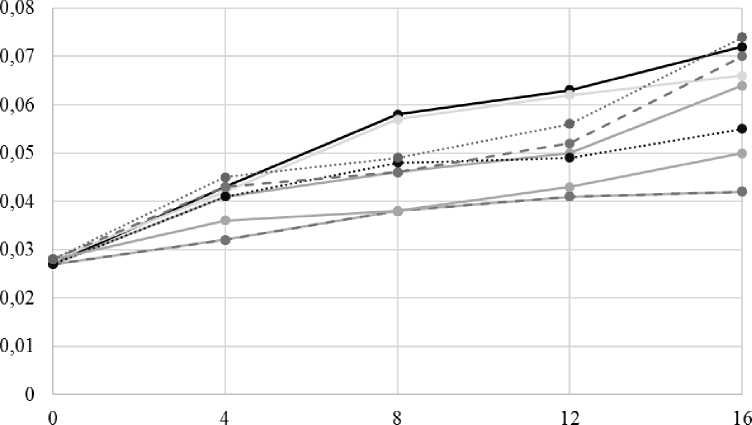
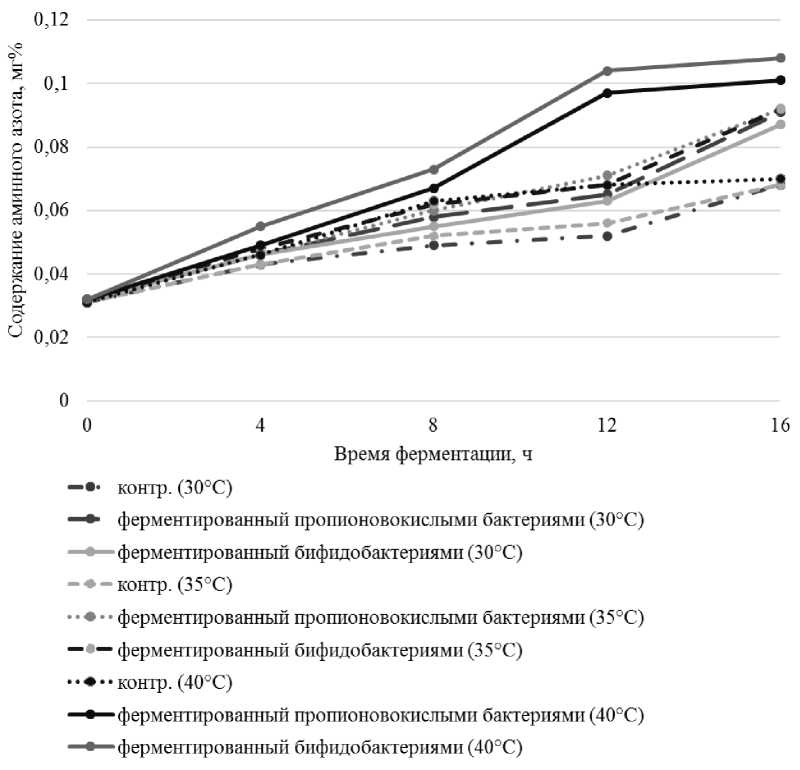
Время ферментации, ч
—•—контр. (30°С)
—•—ферментированный пропионовокислыми бактериями(ЗО°С)
ферментированный бифидобактериями (30°С)
-
- • - контр. (35°С)
ферментированный пропионовокислыми бактериями (35°С)
-
- --• •— ферментированный бифидобактериями (35°С)
-
— •— контр. (40°С)
-
- • - ферментированный пропионовокислыми бактериями (40°С)
-
■ ■■■•■■■ ферментированный бифидобактериями (40°С)
док, содержат большое количество пролина, гидроксипролина и глицина, а также низкие уровни триптофана и тирозина [27].
Таблица 2
Таблица 3
Выводы
Полученные данные могут быть использованы при получении белковых гидролизатов из субпродуктов птицы для дальнейшего включения в состав пищевых продуктов как источника полноценного белка.
Контр. в начале ферментации

Контр. через 16 ч
Ферментированный пропио-

новокислыми бактериями рментации
Ферментированный бифидобактериями


Увеличение ×200
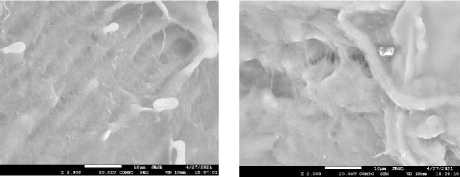
Увеличение ×2000





Увеличение ×5000
Ферментированный
Контр. в начале

Контр. через 16 ч ферментации

Ферментированный пропио- новокислыми бактериями

бифидобактериями
Увеличение ×200


Увеличение ×2000

Увеличение ×5000

Исследование выполнено при финансовой поддержке РФФИ и Челябинской области в рамках научного проекта № 20-416-740002.
Список литературы Микробная ферментация субпродуктов птицы
- Глотова, И.А. Исследование процессов дегидратации биополимерных систем в составе птицепродуктов / И.А. Глотова, А.Н. Литовкин, Е.С. Артемов // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. – 2016. – № 121. – С. 801–812.
- Бектасова, С.С. Совершенствование технологии переработки цыплят-бройлеров / С.С. Бектасова, Г.Т. Салкинбаева, Т.М. Турарбек, Ж.М. Атамбаева // Международная научно-практическая конференция, посвященная памяти Василия Матвеевича Горбатова. – 2016. – № 1. – С. 57–59.
- Peña-Saldarriaga, L.M. Quality of chicken fat by-products: Lipid profile and colour proper-ties / L.M. Peña-Saldarriaga, J. Fernández-López, J.A. Pérez-Alvarez // Foods. – 2020. – № 9. – Р. 1046.
- Гущин, В.В. Сырьевая база побочного сырья, получаемого при убое птицы, и ее использование / В.В. Гущин, В.Г. Волик // Птица и птицепродукты. – 2018. – №3. – С. 18–21.
- Денисюк, Е.А. К вопросу безотходной переработки сырья птицеперерабатывающих производств и пути ее интенсификации / Е.А. Денисюк, И.А. Носова, К.Т. Гусейнов, А.С. Ерахтин // Вестник Нижегородской гос. сель-скохоз. академии. – 2013. – Т. 3. – С. 323–328.
- Roiter, L.M. Poultry by-products, reserve for growth of export potential of the industry / L.M. Roiter, L.A. Zazykina, N.A. Eremeeva // IOP Conf. Ser. Earth Environ. Sci. – 2019. – № 341. – 012209.
- Фисинин, В.И. Глубокая переработка вторичных продуктов птицеводства для разных направлений использования / В.И. Фиси-нин, Д.Ю. Исмаилова, В.Г. Волик, В.С. Лукашенко, И.П. Салеева // Сельскохозяйственная биология. – 2017. – Т. 52, № 6. – С. 1105–1115.
- Курчаева, Е.Е. Особенности переработки вторичных ресурсов мясной промышленности с использованием микробной ферментации / Е.Е. Курчаева, В.Л. Пащенко, И.В. Максимов // Технологии и товароведение сельскохозяйственной продукции. – 2018. – № 2(11). – С. 131–138.
- Процан, А.Г. Рациональное использование малоценных частей тушек птицы / А.Г. Процан, А.Н. Нургазезова, Б.К. Асенова // Международная научно-практическая конференция, посвященная памяти Василия Матвеевича Горбатова. – 2015. – № 1. – С. 376–379.
- Волик, В.Г. Современные технологии переработки белоксодержащего сырья / В.Г. Волик // Птицепром. – 2017. – № 1(35). – С. 66.
- Polaštíková, A. Preparation of protein products from collagen-rich poultry tissues / A. Polaštíková, R. Gál, P. Mokrejš, J. Orsavová // Potravin. Slovak J. Food Sci. – 2020. – № 14. – Р. 713–720.
- Гармашов, С.Ю. Выбор условий ферментативного гидролиза коллагенсодержащего сырья / С.Ю. Гармашов // Вестник Крас-ГАУ. – 2018. – № 3. – С. 268–273.
- Boland, M.J. The future supply of ani-mal-derived protein for human consumption / M.J. Boland, A.N. Rae, J.M. Vereijken, M.P.M. Meuwissen, A.R.H. Fischer, M.A.J.S. van Boekel, S.M. Rutherfurd, H. Gruppen, P.J. Moughan, W.H. Hendriks // Trends Food Sci. Technol. – 2013. – № 29. – Р. 62–73.
- Smid, E.J. Microbe-microbe interactions in mixed culture food fermentations / E.J. Smid, C. Lacroix // Curr. Opin. Biotechnol. – 2013. – № 24. – Р. 148–154.
- Saadi, S. Recent advances in food biopeptides: Production, biological functionali-ties and therapeutic applications / S. Saadi, N. Saari, F. Anwar, A.A. Hamid, H. Mohd-Ghazali // Biotechnol. Adv. – 2015. – № 33. – Р. 80–116.
- Chai, K.F.; Hui Voo, A.Y.; Chen, W.N. Bioactive peptides from food fermentation: A comprehensive review of their sources, bioactivi-ties, applications, and future development / K.F. Chai, A.Y. Hui Voo, W.N. Chen // Compr. Rev. Food Sci. Food Saf. – 2020. – № 19. – Р. 3825–3885.
- Assaad, H. Rapid publication-ready MS-Word tables 597 for one-way ANOVA / H. Assaad, L. Zhou, R.J. Carroll, G. Wu // Springer Plus. – 2014. – № 3. – P. 474.
- Zhumanova, G. Prospects of Using Poul-try by-Products in the Technology of Chopped Semi-Finished Products / G. Zhumanova, M. Rebezov, B. Assenova, E. Okuskhanova // Inter-national Journal of Engineering & Technology. – 2018. – № 7(3.34). – P. 495–498.
- Abdullah, FAA. Comparison of qualita-tive and quantitative properties of the wings, necks and offal of chicken broilers from organic and conventional production systems / FAA. Ab-dullah, H. Buchtova // Veterinarni Medicina. – 2016. – № 61. – P. 643–651.
- Lorusso, A. Use of Selected Lactic Acid Bacteria and Quinoa Flour for Manufacturing Novel Yogurt-Like Beverages / A. Lorusso, R. Coda, M. Montemurro, C.G. Rizzello // Foods. – 2018. – № 7. – P. 51.
- Mirzaei Teshnizi, Z. Optimization of the Enzymatic Hydrolysis of Poultry Slaughterhouse Wastes using Alcalase Enzyme for the Prepara-tion of Protein Hydrolysates / Z. Mirzaei Teshnizi, S.M. Robatjazi, J. Mohammadian Mosaabadi // Appl Food Biotechnol. – 2020. – № 7(3). – Р.153–160.
- Hughes, M.C. Characterization of prote-olysis during the ripening of semi-dry fermented sausages/ M.C. Hughes, J.P. Kerry, E.K. Arendt, P.M. Kenneally, P.L.H. McSweeney, E.E. O’Neill // Meat Science. – 2002. – № 62. – P. 205–216.
- AroAro, J.M. The effect of starter cul-tures on proteolytic changes and amino acid con-tent in fermented sausages / J.M. AroAro, P. Nyam-Osor, K. Tsuji, K.I. Shimada, M. Fuku-shima, M. Sekikawa // Food Chemistry. – 2010. – № 119. –Р. 279–285.
- El Adab, S. Microbiological, biochemi-cal and textural characteristics of a Tunisian dry fermented poultry meat sausage inoculated with selected starter cultures / S. El Adab, I. Essid, M. Hassouna // Journal of Food Safety. – 2015. – № 35. – Р. 75–85.
- Sarbon, N.M. Purification and character-ization of antioxidative peptides derived from chicken skin gelatin hydrolysates / N.M. Sarbon, F. Badiia, N.K. Howell // Food Hydrocolloids. – 2018. – № 85. – Р. 311–320.
- Haq, M. Biofunctional properties of bac-terial collagenolytic protease-extracted collagen hydrolysates obtained using catalysts-assisted subcritical water hydrolysis / M. Haq, T.C. Ho, R. Ahmed, A.T. Getachew, Y.-J. Cho, J.-S. Park, B.-S. Chun // Journal of Industrial and Engineer-ing Chemistry. – 2020. – № 81. – Р. 332–339.
- Jayathilakan, K. Utilization of byprod-ucts and waste materials from meat, poultry and fish processing industries: a review / K. Jayathilakan, K. Sultana, K. Radhakrishna, A.S. Bawa // Journal of Food Science and Tech-nology. – 2012. – №49 (3). – P. 278–293.
- Arihara, K. Bioactivities generated from meat proteins by enzymatic hydrolysis and the Maillard reaction / K. Arihara, I. Yokoyamaa, M. Ohatab // Meat Science. – 2021. – №180. – 108561.
- Unsal, M. Fractionation and characteri-zation of edible sheep tail fat / M. Unsal, N. Aktas // Meat Sci. – 2003. – № 63(4). – Р. 235–239.
- Alemán, A. Contribution of Leu and Hyp residues to antioxidant and ACE-inhibitory activities of peptide sequences isolated from squid gelatin hydrolysate / A. Alemán, B. Giménez, E. Pérez-Santin, M. C. Gómez-Guillén, P. Montero // Food Chemistry. – 2011. – № 125. – P. 334–341.
- Akram, A.N. Extraction of collagen-II with pepsin and ultrasound treatment from chick-en sternal cartilage; physicochemical and func-tional properties / A.N. Akram, C. Zhang // Ultrason Sonochem. – 2020. – № 64. – 105053.


