Микробное сообщество почвоподобного субстрата как потенциальный источник несимбиотических азотфиксирующих штаммов
Автор: Аболенцева П.А., Овсянкина С.В., Величко В.В., Тихомирова Н.А.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Агрономия
Статья в выпуске: 9, 2025 года.
Бесплатный доступ
Цель исследования – проверить потенциал почвоподобного субстрата (ППС), являющегося продуктом биоконверсии несъедобной фитомассы в биологотехнических системах жизнеобеспечения, в качестве источника азотфиксирующих штаммов для улучшения азотного питания растений. Объекты исследования – азотфиксирующие штаммы Azotobacter chroococcum Н1, A. chroococcum Н2 и A. chroococcum Н3, выделенные авторами из ППС. Объектом для сравнения служил выделенный авторами из почвы сельскохозяйственного назначения азотфиксирующий штамм Azomonas macrocytogenes OSV2, ранее показавший свою эффективность в полевых экспериментах в составе комплексного биопрепарата. Тестобъектами служили растения кресссалат Lepidiumsativum L. сорта Московский парниковый, выращиваемые в климатической камере в песчаной культуре в условиях дефицита азота. Бактеризация всеми штаммами статистически значимо увеличила ростовые показатели растений салата в целом по совокупности ростовых показателей, наибольшую прибавку обеспечил штамм Н3, благодаря которому средние значения массы и длины корневой системы выросли соответственно в 2,14 и 1,1 раза, массы и длины надземной части – в 1,5 и 1,31 раза, а массы и длины всего растения – в 1,68 и 1,19 раза относительно небактеризованного контроля. Бактеризация всеми штаммами также статистически значимо повысила содержание пигментов фотосинтетического аппарата (в 1,4–13,1 раза относительно контроля в пересчете на сырой вес листьев и в 1,2–11,9 раз в пересчете на сухой вес), а также повысила отношение суммы хлорофиллов a и b к каротиноидам в 1,1–1,6 раза. Однако в данном случае по эффективности лидировал штамм OSV2. Бактеризация всеми изученными штаммами повысила содержание азота в растениях. Наибольший эффект в плане стимулирования роста растений и повышения содержания пигментов фотосинтетического аппарата обеспечила бактеризация смесью штаммов Н1, Н2, Н3 и OSV2, что позволяет говорить о наличии синергизма в их воздействии на растение.
Почвоподобный субстрат, азотфиксирующие штаммы, Azotobacter chroococcum, Azomonas macrocytogenes, Lepidiumsativum, восполнение дефицита азота
Короткий адрес: https://sciup.org/140312336
IDR: 140312336 | УДК: 579.64 | DOI: 10.36718/1819-4036-2025-9-3-24
Текст научной статьи Микробное сообщество почвоподобного субстрата как потенциальный источник несимбиотических азотфиксирующих штаммов
Funding : the study was funded by the Ministry of Education and Science of the Russian Federation under the State Assignment FWES-2024-0039.
Введение. Азот является важнейшим элементом минерального питания растений. Атомы азота входят в состав аминокислот и состоящих из них белков, нуклеотидов и нуклеиновых кислот, хлорофилла и ряда других жизненно важных молекул. По содержанию в растениях азот занимает четвертое (после углерода, водорода и кислорода) место, а среди поступающих из почвы элементов минерального питания – первое [1]. В связи с тем, что при возделывании сельскохозяйственных культур происходит постоянный вынос азота из почвы (в первую очередь – за счет вывоза с полей продукции растениеводства, а также с ирригационными водами и за счет процессов денитрификации), обеспечение растений азотом рассматривается в качестве одной из ключевых проблем мировой продовольственной безопасности [2]. Исторически проблема восполнения дефицита азота в почве решалась за счет применения сначала органических, а затем – минеральных азотсодержащих удобрений. Однако в последние десятилетия все большее внимание уделяется микробиологическим удобрениям, основанным на азотфиксирующих прокариотических микроорганизмах, способных переводить атмосферный азот в доступную для растений форму. Подобные удобрения рассматриваются как безопасная для окружающей среды и при этом дешевая альтернатива химическим азотным удобрениям [3–5], что обуславливает непрерывный рост их производства. Так, в одном только в Китае по состоянию на 2024 г. производство микробиологических худобрений составило 35 млн т, а объем рынка подобных удобрений превысил 5,5 милрд долларов США в год [6].
Азотфиксирующие микроорганизмы обнаружены в трех крупных таксонах (Bacteria, Cyanobacteria и Archaea) и включают представителей более 30 родов. Среди них есть как симбиотические виды, способные к фиксации атмосферного азота лишь в составе симбиотической ассоциации с определенными видами растений (представители р.р. Rhizobium, Bradyrhi-zobium), «полусимбиотические» виды, способные к фиксации азота как в составе симбиотической ассоциации с растениями, так и вне такой ассоциации (представители р.р. Frankia и Anabaena), а также несимбиотические (свобод-ноживущие) виды, не образующие симбиотических ассоциаций с растениями (представители р.р. Azotobacter, Azomonas, Mycobacterium, Azospirillum, Bacillus, Nostoc, Tolypothrix, Anabae-nopsis, а также семейств Methanococcales, Methanobacteriales, Methanomicrobiales и др.) [7]. В настоящее время наибольшее внимание с точки зрения производства микробиологических удобрений уделяется несимбиотическим азот- фиксаторам. Несколько уступая симбиотическим видам в эффективности с точки зрения обеспечения растений азотом, несимбиотические виды имеют радикальное преимущество в том, что способны колонизовать ризосферу широкого круга сельскохозяйственных культур. Таким образом, применение микробных удобрений, основанных на несимбиотических азотфик-саторах, не ограничивается строго определенными видами растений, как в случае симбиотических видов.
Несмотря на таксономическое разнообразие свободноживущих азотфиксирующих микроорганизмов, практическое применение в качестве микробиологических удобрений для «сухопутных» агроценозов нашли главным образом бактерии р. Azotobacter (в который часто включают вид Azomonas macrocytogenes , являющийся синонимом Azotobacter macrocytogenes ), р. Azospirillum (последние – преимущественно для тропических и субтропических климатических зон), а для обводненных агроценозов (рисовых полей) – цианобактерии р.р. Anabaena, Toly-pothrix и Nostoc [8–12].
Несмотря на отмечаемые многочисленными авторами несомненные преимущества микробиологических удобрений перед химическими, рынок микробиологических удобрений все еще сильно отстает от рынка химических удобрений. Так, согласно уже цитированной статье [6], в 2024 г. в Китае объем рынка химических удобрений в 7,7 раза превышал объем рынка микробиологических, сходная картина наблюдается и в других странах. Основной причиной такой ситуации является недостаток штаммов, обеспечивающих надежную и эффективную замену химическим удобрениям, а также сильная зависимость используемых штаммов от конкретных почвенно-климатических условий. В этой связи во всем мире продолжается поиск новых штаммов для производства микробиологических удобрений, причем основной упор делается на азотфиксирующие штаммы. Настоящая работа посвящена поиску несимбиотических азотфик-сирующих штаммов в таком нетрадиционном источнике, как используемый в биологотехнических системах жизнеобеспечения почвоподобный субстрат, и оценке потенциала этих штаммов с точки зрения применения в растениеводстве.
Цель исследования – проверить потенциал почвоподобного субстрата (ППС), являющегося продуктом биоконверсии несъедобной фитомассы в биолого-технических системах жизнеобеспечения, в качестве источника азотфиксирующих штаммов для улучшения азотного питания растений.
Объекты и методы. Объектами исследования служили 4 штамма несимбиотических азот-фиксирующих бактерий: штаммы Azotobacter chroococcum Н1, Azotobacter chroococcum Н2, Azotobacter chroococcum Н3 и штамм Azomonas macrocytogenes OSV2. Штаммы A. chroococcum Н1, Azotobacter chroococcum Н2, Azotobacter chroococcum Н3 выделены авторами из почвоподобного субстрата (ППС), используемого в качестве субстрата для выращивания растений в биолого-технических системах жизнеобеспечения (БТСЖО), предназначенных для обеспечения жизнедеятельности человека в экстремальных условиях (в первую очередь – в условиях будущих внеземных баз). Данный субстрат получается при биологической конверсии несъедобной растительной биомассы по следующей схеме: 1) выращивание гриба вешенка Pleurotus ostreatus на растительных остатках до получения плодовых тел, которые служат дополнительным элементом рациона экипажа; 2) вермикомпости-рование субстрата, оставшегося после сбора плодовых тел P. ostreatus, с помощью красных калифорнийских червей Eisenia andre [13]. Штаммы представлены крупными (1,5–2,3 × 2,5– 7,4 мкм) подвижными палочками, одиночными и в парах, с капсулами и без, сходными у всех трех штаммов. Штамм OSV2 выделен авторами из почвы сельскохозяйственного назначения в Красноярском крае и использован для сравнения со штаммами из ППС. В молодой культуре штамм представлен крупными (1,5–2,4 × 1,7–4,1 мкм) подвижными палочками, одиночными и в парах, в старой культуре – кокковидными клетками диаметром 1,5–2,5 мкм, склонными к формированию слизистых капсул; клетки внутри капсул могут достигать диаметра 3,5 мкм (рис. 1).
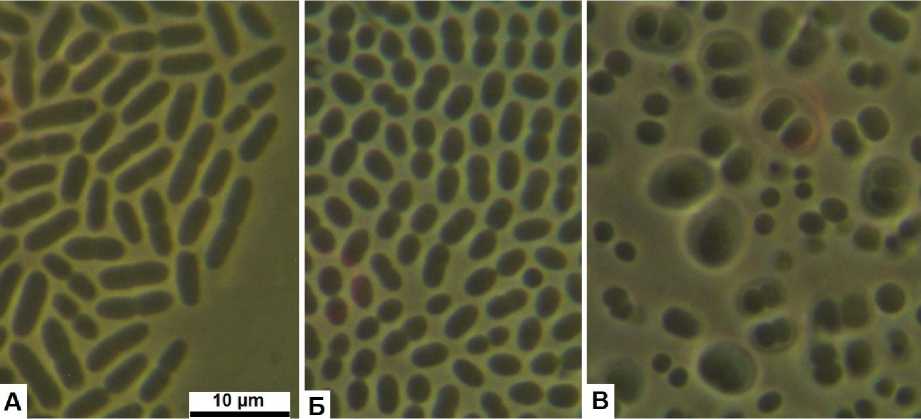
Рис. 1. Характерный вид клеток изучаемых штаммов : А – штамм Н1; Б – штамм OSV2, молодая культура; В – штамм OSV2, старая культура; длина масштабной полоски 10 мкм Typical shape of cells of the studied strains: A – strain H1; Б – strain OSV2, young culture;
В – strain OSV2, old culture; scale bar length 10 µm
В 2023 г. данный штамм был успешно апробирован авторами статьи в полевых условиях в качестве азотфиксатора в составе комплексного биопрепарата при выполнении проекта «Разработка биопрепарата комплексного действия для защиты и стимулирования роста картофеля в технологиях производства органической сельскохозяйственной продукции» по заказу Министерства сельского хозяйства Российской Феде- рации (отчет 224021300245-3ЕГИСУ НИОКТР). Видовая идентификация всех изучаемых штаммов проведена в БРЦ ВКПМ на основе нуклеотидной последовательности гена 16S рРНК.
Тест-культурой служил кресс-салат Lepidium sativum L. сорта Московский парниковый, выращиваемый в условиях дефицита азота. Эксперимент включал 7 вариантов (табл. 1).
Схема эксперимента
Thedesignoftheexperiment
Таблица 1
|
Вариант |
Описание |
|
Контроль |
Выращивание растений в условиях дефицита азота без бактеризации |
|
Раствор Кнопа |
Выращивание растений на среде Кнопа |
|
OSV2 |
Выращивание растений в условиях дефицита азота при бактеризации штаммом OSV2 |
|
Н1 |
Выращивание растений в условиях дефицита азота при бактеризации штаммом Н1 |
|
Н2 |
Выращивание растений в условиях дефицита азота при бактеризации штаммом Н2 |
|
Н3 |
Выращивание растений в условиях дефицита азота при бактеризации штаммом Н3 |
|
Смесь штаммов |
Выращивание растений в условиях дефицита азота при бактеризации смесью штаммов OSV2, Н1, Н2 и Н3 |
В вариантах контроль, а также в вариантах с бактеризацией изучаемыми штаммами растения поливали не содержащим азота минеральным раствором следующего состава, г/л: K 2 SO 4 – 0,44; MgSO 4 ∙7H 2 O – 0,49; CaSO 4 ∙2H 2 O – 0,345; KH 2 PO 4 – 0,132; CuSO 4 ∙2H 2 O – 0,025; FeSO 4 ∙7H 2 O – 0,0278; CoCl 2 ∙6H 2 O – 0,025; MnSO 4 ∙4H 2 O – 0,0223. За основу этого раствора был взят состав, использованный в работе [14] для приготовления безазотистого минерального раствора для выращивания растений в условиях песчаной культуры. В варианте раствор Кнопа растения поливали стандартным раствором Кнопа следующего состава, г/л: KNO 3 – 0,518; MgSO 4 ∙7H 2 O – 0,49; Ca(NO 3 ) 2 ∙4H 2 O – 0,0472; KH 2 PO 4 – 0,132; CuSO 4 ∙2H 2 O – 0,025; FeSO 4 ∙7H 2 O – 0,0278; CoCl 2 ∙6H 2 O – 0,025; MnSO 4 ∙4H 2 O – 0,0223. В качестве источника микроэлементов в оба раствора добавляли 1 мл/л раствора микросолей по Федорову следующего состава, г/л: H 3 BO 3 – 5; (NH 4 ) 2 MoO 4 ∙2H 2 O – 5; ZnSO 4 ∙7H 2 O – 0,2; KI – 0,5; NaBr – 0,5; Al 2 (SO 4 ) 3 ∙18H 2 O – 0,3. Данный набор микроэлементов используется при культивировании азотфиксирующих бактерий, в первую очередь – благодаря наличию молибдена, входящего в состав нитрогеназы. pH растворов составлял 6,5.
Семена дезинфицировали 3,5 % раствором гипохлорита натрия, после чего многократно промывали стерильной водой и высевали в растильни с песком, предварительно простерили-зованным автоклавированием при 121 °С, по
100 семян в каждом варианте, глубина посадки составляла 7–10 мм. В вариантах с бактеризацией семена перед высевом в песок бактеризовали погружением в суспензию соответствующего штамма с титром 108 клеток на 1 мл. В варианте смесь штаммов суспензию для бактеризации получали путем смешивания в равных пропорциях суспензий штаммов OSV2, Н1, Н2 и Н3 с титрами 108 клеток на 1 мл. Суспензии для бактеризации получали путем смыва стерильной водой клеток соответствующих штаммов с 72-часовых культур, выращенных на агаризо-ванной среде Эшби следующего состава: MgSO 4 – 0,2 г/л; NaCl – 0,2; KH 2 PO 4 – 0,1; K 2 SO 4 – 0,1; FeSO 4 – следовые количества; глюкоза – 20; агар-агар микробиологический – 14 г/л; микросоли по Федорову – 1 мл/л. Замена традиционно используемого в среде Эшби маннита на глюкозу была обусловлена тем, что, согласно предварительным экспериментам, глюкоза в качестве источника углерода обеспечивает более быстрое накопление биомассы у изучаемых штаммов. Титр клеток в суспензиях определяли на мутномере Densi-La-Meter II по предварительно построенным для каждого штамма калибровочным кривым.
После высева в растильни семена проращивали в темноте при температуре (22 ± 1) °С. После появления первых всходов (на 3-е сут от посева) растильни инкубировали в климатической камере U-7250 при следующем режиме: фотопериод 16 ч – день, 8 ч – ночь, освещенность – 12000 лк, влажность – 70 %, температу- ра: ночь – 22 °С, день – 26 °С. Полив растений в климатической камере осуществляли ежедневно до постоянного веса. Через 28 сут после появления первых всходов была проведена повторная бактеризация путем точечного полива проростков суспензиями клеток соответствующих штаммов, по 13 мл суспензии с титром 108 клеток на 1 мл на каждый проросток; суспензии готовили так же, как и для бактеризации семян. Перед повторной бактеризацией проверили присутствие изучаемых штаммов в ризосфере проростков и оценили их численность. Для проверки присутствия азотфиксирующих штаммов использовали метод отпечатков корневой системы на агари-зованной среде Эшби с последующим микроскопированием in situ 24-суточных микроколоний, выросших на отпечатках. Для оценки численности использовали высев из смывов с корневой системы проростков (по 5 проростков на каждый вариант эксперимента) на агаризован-ную среду Эшби с последующей микроскопией выросших колоний. Отпечатки и высевы делали для всех вариантов эксперимента.
На ранних стадиях вегетации ежедневно учитывали число проростков салата в каждом варианте вплоть до прекращения увеличения их числа. Отказ от использования рекомендуемых ГОСТ 12038-84 «Семена сельскохозяйственных культур. Методы определения всхожести» показателей «энергия прорастания» и «всхожесть», учитываемых соответственно через 3 и 5 сут, объясняется тем, что в нашем эксперименте семена находились в условиях, отличающихся от обозначенных в ГОСТ (заглублены в песок, а не разложены на влажной фильтровальной бумаге). Через 35 сут после появления первых всходов учитывали сырую массу и длину надземной части растения и корневой системы, общую длину и сырую массу растений, а также корнеобеспеченность как отношение массы корневой системы к массе надземной части.
Кроме этого, оценивали состояние фотосинтетического аппарата растений и определяли их минеральный состав. Состояние фотосинтетического аппарата оценивали по концентрации пигментов фотосинтетического аппарата (хлорофиллы a, b и каротиноиды). Экстракцию пигментов проводили 96 % этанолом. Масса навески составляла не менее 0,3 г. Содержание фотосинтетических пигментов в листьях салата определяли на спектрофотометре UV-2804
(UNICO, США) и рассчитывали по формулам Wintermans, DeMots [15].
Содержание Ca, K, Mg, P и S в пробах определяли методом атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой с помощью спектрометра iCAP 6300 Duo (Thermo Scientific, U.K.). Пробы перед анализом минерализовали методом мокрого сжигания в смеси азотной и хлорной кислот (1 : 1). Подробное описание методики анализа можно найти в работе [16]. Для определения содержания нитратного азота в образцах использовалась методика водной экстракции нитратов, восстановления их до нитритов на кадмиевой колонке с последующим взаимодействием с реактивом Грисса (сульфаниламидом и а-нафтиламином) на светофильтре 540 нм (РД 52.24.380-2017. Массовая концентрация нитратного азота в водах. Методика измерений фотометрическим методом с реактивом Грисса после восстановления в кадмиевом редукторе. Росгидромет, ГХИ. Ростов-н/Д, 2017). Содержание органического азота определяли методом Къельдаля по реакции аммонийного азота с реактивом Несслера с детекцией на длине волны 440 нм [17].
Математическую обработку полученных данных выполняли с помощью пакета StatSoft STATISTICA 8.0. Для сравнения вариантов по числу проростков использовали тест χ2 (хи-квадрат), а в случае сравнения вариантов с контролем – точный тест Фишера для таблиц 2×2. Сравнение вариантов с контролем по ростовым показателям растений (масса, длина, кор-необеспеченность), а также по содержанию пигментов фотосинтетического аппарата проводили с помощью двухвыборочного t-теста. Сравнение вариантов по комплексу показателей проводили с помощью дискриминантного анализа, а также на основе проекций из пространства изучаемых признаков на первые две главные компоненты. Кроме этого, для сравнения вариантов по набору изучаемых показателей использовали непараметрические тесты (парный двухвыборочный тест Уилкоксона и ранговый дисперсионный анализ Фридмана). Связь между ростовыми показателями растений проверяли корреляционным анализом отдельно для каждого варианта с последующим анализом корреляционных матриц методом главных компонент. Сходство вариантов по наборам показателей оценивали проекцией на первые две главные компоненты, а также кластерным анализом;
для того чтобы избежать влияния различий в размерности показателей на результаты кластеризации, при проведении кластерного анализа использовали стандартизованные данные.
Результаты и их обсуждение
Эффективность колонизации ризосферы изучаемыми штаммами после бактеризации семян. Метод отпечатков показал, что через 28 сут после бактеризации семян характерные для изучаемых штаммов клетки присутствуют во всех бактеризованных вариантах, формируя микроколонии на среде Эшби по всему отпечатку (рис. 2). Это говорит о том, что все изучаемые штаммы продемонстрировали способность приживаться в ризосфере после однократной предпосевной бактеризации семян.
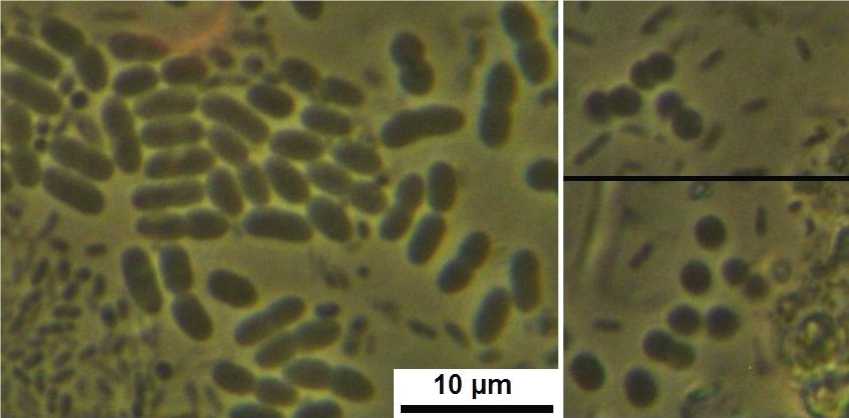
Рис. 2. Рост изучаемых штаммов в отпечатках с корней бактеризованных проростков: штамм Н1 (слева) и штамм OSV2 (справа); мелкие клетки – эндофитные бактерии; длина масштабной полоски 10 мкм
Growth of the studied strains in root imprints of bacterized seedlings: strain H1 (left) and strain OSV2 (right); small cells are endophytic bacteria; scale bar length is 10 µm
В отпечатках корней проростков из небакте-ризованных вариантов подобные клетки не выявлены. В то же время во всех вариантах выявлено достаточно большое разнообразие бактерий, не относящихся к изучаемым штаммам (рис. 3).
Рис. 3. Примеры эндофитных бактерий в отпечатках с корней проростков; длина масштабной полоски 10 мкм
Examples of endophytic bacteria in seedling root imprints; scale bar length 10 µm
Поскольку семена перед высевом дезинфицировали, а субстрат был предварительно про-стерилизован, можно заключить, что речь идет об эндофитных бактериях, находившихся под оболочкой семян либо непосредственно в семенах. В последние годы эндофитные бактерии рассматриваются как обширная группа бактерий, способных колонизовать семена либо растительные ткани не только без вреда для растения-хозяина, но и во многих случаях стимулируя рост растений, повышая их устойчивость к биотическим и абиотическим стрессам и улучшая способность растений к поглощению минеральных веществ. При этом максимальное количество эндофитных бактерий приходится на корневую систему растения, что позволяет ряду авторов рассматривать их как подгруппу ризосферных бактерий [18].
Несмотря на то, что все изучаемые штаммы успешно колонизовали ризосферу, высевы из смывов с корней проростков показали, что численность этих штаммов невысока и для всех штаммов составляет порядка 102 КОЕ на проросток. В этой связи проведенную нами повторную бактеризацию проростков следует считать оправданной.
Влияние бактеризации на прорастание семян и развитие растений салата. На протяжении всего периода от появления первых всходов до прекращения появления новых всходов динамика прорастания в разных вариантах не имела статистически значимых различий. Исключение составил вариант с бактеризацией штаммом OSV2, который статистически значимо (p < 0,001) отставал от остальных вариантов как по динамике появления всходов, так и по итоговому числу проростков. Так, на 7-е сут всхожесть в варианте OSV2 уступала среднему значению всходов в остальных вариантах практически в 2 раза (33 против 60,2 %), этот разрыв сохранился до завершения появления новых всходов на 14-е сут (43 против 74,2 %) (рис. 4).
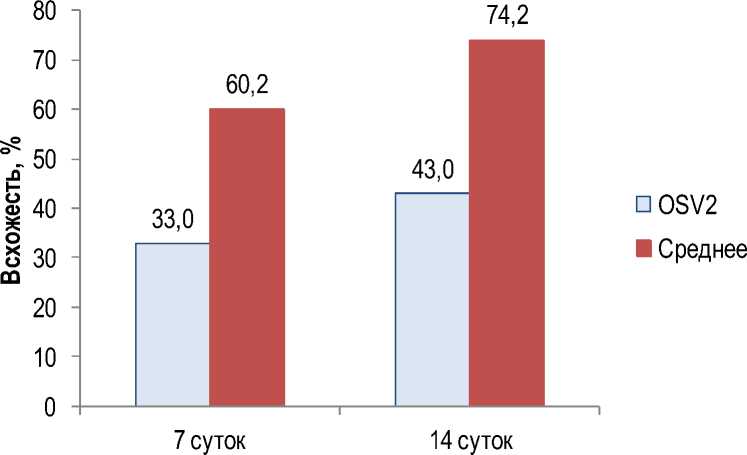
Рис. 4. Всхожесть салата в варианте OSV2 в сравнении со средним значением по остальным вариантам
Germination of lettuce in the OSV2 variant compared to the average value for the other variants
Дефицит азота вполне ожидаемо статистически значимо снизил средние значения всех ростовых характеристик растений салата, за исключением корнеобеспеченности. Отсутствие статистически значимого влияния дефицита азота на корнеобеспеченность объясняется пропорциональным снижением в этом варианте как массы корней, так и массы надземной части. В то же время снижение ростовых показателей в варианте с дефицитом азота (в 1,2–2,6 раза относительно варианта с нормальной обеспеченностью азотом) оказалось далеко не столь значительным, как можно было ожидать (табл. 2).
Таблица 2
|
Показатель |
Раствор Кнопа |
Контроль |
Раствор Кнопа/контроль |
Статистическая значимость различий, p |
|
Длина растения, мм |
129,73 |
100,22 |
1,29 |
< 0,001 |
|
Масса растения, г |
0,68 |
0,27 |
2,55 |
< 0,001 |
|
Длина корня, мм |
70,59 |
58,62 |
1,20 |
< 0,001 |
|
Масса корня, г |
0,17 |
0,07 |
2,41 |
< 0,001 |
|
Длина надземной части, мм |
59,14 |
41,60 |
1,42 |
< 0,001 |
|
Масса надземной части, г |
0,51 |
0,19 |
2,61 |
< 0,001 |
|
Корнеобеспеченность |
0,37 |
0,51 |
0,73 |
Нет |
Влияние дефицита азота на ростовые характеристики растений салата
Effectofnitrogendeficiencyongrowthcharacteristicsoflettuceplants
Можно предположить, что дефицит азота в контрольном варианте был частично восполнен азотфиксаторами, присутствовавшими среди упомянутых выше эндофитных бактерий. Действительно, многочисленными исследованиями показано присутствие среди эндофитных бактерий азотфиксирующих штаммов самой разной таксономической принадлежности [19].
Бактеризация штаммом Н3, а также смесью штаммов, статистически значимо (от p < 0,05 до p < 0,001) повысила все ростовые характеристики растений салата, за исключением кор-необеспеченности, в 1,1–2,44 раза относительно контрольного варианта. Бактеризация штаммом Н2 статистически значимо увеличила средние значения длины и массы растения, а также длины и массы надземной части (соответствен- но в 1,12; 1,25; 1,22 и 1,25 раза относительно контроля). Бактеризация штаммом Н1 хотя и повысила среднюю длину и массу растений, среднюю длину и массу корня, а также среднюю длину надземной части, но это повышение было небольшим (в зависимости от показателя - в 1,03-1,19 раза относительно контроля), и статистическая значимость различий с контролем не доказана. Бактеризация штаммом OSV2 статистически значимо повысила среднюю массу растений и среднюю массу корня (соответственно в 1,79 и 3,65 раз относительно контроля), несколько снизила среднюю длину надземной части растений (на 10 % относительно контроля) и повысила корнеобеспеченность (в 2,86 раза относительно контроля).
Таблица 3
|
Показатель |
OSV2 |
Н1 |
Н2 |
Н3 |
Смесь штаммов |
|||||
|
Длина растения, мм |
98,97 |
0,99 |
106,8 |
1,07 |
112,63** |
1,12 |
119,0*** |
1,19 |
118,4*** |
1,18 |
|
Масса растения, г |
0,48*** |
1,79 |
0,28 |
1,03 |
0,33* |
1,25 |
0,45*** |
1,68 |
0,5*** |
1,88 |
|
Длина корня, мм |
61,66 |
1,05 |
62,16 |
1,06 |
61,89 |
1,06 |
64,54* |
1,1 |
67,29** |
1,15 |
|
Масса корня, г |
0,26*** |
3,65 |
0,09 |
1,19 |
0,09 |
1,27 |
0,16*** |
2,14 |
0,18*** |
2,44 |
|
Длина надземной части, мм |
37,31* |
0,9 |
44,65 |
1,07 |
50,75*** |
1,22 |
54,49*** |
1,31 |
51,11*** |
1,23 |
|
Масса надземной части, г |
0,21 |
1,09 |
0,21 |
1,05 |
0,24* |
1,25 |
0,32*** |
1,62 |
0,32*** |
1,66 |
|
Корнеобеспеченность |
1,47*** |
2,86 |
0,37 |
0,71 |
0,53 |
1,03 |
0,47 |
0,92 |
0,56 |
1,09 |
Примечание: для каждого варианта в первом столбце показано среднее значение показателя, во втором - отношение среднего значения к среднему значению соответствующего показателя в контроле; (*) - статистическая значимость различий с контролем p < 0,05; (**) - статистическая значимость различий с контролем p < 0,01; (***) - статистическая значимость различий с контролем p < 0,001.
Влияние бактеризации на ростовые характеристики растений салата Effect of bacterization on growth characteristics of lettuce plants
Следует отметить, что двухвыборочный t-тест, примененный для расчета статистической значимости различий между бактеризованными вариантами и контролем, не лишен недостатков. Этот тест адекватно работает с индивидуальными показателями, однако не учитывает величины и направленности одновременного изменения целого набора показателей. В этой связи в качестве дополнительных тестов для сравнения бактеризованных вариантов между собой и с контролем были применены дискриминантный анализ (который при сравнении вариантов одновременно работает со всем набором изучаемых показателей), а также тесты для связанных выборок (тест Уилкоксона в случае сравнения двух вариантов) и непараметрический дисперсионный анализ Фридмана (в случае одновременного сравнения нескольких вариантов), которые отслеживают направленность изменения набора показателей.
Дискриминантный анализ показал, что по набору изученных ростовых показателей растений все варианты, за исключением варианта с бактеризацией штаммом Н1, статистически значимо отличаются от контроля, хотя и не достигают уровня показателей растений, выращенных на среде Кнопа (табл. 4).
Таблица 4
Статистическая значимость (p) различий между вариантами по набору ростовых показателей согласно результатам дискриминантного анализа Statistical significance (p) of differences between variants in a set of growth indicators according to the results of discriminant analysis
|
Вариант |
Раствор Кнопа |
OSV2 |
Н1 |
Н2 |
Н3 |
Смесь штаммов |
Контроль |
|
Раствор Кнопа |
< 0,001 |
< 0,001 |
< 0,001 |
< 0,001 |
< 0,001 |
< 0,001 |
|
|
OSV2 |
< 0,001 |
< 0,001 |
< 0,001 |
< 0,001 |
< 0,001 |
< 0,001 |
|
|
Н1 |
< 0,001 |
< 0,001 |
< 0,01 |
< 0,001 |
< 0,001 |
Нет |
|
|
Н2 |
< 0,001 |
< 0,001 |
< 0,01 |
< 0,05 |
< 0,001 |
< 0,001 |
|
|
Н3 |
< 0,001 |
< 0,001 |
< 0,001 |
< 0,05 |
< 0,01 |
< 0,001 |
|
|
Смесь штаммов |
< 0,001 |
< 0,001 |
< 0,001 |
< 0,001 |
< 0,01 |
< 0,001 |
|
|
Контроль |
< 0,001 |
< 0,001 |
Нет |
< 0,001 |
< 0,001 |
< 0,001 |
Примечание: «Нет» – отсутствие статистически значимых различий.
Набор показателей, по которому, согласно результатам дискриминантного анализа, различаются варианты (см. табл. 4), включает длину и массу растений, длину и массу корня, длину и массу надземной части, однако не включает корнеобеспеченность.
Тест Уилкоксона для связанных выборок (без включения в анализ корнеобеспеченности, которая не прореагировала на дефицит азота (см. табл. 2)) показал, что, несмотря на то, что вариант с бактеризацией штаммом Н1 не отличается статистически значимо от контроля ни по отдельным показателям (согласно результатам двухвыборочных t-тестов), ни по их набору (согласно результатам дискриминантного анализа), тем не менее статистически значимо (p < 0,05) отличается от контроля в связи с тем, что превосходит контрольный вариант по всем шести ростовым показателям.
Ранговый дисперсионный анализ Фридмана подтвердил статистическую значимость разли- чий между всеми вариантами эксперимента по всему набору ростовых показателей (длина и масса растений, длина и масса корня, длина и масса надземной части, но без показателя кор-необеспеченности) на уровне p < 0,001. При этом коэффициент конкордации Кендалла оказался довольно высоким (0,738), а при исключении варианта OSV2 – очень высоким (0,935), что близко к его максимальному значению (1,0). Применительно к анализируемым данным этот коэффициент отражает согласованность реакции изучаемых ростовых показателей на разные варианты эксперимента. Другими словами, если при ранжировании вариант занимает первое место по одному из показателей, он будет занимать первое место и по большинству других показателей; если вариант занимает последнее место по одному из показателей, то он будет занимать последнее место и по большинству остальных показателей; то же касается вариантов, занимающих промежуточные места.
Действительно, совпадение либо близость мест, занимаемых вариантами при ранжировании по различным показателям, характерно для всех вариантов, кроме OSV2 (табл. 5). Ранг 1 соот- ветствует максимальному значению показателя, ранг 7 – минимальному. Порядок следования вариантов в таблице 5 соответствует занимаемым ими местам по совокупности рангов.
Таблица 5
Результаты ранжирования вариантов по различным ростовым показателям числа в ячейках означают место, которое занял вариант по величине соответствующего показателя
Results of ranking variants by various growth indicators; numbers in cells indicate the place that the variant took by the value of the corresponding indicator
|
Вариант |
Длина растения, мм |
Масса растения, г |
Длина корня, мм |
Масса корня, г |
Длина надземной части, мм |
Масса надземной части, г |
|
Раствор Кнопа |
1 |
1 |
1 |
3 |
1 |
1 |
|
Смесь штаммов |
3 |
2 |
2 |
2 |
3 |
2 |
|
Н3 |
2 |
4 |
3 |
4 |
2 |
3 |
|
Н2 |
4 |
5 |
5 |
5,5 |
4 |
4 |
|
OSV2 |
7 |
3 |
6 |
1 |
7 |
5 |
|
Н1 |
5 |
6 |
4 |
5,5 |
5 |
6 |
|
Контроль |
6 |
7 |
7 |
7 |
6 |
7 |
Примечание: числа в ячейках означают место, которое занял вариант по величине соответствующего показателя.
Проекция вариантов эксперимента на первые две главные компоненты с сохранением 96,71 % информации и кластерный анализ сходства вариантов по набору указанных пока- зателей подтверждают, что вариант OSV2 дос таточно сильно отличается от остальных ва риантов (рис. 5).
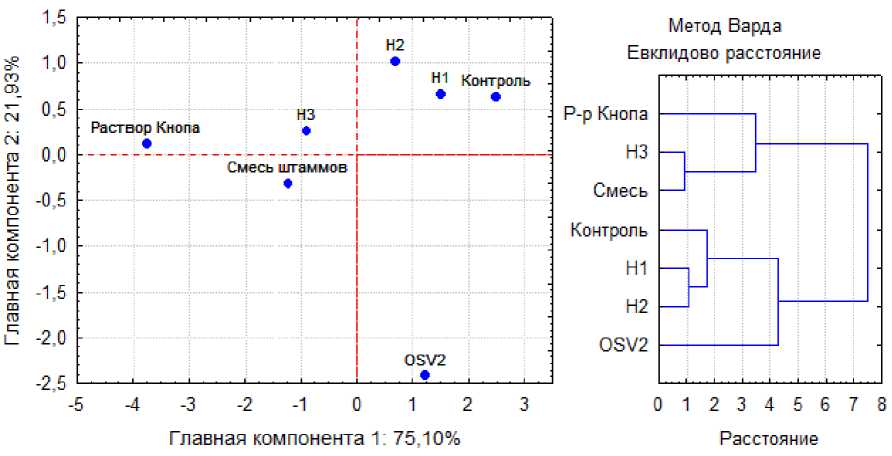
Рис. 5. Проекция вариантов по совокупности ростовых показателей на первые две главные компоненты (слева), каждая точка соответствует среднему для данного варианта; кластеризация вариантов по совокупности тех же показателей (справа)
Projection of variants by the set of growth indicators onto the first two principal components (left) , each point corresponds to the average for a given variant; clustering of variants by the set of the same indicators (right)
Одним из свидетельств нормального развития растений является высокая корреляция между развитием корневой системы и надземной части [20]. При этом улучшение азотного питания повышает координацию между развитием подземных и надземных органов растения, вующих коэффициентов корреляции [21, 22]. В этой связи нами были рассчитаны коэффициенты корреляции между длиной и массой корней и длиной и массой надземной части растений в разных вариантах эксперимента (табл. 6).
что находит отражение в увеличении соответст-
Таблица 6 Коэффициенты корреляции между основными ростовыми показатели в разных вариантах; статистически значимые (p < 0,05) коэффициенты корреляции выделены жирным шрифтом
Correlation coefficients between the main growth indicators in different variants; statistically significant (p < 0.05) correlation coefficients are highlighted in bold
|
Показатель |
Длина корня |
Масса корня |
Длина надземной части |
Масса надземной части |
|
Раство |
р Кнопа |
|||
|
Длина корня |
1,000 |
0,782 |
0,233 |
0,630 |
|
Масса корня |
0,782 |
1,000 |
0,361 |
0,611 |
|
Длина надземной части |
0,233 |
0,361 |
1,000 |
0,289 |
|
Конт |
роль |
|||
|
Длина корня |
1,000 |
0,341 |
0,189 |
0,417 |
|
Масса корня |
0,341 |
1,000 |
0,055 |
0,024 |
|
Длина надземной части |
0,189 |
0,055 |
1,000 |
0,408 |
|
OSV2 |
||||
|
Длина корня |
1,000 |
0,360 |
0,493 |
0,380 |
|
Масса корня |
0,360 |
1,000 |
0,719 |
0,582 |
|
Длина надземной части |
0,493 |
0,719 |
1,000 |
0,625 |
|
Н1 |
||||
|
Длина корня |
1,000 |
0,308 |
0,187 |
0,539 |
|
Масса корня |
0,308 |
1,000 |
0,529 |
0,526 |
|
Длина надземной части |
0,187 |
0,529 |
1,000 |
0,484 |
|
Н2 |
||||
|
Длина корня |
1,000 |
0,550 |
0,287 |
0,733 |
|
Масса корня |
0,550 |
1,000 |
0,332 |
0,649 |
|
Длина надземной части |
0,287 |
0,332 |
1,000 |
0,453 |
|
Н3 |
||||
|
Длина корня |
1,000 |
0,411 |
0,392 |
0,526 |
|
Масса корня |
0,411 |
1,000 |
0,234 |
0,609 |
|
Длина надземной части |
0,392 |
0,234 |
1,000 |
0,497 |
|
Смесь штаммов |
||||
|
Длина корня |
1,000 |
0,780 |
0,415 |
0,668 |
|
Масса корня |
0,780 |
1,000 |
0,372 |
0,726 |
|
Длина надземной части |
0,415 |
0,372 |
1,000 |
0,535 |
Примечание: статистически значимые (p < 0,05) коэффициенты корреляции выделены жирным шрифтом.
Как видно из представленных данных, для варианта с нормальным азотным питанием (раствор Кнопа) характерна высокая и статистически значимая положительная корреляция (r = 0,611) между массой надземной части и массой корня.
В то же время дефицит азота (вариант Контроль) привел к фактическому исчезновению корреляции (r = 0,024), а бактеризация азотфиксаторами привела к восстановлению корреляционной связи между этими показателями.
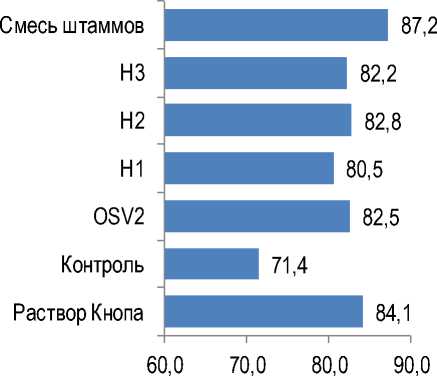
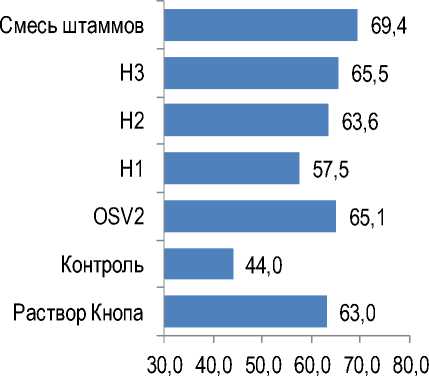
Хорошим инструментом для общей оценки тесноты корреляционных связей между набором показателей является анализ корреляционной матрицы методом главных компонент. Чем выше уровень коррелированности изучаемых показателей, тем больше процент дисперсии, приходящейся на 1-ю либо на 1-ю и 2-ю главные компоненты (точнее – на соответствующие этим компонентам собственные значения корреляционной матрицы). При полном отсутствии корреляций между показателями (все коэффициенты корреляции равны 0) процент дисперсии, приходящейся на 1-ю главную компоненту
(а также на все остальные главные компоненты), будет в точности равен 100/N, где N – число изучаемых показателей. В случае четырех показателей (длина корня, масса корня, длина надземной части, масса надземной части) он составит 25 %. При полной коррелированности показателей (все коэффициенты корреляции равны 1) процент дисперсии, приходящейся на 1-ю главную компоненту, будет равен 100 %, а на остальные главные компоненты – 0 %. На рисунке 6 показаны результаты подобного анализа корреляционных матриц, представленных в таблице 6.
% дисперсии, приходящейся на 1-ю и 2-ю Главные компоненты
% дисперсии, приходящейся на 1-ю Главную компоненту
Рис. 6. Доля дисперсии, приходящаяся на 1-ю и 2-ю главную компоненту корреляционных матриц, представленных в таблице 6
The proportion of variance accounted for by the 1st and 2nd principal components of the correlation matrices presented in Table 6
Как видно из представленных на рисунке 6 данных, дефицит азота не только привел к исчезновению корреляции между массой надземной части, но и существенно снизил общую кор-релированность между показателями, характеризующими развитие корневой системы и надземной части, что отразилось в низкой доле дисперсии, приходящейся на 1-ю главную компоненту (44,0 % в контроле против 63,0 % в варианте с поливом растений раствором Кнопа). То же касается суммы дисперсий, приходящихся на 1-ю и 2-ю главные компоненты (71,4 % в контроле против 84,1 % на растворе Кнопа). В то же время все варианты бактеризации привели к восстановлению степени корреляционных связей между указанными показателями до уровня, соответствующего варианту с раствором Кнопа, или даже до более высокого уровня.
Влияние бактеризации на содержание пигментов фотосинтетического аппарата в листьях растений салата. Многочисленными исследованиями показано, что дефицит азота ведет к уменьшению содержания пигментов фотосинтетического аппарата в листьях [23, 25]. В этой связи содержание этих пигментов широко используется для диагностики уровня азотного питания растений [26, 27]. В нашем исследовании дефицит азота снизил содержание хлорофилла a в листьях салата в пересчете на сырой вес более чем в 10 раз, а в пересчете на сухой вес – более чем в 13 раз; содержание хлорофилла b в пересчете на сырой вес – почти в 47 раз, в пересчете на сухой вес – почти в 61 раз; содержание каротиноидов в пересчете на сырой вес – почти в 6 раз, в пересчете на сухой вес – более чем в 8 раз. Кроме этого, дефицит азота в 2 раза снизил отношение суммы хлорофиллов a и b к каротиноидам (табл. 7, 8).
Таблица 7
Влияние дефицита азота на содержание пигментов фотосинтетического аппарата, мг/г сырого веса листьев
Effect of nitrogen deficiency on the content of pigments of the photosynthetic apparatus, mg/g fresh weight of leaves
|
Показатель |
Раствор Кнопа |
Контроль |
Раствор Кно-па/контроль |
Статистическая значимость различий, p |
|
Хлорофилл а |
0,621 |
0,061 |
10,13 |
< 0,05 |
|
Хлорофилл b |
0,165 |
0,004 |
46,77 |
< 0,05 |
|
Хлорофиллы (а+b) |
0,786 |
0,065 |
12,13 |
< 0,05 |
|
Каротиноиды |
0,190 |
0,032 |
5,93 |
< 0,05 |
|
Хл. (а+b)/каротиноиды |
4,133 |
2,050 |
2,02 |
< 0,05 |
Таблица 8
Влияние дефицита азота на содержание пигментов фотосинтетического аппарата, мг/г сухого веса листьев
Effect of nitrogen deficiency on the content of pigments of the photosynthetic apparatus, mg/g dry weight of leaves
|
Показатель |
Раствор Кнопа |
Контроль |
Раствор Кнопа/Контроль |
Статистическая значимость различий, p |
|
Хлорофилл а |
5,501 |
0,397 |
13,85 |
< 0,05 |
|
Хлорофилл b |
1,463 |
0,024 |
60,79 |
< 0,05 |
|
Хлорофиллы (а+b) |
6,964 |
0,421 |
16,53 |
< 0,05 |
|
Каротиноиды |
1,684 |
0,207 |
8,13 |
< 0,05 |
|
Хл. (а+b)/каротиноиды |
4,133 |
2,050 |
2,02 |
< 0,05 |
Бактеризация во всех вариантах повысила содержание пигментов в пересчете на сырой вес в 1,4–13,1 раза, а в пересчете на сухой вес – в 1,2–11,9 раза, а также повысила отношение суммы хлорофиллов a и b к каротиноидам в 1,1– 1,6 раза (см. табл. 9, 10).
Таблица 9
Влияние бактеризации на содержание пигментов фотосинтетического аппарата, мг/г сырого веса листьев
Effect of bacterization on the content of pigments of the photosynthetic apparatus, mg/g fresh weight of leaves
|
Показатель |
OSV2 |
H1 |
H2 |
H3 |
Смесь штаммов |
|||||
|
Хлорофилл а |
0,166** |
2,7 |
0,143* |
2,3 |
0,122* |
2,0 |
0,097 |
1,6 |
0,233** |
3,8 |
|
Хлорофилл b |
0,022* |
6,2 |
0,017 |
4,8 |
0,015 |
4,1 |
0,015 |
4,1 |
0,046** |
13,1 |
|
Хлорофиллы (а+b) |
0,188*** |
2,9 |
0,160* |
2,5 |
0,136* |
2,1 |
0,112 |
1,7 |
0,279** |
4,3 |
|
Каротиноиды |
0,068* |
2,1 |
0,062* |
1,9 |
0,059* |
1,8 |
0,044 |
1,4 |
0,086** |
2,7 |
|
Хл. (а+b)/каротиноиды |
2,752 |
1,3 |
2,569 |
1,3 |
2,320 |
1,1 |
2,514 |
1,2 |
3,251* |
1,6 |
Таблица 10
Влияние бактеризации на содержание пигментов фотосинтетического аппарата, мг/г сухого веса листьев
Effect of bacterization on the content of pigments of the photosynthetic apparatus, mg/g dry weight of leaves
|
Показатель |
OSV2 |
H1 |
H2 |
H3 |
Смесь штаммов |
|||||
|
Хлорофилл а |
1,057 |
2,7 |
0,892 |
2,2 |
0,667** |
1,7 |
0,553 |
1,4 |
1,448** |
3,6 |
|
Хлорофиллb |
0,14 |
5,8 |
0,106 |
4,4 |
0,08 |
3,3 |
0,083 |
3,5 |
0,287** |
11,9 |
|
Хлорофиллы (а+b) |
1,197 |
2,8 |
0,998 |
2,4 |
0,748* |
1,8 |
0,637 |
1,5 |
1,735** |
4,1 |
|
Каротиноиды |
0,437 |
2,1 |
0,386 |
1,9 |
0,322** |
1,6 |
0,251 |
1,2 |
0,535** |
2,6 |
|
Хл. (а+b)/Каротиноиды |
2,752 |
1,3 |
2,569 |
1,3 |
2,320 |
1,1 |
2,514 |
1,2 |
3,251* |
1,6 |
Хотя с помощью двухвыборочного t-теста статистическая значимость повышения содержания пигментов фотосинтетического аппарата доказана не во всех вариантах, дискриминантный анализ показал, что по совокупности со- держания хлорофиллов a, b и каротиноидов в пересчете на сырой вес все варианты с бактеризацией статистически значимо превосходят контроль (табл. 11).
Таблица 11
Статистическая значимость (p) различий между вариантами по набору совокупности содержания хлорофиллов a , b и каротиноидов в пересчете на сырой вес согласно результатам дискриминантного анализа
Statistical significance (p) of differences between variants in terms of the total content of chlorophylls a , b and carotenoids in terms of raw weight according to the results of discriminant analysis
|
Вариант |
OSV2 |
H2 |
H3 |
Смесь штаммов |
H1 |
Контроль |
|
OSV2 |
Нет |
Нет |
< 0,01 |
Нет |
< 0,05 |
|
|
H2 |
Нет |
Нет |
< 0,01 |
Нет |
< 0,05 |
|
|
H3 |
Нет |
Нет |
< 0,01 |
Нет |
0,05 |
|
|
Смесь штаммов |
< 0,01 |
< 0,01 |
< 0,01 |
< 0,01 |
< 0,001 |
|
|
H1 |
Нет |
Нет |
Нет |
< 0,01 |
< 0,05 |
|
|
Контроль |
< 0,05 |
< 0,05 |
0,05 |
< 0,001 |
< 0,05 |
Примечание: «Нет» означает отсутствие статистически значимых различий.
Парный двухвыборочный тест Уилкоксона показал, что все варианты с бактеризацией статистически значимо (p < 0,05) превосходят контроль по набору показателей, представленных в таблицах 9 и 10, как при расчете содержания пигментов на сырой вес, так и при расчете на сухой вес.
Ранги, занимаемые вариантами эксперимента по разным показателям содержания пигментов фотосинтетического аппарата, практически совпадают, о чем говорит высокий коэффициент конкордации (0,983 при расчете содержания пигментов как на сырой, так и на сухой вес). Результаты ранжирования вариантов по показателям содержания пигментов представлены в таблице 12. Ранг 1 соответствует максимальному значению показателя, ранг 7 – минимальному. Порядок следования вариантов в таблице 12 соответствует занимаемым ими местам по совокупности рангов. Представлены результаты ранжирования по содержанию пигментов на сырой вес; ранжирование по содержанию пигментов в пересчете на сухой вес дает такие же результаты.
Таблица 12
Результаты ранжирования вариантов по показателям содержания пигментов фотосинтетического аппарата
Results of ranking variants by the content of photosynthetic apparatus pigments
|
Вариант |
Хлорофилл а |
Хлорофилл b |
Хлорофиллы ( а + b ) |
Каротиноиды |
Хл. ( а + b )/ каротиноиды |
|
Раствор Кнопа |
1 |
1 |
1 |
1 |
1 |
|
Смесь штаммов |
2 |
2 |
2 |
2 |
2 |
|
OSV2 |
3 |
3 |
3 |
3 |
3 |
|
H1 |
4 |
4 |
4 |
4 |
4 |
|
H2 |
5 |
6 |
5 |
5 |
6 |
|
H3 |
6 |
5 |
6 |
6 |
5 |
|
Контроль |
7 |
7 |
7 |
7 |
7 |
Примечания: числа в ячейках означают место, которое занял вариант по величине соответствующего показателя.
Следует отметить, что результаты ранжирования вариантов с бактеризацией по положительному воздействию на ростовые параметры растений не совпадают с ранжированием по воздействию на показатели содержания пигментов фотосинтетического аппарата. Об этом свидетельствует крайне низкая величина коэффициента ранговой корреляции Спирмена (0,1) между суммами рангов бактеризованных вариантов по ростовым параметрам (см. табл. 5) и по содержанию пигментов (см. табл. 12). Единственным совпадением является тот факт, что вариант смесь штаммов в обоих случаях занял первое место среди остальных вариантов по положительному эффекту. Это может говорить о разных механизмах воздействия изучаемых штаммов на рост растений и накопление фотосинтетических пигментов.
Дефицит азота вполне закономерно привел к резкому падению содержания этого элемента в растениях. Так, если в варианте с поливом раствором Кнопа содержание азота по Къельдалю составило 40,6 мг/г сухого вещества, содержание нитратного азота – 7,3 мг/г сухого вещества, содержание общего азота – 47,9 мг/г сухого ве- щества, то в контрольном варианте эти показатели были равны соответственно 11,6; 0,1 и 11,6 мг/г сухого вещества. Бактеризация во всех вариантах повысила содержание азота по Къельдалю и общего азота, а в варианте с бактеризацией штаммом OSV2 – и содержание нитратного азота. Однако во всех вариантах растения по содержанию азота очень сильно отставали от варианта с поливом раствором Кнопа. Максимальная прибавка содержания азота по Къельдалю и общего азота наблюдалась при бактеризации штаммом H2 (в 1,3 раза относительно контроля), максимальная прибавка нитратного азота – в варианте с бактеризацией штаммом OSV2 (в 10 раз относительно контроля) (рис. 7).
В вариантах с бактеризацией не выявлено статистически значимой связи содержания азота в растениях ни с ростовыми показателями, ни с показателями содержания пигментов фотосинтетического аппарата в листьях; соответствующие коэффициенты корреляции Пирсона и коэффициенты ранговой корреляции Спирмена оказались статистически незначимыми.


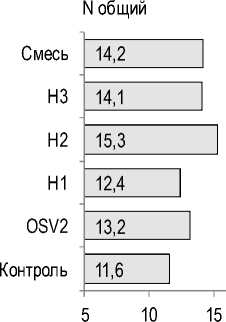
Рис. 7. Влияние бактеризации на содержание азота в растениях салата, мг/г сухого вещества Effect of bacterization on nitrogen content in lettuce plants, mg/g dry matter
Таблица 13
Содержание минеральных элементов в растениях в разных вариантах эксперимента, % от сухой массы
Content of mineral elements in plants in different experimental variants, % of dry mass
|
Вариант |
Ca |
K |
Mg |
P |
S |
|
Раствор Кнопа |
2,52 |
6,79 |
0,84 |
0,05 |
0,64 |
|
Контроль |
2,51 |
4,29 |
0,87 |
0,13 |
0,94 |
|
OSV |
1,91 |
4,94 |
0,69 |
0,04 |
0,82 |
|
Н1 |
2,4 |
5,12 |
0,67 |
0,02 |
0,71 |
|
Н2 |
2,32 |
6,25 |
0,74 |
0,11 |
0,76 |
|
Н3 |
2,47 |
6,03 |
0,74 |
0,06 |
0,57 |
|
Смесь штаммов |
2,1 |
4,57 |
0,57 |
0,02 |
0,52 |
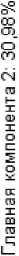
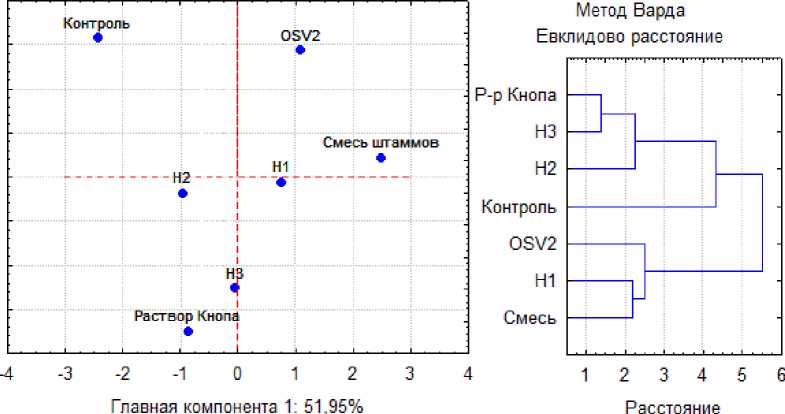
Рис. 8. Проекция вариантов по совокупности содержания минеральных элементов на первые две главные компоненты (слева), каждая точка соответствует среднему для данного варианта; кластеризация вариантов по совокупности тех же элементов (справа)
Projection of variants by the total content of mineral elements onto the first two principal components (left), each point corresponds to the average for a given variant; clustering of variants by the total content of the same elements (right)
Каких-либо явных закономерностей в различиях минерального состава в зависимости от варианта эксперимента не выявлено, что подтверждается проекцией на главные компоненты и результатами кластерного анализа.
Заключение. Наши исследования показали, что бактеризация штаммами несимбиотических азотфиксирующих бактерий, выделенными из ППС, статистически значимо увеличила ростовые показатели растений салата, находящихся в условиях дефицита азота. В целом по совокупности ростовых показателей наибольшую прибавку обеспечил штамм A. chroococcum Н3, благодаря которому средние значения массы и длины корневой системы выросли соответственно в 2,14 и 1,1 раза, массы и длины надземной части – в 1,5 и 1,31 раза, а массы и длины всего растения – в 1,68 и 1,19 раза относительно небактеризованного контроля. В плане улучшения изученных ростовых показателей, за исключением массы корня, бактеризация данным штаммом превзошла по эффективности бактеризацию почвенным азотфиксирующим штаммом A. macrocytogenes OSV2 (который повысил среднюю массу корня в 3,65 раза относительно контроля). Бактеризация всеми азотфиксирую-щими штаммами также статистически значимо повысила содержание пигментов фотосинтетического аппарата (в 1,4–13,1 раза относительно контроля в пересчете на сырой вес листьев и в 1,2–11,9 раза в пересчете на сухой вес листьев), а также повысила отношение суммы хлорофиллов a и b к каротиноидам в 1,1–1,6 раза. Однако в данном случае по эффективности лидировал штамм OSV2. Кроме этого, бактеризация всеми изученными штаммами повысила содержание азота в растениях. При этом лидером по эффективности оказался штамм Н2, бактеризация которым обеспечила прибавку содержания азота по Къельдалю и общего азота в 1,31, а нитратного азота – в 1,36 раза относительно контроля. Таким образом, можно констатировать, что микробное сообщество ППС является перспективным источником несимбиотических азотфиксирующих штаммов для использования в биопрепаратах, предназначенных для улучшения азотного питания растений.
Наибольший эффект в плане стимулирования роста растений и повышения содержания пигментов фотосинтетического аппарата обеспечила бактеризация смесью штаммов A. chroo-coccum Н1, A. chroococcum Н2, A. chroococcum Н3 и A. macrocytogenes OSV2, что позволяет говорить о наличии синергизма в их воздействии на растение.
Несмотря на то что в условиях дефицита азота все штаммы, а также их комбинация, обеспечили статистически значимое повышение ростовых показателей, содержания фотосинтетических пигментов и содержания азота в растениях, растения в бактеризованных вариантах практически по всем показателям уступили растениям, выращенным на растворе Кнопа. Исключение составил вариант с бактеризацией смесью штаммов, который обеспечил среднюю длину и массу корня на том же уровне, что и раствор Кнопа, и вариант с бактеризацией штаммом A. chroococcum Н3, обеспечивший среднюю длину корня на уровне варианта с раствором Кнопа. Таким образом, предпосевная бактеризация семян изучаемыми азотфикси-рующими штаммами не обеспечила полной нормализации азотного питания. Это можно объяснить низкой численностью данных штаммов в ризосфере, которая у 28-суточных растений составила порядка 102 КОЕ/на одно растение. В этой связи при использовании данных штаммов для улучшения азотного питания растений предлагается после первоначальной бактеризации семян проводить повторную бактеризацию проростков.
Интерес представляет тот факт, что в контрольном варианте растения продемонстрировали способность к росту, формированию фотосинтетического аппарата и накоплению азота в тканях, несмотря на отсутствие этого элемента в поливочном растворе. Мы полагаем, что это связано с развитием в ризосфере этих растений эндофитных азотфиксирующих бактерий, присутствовавших внутри семян и частично восполнивших дефицит азота в этом варианте эксперимента. В дальнейшем предполагается более детальное изучение данных бактерий с точки зрения потенциальной возможности их использования в качестве микробиологического азотного удобрения.


