Микробные сообщества карстовых пещер как потенциальный источник продуцентов низкотемпературных амилаз
Автор: Хижняк Сергей Витальевич, Пампуха Владимир Тарасович
Журнал: Вестник Омского государственного аграрного университета @vestnik-omgau
Рубрика: Биологические науки
Статья в выпуске: 1 (21), 2016 года.
Бесплатный доступ
Шесть штаммов адаптированных к низкой температуре амилолитических грибов рода Geomyces, выделенных из низкотемпературной карстовой пещеры, были исследованы на скорости роста при различных температурах, а для двух из них было также изучено влияние температуры на амилолитическую активность культуральной жидкости (КЖ). Было установлено, что влияние температуры на скорости роста штаммов хорошо описывается уравнением Ratkowsky et al. (1983) с коэффициентами детерминации R2 0,987 - 0,999, а влияние температуры на амилолитическую активность КЖ в диапазоне 31-50°С хорошо описывается логистической функцией (R2 = 0,994 и 0,997). Все штаммы не способны расти при температуре +30°С и выше. Пять штаммов являются психротолерантными с оптимальными температурами роста в диапазоне от +21,50 до + 25,25°С, один штамм является психрофильным с оптимальной температурой роста +18,50°C. Сравнение влияния температуры на амилолитическую активность КЖ показало, что температура, соответствующая середине сигмоиды, для психрофильного штамма лежит на 7°С ниже, чем для психротолерантного, что практически равно разности оптимальных температур роста у данных штаммов (6°С). Наклон логарифмической прямой на экспоненциальном участке температурной кривой амилолитической активности КЖ у психрофильного штамма в 2 раза выше, чем у психротолерантного. Полученные результаты показывают, что снижение оптимальной температуры роста в процессе адаптации к условиям пещеры приводит к соответствующему уменьшению температурного оптимума амилолитических ферментов, и демонстрирует перспективность поисков продуцентов низкотемпературных амилаз в пещерных сообществах.
Низкотемпературная амилаза, продуценты, карстовые пещеры, мицелиальные грибы, психрофилы
Короткий адрес: https://sciup.org/142199108
IDR: 142199108 | УДК: 663.11:579.6
Текст научной статьи Микробные сообщества карстовых пещер как потенциальный источник продуцентов низкотемпературных амилаз
Амилазы микробного происхождения являются одними из наиболее востребованных ферментов, применяемых в сельском хозяйстве, пищевой и перерабатывающей промышленности, и в настоящее время занимают примерно 25% мирового рынка ферментов. Амилазы используют для конверсии крахмала в олигосахариды и глюкозу в крахмало-паточном и бродильном производствах, для отбеливания растительного сырья в текстильном и бумажном производствах, в качестве биодобавок к моющим средствам [1]. Кроме этого, микробные амилазы все шире применяются для повышения усвояемости крахмалсодержащих растительных кормов в животноводстве и птицеводстве [2; 3]. До недавнего времени в промышленности и сельском хозяйстве применялись почти исключительно термофильные амилазы c температурными оптимумами 70–90°C, однако в последние годы в мире наблюдается стремительно растущий интерес к средне- и низкотемпературным амилазам с оптимумом от 50–60°C и ниже [4; 5]. Поиск продуцентов подобных амилаз ведется среди психрофильных и психротолерантных микроорганизмов, адаптированных к низкотемпературным местообита-
ниям, таким как Арктика, Антарктика и высокогорье. Однако на нашей планете существует еще один природный источник подобных микроорганизмов – карстовые пещеры умеренной климатической зоны, характеризующиеся стабильной низкой температурой (около 4°C вне зависимости от сезона). В подобных пещерах присутствует достаточно богатая в таксономическом плане гетеротрофная микрофлора, представленная бактериями и грибами, находящимися на разных стадиях эволюционной адаптации к пониженной температуре подземных местообитаний [6; 7]. При этом пещеры в силу своей высокой распространенности являются существенно более доступными объектами для поиска психрофильных и психротолерантных штаммов, чем районы Арктики, Антарктики и высокогорья. Данная работа посвящена оценке перспектив поиска продуцентов низкотемпературных амилаз в микробных сообществах карстовых пещер умеренной зоны.
Объекты и методы
Объектом исследования служили образцы грунта, собранные в известняковой карстовой пещере «Караульная-2» (Красноярский край, Емельяновский район). Протяженность пещеры 540 м, глубина 34 м, температура грунта от 2,8 до 4,0°С в зависимости от удаленности от входа, относительная влажность воздуха около 95%.
Выделение амилолитических изолятов проводили методом рассева из суспензий грунта на среде следующего состава (г/л): крахмал – 10,0; NH 4 NO 3 – 2,0; KH 2 PO 4 – 1,0; MgSO 4 ∙ 7H2O – 0,5; KCl – 0,5; FeSO 4 – следовые количества; агар микробиологический – 20,0; рН = 6,5–7,0. Температура инкубации составляла 8°C. Для дальнейшей работы отбирали изоляты с максимальной зоной гидролиза крахмала, определяемой после окраски раствором Люголя (рис. 1).
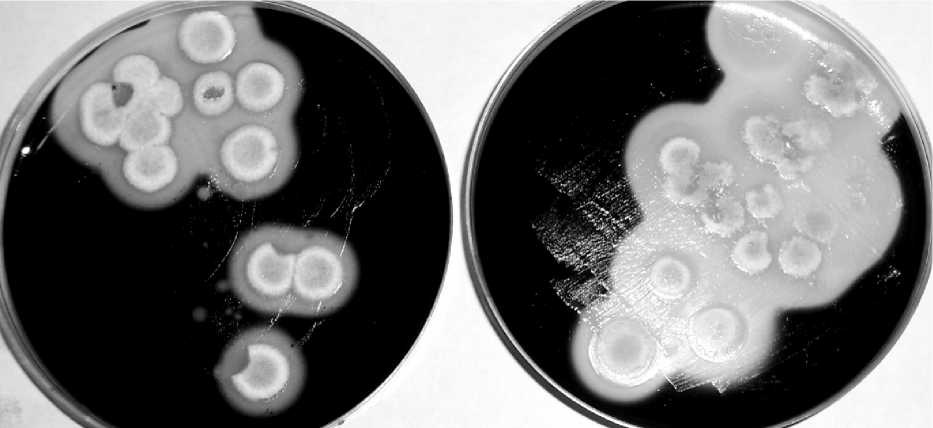
Рис. 1 . Выделение амилолитических изолятов на среде Чапека с крахмалом (окраска раствором Люголя)
Для проверки влияния температуры на активность продуцируемых изолятами амилаз изоляты выращивали на жидкой среде того же состава поверхностным способом в течение 7 суток, температура культивирования составляла 15–17°C. Амилолитическую активность при разных температурах определяли в трехкратной повторности по времени полного обесцвечивания окрашенного йодом 0,1%-ного раствора крахмала после добавления культуральной жидкости в соотношении 1:1 при температуре в диапазоне 21–50°C. Стабильность температуры во время реакции обеспечивали с помощью водяной бани. Скорость гидролиза крахмала выражали величиной, обратной времени обесцвечивания, для описания зависимости скорости гидролиза от температуры в изучаемом диапазоне температур использовали логистическую функцию
L г =________
1 + e"k(T-T0) , где r – скорость гидролиза крахмала; T – температура; L, k и T0 – коэффициенты.
Влияние температуры на скорость роста штаммов изучали путем высева конидий на ПД-агар (пептон ферментативный – 9,0 г/л; гидролизат казеина ферментативный – 8,0 г/л; дрожжевой экстракт – 3,0 г/л; NaCl – 5,0 г/л; Na 2 HPO 4 – 2,0 г/л; агар– 20,0 г/л; pH = 7,0– 7,2) с последующим параллельным культивированием при температурах 9, 15, 21, 27, 30°C. Скорость роста при каждой температуре (мкм в час) определяли по изменению средней длины проростковой гифы за интервал времени. Первое измерение проводили после прорастания конидий, второе – через 12 ч для температуры 9°C и через 7–9 ч для остальных температур. Измерение проводили по микрофотографиям с использованием бесплатной программы ImageJ, в каждом случае измеряли по 15–30 гиф. Масштабный коэффициент для пересчета результатов измерений в микрометры определяли с помощью объект-микрометра проходящего света ОМП ГОСТ 7513-55 производства ОАО «ЛОМО». В качестве теоретической модели зависимости скорости роста от температуры использовали модель Ratkowsky et al. [8]:
ц = (b• (T-T•• (1 -e..........))2 ,
где µ – скорость роста; T – температура; T max и T min – соответственно максимальная и минимальная температуры роста; b и c – коэффициенты.
Коэффициенты в моделях определяли по экспериментальным данным методом наименьших квадратов с использованием пакета Stat Soft STATISTICA 6.0, модуль «Нелинейная оценка/Пользовательская регрессия». Микроскопические исследования проводили с помощью микроскопа «Микмед 6», вар. 3, оснащенного цифровой камерой DCM-130E.
Результаты исследований
В результате было выделено 6 изолятов микромицетов, сочетавших высокую скорость роста при низкой температуре с большой зоной гидролиза крахмала. Все изоляты относятся к р. Geomyces и имеют верхний температурный предел роста в районе 30°C (рис. 2).
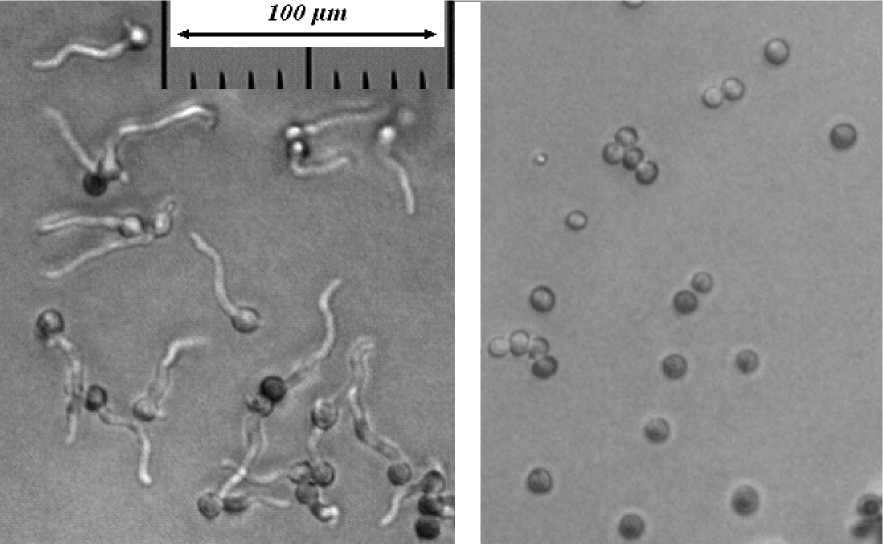
Рис. 2 . Влияние температуры на прорастание конидий выделенных изолятов. Слева – прорастание через 18 ч инкубации при 21°C, справа – отсутствие прорастания через 18 ч инкубации при 30°C
Анализ температурных кривых роста показал, что среди выделенных изолятов преобладают психротолерантные формы с температурным оптимумом в диапазоне 21–25°C, один изолят оказался психрофильным с температурным оптимумом 18,5°C. Экспериментальные данные хорошо согласуются с моделью Ratkowsky et al. (рис. 3, таблица).
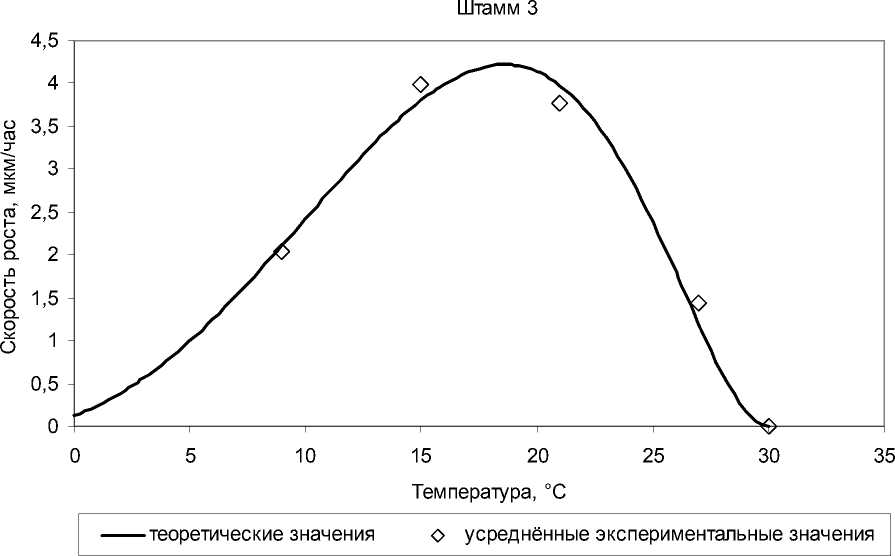
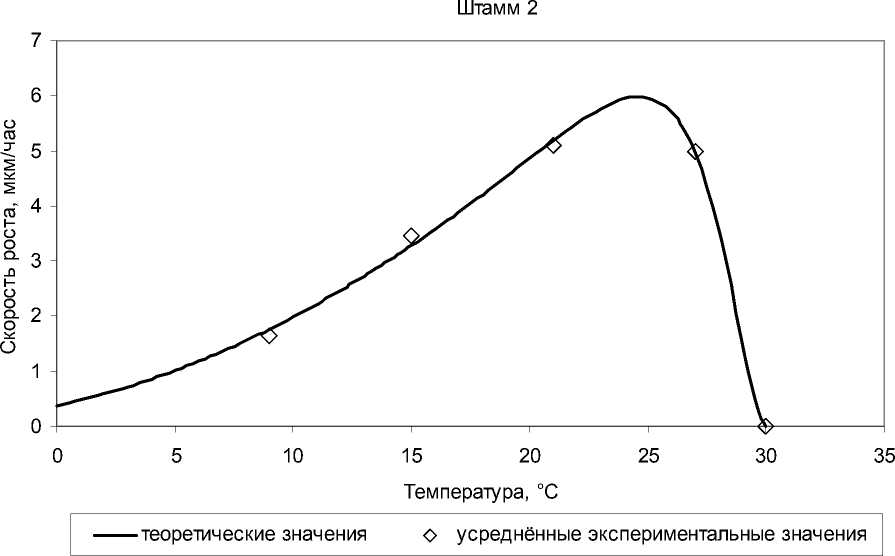
Рис. 3 . Влияние температуры на скорость роста психрофильного (штамм 3) и психротолерантного (штамм 2) амилолитических изолятов
Теоретические температурные оптимумы выделенных изолятов
|
Изолят |
Оптимальная температура согласно модели, °C |
Скорость роста при оптимальной температуре, мкм в час |
Соответствие модели Ratkowsky et al., R2 |
|
Штамм 1 |
+21,50 |
14,58 |
0,999 |
|
Штамм 2 |
+24,50 |
5,98 |
0,997 |
|
Штамм 3 |
+18,50 |
4,22 |
0,987 |
|
Штамм 4 |
+25,25 |
8,07 |
0,998 |
|
Штамм 6 |
+22,75 |
16,66 |
0,997 |
|
Штамм Г-1 |
+22,75 |
17,51 |
0,999 |
Для количественной оценки влияния температуры на активность продуцируемых пещерными изолятами амилаз были выбраны психрофильный (штамм 3) и психротолерантный (штамм 2) изоляты. Было установлено, что в диапазоне температур 31–50°C кривая «температура – скорость» имеет вид сигмоиды (рис. 4), что позволяет сравнить температурные характеристики амилаз психрофильного и психротолерантного изолятов по углу наклона логарифмической прямой на экспоненциальном участке графика.
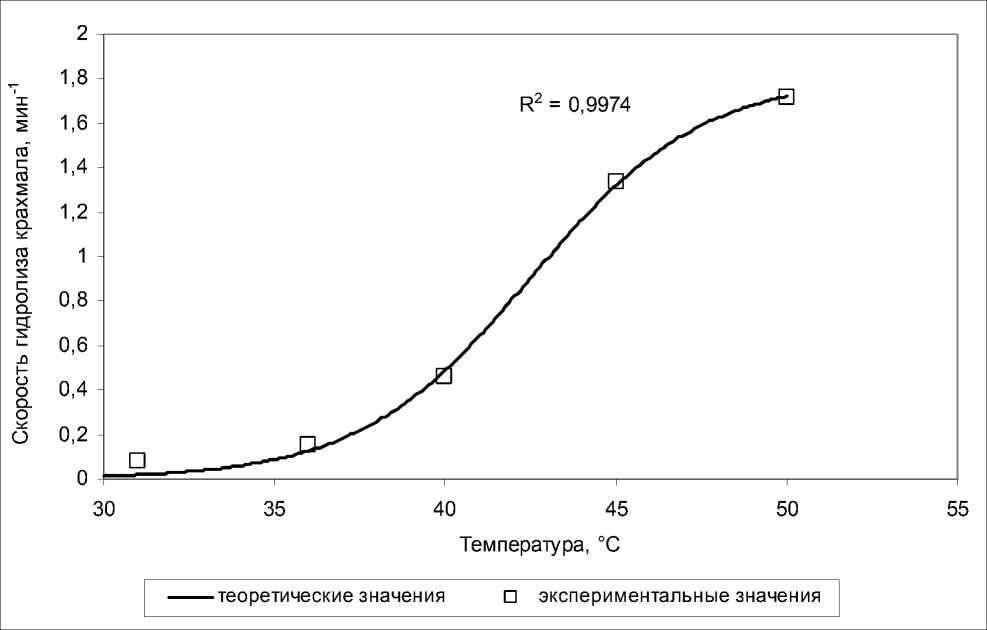
Рис. 4 . Влияние температуры на скорость (мин–1) гидролиза крахмала культуральной жидкостью на примере психрофильного штамма 3
Результаты сравнения представлены на рис. 5. Как видно, угол наклона логарифмической прямой для психрофильного изолята в области низких температур в 2 раза больше, чем для психротолерантного. При этом параметр T 0 (температура, при которой скорость ферментативной реакции равна половине максимальной) сигмоиды у психрофильного изолята на 7°C меньше, чем у психротолерантного (42,5 против 49,5), что почти точно соответствует разности температурных оптимумов этих изолятов (6°C).
Температура, °С
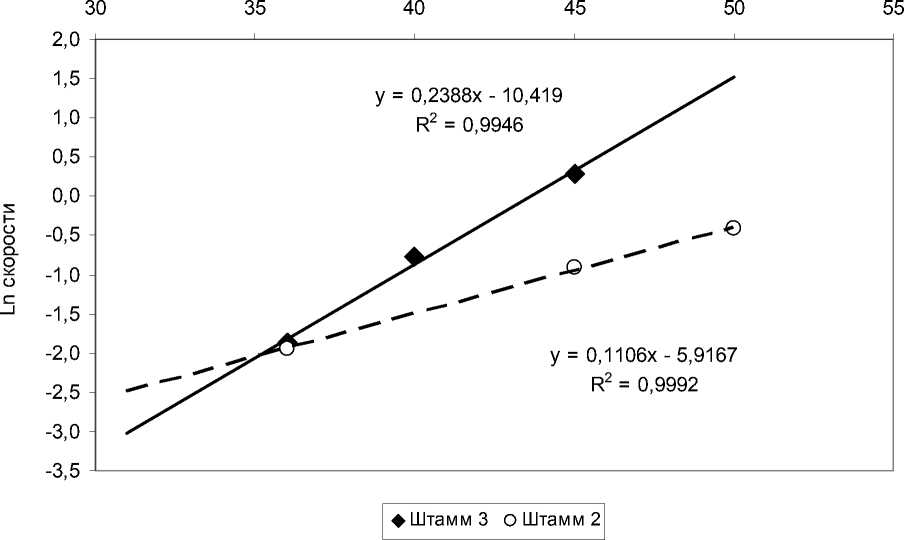
Рис. 5 . Влияние температуры на скорость гидролиза крахмала культуральной жидкостью психрофильного (штамм 3) и психротолерантного (штамм 2) изолятов на экспоненциальных участках температурной кривой (в логарифмических координатах)
Заключение
Несмотря на то, что по международной классификации характер температурных кривых амилолитической активности культуральной жидкости изученных штаммов соответствует скорее мезофильным (с полумаксимумом в районе 40–50°C), а не психрофильным ферментам, полученные результаты показывают, что снижение оптимальной температуры роста в процессе адаптации микроорганизмов к низкотемпературным условиям пещеры приводит к соответствующему уменьшению температурного оптимума их амилаз. При этом следует учитывать, что наиболее изученный на сегодняшний момент психротолерантный представитель р. Geomyces , G. pannorum , продуцирует как низкотемпературную амилазу с оптимумом в районе 40°C [9], так и высокотемпературную с оптимумом в районе 70°C [10]. Можно предположить, что наблюдаемые в исследовании температурные кривые амилолитической активности сдвинутся в существенно более низкотемпературную область после выделения «низкотемпературной фракции» амилаз. Тем не менее, даже неочищенная культуральная жидкость исследованных штаммов по своим характеристикам подпадает под определение «низкотемпературная амилаза», используемое русскоязычными производителями в отношении таких ферментных продуктов, как АмилоЛюкс-А (диапазон рабочих температур 50– 65°C). Таким образом, можно констатировать, что микробные сообщества карстовых пещер могут рассматриваться как природный источник продуцентов низкотемпературных амилаз. Направления дальнейших исследований могут быть связаны как с изучением температурных характеристик очищенных ферментов, так и с вовлечением в исследования более широкого круга пещерных микроорганизмов. По данным исследований, только в пещерах Красноярского края присутствуют психрофильные и психротолерантные представители не менее чем 16 родов микромицетов и не менее чем 10 родов бактерий.
Список литературы Микробные сообщества карстовых пещер как потенциальный источник продуцентов низкотемпературных амилаз
- De Souza, P.M. Application of microbial α-amylase in industry -A review/P.M. De Souza, P. Oliveira Magalhães//Brazilian Journal of Microbiology. -2010. -№ 4. -P. 850-861.
- Смаглюк, М. Амилаза увеличит привесы поросят/М. Смаглюк, Х.И. Фернандез//Животноводство России. -2013. -№ 11. -С. 66-67.
- Сванн, Д. Оптимальное решение для современных рационов птицы/Д. Сванн//Птицеводство. -2015. -№ 6. -С. 33-37
- Kuddus, M. An overview of cold-active microbial α-amylase: Adaptation strategies and biotechnological potentials/M. Kuddus, J.M. Arif Roohi, P.W. Ramteke//Biotechnology. -2011. -№ 10. -P. 246-258.
- Sarmiento, F. Cold and Hot Extremozymes: Industrial Relevance and Current Trends/F. Sarmiento, R. Peralta, J.M. Blamey//Frontiers in Bioengineering and Biotechnology. -2015. -№ 3(148). -P. 1-15.
- Хижняк, С.В. Психрофильные и психротолерантные гетеротрофные микроорганизмы карстовых полостей Средней Сибири/С.В. Хижняк, И.В. Таушева, А.А. Березикова, Е.В. Нестеренко, Д.Ю. Рогозин//Экология. -2003. -№ 4. -С. 261-266.
- Хижняк, С.В. Микромицеты карстовых пещер Средней Сибири: монография/С.В. Хижняк, Е.В. Нестеренко, И.Р. Сафина: Красноярский гос. аграр. ун-т. -Красноярск: Изд-во КрасГАУ, 2014. -175 с.
- Ratkowsky, D.A. Model for bacterial culture growth rate throughout the entire biokinetic temperature range/D.A. Ratkowsky, R.K. Lowry, T.A. McMeekin, A.N. Stokes, R.E. Chandler//J. Bacteriol. -1983. -№ 154. -P. 1222-1226.
- Mao, Y. Development of a novel Aspergillus uracil deficient expression system and its application in expressing a cold-adapted α-amylase gene from Antarctic fungi Geomyces pannorum/Y. Mao, Y.Yin, L. Zhang, S.A. Alias, B. Gao, D. Wei//Process Biochemistry. 2015. -№ 50 (10). -P. 1581-1590.
- Gao, B. A novel saccharifying α-amylase of Antarctic psychrotolerant fungi Geomyces pannorum: Gene cloning, functional expression, and characterization/B. Gao, Y. Mao, L. Zhang, L. He, D. Wei//Starch -Stärke. -2015. -№ 67. -P. 1-9.


