Микрокапсулирование и оценка субхронической токсичности пептидов, выделенных из молозива коров, и пептидов экстракта фабрициевой сумки цыплят-бройлеров
Автор: Тихонов С. Л., Тихонова Н. В., Кольберг Н. А., Ожгихина А. С., Шихалев С. В.
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Технология продовольственных продуктов
Статья в выпуске: 3 т.25, 2022 года.
Бесплатный доступ
Пептиды обладают высокой биологической активностью и применяются в составе лекарственных препаратов. Однако широкого использования в технологии пищевой продукции они не получили, так как чувствительны к действию протеолитических ферментов желудочно-кишечного тракта и характеризуются быстрым распадом, что снижает их эффективность. Перспективным источником пептидов с различной функциональной направленностью является молозиво коров. Одним из направлений, способствующих расширению использования пептидов при введении внутрь, является их микрокапсулирование. Цель исследований – разработка технологии и способа микрокапсулирования пептидов, выделенных из молозива коров после отела, и оценка их субхронической токсичности. Разработку установки для микрокапсулирования пептидов проводили с учетом диаметра широкой части конуса рабочей камеры и скорости витания мелких частиц конгломератов пептидов. Для эксперимента по сравнительной оценке субхронической токсичности капсулированных и свободных пептидов сформировали 4 группы нелинейных мышей. 1 группа мышей – контрольная, 2 – опытная – животные получали экстракт фабрициевой сумки цыплят-бройлеров, содержащий пептиды с различной молекулярной массой дозой 15 000 мг/кг, 3 – свободные пептиды, выделенные из сыворотки молозива коров в количестве 1 500 мг/кг, 4 – капсулированные пептиды в количестве 15 000 мг/кг. Гематологический анализ крови проводили с использованием анализатора PCE-90Vet. Взвешивание мышей проходило на 7, 9, 14, 21 и 28 день эксперимента. Биохимический анализ сывороток крови животных осуществляли с помощью анализатора StatFax 3300. Установлено, что обработка пептидов раствором мальтодекстрина в течение 1,0–1,5 минут образует защитное покрытие толщиной более 2 мкм. Рассчитаны диаметры широкой и узкой частей конуса устройства и скорость фонтанирующих потоков для самых мелких и крупных частиц конгломерата пептидов. Доказано отсутствие токсичности микрокапсулированных пептидов.
Пептиды, молозиво коров, микрокапсулирование, псевдокипящий слой, лабораторные животные, субхроническая токсичность, гематологические и биохимические показатели крови, peptides, cow colostrum, microcapsulation, pseudo-boiling layer, laboratory animals, subchronic toxicity, hematological and biochemical parametersof blood
Короткий адрес: https://sciup.org/142234720
IDR: 142234720 | УДК: 636.03 | DOI: 10.21443/1560-9278-2022-25-3-207-218
Текст статьи Микрокапсулирование и оценка субхронической токсичности пептидов, выделенных из молозива коров, и пептидов экстракта фабрициевой сумки цыплят-бройлеров
e-mail: , ORCID:
Тихонов С. Л. и др. Микрокапсулирование и оценка субхронической токсичности пептидов, выделенных из молозива коров, и пептидов экстракта фабрициевой сумки цыплят-бройлеров. Вестник МГТУ. 2022. Т. 25, № 3. С. 207–218. DOI:
e-mail: , ORCID:
Tikhonov, S. L. et al. 2022. Microcapsulation and evaluation of subchronic toxicity of peptides extracted from cow colostrum and peptides of Fabricius bursa extract of broiler chickens. Vestnik of MSTU, 25(3), pp. 207–218. (In Russ.) DOI:
За последние десятилетия большое количество исследований продемонстрировало полезность биоактивных пептидов, некоторые из этих продуктов были успешно коммерциализированы. С начала XXI в. во всем мире внедрено в производство 28 неинсулиновых биологически активных добавок к пище и пептидных препаратов, некоторые из которых высококонкурентны на рынке ( Henninot et al., 2018 ). Кроме того, более 150 пептидных биологически активных добавок и препаратов находятся в активной клинической разработке, демонстрируя весьма многообещающие результаты ( Lau et al., 2018 ).
Клеточные проникающие пептиды (CPPs) – также известные как домены белковой трансдукции (PtdS) – являются интенсивно изученным и разнообразным классом пептидов в отношении аминокислотного состава, размера, заряда и структуры. Классификации основаны на физико-химической природе последовательности (первичная, вторичная или неамфифатическая) ( Ziegler et al., 2008 ).
Установлено, что четыре пептида – p61-80, p115-132, p206–225 и p337–353 – могут рассматриваться как иммунодоминантные Т-клеточные эпитопы и могут быть полезны для разработки иммунотерапии на основе пептидов ( Keisuke et al., 2009 ).
Биологическая активность пептидов разнообразна. Так, выделяют антимикробные пептиды (AMPS), которые рассматриваются как альтернативные биологически активные вещества для обычных антибиотиков. Гепсидин, богатый цистеином антимикробный пептид, является важным компонентом врожденного иммунного ответа. В исследованиях ( Athira et al., 2022 ) идентифицирован и охарактеризован ген гепсидина из рыбы Catla catla (индийский крупный карп), названный Cc -Hep. Cc -Hep состоит из 261 пары оснований и кодирует 87 аминокислот. Доказана антибактериальная, антиоксидантная и противоопухолевая активность Cc -Hep.
Современные стратегии открытия искусственных биоактивных пептидов можно в широком смысле разделить на два направления: 1) построение и скрининг пептидных библиотек из случайных аминокислотных композиций в пределах определенной макромолекулярной топологии (скрининг пептидных библиотек, подход снизу вверх); 2) выделение биоактивных последовательностей из природных белков на основе их трехмерных (3D) структур ( Wang et al., 2018; Marasco et al., 2008; Ryvkin et al., 2018 ).
STAT6 – ингибирующие пептиды (STAT6-IP или IP) и STAT6 – контрольные пептиды (STAT6-CP или CP) были синтезированы Университетом Калгари Integrated Peptide Services (г. Калгари, провинция Альберта, Канада). Пептиды состоят из производного домена трансдукции белка TAT, YARAAARQARA. Эта последовательность представлена 8 аминокислотами, окружающими тирозин 641 в мышином STAT6. В STAT6-IP остаток тирозина фосфорилируется (GRG*YVSTT), а в контрольном пептиде STAT6-CP этот остаток заменяется фенилаланином (GRGFVSTT). Пептиды были амидированы на карбоксильном конце, очищены RP-HPLC и проанализированы пептидными последовательностями MS ( Wang et al., 2011 ).
Что касается механизма поглощения пептидов клетками организма человека, он до сих пор является спорным. Первые пептиды CPP, Tat и penetratin, были описаны уже в конце 1980-х и начале 1990-х годов и являются сейчас одними из наиболее изученных CPP ( Madani et al., 2011 ). Tat получен из аминокислот 48-60 транс-активатора транскрипции ВИЧ-1 (Tat) белка, в то время как пенетратин получен из гомеодоменного белка Drosophila melanogaster Antennapedia (Antp). Antp является фактором транскрипции, его гомеодомен 60 aa (pAntp) может быть нетрадиционно секретирован без необходимости сигнального пептида ( Dupont et al., 2007 ). Следовательно, он может быть поглощен соседними клетками независимым от рецептора способом. Пенетратин, 16-аминокислотный пептид, соответствует третьей спирали гомеодомена Antp и, как было показано, достаточен для поглощения всего белка. Поглощение пенетратина происходит в результате эндоцитоза, но также может присутствовать прямая транслокация ( Jiao et al., 2009 ). Тем не менее механизм поглощения остается спорным ( Madani et al., 2011 ).
Пептиды выделяют, как правило, из ферментативного гидролизата растительного и животного сырья, содержащего белок, с помощью ультра или гельфильтрации (хромотографии).
Авторами ( Hjellnes et al., 2021 ) изучена функциональность ультрафильтрации как метода промышленной переработки и ее влияние на биологическую активность гидролизатов белка. Белковые гидролизаты были получены ферментативным гидролизом Pollachius virens . Ультрафильтрация эффективно концентрировала более крупные пептиды (> 4 кДа) и более мелкие пептиды (< 4 кДа) в отдельных фракциях, с выходом белка 31 % во фракции < 4 кДа. Установлено, что нефильтрованный гидролизат обладает более высокой антиоксидантной активностью по сравнению с фракцией < 4 кДа. Эти результаты показывают, что ультрафильтрация не увеличивает биоактивность путем концентрации небольших пептидов и биоактивность зависит от нескольких свойств, включая взаимодействие с более крупными пептидами.
Несмотря на высокую биологическую активность и большие достижения в области технологии выделения пептидов, они не используются широко по следующим причинам:
-
– более низкая аффинность и селективность связывания с мишенью, чем у белков, а также уязвимость к перевариванию протеазы в биологических средах ( Weinstock et al., 2018 );
-
– короткий циркулирующий период полураспада, приводящий к необходимости частого введения для поддерживания их эффективности ( Talmadge et al., 1998 ).
В этой связи проводятся исследования по разработке системы доставки наночастиц на основе полисахаридов, белков/пептидов, которая может эффективно доставлять молекулы биологически активных веществ и сами пептиды в клетки организма. С помощью метода ионного гелеобразования получены наночастицы, состоящие из хитозана, сывороточного альбумина и пептидов ( Yadav et al., 2021 ). Эти наночастицы были охарактеризованы по размеру, биологическому потенциалу, эффективности инкапсуляции, цитотоксичности клеток, изучению поглощения, профилю высвобождения и распределению по размерам и однородности. Установлено, что эффективность инкапсуляции находилась в диапазоне от 80,73 ± 6,37 % до 92,34 ± 1,72 %. Кумулятивное высвобождение пептидов из наночастиц составило 72,56 ± 6,67 % через 2 недели. Инкапсулированные пептиды показали хорошее поглощение, при этом цитотоксичность в клеточной линии A549 полностью отсутствовала. В процессе исследования отмечено, что во время синтеза наночастиц структура и целостность пептидов не нарушаются. Пептиды показали контролируемое и устойчивое высвобождение с первоначальным усиленным высвобождением.
Перспективным источником пептидов с различной функциональной направленностью благодаря своему химическому составу является молозиво коров – молоко, выделяемое коровами в течение первых нескольких дней после отела. Оно содержит много питательных веществ и биоактивных компонентов, включая иммуноглобулины, факторы роста, α-лактальбумин (α-LA) и β-лактоглобулин (β-lg), лизоцим, лактопероксидазу, лактоферрин (LF), нуклеозиды, цитокины, витамины, пептиды и олигосахариды ( Pecka-Kiełb et al., 2018 ). За рубежом молозиво используется в качестве биологически активной добавки, поскольку многие исследования показали, что оно может обладать антиатеросклеротическими, противораковыми, антибактериальными и антиоксидантными свойствами ( Godhia et al., 2013 ). Исследования ( Champagne et al., 2013 ) доказали положительное влияние молозива на восстановление состава кишечного микробиома и процесс заживления поврежденной слизистой оболочки.
Автором ( Korhonen, 1977 ) определено содержание определенных антимикробных белков в молозиве пяти коров Айршира в течение первых 9 доек и в молоке через 14 дней после отела. Проанализированы следующие показатели: общий сывороточный белок (WP), общие иммуноглобулины (Ig), лактоферрин (LF), лактопероксидаза (LP), лизоцим (LZM) и титр антител Salmonella typhimurium к соматическим (04,12) и жгутиковым (H1.5, Hi) антигенам. Установлено, что все исследуемые показатели значительно варьировались при первом доении различных коров, но разница в содержании для всех, кроме LP и LZM, уменьшалась вместе с количеством доек. Концентрации WP, Ig и LF были самыми высокими в первом доении и заметно снизились в следующих дойках. С другой стороны, концентрация ЛП была в среднем наибольшей во время 3-го и 4-го доений, а концентрация LZM – во время 7-го и 8-го доений. Молозивная сыворотка от первого доения имела следующие концентрации (в среднем): WP – 69,2 мг/мл, Ig – 52,0, LF – 1,53, LP – 22,8 и LZM – 0,40 мкг/мл. В молочной сыворотке концентрации были следующими: WP – 12,2 мг/мл, Ig – 0,95, LF – 0,09, LP – 20,1 и LZM – 0,37 мкг/мл. В молозиве всех коров обнаружены агглютинирующие антитела к патогенному штамму S. typhimurium человека против О- и Н-антигенов. Одно животное, которое было вакцинировано S. typhimurium до родов, имело значительно более высокие титры, чем невакцинированные животные. У последних были обнаружены антитела только в первых двух или трех дойках после отела, в то время как у вакцинированной коровы антитела в молоке были через 14 дней после отела. Полученные результаты позволяют предположить, что в дополнение к антителам неспецифические антибактериальные факторы (LF, LP и LZM) могут способствовать проявлению антимикробной активности молозива.
Целью исследований является разработка технологии и способа микрокапсулирования пептидов, выделенных из молозива коров после отела, и оценка субхронической токсичности.
Материалы и методы
В качестве материала для исследования использовали пептиды, выделенные из сыворотки молозива коров, экстракт фабрициевой сумки цыплят-бройлеров с известным содержанием пептидов и нелинейных мышей.
Пептиды получали из обезжиренной сыворотки молозива коров следующим образом: центрифугирование обезжиренной сыворотки молозива коров в течение 10 минут при 11 000 об./мин; гидролиз пепсином из расчета 50 мг/л в течение 6 часов при температуре 36 °C и рН 5,0; температурная инактивация фермента (75 °C, 90 сек), гельфильтрация на жидкостном высокоэффективном хроматографе Agilent 1260 Infinity II с применением сорбентов Sefadex G-10, 25 и 75; определение молекулярной массы методом электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия. Молекулярное распределение фракций пептидов в полученном продукте из обезжиренного молозива коров следующее: менее 10 кДа – 18 %, 10–25 кДа – 37, 25–75 кДа – 32, более 75 кДа – 13 %.
Для получения экстракта фабрициевой сумки замороженные бурсы цыплят-бройлеров измельчали при помощи ножа до размера частей сырья 1 мм. Измельченное сырье переносили в плоскодонную колбу, заливали экстрагентом в соотношении 3 : 10 (на 30 г замороженного измельченного сырья приходилось 100 мл экстрагента). Для экстрагирования использовали экстрагент с рН 7,0, приготовленный на фосфатном буфере по ГОСТ 4919.2-20161. Экстракцию проводили на холоде при температуре 6–8 °С. Колбы с измельченным сырьем, залитым экстрагентом, устанавливали в шуттель-аппарат. Истинная концентрация белка в экстракте составила 21,53 мг/мл. Затем протеолитическую активность белков определяли в супернатанте, полученном в ходе экстракции на холоде.
Определение протеолитической активности проводили в разведениях в 10, 20, 50 и 100 раз следующим образом. В две пробирки – испытуемую и контрольную – вносили по 2 мл 1%-го раствора казеина, помещали их в водяную баню при температуре воды 30 °С на 10 минут. По окончании выдержки в испытуемую пробирку вносили 0,5 мл разведенного супернатанта, а в контрольную – 0,5 мл воды очищенной. Содержимое пробирок перемешивали стеклянной палочкой и ставили на повторную выдержку на 10 минут при той же температуре.
По истечении времени в обе пробирки добавляли по 2,5 мл 5%-го раствора трихлоруксусной кислоты для прекращения действия ферментов, содержимое пробирок перемешивали. Выделившийся осадок отфильтровывали самотеком на плотной фильтровальной бумаге. Для полученного фильтрата измеряли оптическую плотность при длине волны λ = 280 нм. В качестве раствора сравнения использовали воду очищенную.
Количество протеолитических единиц в 1 мл исследуемого раствора А (ПЕ/мл) рассчитывали по формуле
A = ( D оп - D к ) x P x 2, (1)
где D оп – оптическая плотность опытного раствора; D к – оптическая плотность контрольного раствора; P – разведение раствора; 2 – коэффициент пересчета протеолитической активности фермента на 1 мл исследуемого раствора.
Результаты исследования представлены в табл. 1.
Таблица 1. Результаты исследования протеолитической активности экстракта фабрициевой сумки цыплят-бройлеров
Table 1. Results of studying the proteolytic activity of the extract of the broiler chickens' fabricius bursa
|
Разведение |
Протеолитическая активность, ПЕ/мл |
|
10 |
4,68 |
|
20 |
4,32 |
|
50 |
5,4 |
|
100 |
4,8 |
|
Среднее значение |
4,8 |
Затем экстракт дополнительно ферментировали трипсином из расчета 50 мг/л в течение 6 часов при температуре 36 °C и рН 7,8, проводили гельфильтрацию на жидкостном высокоэффективном хроматографе Agilent 1260 Infinity II с применением сорбентов Sefadex G-10 и Sefadex G-25. Молекулярное распределение фракций пептидов в экстракте фабрициевой сумки, установленное методом гельфильтрации, следующее: менее 18 кДа – 7 %, 18–27 кДа – 82, более 27 кДа – 11 %.
Микрокапсулирование пептидов проводили на опытной установке, основой которой являлся аппарат с псевдоожиженным слоем, путем нанесения на поверхность пептидов 10%-го раствора мальтодекстрина МД 6 (ГОСТ 34275-20172, производитель ООО "НьюБио") (рис. 1).
Опытная установка для проведения микрокапсулирования пептидов представляет стеклянный корпус модельного аппарата конической формы 2, в нижнюю часть которого подавался воздух вентилятором 6. Протеолитические пептиды 1 засыпали в корпус аппарата на пористую перегородку 5. Путем изменения напряжения (автотрансформатором) питания вентилятора устанавливали скорость воздуха, обеспечивающую образование псевдоожиженного слоя в виде фонтанирующих потоков. Размеры конуса корпуса аппарата позволяют наносить покрытия разных по размеру частиц и исключить их унос. После установления фонтанирующего режима включался компрессор 4 диспергатора жидкого компонента 3 (рис. 1).
Расчет параметров установки для микрокапсулирования пептидов: диаметр широкой части конуса рабочей камеры, а также скорость витания мелких частиц конгломератов пептидов высчитывали с помощью уравнения неразрывности потока d ш=d »-^.
где d уз – диаметр отверстия в узкой части рабочей камеры; d ш – диаметр широкой части конуса рабочей камеры; υуз – скорость воздушного потока в узком сечении конуса рабочей камеры, равная скорости витания крупных частиц материала; υш – скорость воздушного потока в широком сечении конуса рабочей камеры, равная скорости витания мелких частиц материала.
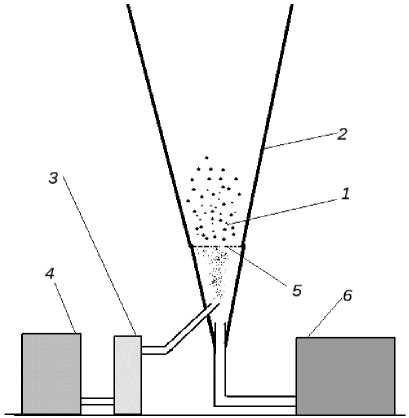
Рис. 1. Принципиальная схема установки для микрокапсулирования в псевдокипящем слое:
1 - протеолитические пептиды; 2 - корпус аппарата конической формы; 3 - диспергатор жидкого компонента; 4 - компрессор для диспергатора; 5 - пористая перегородка; 6 – вентилятор
Fig. 1. Schematic diagram of the installation for microcapsulation in a pseudo-boiling layer:
1 – proteolytic peptides; 2 – the body of the apparatus with a conical shape; 3 – the liquid component disperser; 4 – the compressor for the dispersant; 5 – the porous partition; 6 – the fan
Скорость витания мелких частиц конгломератов пептидов ( d = 10 мкм) в широком сечении аппарата определяли согласно уравнению для определения критических скоростей витания частиц сыпучего материала по полуэмпирической зависимости Аэрова – Тодеса ( Тодес, 1981 )
_ Ar -v / d
18 + 0.61-Ar. ’ где Ar = g (Рч—— - критерий Архимеда; v - коэффициент кинематической вязкости воздушной смеси;
V2 -р d – размер частиц материала; ρч – плотность частиц сыпучего материала; ρ – плотность воздушной смеси; g – ускорение свободного падения.
Пептиды, выделенные из сыворотки молозива коров, микрокапсулировали в псевдокипящем слое 10%-го раствора мальтодекстрина.
Эксперимент по оценке субхронической токсичности капсулированных и свободных пептидов в сравнении с токсичностью пептидов в составе экстракта фабрициевой сумки цыплят-бройлеров, не обладающих острой, субхронической и хронической токсичностью, проводили на нелинейных мышах. Для эксперимента сформировали 4 группы беспородных мышей по 10 в каждой (5 самцов и 5 самок). 1 группа мышей с массой тела 20,8 ± 1,6 г – контрольная; 2 – опытная: животные с массой тела 20,0 ± 1,4 г получали экстракт фабрициевой сумки цыплят-бройлеров, содержащий пептиды различной молекулярной массы с дозой 15 000 мг/кг; 3 группа (нелинейные мыши с массой тела 21,0 ± 1,4 г) получала свободные пептиды, выделенные из сыворотки молозива коров, в количестве 1 500 мг/кг; 4 группа мышей с массой тела 20,8 ± 1,6 г – капсулированные пептиды в количестве 15 000 мг/кг. При микрокапсулировании соотношение твердых пептидов к жидкому раствору мальтодекстрина выдерживали в пределах 10/1÷11/1. Лабораторно-экспериментальное изучение субхронической токсичности проводили на базе Государственного научного центра прикладной микробиологии и биотехнологии Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека Российской Федерации.
Срок наблюдения за животными составил 37 дней с начала эксперимента. Ежедневно регистрировали вес животных, наличие или отсутствие клинических симптомов интоксикации, факт гибели. Взвешивание мышей происходило на 7, 9, 14, 21 и 28 день эксперимента. Индивидуальные образцы крови отбирали у животных через сутки после окончания курса введения пептидов (31 сутки). Гематологический анализ крови проводили с использованием автоматического гематологического анализатора PCE-90Vet (High Technology, США). Биохимический анализ сывороток крови животных – с помощью полуавтоматического анализатора StatFax 3300 (Awareness Technology, США).
Статистическую обработку полученных данных проводили на компьютере Pentium IV с использованием программ Microsoft Excel и Primer Biostatistic 4.03. for Windows методом однофакторного дисперсионного анализа, двухстороннего и парного критериев Стьюдента. Различия между показателями считали достоверными при р < 0,05.
Результаты и обсуждение
Жидкий компонент (10%-й раствор мальтодекстрина) подавали через воздуховод в виде тумана, который образовывал защитное покрытие на пептидах.
В качестве контроля был взят чистый некапсулированный пептид (свободный пептид).
Соотношение твердых пептидов к жидкому раствору мальтодекстрина выдерживали в пределах 10/1÷11/1. Для создания кипящего слоя в фонтанирующих потоках использовали воздух комнатной температуры.
Опытным путем была получена зависимость ( p ≤ 0,05) средней толщины нанесения раствора мальтодекстрина на конгломерат пептида в зависимости от продолжительности нанесения (рис. 2).
Δ, мкм 12
0 τ, мин
Рис. 2. Зависимость толщины поверхностного слоя мальтодекстрина от продолжительности нанесения на конгломерат пептидов Fig. 2. Dependence of the thickness of the maltodextrin surface layer on the duration of application to the peptide conglomerate
Размер конгломератов из пептидов в результате микрокапсулирования составлял от 5 до 30 мкм при толщине поверхностного слоя от 2 до 10 мкм, которая определялась продолжительностью проведения процесса псевдоожижения. Через 1–1,5 минуты обработки раствором мальтодекстрина на конгломерате пептидов активно образуется защитный поверхностный слой толщиной более 2 мкм от его среднего значения. С течением времени интенсивность образования защитного слоя снижается при достижении конечной толщины слоя до 10 мкм.
Для определения геометрических параметров установки с кипящим слоем, в частности размеров широкой и узкой частей конической рабочей камеры, использовали уравнения (2) и (3).
Правильный подбор скоростей для образования фонтанирующих потоков в зависимости от свойств и размеров частиц обеспечивали необходимым диаметром проходного отверстия в узкой части и размером рабочей камеры широкой части аппарата. Благодаря этому исключался вынос из аппарата наименьших конгломератов с покрытием и размерами до 10 мкм.
С этой целью критерий Архимеда вычисляли с использованием уравнения (3)
9,81 - (10 - IO - 6)3 - (1450 - 1,205)
Ar =------------—---------= 0,052.
(15,06 - 10 - 6)2 - 1,205
Скорость витания частиц продукта в широкой части аппарата определяли по уравнению (3)
0,052 - (15,06-10-6)/(10-10-6) AAA,A , u = ,----—----------- = 0,0042 м/с.
18 + 0,61 - V 0,052
Аналогично находили скорость витания крупных частиц конгломератов ( d = 50 мкм) в узком сечении аппарата.
Критерий Архимеда определяли как
_ 9,81 - (50 - 10 - 6)3 - (1450 - 1,205)
Ar г 25.
(15,06 - 10 - 6)2 - 1,205
Скорость витания частиц материала в узкой части аппарата вычисляли согласно уравнению (3)
25 - (15,06 - 10-6)/(100 - 10-6)
и =------------- '--------- = 0,17 м/с.
уз 18 + 0,61 -7 0,052
В результате расчета по уравнению неразрывности потока (2) соотношение размеров широкой части конуса и узкой части аппарата при капсулировании составило
d = d - ш уз
0,34 0,0042
= 6,3 - d у, .
Полученное соотношение позволяет подбирать оптимальные геометрические параметры рабочей камеры аппаратов с кипящем слоем для проведения процесса микрокапсулирования пептидов.
В результате исследования субхронической токсичности установлено, что ежедневное (в течение 30 суток) внутрижелудочное введение мышам экстракта фабрициевой сумки, а также микрокапсулированных и свободных пептидов в максимальной дозе, не приводило к гибели животных и не влияло на общее состояние организма как у самцов, так и самок. Поведенческие реакции и внешний вид мышей из экспериментальных и контрольной групп не отличались. Кривые динамики массы тела контрольных (интактных) животных и получавших экстракт фабрициевой сумки, содержащий пептиды и свободные и микрокапсулированные пептиды, выделенные из молозива коров, не имели статистически достоверных различий (рис. 3).
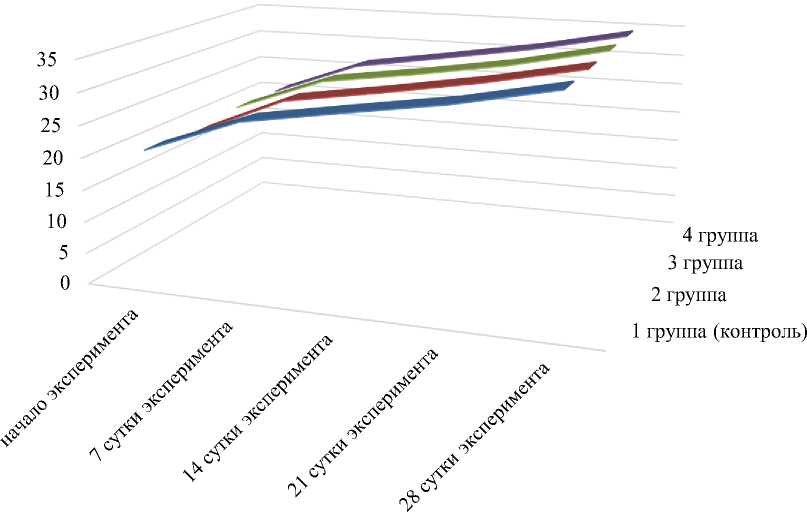
1 группа (контроль)
2 группа 3 группа 4 группа
Рис. 3. Динамика массы тела нелинейных мышей контрольных (интактных) животных и получавших внутрь экстракт фабрициевой сумки, содержащий пептиды, свободные и микрокапсулированные пептиды, выделенные из молозива коров
Fig. 3. Body mass dynamics of nonlinear mice of control (intact) animals and ingested fabricium bag extract containing peptides, free and microcapsulated peptides extracted from cow colostrum
Исследования показали, что испытуемые пептиды при ежедневном внутрижелудочном введении мышам в течение 30 дней не оказывали достоверного влияния на содержание гемоглобина и форменных элементов крови, что сопоставимо с данными, полученными в группе биоконтроля, которые находятся в пределах нормальных физиологических значений для этого вида животных. Показатели крови мышей представлены в табл. 2.
Таблица 2. Гематологические показатели крови мышей, получавших внутрижелудочно исследуемые пептиды в течение 30 суток Table 2. Hematological blood parameters of mice treated with intragastric peptides for 30 days
|
Показатели крови |
Ед. измерения |
Норма |
1 группа (контроль) |
2 группа |
3 группа |
4 группа |
|
Лейкоциты |
×109/л |
3,0–14,2 |
4,82 ± 0,01 |
5,10 ± 0,01 |
5,03 ± 0,01 |
5,02 ± 0,01 |
|
Лимфоциты |
×109/л |
3,22–11,20 |
3,74 ± 0,04 |
3,62 ± 0,05 |
3,58 ± 0,5 |
3,73 ± 0,15 |
|
Моноциты |
×109/л |
0,30–1,43 |
0,41 ± 0,04 |
0,40 ± 0,01 |
0,45 ± 0,02 |
0,43 ± 0,01 |
|
Лимфоциты |
% |
52–86 |
58,2 ± 1,8 |
54,1 ± 2,4 |
59,2 ± 1,6 |
58,3 ± 2,5 |
|
Моноциты |
% |
0–8 |
4,7 ± 0,7 |
4,7 ± 0,2 |
4,7 ± 0,3 |
4,7 ± 0,1 |
|
Гранулоциты |
% |
10–40 |
37,1 ± 1,2 |
36,5 ± 0,4 |
35,8 ± 0,3 |
31,2 ± 0,4 |
|
Эритроциты |
×1012/л |
5,0–9,9 |
9,51 ± 0,53 |
9,25 ± 0,62 |
9,24 ± 0,63 |
9,25 ± 0,41 |
|
Концентрация гемоглобина |
г/л |
109–163 |
123 ± 9 |
124 ± 2 |
124 ± 3 |
125 ± 1 |
|
Гематокрит |
% |
42–62 |
45,9 ± 3 |
47,1 ± 1,5 |
44,5 ± 1,8 |
43,1 ± 2,1 |
|
Средний объем эритроцита |
фл |
48,0–56,0 |
43,2 ± 3,4 |
46,8 ± 5,1 |
45,2 ± 2,3 |
46,5 ± 2,7 |
|
Среднее содержание гемоглобина в эритроците |
пг |
11,9–19,0 |
12,9 ± 1,2 |
13,1 ± 1 |
13,2 ± 1 |
13,0 ± 1 |
|
Средняя концентрация гемоглобина в эритроците |
г/л |
259–351 |
300 ± 9 |
289 ± 15 |
297 ± 14 |
295 ± 18 |
|
Ширина распределения эритроцитов |
% |
12–23,5 |
16,4 ± 1,5 |
14,2 ± 1,7 |
15,6 ± 1,2 |
14,8 ± 1,6 |
|
Тромбоциты |
×109/л |
600–1 843 |
909 ± 115 |
1 075 ± 141 |
1 028 ± 137 |
1 075 ± 143 |
|
Средний объем тромбоцита |
фл |
4,5–6 |
5,12 ± 0,03 |
5,27 ± 0,03 |
5,32 ± 0,04 |
5,31 ± 0,03 |
|
Ширина распределения тромбоцитов |
% |
15–16,5 |
15,5 ± 0,4 |
15,9 ± 0,1 |
15,8 ± 0,2 |
15,9 ± 0,3 |
|
Тромбокрит |
% |
0,400–0,700 |
0,459 ± 0,012 |
0,576 ± 0,059 |
0,571 ± 0,048 |
0,573 ± 0,034 |
О функциональном состоянии внутренних органов мышей судили по биохимическим показателям крови – содержанию общего белка, креатинина, глюкозы и активности аминотрансфераз (АСТ-аспартатаминотрансфераза и АЛТ-аланинаминотрансфераза).
Полученные результаты показывают, что колебания биохимических показателей плазмы крови у мышей после многократного перорального введения пептидов не отличались от таковых у интактных (контрольных) животных (табл. 3).
Таблица 3. Биохимические показатели сывороток крови беспородных мышей, получавших внутрижелудочно исследуемые пептиды в течение 30 суток Table 3. Biochemical parameters of blood sera of mongrel mice treated with intragastrically studied peptides for 30 days
|
Биохимические показатели |
Ед. измерения |
Границы нормы |
1 группа (контроль) |
2 группа |
3 группа |
4 группа |
|
Креатинин |
мкмоль/л |
40,8–70,8 |
44,6 ± 2,8 |
49,7 ± 0,9 |
48,6 ± 6,8 |
49,5 ± 6,8 |
|
Общий белок |
г/л |
40,5–64 |
62,62 ± 1,5 |
67,9 ± 3,0 |
65,1 ± 3,4 |
65,1 ± 2,8 |
|
Аспартатаминотрансфераза (АСТ) |
МЕ/л |
69–191 |
142,8 ± 26,0 |
166,3 ± 19,4 |
175,8 ± 26,5 |
166,1 ± 34,2 |
|
Аланинаминотрансфераза (АЛТ) |
МЕ/л |
26–120 |
59,4 ± 7,9 |
49,8 ± 7,5 |
54,3 ± 9,2 |
54,3 ± 7,1 |
|
Глюкоза |
ммоль/л |
5,88–15,43 |
9,66 ± 1,28 |
8,97 ± 0,34 |
7,94 ± 0,74 |
7,86 ± 0,71 |
Заключение
Разработана экспериментальная установка для микрокапсулирования пептидов в псевдоожиженным слое. В результате исследований определена зависимость толщины защитного слоя мальтодекстрина на конгломерате пептида от продолжительности процесса микрокапсуляции. Расчетным путем установлен критерий Архимеда и скорость витания конгломерата в узкой и широкой частях конуса установки, найдено соотношение размеров широкой и узкой частей аппарата для микрокапсулирования. Полученное в результате расчета соотношение позволяет определить продолжительность микрокапсулирования – от 2 минут и максимальный слой покрытия на исходные частицы – до 10 мкм. В исследованиях по определению субхронической токсичности свободных и микрокапсулированных пептидов на основании общего состояния, динамики массы тела, гематологических и биохимических показателей крови лабораторных мышей установлена безопасность их применения при внутрижелудочном введении.


