Микрокапсулирование пепсина в двухкомпонентном защитном слое
Автор: Дьячкова Анна Викторовна, Тихонов Сергей Леонидович, Тихонова Наталья Валерьевна
Рубрика: Пищевые ингредиенты, сырье и материалы
Статья в выпуске: 3 т.8, 2020 года.
Бесплатный доступ
Статья имела целью проведение эксперимента с производством микрокапсул в псевдокипящем слое и оценке влияния двухкомпонентного защитного материала микрокапсулы - мальтодекстрина с гуммиарабиком и мальтодекстрина с желатином на протеолитическую активность микрокапсулированного пепсина. В результате проведенного факторного анализа было обнаружено, что микрокапсулы с различной толщиной защитного слоя демонстрируют лучшее сохранение первоначальной активности фермента, при этом выявлено наличие существенных различий между некапсулируемым и капсулируемым ферментом с пятой минуты ферментации. Различия между микрокапсулами разной толщины (2, 4, 6 мкм) существенны с 15 минуты ферментации; существенное различие и влияние оказывает не вид защитного слоя, а его толщина. Микрокапсулы с пепсином с защитным материалом мальтодекстрина и желатина, мальтодекстрина и гуммиарабика с толщиной слоя 4 и 6 мкм не проявляли потери активности на протяжении всего срока хранения (18 мес.) при 2 °С. Выявлены отличия в активности пепсина при хранении только между некапсулируемым ферментом и закапсулированным, при этом отсутствует существенная разница между различными микрокапсулами в активности пепсина на протяжении всего срока хранения. Результаты эксперимента по микрокапсуляции пепсина в двухкомпонентный защитный материал в псевдокипящем слое позволяют рекомендовать использовать любой из двухкомпонентных составов в пропорции 3:1, толщина покрытия 4 мкм. Выбор между гуммиарабиком или желатином к мальтодекстрину - вопрос скорее о доступности материала, а не эффективности. Данная технология и материалы для микрокапсулирования могут быть внедрены и активно использоваться в пищевом производстве.
Микрокапсулирование, псевдокипящий слой, пепсин, мальтодекстрин и желатин, мальтодекстрин и гуммиарабик
Короткий адрес: https://sciup.org/147234308
IDR: 147234308 | УДК: 663.15 | DOI: 10.14529/food200305
Текст научной статьи Микрокапсулирование пепсина в двухкомпонентном защитном слое
Наука в области пищевой биотехнологии активно исследует возможности микрокапсулирования витаминов, ферментов, пробиотиков, антиоксидантов для улучшения пищевых свойств продуктов, увеличения сроков годности. Необходимость капсулирования ферментов обусловлена тем, что их активность снижается под воздействием окружающей среды (температура, свет). За счет микрокапсулирования можно повысить термическую и эксплуатационную стабильность ферментов. В многочисленных исследованиях было подтверждено, что технология микрокапсулирования в псевдокипящем слое экономически целесообразна по причине невысокой стоимости производства и легкой воспроизводимости процесса [1–4]. При этом обеспечивается высокая эффективность микрокапсулирования (уровень инкапсуляции вещества в качестве ядра, гигроскопичность, слипаемость микрокапсул), которая сохраняется на протя- жении относительно длительного срока хранения (от 6 до 12 мес.) [5–7].
Дальнейший вектор исследовательских задач связан с выбором оптимального вещества в качестве защитного материала. В многочисленных работах, исследующих инкапсуляцию различных пищевых ингредиентов, но использующих одинаковый защитный материал, часто имеют схожие выводы о высоких исследуемых показателях [8–11]. Это может означать, что вид ядра скорее не оказывает существенного влияния на качество микрокапсулы. В то время как вид защитного материала является определяющим для обеспечения высоких показателей эффективности микрокапсулирования. При этом исследователи выделяют, что монокомпонентный защитный материал уступает по исследуемым показателям двухкомпонентным материалам [6, 12, 13]. В работах объясняется это тем, что защитный материал не способен одновременно защищать вещество ядра от его разруше- ния, иметь требуемую механическую прочность, быть совместимым с пищевым продуктом, обеспечивать контролируемое высвобождение и иметь требуемые термические свойства, совместимые со свойствами продукта одновременно по всем параметрам.
В современных исследованиях встречаются эксперименты по производству микрокапсул с двухкомпонентым защитным материалом хитозана или мальтодекстрина в сочетании с желатином или гуммиарабиком [6, 8, 12]. В этих исследованиях значимых выводов об эффективности определенного двухкомпонентного защитного материала не сделано.
В связи с этим перспективная исследовательская задача состоит в поиске эффективного двухкомпонентного материала для защитного слоя в производстве микрокапсул.
Цель работы – экспериментально оценить влияние двухкомпонентного защитного материала микрокапсулы – мальтодекстрина с гуммиарабиком и мальтодекстрина с желатином на протеолитическую активность микрокапсулированного пепсина и разработать рекомендации по его микрокапсулированию
Объекты и методы исследования
В эксперименте в качестве капсулируемо-го вещества – ядра – выбран пепсин. Двухкомпонентное защитное вещество микрокапсул: мальтодекстрин с желатином и мальтодекстрин с гуммиарабиком. Пропорция двух материалов была выбрана 3:1, которая была обозначена в работах [12, 14] как оптимальная.
Двухкомпонентный раствор мальтодекстрина с гуммиарабиком растворяли в дистиллированной воде, нагретой до 70 °С, при постоянном перемешивании при 120 об./мин в течение 1 часа, остужали постепенно и затем выдерживали в течение ночи при (4 ± 2) °С для регидратации. Для второго вида микрокапсул растворяли желатин в горячей дистиллированной воде при перемешивании до образования водного раствора, затем вносили мальтодекстрин при постоянном перемешивании до полного растворения всех материалов. Производство микрокапсул было проведено в разработанном исследователями аппарате, состоящим из стеклянной емкости, непосредственно в которой происходит нанесение на поверхность фермента псевдоожиженного слоя. К стеклянной емкости через патрубок с помощью компрессора с воздухом подается поток ферментов. Частицы в турбулентном потоке подсушиваются и поступают в корпус аппарата. После выдачи всей порции жидких компонентов вентиль закрывают. Продолжительность сушки составляет 5–8 минут. По окончанию сушки нижнюю горловину корпуса перекрывают затвором с заслонкой, и порция капсулированного фермента самотеком ссыпается в емкость для готового продукта [2].
Микрокапсулы были выполнены с толщиной защитного слоя 2, 4 и 6 мкм посредством разной продолжительностью протекания процесса капсулирования (для увеличения толщины защитного слоя увеличивали время капсулирования).
Протеолитическая активность пепсина оценивалась по методу, описанному в работах [15, 16], в качестве субстрата использовали казеин по Гамерстену. Активность пепсина определяли в диапазоне от 1,5 до 5,0 рН по количеству тирозина, образующегося в результате гидролиза казеина после инкубации в течение 15 мин при температуре 40 °С. Образцы были подвергнуты центрифугированию и фильтрации. Активность пепсина оценивали по увеличению УФ-поглощения супернатанта при 280 нм.
Контрольными образцами являлся чистый некапсулированный пепсин. Полученные образцы хранили в защищенном от света месте при комнатной температуре. Проверены истинные различия в начале эксперимента и сделаны замеры по прошествии 3, 6, 12, 18 месяцев хранения.
Для оценки различия скорости изменения активности микрокапсулированного фермента и нативного фермента использовался коэффициент опережения. Он рассчитывается как отношение активности микрокапсулированного фермента к некапсулированному для каждого момента измерения. Если показатель означает насколько медленнее падает активность капсулированного фермента по отношению к некапсулированному.
Для определения влияния вида защитного слоя на протеолитическую активность был проведен дисперсионный анализ результатов. Данные были протестированы на 5 %-ном уровне значимости.
Результаты и их обсуждение
Первоначальная активность ферментного препарата рассматривалась в качестве стандарта для оценки его стабильности. Микрокапсулы с различной толщиной защитного слоя демонстрируют лучшее сохранение первоначальной активности фермента (рис. 1).
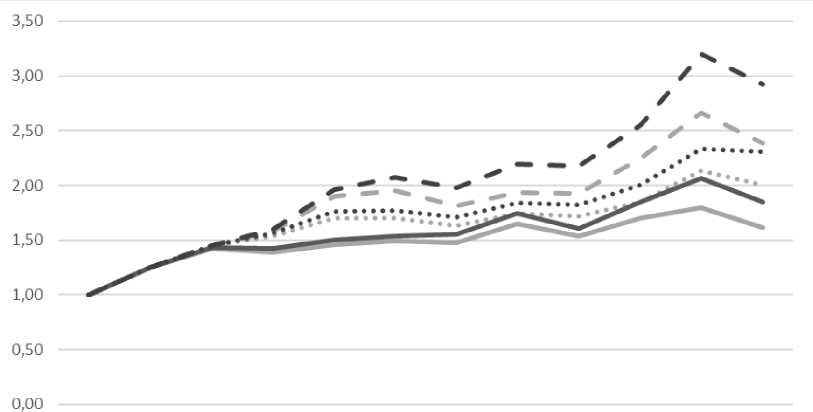
Поскольку наблюдается снижение активности как некапсулированного пепсина, так и в микрокапсулах, поэтому следует выявить скорость изменения активности в микрокапсулах по отношению к нативному ферменту. Для этого рассчитали коэффициент опережения, по которому соотносили активность фермента каждого вида образца микрокапсулы с некап-сулируемым ферментом, на основе полученных данных построили график (рис. 2).
Из графика видно (см. рис. 2), что наибольшую результативность обеспечили микрокапсулы с защитным материалом из мальтодекстрина и гуммиарабика с защитным слоем толщиной 6 мкм. В целом было выявлено, что большая толщина слоя имеет больший защитный эффект.
Проведен факторный анализ данных активности микрокапсулированного фермента и некапсулированного. Значение F-критерия влияния активности пепсина от продолжительности ферментации превышает F критическое (203,695229 > 1,93695813). Вычисленная наименьшая существенная разница составила 4,05573796, что позволяет заключить о наличии существенных различий между не-капсулируемым и капсулируемым ферментом с пятой минуты ферментации. Различия между микрокапсулами разной толщины (2, 4, 6 мкм) существенны с 15 минуты ферментации. При этом существенные различия не подтверждаются для микрокапсул с разным защитным материалом, но одинаковой толщины. Это означает, что существенное различие и влияние оказывает не вид защитного слоя, а его толщина.
Дисперсионный анализ данных протеолитической активности пепсина при хранении подтверждает отсутствие существенной разницы между различными микрокапсулами ( F факт < F теор; 1,07344834 < 2,36375096). Наблюдаются отличия между некапсулируе-мым ферментом и закапсулированным (см. таблицу).
Микрокапсулы с пепсином с защитным материалом мальтодекстрина и желатина, мальтодекстрина и гуммиарабика с толщиной слоя 4 и 6 мкм не проявляли потери активности до 18 месяцев хранения при 2 °С. Снижение активности объясняется зависимой от времени естественной потерей, и это может быть в значительной степени предотвращено путем микрокапсулирования. Зашитый в матрицу защитного материала из смеси мальтодекстрина с желатином или гуммиарабиком дает преимущество за счет увеличения стабильности фермента в течение всего срока хранения при 2 °С, что определено экспериментом по стабильности при хранении. Данные выводы согласуются с исследованиями [10, 12, 14].
Выводы
В результате проведенного эксперимента с микрокапсулированием пепсина с двухкомпонентными составами защитного покрытия и толщины были сделаны следующие выводы (на 5 %-ном уровне значимости):
– наличие существенных различий между некапсулируемым и капсулируемым ферментом с пятой минуты ферментации;
– различия между микрокапсулами разной толщины (2, 4, 6 мкм) существенны с 15 минуты ферментации;
– существенное различие и влияние оказывает не вид защитного слоя, а его толщина;
– выявлены отличия в активности пепсина на протяжении всего срока хранения (18 мес.) только между некапсулируемым ферментом и закапсулированным;
– отсутствие существенной разницы между различными микрокапсулами в активности пепсина на протяжении всего срока хранения.
Результаты эксперимента по микрокапсуляции пепсина в двухкомпонентный защитный материал в псевдокипящем слое позволяют рекомендовать использовать любой из двухкомпонентных составов в пропорции 3:1, толщина покрытия 4 мкм. Выбор между гуммиарабиком или желатином к мальтодекстрину – вопрос скорее о доступности материала, а не эффективности. Увеличение толщины защитного слоя может сопровождаться большими временными расходами и расходами материалов, не обеспечивая рост сохраняемости активности капсулированного фермента на значимом уровне (р = 0,01).
Данная технология и материалы для микрокапсулирования могут быть внедрены и активно использоваться в пищевом производстве.
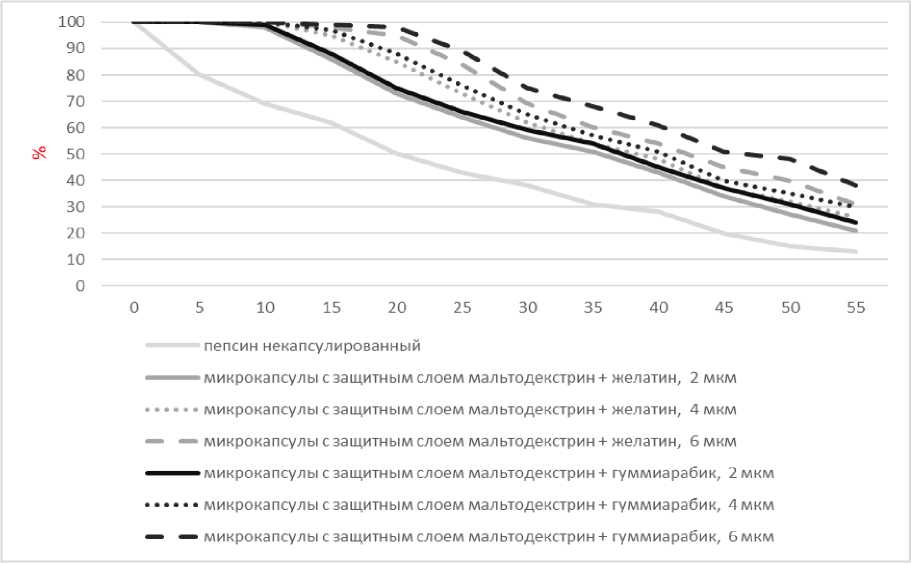
Рис. 1. Активность пепсина для различных микрокапсул, %
123456789 10 11 12
микрокапсулы с защитным слоем мальтодекстрин + желатин, 2 мкм микрокапсулы с защитным слоем мальтодекстрин + желатин, 4 мкм микрокапсулы с защитным слоем мальтодекстрин + желатин, 6 мкм микрокапсулы с защитным слоем мальтодекстрин + гуммиарабик, 2 мкм микрокапсулы с защитным слоем мальтодекстрин + гуммиарабик, 4 мкм микрокапсулы с защитным слоем мальтодекстрин + гуммиарабик, 6 мкм
Рис. 2. Коэффициент опережения снижения активности фермента
Протеолитическая активность пепсина
|
Месяцы хранения |
0 |
3 |
6 |
9 |
12 |
15 |
18 |
|
Пепсин некапсулированный |
100 |
98 |
96 |
91 |
87 |
85 |
83 |
|
Микрокапсулы с защитным слоем мальтодекстрин + желатин, 2 мкм |
100 |
100 |
100 |
100 |
100 |
100 |
99 |
|
Микрокапсулы с защитным слоем мальтодекстрин + желатин, 4 мкм |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
|
Микрокапсулы с защитным слоем мальтодекстрин + желатин, 6 мкм |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
|
Микрокапсулы с защитным слоем мальтодекстрин + гуммиарабик, 2 мкм |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
|
Микрокапсулы с защитным слоем мальтодекстрин + гуммиарабик, 4 мкм |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
|
Микрокапсулы с защитным слоем мальтодекстрин + гуммиарабик, 6 мкм |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
Список литературы Микрокапсулирование пепсина в двухкомпонентном защитном слое
- Gomes B., Barba F.J., Dominguez R., et al. Microencapsulation of antioxidant compounds through innovative technologies and its specific application in meat processing. Trends in Food Science & Technology, 2018, 82. pp. 135-147. DOI: 10.1016/j.tifs.2018.10.006
- Kudryashov L.S., Uzakov Ya.M., Tikhonov S.L., Tikhonova N.V., Diachkova A.V. Microencapsulation of proteolytic enzymes for industrial application // Известия НАН РК. Серия геологии и технических наук. 2020. С. 161-170. [Kudryashov L.S., Uzakov Ya.M., Tikhonov S.L., Tikhonova N.V., Diachkova A.V. Microencapsulation of proteolytic enzymes for industrial application. Izvestiya NAN RK. Seriya geologii i tekhnicheskih nauk [News of the National Academy of Sciences of the Republic of Kazakhstan. Series of Geology and Technology Sciences], 2020, pp. 161-170].
- Silva P.T., Fries L.L.M., Menezes C.R., Holkem A.T., Schwan C.L., Wigmann E.F., ..., da Silva C.D. Microencapsulation: Concepts, mechanisms, methods and some applications in food technology. Ciencia Rural, 2014, vol. 44(7), pp. 1304-1311. DOI: 10.1590/0103-8478cr20130971
- Кудряшов Л.С., Тихонов С.Л., Тихонова Н.В., Дьячкова А.В. Микрокапсулирование пепсина и оценка его протеолитических свойств // Вестник ВСГУТУ. 2019. Т. 3 (74). - С. 31-41. [Kudryashov L.S., Tikhonov S.L., Tikhonova N.V., Dyachkova A.V. Microencapsulation of pepsin and estimation of its proteolytic properties. Vestnik VSGUTU [ESSUTM Bulletin], 2019, vol. 3(74), pp. 31-41. (in Russ.)]
- Shiwani Guleria Sh., Walia A., Chauhan A & C. K. Shirkot Optimization of milk-clotting enzyme production by Bacillus amyloliquefaciens SP1 isolated from apple rhizosphere. Bioresources and Bioprocessing, 2016, vol. 3. DOI: 10.1186/s40643-016-0108-6
- Mehran M., Masoum S., Memarzadeh M. Improvement of thermal stability and antioxidant activity of anthocyanins of Echium amoenumpetal using maltodextrin/modified starch combination as wall material. International Journal of Biological Macromolecules, 2020, vol. 148, pp. 768-776. DOI: 10.1016/j.ijbiomac.2020.01.197
- Маковская Ю.В., Гордиенко М.Г. Исследование качества покрытия при инкапсуляции лекарственных веществ в псевдоожиженном слое методами статистики // Успехи в химии и химической технологии. 2009. Т. XXIII, № 1 (94). [Makovskaya Yu.V., Gordienko M.G. Issledovanie kachestva pokrytiya pri inkapsulyacii lekarstvennyh veshchestv v psevdoozhizhennom sloe metoda-mi statistiki. Uspekhi v himii i himicheskoj tekhnologii, 2009, vol. XXIII, no. 1 (94)]
- Ferrari C.C., Marconi Germer S.P., Alvim I.D., J.M. de Aguirre. Storage stability of spray-dried blackberry powder produced with maltodextrin or gum Arabic. Dry. Technol, 2013, vol. 31 (4), pp. 470-478. DOI: 10.1080/07373937.2012.742103
- Sartori T., Consoli L., Hubinger M.D and F. C. Menegalli Ascorbic acid microencapsulation by spray chilling: Production and characterization. LWT - Food Science and Technology, 2015, vol. 63, pp. 353-360. DOI: 10.1016/j.lwt.2015.03.112
- Ying D., Sanguansri L., Weerakkody R., Bull M., Singh T.K., Augustin M. Effect of encapsulant matrix on stability of microencapsulated probiotics. J. Funct. Foods, 2016, vol. 25. DOI: 10.1016/j.jff.2016.06.020
- Hoyos-Leyva J.D., Chavez-Salazar A., Castellanos-Galeano F., Bello-Perez L.A., Alvarez-Ramirez J. Physical and chemical stability of L-ascorbic acid microencapsulated into taro starch spherical aggregates by spray drying. Food Hydrocolloids, 2018, vol. 83, pp. 143-152. DOI: 10.1016/j.foodhyd.2018.05.002
- MahdaveeKhazaei K., S.M. Jafari, M. Ghorbani, A. HemmatiKakhki Application of maltodextrin and gum Arabic in microencapsulation of saffron petal's anthocyanins and evaluating their storage stability and color. Carbohydrate Polymers, 2014, vol. 105, pp. 57-62. DOI: 10.1016/j.carbpol.2014.01.042
- Boiero M L., Mandrioli M.,Vanden Braber N., Rodriguez-Estrada M.T., Garca N.A., C D. Borsarelli, M.A. Montenegro Gum arabic microcapsules as protectors of the photoinduced degradation of riboflavin in whole milk. Journal of Dairy Science, 2014, vol. 97(9). pp. 5328-5336. DOI: 10.3168/jds.2013-7886
- Mahdavi S.A., Jafari S.M., Assadpoor E., Dehnad D. Microencapsulation optimization of natural anthocyanins with maltodextrin, gum Arabic and gelatin. International Journal of Biological Macromolecules, 2016, vol. 85, pp. 379-385. DOI: 10.1016/j.ijbiomac.2016.01.011
- Hasem, A. M. Purification and properties of a milk-clotting enzyme produced by Penicillium oxalicum. Bioresource Technology, 2000, vol. 75, pp. 219-222. DOI: 10.1016/S0960-8524(00)00055-9
- Bergkvist, R. The proteolytic enzyme of Aspergillus oryzae 1. Methods for the estimation and isolation of the proteolytic enzymes. Acta Chemica Scandinavica, 1963, vol. 17, pp. 1521-1540. DOI: 10.3891/acta.chem.scand.17-1521


