Микромеханические ответы эритроцитов человека на стимулирование мембранных рецепторов, ионных каналов и ферментов
Автор: Муравьев А.В., Тихомирова И.А., Ахапкина А.А., Булаева С.В., Михайлов П.В., Муравьев А.А.
Журнал: Российский журнал биомеханики @journal-biomech
Статья в выпуске: 1 (71) т.20, 2016 года.
Бесплатный доступ
Эритроциты - высокоспециализированные клетки, основной функцией которых является транспорт кислорода. Они лишены ядра и митохондрий, однако сохранили многие элементы молекулярных сигнальных путей. При выполнении транспортной функции эритроциты изменяют свои механические свойства и в том числе деформируются и объединяются в комплексы - агрегаты. Имеются отдельные свидетельства того, что изменение механических свойств эритроцитов происходит под влиянием сигнальных молекул, таких как рецепторы, ферменты и ионные каналы. С учетом вышесказанного целью исследования было изучение микромеханических ответов эритроцитов на стимулирование мембранных рецепторов, ионных каналов и ферментов. Для этого эритроциты инкубировали с агонистами адренорецепторов, стимуляторами и ингибиторами ферментов и ионных каналов мембраны с последующей регистрацией их деформируемости и агрегации. Было показано, что адреналин умеренно повышает деформируемость эритроцитов вместе с выраженным подъемом их агрегации (на 34 %), агонист альфа-1-адренорецепторов фенилэфрин мало изменял деформируемость эритроцитов, но сильно стимулировал их агрегацию, прирост составил 53 %. Напротив, стимулирование бета-адренорецепторов изопротеренолом привело к выраженному приросту деформируемости эритроцитов на 19 % и лишь умеренному снижению их агрегации. Более существенные и позитивные сдвиги деформируемости эритроцитов наблюдали в условиях изменения активности ферментов. В среднем прирост деформируемости составил 14 %. Стимулирование входа Са2+ в эритроциты или блокирование ионных каналов достоверно изменяло их деформируемость и агрегацию, особенно под влиянием блокатора Са2+-каналов верапамила. Наиболее сильный эффект Са2+ наблюдали в отношении агрегации, она изменялась в среднем на 44 %. Полученные данные позволяют заключить, что механические свойства эритроцитов и их транспортные возможности статистически достоверно изменяются под влиянием активации или ингибирования элементов молекулярных сигнальных каскадов клеток (рецепторов, ферментов и ионных каналов).
Эритроциты, механические свойства, деформируемость, агрегация, мембрана, рецепторы, ионные каналы, ферменты
Короткий адрес: https://sciup.org/146216191
IDR: 146216191 | УДК: 616.314-08 | DOI: 10.15593/RZhBiomeh/2016.1.02
Текст научной статьи Микромеханические ответы эритроцитов человека на стимулирование мембранных рецепторов, ионных каналов и ферментов
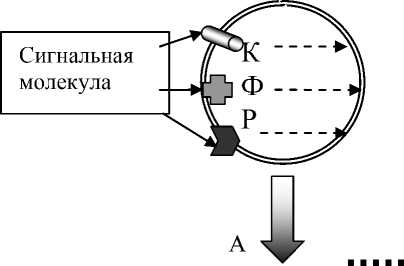
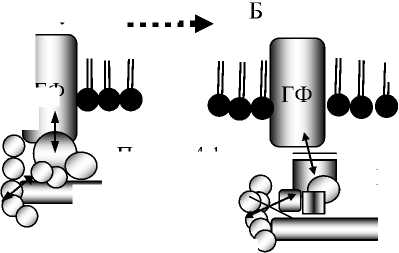
Механические свойства мембраны человеческих эритроцитов регулируются белками подмембранного цитоскелета, основными компонентами которого являются: альфа- и бета-спектрин, актин, полоса 4.1, аддуцин и дематин [15]. Все эти белки, кроме актина, фосфорилируются протеинкиназами, представленными в эритроцитах [9]. Кроме того, три двойных белок-белковых взаимодействия, такие как гликофорин С (ГФС) – белок полосы 4.1R, ГФС – р55 и р55 – 4.1R составляют тройной комплекс в эритроцитарной мембране [20]. Он является ответственным за проявление механических свойств мембраны, эластичности и стабильности клетки в целом [26]. При фосфорилировании белка полосы 4.1 происходит диссоциация указанного выше тройного комплекса, изменяется состояние цитоскелета и мембранной эластичности эритроцита (рис. 1) [8, 21]. Последняя определяет деформируемость эритроцита в целом и способность его эффективно участвовать в тканевой перфузии и доставке кислорода клеткам [1, 2, 6, 19].
Начальным этапом регуляторного пути при изменениях механических свойств является действие сигнальной молекулы на рецепторы, которые экспонированы на мембране зрелых эритроцитов [5, 11, 22, 25]. Действительно, при исследованиях in vitro в качестве мишеней для сигнальных молекул в эритроцитах могут быть рассмотрены рецепторы, ионные каналы и ферменты, представленные в клетках данного типа [10, 13, 15, 23]. Вместе с тем комплексных исследований изменения микрореологических свойств эритроцитов при активации мембранных рецепторов, ионных каналов и ферментов недостаточно.
Эритроцит
ГФ
ш
Актин
Полоса 4.1
Полоса 4.1
Спектрин
Актин
Диссоциация комплекса белков мембраны и прирост деформируемости

Спектрин
Рис. 1. Схема, иллюстрирующая диссоциацию тройного комплекса: спектрин -актин - полоса 4.1 - гликофорин С мембраны эритроцита при фосфорилировании полосы 4.1 протеинкиназой, при активации мембранных белков-мишеней (рецепторов, ферментов или каналов). Обозначения: А - дефосфорилированное состояние полосы 4.1; Б - фосфорилированное состояние полосы 4.1; ГФ -интегральный белок мембраны эритроцита гликофорин С; К - мембранный канал;
Ф - ассоциированный с мембраной фермент; Р - мембранный рецептор
Учитывая вышесказанное, целью данного исследования было изучение микромеханических ответов зрелых эритроцитов человека на стимулирование мембранных рецепторов, ионных каналов и ферментов.
Материалы и методы
Цельную кровь получали венопункцией. В качестве антикоагулянта использовали гепарин. Эритроциты отделяли от плазмы центрифугированием (15 мин при 3000 об/мин), клетки трижды отмывали в изотоническом растворе хлорида натрия, содержавшем глюкозу (5,0 мМ), и ресуспендировали в растворе Рингера (рH – 7,4, осмолярность – 300 мОсм/л; определяли на осмометре Fogel ОМ -801, Германия) до гематокрита 40 % для последующей их инкубации с препаратами и регистрации их микрореологических свойств.
В первой серии эритроциты делили на четыре аликвоты и клетки инкубировали:
-
1) с агонистом альфа-1 и бета-адренорецепторов мембраны эритроцитов: адреналином (1,0 µM);
-
2) с агонистом альфа-1-адренорецепторов мембраны эритроцитов: фенилэфрином (1,0 µM);
-
3) с агонистом бета-адренорецепторов мембраны: изопротеренолом (1,0 µM);
-
4) только в растворе Рингера (без препарата) – контрольные образцы.
Во второй серии опытов эритроциты делили на четыре аликвоты и клетки инкубировали:
-
1) с неселективным ингибитором фосфодиэстераз (ФДЭ):
изобутилметилксантином (ИБМК, 100 µM);
-
2) с ингибитором фосфодиэстеразы-3: цилостазолом (10 µM);
-
3) со стимулятором аденилатциклазы (АЦ): форсколином (10 µM);
-
4) только в растворе Рингера (без препаратов) – контрольные образцы.
В третьей серии опытов эритроциты делили на четыре аликвоты и клетки инкубировали:
-
1) со стимулятором входа кальция в эритроциты: кальциевым ионофором (А23186, 3,0 μМ);
-
2) с блокатором кальциевых каналов: верапамилом (10 µM);
-
3) с блокатором кальцийзависимых калиевых каналов: клотримазолом (10 µM);
-
4) только в растворе Рингера (без препарата) – контрольные образцы.
Суспензии эритроцитов инкубировали с препаратами в течение 15 мин при 37 ºС. После инкубации эритроцитов регистрировали их микрореологические свойства: измеряли агрегацию, вязкость их суспензии (гематокрит 40 %) и степень деформируемости. Матричные растворы препаратов готовили в DMSO , этиловом спирте или в воде. Анализы были выполнены в течение 4 часов после взятия крови. Все препараты получены от фирмы « Sigma-Aldrich » (США).
Деформируемость эритроцитов исследовали двумя методами:
-
1. Регистрировали вязкость суспензий эритроцитов с гематокритом 40 % ( Hct ) на полуавтоматическом капиллярном вискозиметре при высоком напряжении сдвига (2,45 Н∙м–2). Все измерения выполнены при комнатной температуре (20,0 ± 1,0 ºС, поддерживалась путем кондиционирования воздуха). Вязкость суспензионной среды (изотонический раствор Рингера) была постоянной и составила 1,10 мПа с. Коэффициент вариации при измерении вязкости не превышал 1,0 %.
-
2. Для оценки мембранной вязкоэластичности эритроцитов и их деформируемости в целом определяли индекс удлинения эритроцитов (ИУЭ) в проточной микрокамере, где создавали постоянное течение путем приложения
Эритроциты, вытянутые напряжением сдвига потока жидкости

Расчет индекса удлинения эритроцитов
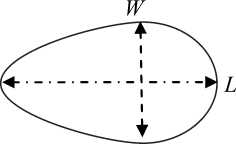
ИУЭ = ( L - W)/(L + W )
а б
Рис. 2. Эритроциты, закрепленные одной точкой к дну микрокамеры и вытянутые потоком жидкости (а). Расчет индекса удлинения эритроцитов как показателя их деформируемости (б). Стрелкой указано направление потока в микрокамере напряжения сдвига 0,98 Н^м-2. Микрокамеру заполняли суспензией эритроцитов (Hct = 0,5%). Суспензионной средой для них был раствор Рингера с добавлением декстрана-200 (10 % ХАЕС-стерил, Fresenius Kabi, Германия) соотношение: 30 % декстрана-200, 70 % - раствор Рингера. Вязкость этой жидкости составила 1,30 мПа-с. В микрокамеру подавали давление, которое вытягивало клетки, прикрепленные к дну камеры. На основе измерения длины (L) и ширины (W) вытянутых клеток (около 100 клеток) рассчитывали индекс удлинения эритроцитов (ИУЭ) как показатель их деформируемости (рис. 2): ИУЭ = (L - W)/(L + W), автоматически, на основе специально написанной компьютерной программы (№ 2010613237 - номер регистрации в федеральной службе по интеллектуальной собственности, патентам и товарным знакам).
Агрегацию эритроцитов оценивали с помощью агрегометра Myrenne M 1 (Германия), который дает возможность получить четыре индекса агрегации, при низких (3 с-1) и высоких скоростях сдвига (600 с-1). Кроме того, процесс агрегации контролировали методом прямой микроскопии с компьютерной регистрацией и анализом изображения.
Гематокрит определяли при помощи микрогематокритной центрифуги ( Elmi СМ -70).
Статистическая обработка экспериментальных данных
Весь цифровой материал обработан статистически с определением выборочной средней величины ( M ), величины среднего квадратичного отклонения ( ) и статистической ошибки средней ( m ). Проверку выборочного распределения на нормальность проводили с помощью теста Шапиро–Уилка. Если выборка подчинялась закону нормального распределения, достоверность различий в исследуемых группах определяли с помощью t -критерия Стьюдента. За уровень статистически значимых принимали изменения при p < 0,05. В тексте и таблице приведены средние величины ( М) и величины статистической ошибки средней ( m ).
Результаты
Изменения микрореологических характеристик эритроцитов при активации мембранных рецепторов
Имеются данные о том, что на мембране эритроцитов экспонированы альфа-1 и бета-адренорецепторы [11]. При инкубации с адреналином наблюдали умеренный прирост деформируемости эритроцитов на 6-8 % и выраженное увеличение их агрегации (на 34 %, таблица).
Альфа-1-адренорецептор сопряжен с кальциевым каналом [25]. При инкубации эритроцитов с фенилэфрином деформируемость эритроцитов достоверно не изменялась, хотя некоторое ее уменьшение наблюдалось, тогда как агрегация эритроцитов возросла в этих условиях на 53 % (таблица). Стимулирование бета-адренорецепторов изопротеренолом привело к существенному увеличению деформируемости эритроцитов на 19 % (р < 0,05), в то время как агрегация эритроцитов оказалась на 12 % ниже, чем в контроле (р < 0,05; таблица).
Изменения микрореологических характеристик эритроцитов при активации ферментов, расположенных в структурах мембраны эритроцитов
Прямая активация фермента мембраны аденилатциклазы (АЦ) с помощью форсколина сочеталась с приростом мембранной эластичности. На это указывало увеличение индекса удлинения эритроцитов на 17 % ( р < 0,05). При этом агрегация эритроцитов снизилась на 27 % (р < 0,05, таблица). С другой стороны, при ингибировании активности фосфодиэстеразы с помощью ИБМК был выявлен сходный с форсколином ответ эритроцитов. Так, индекс удлинения эритроцитов достоверно повышался на 11 %, а агрегация уменьшилась на 25 % (р < 0,05, таблица). ИБМК является неселективным ингибитором активности фосфодиэстеразы в клетках.
Изменение микрореологических показателей эритроцитов при их инкубации с препаратами
|
Показатель |
ИУЭ, отн. ед. |
г|с, мПа^с |
ПА, отн. ед. |
|
Препараты, действующие на мембранные рецепторы клеток ( M ± m , n = 26) |
|||
|
Контроль (без препарата) |
0,218 ± 0,005 |
3,55 ± 0,09 |
7,34 ± 0,32 |
|
Адреналин (1,0 цМ) |
0,236 ± 0,004* |
3,34 ± 0,012 |
9,83 ± 0,36* |
|
Фенилэфрин (1,0 цМ) |
0,214 ± 0,005 |
3,48 ± 0,10 |
11,20 ± 0,42* |
|
Изопротеренол (1,0 цМ) |
0,259 ± 0,004* |
3,15 ± 0,13* |
6,46 ± 0,26* |
|
Препараты, действующие на активность ферментов мембран клеток ( M ± m , n = 24) |
|||
|
Контроль (без препарата) |
0,209 ± 0,005 |
3,62 ± 0,10 |
7,12 ± 0,22 |
|
Форсколин (10 цМ) |
0,244 ± 0,004* |
3,37 ± 0,012 |
5,22 ± 0,23* |
|
ИБМК (100 рМ) |
0,233 ± 0,006* |
3,39 ± 0,10 |
5,34 ± 0,16* |
|
Цилостозол (10 рМ) |
0,238 ± 0,005* |
3,29 ± 0,12* |
5,46 ± 0,24* |
|
Препараты, действующие на ионные каналы мембран клеток ( M ± m , n = 24) |
|||
|
Контроль (без препарата) |
0,210±0,004 |
3,40±0,08 |
7,18±0,28 |
|
А23187 (3 рМ) |
0,198±0,004* |
3,48±0,012 |
12,78±0,54* |
|
Верапамил (10 цМ) |
0,243±0,005* |
3,02±0,12* |
5,88±0,25* |
|
Клотримазол (10 цМ) |
0,234±0,005* |
3,19±0,10 |
7,36±0,22 |
Примечание : т|с - вязкость суспензии эритроцитов; ПА - показатель агрегации эритроцитов; * - р < 0,05 относительно контроля.
Инкубация эритроцитов с цилостазолом - ингибитором фосфодиэстеразы-3 -привела к приросту деформируемости эритроцитов на 14 % и уменьшению их агрегации (на 23 %, p < 0,05). В этих условиях и вязкость суспензии эритроцитов достоверно снизилась на 9 % (см. таблицу).
Известно что кальций (Са2+) оказывает существенное влияние на механические свойства клеток [23]. Стимулирование его входа в эритроциты при помощи ионофора А23187 сопровождалось выраженным приростом агрегации эритроцитов и небольшими негативными изменениями деформируемости (см. таблицу).
С другой стороны, блокирование входа Са2+ в эритроциты с помощью верапамила привело к увеличению ИУЭ на 16 % по сравнению с контролем, а также к снижению вязкости суспензии и агрегации эритроцитов на 11 и 18 % соответственно (см. таблицу). На механическом поведении эритроцитов может сказаться и потеря калия (K+) через кальцийактивируемые К+-ионные каналы (Гардош-каналы [12]). Блокирование этих каналов клотримазолом положительно сказалось на деформируемости эритроцитов и мало повлияло на их агрегацию (см. таблицу).
Обсуждение результатов
Вне- и внутриклеточный сигнальный путь, ассоциированный со срочным изменением пластичности мембран эритроцитов и деформируемости клетки в целом, включает: активацию мембранного рецептора при связывании лиганда, изменение состояния G -белков, активацию АЦ, продукцию цАМФ и стимулирование цАМФ-зависимой протеинкиназы А (ПКА) [22]. Известно, что на мембране человеческих эритроцитов представлены как альфа-1, так и бета-1- и -2-адренорецепторы [5, 11, 24, 25]. Полученные нами данные показали, что бета-агонист изопротеренол существенно изменял микрореологические свойства эритроцитов. Поскольку бета-адренорецепторы сопряжены с Gs -белками, активирующими фермент - аденилатциклазу [27], то можно ожидать такого же эффекта от ее прямого стимулирования. Форсколин -специфический симулятор АЦ [17] - достоверно увеличивал деформируемость эритроцитов и снижал их агрегацию. Роль фермента аденилатциклазы заключается в повышении продукции цАМФ в клетках [14]. Поэтому можно полагать, что положительные изменения микрореологических свойств эритроцитов и повышение их текучести связаны с приростом концентрации цАМФ. При инкубации эритроцитов с проникающим аналогом цАМФ были получены изменения, сходные с действием форсколина и другого стимулятора АЦ - простагландина Е 1 [18]. Конечным звеном этого регуляторного каскада является фосфорилирование белков мембраны протеинкиназой А (ПКА), что ведет к изменению ее механических свойств. Было показано, что фосфорилирование белка полосы 4.1 при помощи ПКА сопровождается позитивным изменением деформируемости эритроцитов [4]. С другой стороны, активация Са2+-сигнального пути (в наших опытах при инкубации эритроцитов с кальциевым ионофором), вероятно, сопровождалась интенсификацией формирования белкового комплекса с участием спектрина, актина, полосы 4,1 и интегральных белков - полосы 3 и ГФС [3]. Известно, что при концентрации Са2+ выше 100 цМ происходит снижение деформации эритроцитов [22, 26]. Было показано, что блокирование входа Са2+ в клетку верапамилом, напротив, повышает деформируемость эритроцитов и текучесть их суспензий. Сходный эффект наблюдали при ингибировании Гардош-эффекта [12] с помощью клотримазола. Возможно, прирост деформируемости каким-то образом связан с обменом К+. Так, было установлено, что происходит диссоциация тройного комплекса актин - спектрин - полоса 4.1 цитоскелета мембраны эритроцита при повышении концентрации KCl выше 100 мМ.
эритроцитов эритроцитов
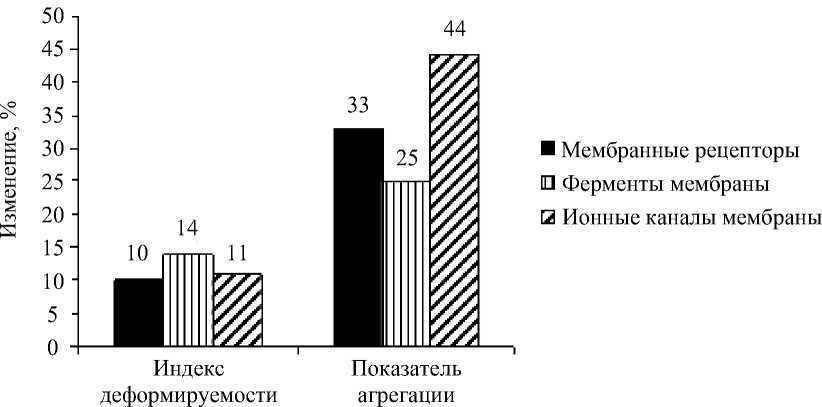
Рис. 3. Усредненные данные (в каждом случае по трем препаратам) изменений деформируемости эритроцитов и показателя их агрегации при активации или ингибировании: мембранных рецепторов эритроцитов; ферментов мембраны и ионных каналов мембраны
Другой эффект ингибирования активности Гардош-каналов может быть связан с повышением обмена К+ и воды в эритроцитах и сохранением ими двояковогнутой формы [7]. Это может обеспечить их оптимальную деформируемость [19].
Сравнительный анализ показал, что наиболее существенно деформируемость эритроцитов изменяется при активации/ингибировании исследованных ферментов мембраны эритроцитов (рис. 3). В среднем по всем трем препаратам (форсколин, ИБМК и цилостазол) прирост деформируемости эритроцитов составил 14 %, что несколько больше, чем при активации рецепторов и ионных каналов (см. рис. 3).
Что касается агрегации эритроцитов, то она в большей степени изменялась при активации или ингибировании активности ионных каналов (см. рис. 3).
Выводы
-
1. Микромеханические свойства эритроцитов статистически достоверно изменяются под влиянием активации или ингибирования элементов молекулярных сигнальных каскадов клеток (рецепторов, ферментов и ионных каналов).
-
2. Наиболее существенные изменения деформируемости эритроцитов наблюдаются в условиях активизации аденилатциклазного сигнального пути, поскольку при активации его элементов были получены наибольшие изменения деформируемости эритроцитов. Так, стимулирование бета-адренорецепторов изопротеренолом сопровождалось приростом деформируемости на 19 %, активации аденилатциклазы форсколином – на 17 %, ингибирования активности фосфодиэстераз цилостазолом – на 14 %.
-
3. Что касается агрегации эритроцитов, то она также существенно снижалась при активации указанного выше молекулярного сигнального пути, а повышение агрегации эритроцитов связано с поступлением Са2+ в эритроциты через соответствующие мембранные каналы.
Благодарности
Работа выполнена при поддержке РФФИ, грант № 14-04-01703-а, и гранта № 243 Минобрнауки.
Список литературы Микромеханические ответы эритроцитов человека на стимулирование мембранных рецепторов, ионных каналов и ферментов
- Муравьев А.В., Тихомирова И.А., Булаева С.В., Вдовин В.А., Муравьев А.А. Исследование роли отдельных реологических характеристик крови в изменении ее текучести и транспортного потенциала//Российский журнал биомеханики. -2012. -Т. 16, № 3. -С. 32-41.
- Муравьев А.В., Тихомирова И.А., Маймистова А.А., Михайлов П.В., Муравьев А.А. Роль микрореологических свойств эритроцитов в неньютоновском поведении цельной крови//Российский журнал биомеханики. -2010. -Т. 14, № 4. -С. 96-104.
- Anderson J.P., Morrow J.S. The interaction of calmodulin with human erythrocyte spectrin. Inhibition of protein 4.1-stimulated actin binding//J. Biol. Chem. -1987. -Vol. 262, № 13. -P. 6365-6372.
- Boivin P., Garbarz M., Dhermy D., Galand C. In vitro phosphorylation of the red blood cell cytoskeleton complex by cyclic AMP-dependent protein kinase from erythrocyte membrane//Biochim. Biophys. Acta. -1981. -Vol. 647, № 1. -P. 1-6 DOI: 10.1016/0005-2736(81)90289-3
- Bree F., Gault I., d’Athis P., Tillement J.P. Beta adrenoceptors of human red cells, determination of their subtypes//Biochem. Pharmacol. -1984. -Vol. 33, № 24. -P. 4045-4050 DOI: 10.1016/0006-2952(84)90019-4
- Chien S., Sung L.P. Molecular basis of red cell membrane rheology. Part 1//Biorheology. -1990. -Vol. 27. -P. 327-344.
- De Franceschi L., Rivera A., Fleming M.D., Honczarenko M., Peters L.L., Gascard P., Mohandas N., Brugnara C. Evidence for a protective role of the Gardos channel against hemolysis in murine spherocytosis//Blood. -2005. -Vol. 106, № 4. -P. 1454-1459 DOI: 10.1182/blood-2005-01-0368
- Eder P.S., Soong C.J., Tao M. Phosphorylation reduces the affinity of protein 4.1 for spectrin//Biochemistry. -1986. -Vol. 25, № 7. -P. 1764-1770 DOI: 10.1021/bi00355a047
- Govekar R.B., Zingde S.M. Protein kinase C isoforms in human erythrocytes//Ann. Hematol. -2001. -Vol. 80, № 9. -P. 531-534 DOI: 10.1007/s002770100352
- Hanson M.S., Stephenson A.H., Bowles E.A., Sprague R.S. Insulin inhibits human erythrocyte cAMP accumulation and ATP release: role of phosphodiesterase 3 and phosphoinositide 3-kinase//Exp. Biol. Med. -2010. -Vol. 235, № 2. -P. 256-262 DOI: 10.1258/ebm.2009.009206
- Horga J.F., Gisbert J., De Agustin J.C. A beta-2-adrenergic receptor activates adenilate cyclase in human erythrocyte membranes at physiological calcium plasma concentrations//Blood Cells, Molecules and Diseases. -2000. -Vol. 26, № 3. -P. 223-228 DOI: 10.1006/bcmd.2000.0299
- Kaiserova K., Lakatos B., Peterajova E., Orlicky J., Varecka L. Investigation of properties of the Ca2+ influx and of the Ca2+-activated K+ efflux (Gardos effect) in vanadate-treated and ATP-depleted human red blood cells//Gen. Physiol. Biophys. -2002. -Vol. 21, № 4. -P. 429-442.
- Lang F., Birka C., Myssina S., Lang K.S., Lang P.A., Tanneur V., Duranton C., Wieder T., Huber S.M. Erythrocyte ion channels in regulation of apoptosis//Adv. Exp. Med. Biol. -2004. -Vol. 559. -P. 211-217.
- Ling E., Danilov Y.N., Cohen C.M. Modulation of red cell band 4.1 function by cAMP-dependent kinase and protein kinase C phosphorylation//J. Biol. Chem. -1988. -Vol. 263, № 5. -P. 2209-2216.
- Manno S., Takakuwa Y., Mohandas N. Modulation of erythrocyte membrane mechanical function by protein 4.1 phosphorylation//J. Biol. Chem. -2005. -Vol. 280, № 9. -P. 7581-7587 DOI: 10.1074/jbc.M410650200
- Minetti G., Ciana A., Balduini C. Differential sorting of tyrosine kinases and phosphotyrosine phosphatases acting on band 3 during vesiculation of human erythrocytes//Biochem. J. -2004. -Vol. 377, № 2. -P. 489-497 DOI: 10.1042/bj20031401
- Morris S.A., Bilezikian J.P. Evidence that forskolin activates turkey erythrocyte adenylate cyclase through a noncatalytic site//Arch. Biochem. Biophys. -1983. -Vol. 220, № 2. -P. 628-636 DOI: 10.1016/0003-9861(83)90456-3
- Muravyov A.V., Tikhomirova I.A. Role molecular signaling pathways in changes of red blood cell deformability//Clin. Hemorheol. Microcirc. -2013. -Vol. 53, № 1-2. -P. 45-59 DOI: 10.3233/CH-2012-1575
- Nash G.B. Red cell mechanics: what changes are needed to adversely affect in vivo circulation//Biorheology. -1991. -Vol. 28. -P. 231-239.
- Nunomura W., Takakuwa Y., Parra M., Conboy J., Mohandas N. Regulation of protein 4.1R, p55, and glycophorin C ternary complex in human erythrocyte membrane//J. Biol. Chem. -2000. -Vol. 275, № 32. -P. 24540-24546 DOI: 10.1074/jbc.M002492200
- Nunomura W., Takakuwa Y. Regulation of protein 4.1R interactions with membrane proteins by Ca2+ and calmodulin//Front. Biosci. -2006. -Vol. 11, № 2. -P. 1522-1539. DOI: 10.2741/1901.
- Oonishi T., Sakashita K., Uysaka N. Regulation of red blood cell filterability by Ca2+ inflax and cAMP-mediated signaling pathways//Am. J. Physiol. -1997. -Vol. 273, № 6. -P. 1828-1834.
- Romero P.J., Romero E.A. New vanadate-induced Ca2+ pathway in human red cells//Cell Biol. Int. -2003. -Vol. 27, № 11. -P. 903-912 DOI: 10.1016/j.cellbi.2003.07.002
- Sager G., Jacobsen S. Effect of plasma on human erythrocyte beta-adrenergic receptors//Biochem. Pharmacol. -1985. -Vol. 34, № 20. -P. 3767-3771 DOI: 10.1016/0006-2952(84)90019-4
- Sundquist J., Blas S., Hogan J.E., Davis F.B., Davis P.J. The alpha 1-adrenergic receptor in human erythrocyte membranes mediated interaction in vitro of epinephrine and thyroid hormone at the membrane Ca(2+)-ATPase//Cell. Signal. -1992. -Vol. 4, № 6. -P. 795-799 DOI: 10.1016/0898-6568(92)90060-L
- Takakuwa Y., Mohandas N., Ishibashi T. Regulation of red cell membrane deformability and stability by skeletal protein network//Biorheology. -1990. -Vol. 27. -P. 357-365.
- Xiao R.P., Avdonin P., Zhou Y.Y., Cheng H., Akhter S.A., Eschenhagen T., Lefkowitz R.J., Koch W.J., Lakatta E.G. Coupling of beta-2-adrenoceptor to Gi proteins and its physiological relevance in murine cardiac myocytes//Circulation Res. -1999. -Vol. 84, № 1. -P. 43-52 DOI: 10.1161/01.RES.84.1.43


