Миокардиальный мышечный мостик: осложнения и лечение (клинический случай)
Автор: Андреев Сергей Леонидович, Шипулин Владимир Митрофанович, Александрова Екатерина Александровна, Гуля Марина Олеговна
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: В помощь практическому врачу
Статья в выпуске: 3 т.29, 2014 года.
Бесплатный доступ
Представлен клинический случай диагностики, лечения и динамического наблюдения мышечного мостика передней нисходящей артерии у пациента молодого возраста. Показано и обсуждено развитие осложнений заболевания с дальнейшим успешным хирургическим лечением.
Миокардиальный мышечный мостик, ишемическая болезнь сердца, постинфарктное ремоделирование левого желудочка, резекция аневризмы левого желудочка
Короткий адрес: https://sciup.org/14919973
IDR: 14919973 | УДК: 616.13-089
Текст научной статьи Миокардиальный мышечный мостик: осложнения и лечение (клинический случай)
Миокардиальными мышечными мостиками (ММ) называется одна из самых распространенных врожденных патологий коронарных артерий (КА), при которой сосуд частично локализуется в толще миокарда, а не непосредственно под эпикардом. Типичное расположение – средняя треть передней нисходящей артерии (ПНА). Эта врожденная аномалия ассоциируется с ишемией миокарда, нарушением проводимости, инфарктом миокарда и внезапной смертью [11].
Патофизиологически ММ характеризуется наружным сжатием сосуда в фазу систолы с уменьшением или полным прекращением антероградного кровотока в систолу и даже возникновением ретроградного тока крови. Кроме того, в связи с затрудненным или ретроградным кровотоком в указанном сегменте участок КА, сдавливаемый ММ, более склонен к эндотелиальной дисфункции, атеросклерозу и тромбозу [5].
По распространенности ММ в миокарде присутствуют практически у трети взрослых людей, хотя далеко не все из них настолько выражены, что могут оказывать влияние на клиническое состояние больного и проявляться симптомами нарушения перфузии сердца [11]. Гемодинамически значимые ММ во время коронарографии обнаруживаются у 0,5–4,9% больных [4].
В случае клинической значимости ММ больным показано лечение препаратами с отрицательными ино- и хронотропным эффектами, такими как β -адреноблока-торы или антагонисты кальциевых каналов, либо их комбинацией. В случаях, рефрактерных к фармакотерапии, используется чрескожное коронарное вмешательство (стентирование данного сегмента артерии) или аортокоронарное шунтирование. Возможно проведение миотомии (рассечение “мостика”). В случае возникновения осложнений (нарушения ритма, аневризмы левого желудочка) – симптоматическое лечение [4, 6].
Цель исследования: представить клинический случай диагностики ММ у пациента молодого возраста с осложненным течением и определить последующую тактику его лечения.
Результаты
Пациент К., 23 лет, поступил в отделение сердечнососудистой хирургии ФГБУ “НИИ кардиологии” СО РАМН в апреле 2013 г. с основным диагнозом – ишемическая болезнь сердца (ИБС): стенокардия напряжения II функционального класса. Постинфарктный кардиосклероз (23.09.2011 г.). Хроническая аневризма верхушки левого желудочка (ЛЖ), передней стенки и межжелудочковой перегородки. Пристеночный тромб ЛЖ. Желудочковая экстрасистолия 4а градации по Lown. Хроническая сердечная недостаточность IIА стадии, I функционального класса по Нью-Йоркской классификации. Предъявлял жалобы на боли в области сердца при значительной физической нагрузке с одышкой, снижение трудоспособности.
Из анамнеза выяснено, что 23.09.2011 г. больной на фоне интенсивной физической нагрузки почувствовал жгучие, нестерпимые боли в области сердца. По скорой медицинской помощи был доставлен в кардиологичес- кий стационар, где по данным электрокардиограммы зафиксирован острый крупноочаговый передне-перегородочный инфаркт миокарда. Проводилась специализированная антиангинальная, тромболитическая и антикоагулянтная терапия. Выполнено ультразвуковое исследование сердца, где отмечено, что фракция выброса (ФВ) ЛЖ не снижена, полости сердца не расширены; в области верхушки левого желудочка и передне-перегородочного сегмента участки а- и гипокинезии, картина формирующейся аневризмы верхушки ЛЖ. Выполнено коро-нарографическое исследование, где установлено наличие мышечного мостика в средней трети передней нисходящей артерии со стенозом во время систолы до 60–70% (рис. 1). После курса консервативного стационарного лечения пациент был выписан с рекомендациями к приему β-блокаторов, антагонистов кальция и антиагреган-тов.
После госпитализации в апреле 2013 г. пациенту в стационаре выполнили ультразвуковое исследование сердца, было дано заключение – выраженная дилатация ЛЖ: конечный диастолический объем (КДО) 163 мл, размеры других камер в норме. Мышечно-фиброзная аневризма верхушки ЛЖ и прилежащих к ней части передних отделов межжелудочковой и передней стенки ЛЖ объемом 56 мл; стенка аневризмы значительно истончена (до 2,5– 3 мм) в передних и боковых отделах верхушки, меньше – в других отделах; в передних отделах МЖП зоны истончения перемежаются с зонами с относительно сохраненной толщиной миокарда. Гипокинез задних отделов МЖП. Пристеночный тромб 42x58x10 мм, выстилающий полость аневризмы в области верхушки ЛЖ. ФВ ЛЖ умеренно снижена (по Симпсону 36%). Замедление расслабления ЛЖ. Структура и функция клапанов не нарушена.
Повторно выполнена коронарография, на фоне медикаментозной терапии наличие гемодинамически значимых стенозов не выявлено.
В мае 2013 г. пациенту выполнено оперативное лечение в объеме резекции аневризмы ЛЖ с реконструкцией по Мениканти и тромбэндокардэктомия из ЛЖ. Размер тромба, измеренный интраоперационно, составил 45*60*12 мм (рис. 2). Состояние пациента в послеоперационном периоде стабильное, лечение плановое.
В дальнейшем пациент проходил контрольные обследования после операции в сроки через 2 недели, 6 мес. и 12 мес. За время наблюдения пациент отмечал стабильное состояние, стенокардию напряжения на уровне I–II функционального класса, периодические перебои в работе сердца. Продолжал получать консервативное лечение в виде β -блокаторов, антагонистов кальция, антиаг-
Таблица 1
Динамика эхокардиографических показателей пациента К.
|
Показатели |
До операции |
2 недели |
6 мес. |
12 мес. |
|
КДО, мл |
163 |
128 |
120 |
118 |
|
КДИ |
83,7 |
65,7 |
61,6 |
60,6 |
|
КСИ |
53,4 |
38 |
34,9 |
35,4 |
|
ФВ ЛЖ, % |
36 |
42 |
43 |
42 |
|
Ударный объем, мл |
59 |
54 |
52 |
49 |
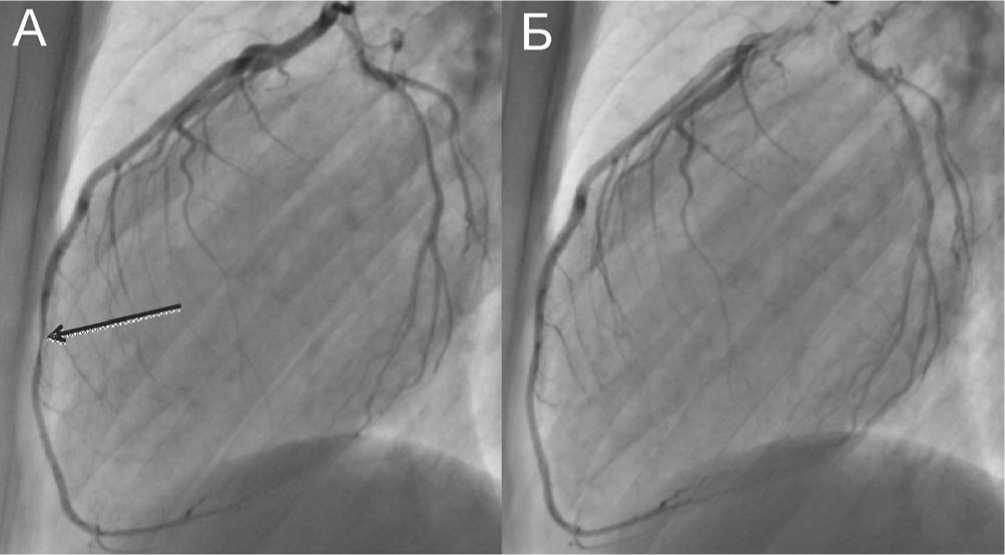
Рис. 1. Коронарография пациента К. А – фаза систолы. Стрелкой показан ММ в средней трети ПНА с гемодинамически значимым сужением. Б – фаза диастолы. Стеноз в ПНА не отмечен
регантов и антиаритмических средств. Пациенту выполнялись общеклинические исследования, магнитно-резонансная томография сердца с контрастированием полостей сердца, спировелоэргометрия с определением объема потребления кислорода на кг массы тела в минуту и сцинтиграфия миокарда с 99мТС-Технетрилом.
При спировелоэргометрии с подсчетом объема потребления кислорода на кг массы тела в минуту до операции отмечен показатель 16,3, через 6 мес. результат вырос до 18,2 и оставался на прежнем уровне через 12 мес. – 18,0.
Отмечено снижение дефекта перфузии миокарда ЛЖ по данным сцинтиграфии с 40 до 32% до операции и через 12 мес. после нее.
Касательно эхокардиографической динамики отмечалось постепенное увеличение ФВ с сокращением объемов ЛЖ. Динамика изменений эхокардиографических показателей пациента К. приведена в таблице 1.
Обсуждение
Патология КА в виде ММ, по данным различных авторов, варьируется достаточно широко – в зарубежной литературе частота их выявления, по материалам вскрытий, – от 5,4 до 85,7% [12].
Тем не менее, несмотря на довольно частую встречаемость, в большинстве случаев ММ клинически не проявляются и не приводят к каким-либо осложнениям. Так, в 1995 г. Y. Juillieri и соавт. [9] изучили отдаленные результаты у 28 больных с ММ на коронарограмме, что составило 0,82% от всех исследований, выполненных за 8-летний период. Пациенты были разделены на 2 группы в зависимости от степени систолического сужения до и более 50%. Через 11 лет ни у одного из пациентов не воз- никло инфаркта миокарда. 71% пациентов 1-й группы и половина больных 2-й группы (степень сужения более 50%) чувствовали себя удовлетворительно. Однако 70% пациентов 2-й группы имели клинические симптомы стенокардии, в связи с чем требовался прием антиангиналь-ных препаратов.
По данным испанских авторов I. Lozano и соавт. [10], в течение 4 лет были прослежены 35 больных с ММ без ИБС. Все пациенты имели хороший отдаленный прогноз, однако большей половине из них из-за наличия атипичного болевого синдрома была необходима регулярная терапия β -блокаторами или антагонистами кальция.
Стоит отметить, что нитроглицерин не используется для лечения данной группы больных, он увеличивает степень систолического сужения артерии в области мостика, а нагрузка жидкостью, напротив, увеличивает сопротивление сосудов к компрессии и уменьшает ишемию. Следовательно, классические антиангинальные подходы в случае ишемии, обусловленной интрамуральным прохождением коронарной артерии, не только неэффективны, но и могут усугубить нарушения перфузии миокарда [11]. Таким больным показано лечение препаратами с отрицательными ино- и хронотропным эффектами, такими как β -адреноблокаторы или антагонисты кальциевых каналов, либо их комбинацией [7]. Антиишемичес-кое действие этих препаратов определяется снижением потребности миокарда в кислороде, уменьшением внут-римиокардиального давления и экстрасосудистой коронарной сопротивляемости.
Кроме того, педиатры и кардиологи должны помнить, что ишемия миокарда, инфаркт, внезапная сердечная смерть у детей, подростков и молодых людей очень редко вызываются атеросклерозом и тромбозом сосудов; зачастую причиной такой патологии в детском и юном воз- расте становятся аномалии коронарных артерий, в том числе и их интрамуральное расположение [1].
В случаях, рефрактерных к фармакотерапии, используется чрескожное коронарное вмешательство (стентирование данного сегмента артерии) или аортокоронарное шунтирование. Ранее широко использовалось проведение миотомии в виде рассечения “мостика”, но, по данным современной литературы, к данному способу прибегают все реже из-за невысокой эффективности и травматизации миокарда [2]. При развитии осложнений проводится симптоматическое лечение [3].
Представленный клинический пример является во многом показательным, манифестация патологии проявилась у пациента в виде острого инфаркта миокарда в возрасте 21 года. Не менее типично расположение ММ со стенозом до 70% в средней трети ПНА по данным коронарографии. Несмотря на консервативное лечение, заболевание осложнилось возникновением аневризмы верхушки ЛЖ и тромбозом полости ЛЖ, возникновением частой экстрасистолии. При повторной коронарографии через 1,5 года после острого инфаркта миокарда значимых стенозов КА выявлено не было, это может быть объяснено медикаментозной терапией (провокационные пробы во время исследования не проводились) и выраженным снижением сократимости миокарда ЛЖ в бассейне ПНА в виде гипо- и акинезии, что, очевидно, привело к снижению давления ММ на стенку артерии.
Хирургическая тактика была обусловлена необходимостью удаления тромба ЛЖ и борьбы с постинфарктным ремоделированием ЛЖ в виде реконструкции его в модификации Мениканти. Послеоперационный период наблюдения в течение 12 мес. показал эффективность хирургического лечения, что отобразилось на инструментальных показателях работы сердца.
Таким образом, наличие ММ является важным фактором возникновения ИБС и возможных осложнений, особенно у пациентов молодого возраста. Знания о данной патологии и использование в дифференциальной диагностике является необходимым в практике кардиологов и педиатров.
Список литературы Миокардиальный мышечный мостик: осложнения и лечение (клинический случай)
- Белозеров Ю.М. Инфаркт миокарда у детей//Российский вестник перинатологии и педиатрии. -1996. -№ 3. -С. 36-40.
- Бокерия Л.А., Суханов С.Г., Стерник Л.И., Шатахян М.П. Миокардиальные мостики. -М.: НЦССХ им. А.Н. Бакулева РАМН, 2013. -158 с.
- Карташева А. Мышечные мостики миокарда//Medicine review. -2008. -Т. 1(01). -С. 60-61.
- Мазур Н.А. Факторы риска внезапной кардиальной смерти у больных молодого возраста и меры по профилактике//Рус. мед. журнал. -2003. -Т. 11, № 19. -С. 1077-1079.
- Berry J.F., von Mering G.O., Schmalfuss C. et al. Systolic compression of the left anterior descending coronary artery: a case series, review of the literature, and therapeutic options including stenting//Cath. Cardiovasc. Intervent. -2002. -Vol. 56. -P. 58-63.
- Bose D., Philipp S. High-Resolution Imaging of Myocardial Bridging//New England Journal of Medicine. -2008. -Vol. 4. -P. 358-392.
- Elyonassi B., Kendoussi M., Khatouri A. et al. Muscle bridge and myocardial ischemia. Study of 6 cases//Ann. Cardiol. Angiol. -1998. -Vol. 47, No. 7. -P. 459-463.
- Hongo Y., Tada H., Ito K. et al. Augmentation of vessel squeezing at coronary myocardial bridge by nitroglycerin: study by quantitative coronary angiography and intravascular ultrasound//Am. Heart J. -1999. -Vol. 138, No. 2. -P. 345-350.
- Juilliere Y., Berder V., Suty-Selton C. et al. Isolated myocardial bridges with angiographic milking of the left anterior descending coronary artery: a long-term follow-up study//Am. Heart J. -1995. -Vol. 129, No. 4. -P. 663-665.
- Lozano I., Baz J.A., Lopez-Palop R. et al. Long-term prognosis of patients with myocardial bridge and angiographic milking of the left anterior descending coronary artery//Rev. Esp. Cardiol. -2002. -Vol. 55, No. 4. -P. 359-364.
- Mohlenkamp S., Hort W., Ge J., Erbel R. Update on Myocardial Bridging//Circulation. -2002. -Vol. 106. -P. 2616-2622.
- Venkateushu K.V., Mysorekar V.R., Sanikop M.B. Myocardial bridges//J. Indian Med. Ass. -2000. -Vol. 98, No. 11. -P. 691-693.


