Множественная фиброаденома молочной железы в сочетании с аномалией развития внутренних половых органов у девочки-подростка (клинический случай)
Автор: Федюшина А.О., Трушина О.В., Хворостухина Н.Ф., Новичков Д.А., Покалицина Ю.А., Суханов С.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Акушерство и гинекология
Статья в выпуске: 1 т.17, 2021 года.
Бесплатный доступ
Фиброаденома — наиболее частое доброкачественное новообразование молочных желез. В большинстве случаев опухоль встречается в виде единичных узлов, диаметр которых не превышает Зсм. Описан клинический случай множественной фиброаденомы молочной железы больших размеров у девочки-подростка в сочетании с аномалией развития внутренних половых органов. Представленное наблюдение акцентируют внимание на важном аспекте ювенильной маммологии и показывает целесообразность динамического наблюдения за ростом и развитием молочных желез в детском и подростковом возрастах, что позволит не допустить случаев поздней диагностики иногда столь очевидных заболеваний.
Фиброаденома, подростки, молочные железы, дети, аномалия развития половых органов
Короткий адрес: https://sciup.org/149134973
IDR: 149134973 | УДК: 618.19
Текст научной статьи Множественная фиброаденома молочной железы в сочетании с аномалией развития внутренних половых органов у девочки-подростка (клинический случай)
возрастах. Многие аспекты проблемы ювенильной маммологии — от терминологии до диагностического и лечебного алгоритмов — остаются предметом активных дискуссий [1]. М. Л. Травиной и соавт. предложена клинико-морфологическая классификационная система, в которой выделены четыре варианта оценки состояния молочных желез у детей и подрост- ков [2]. В первую группу авторы включили физиологические состояния молочных желез, соответствующие возрастным нормам развития. Вторая группа — это временные отклонения от нормального развития молочных желез, которые носят преходящий характер и не провоцируют стойких патологических изменений в маммарной ткани. В третью группу внесены патологические процессы, сопровождаемые структурными изменениями в маммарной ткани — фибрознокистозная мастопатия, новообразования, масталгия и мастодиния, воспалительное поражение, внутрипротоковая патология. Четвертая группа — это пороки развития (дисморфии) молочных желез.
В структуре доброкачественных новообразований молочных желез, в том числе в подростковом возрасте, особое место занимает фиброаденома [3, 4]. Фиброаденома молочных желез (ФМЖ) представляет собой доброкачественную опухоль из стромальной и эпителиальной (протоковой) тканей. Этиология ФМЖ до настоящего времени остается предметом научных дискуссий. Ключевую роль отводят влиянию половых стероидных гормонов, в первую очередь гиперэстрогенной стимуляции.
Морфологически ФМЖ не имеют истинной капсулы, представлены пролиферацией эпителиальных и стромальных элементов терминальной протоково-дольчатой единицы, гистологически различаются по пролиферации пери- или интраканаликулярной стром. Размер узлов ФМЖ обычно не превышает 3 см. В случае если размер узлов превышает 5 см (или имеют массу более 500,0 граммов, или замещают 80% ткани молочной железы), то используют термин «гигантские» [5]. В то же время G. Doğan и соавт. представлены случаи спонтанного регресса новообразований в подростковом возрасте на 10-15% наблюдений [6].
Наряду с классическими ФМЖ предложено выделять гистологический подтип — ювенильную (клеточную) фиброаденому, характеризующуюся быстрым ростом и способностью достигать больших размеров. Например, S. Islam и соавт. представили клиническое наблюдение ювенильной ФМЖ у 16-летней девочки с размерами узла 28×25 см [7]. Морфологическими особенностями ювенильной ФМЖ являются более выраженная, чем у классической фиброаденомы, эпителиальная и стромальная гиперплазия с протоковым, дольчатым или комбинированным протоково-дольчатым рисунком. Ювенильные формы составляют 0,5-2% всех ФМЖ у подростков и могут демонстрировать локальную агрессию, вызывая фиброзный ответ в прилегающих тканях, что приводит к физическому и психологическому дискомфорту и может стать причиной формирования нарушения осанки [7, 8]. N. Rafeek и соавт. сообщили об уникальном случае билатеральных гигантских ювенильных фиброаденом — общая масса удаленных опухолей (21 кг) составила практически половину собственного веса 13-летней пациентки [9]. Чаще всего ФМЖ представлена одиночным узлом и пальпируется в виде эластичного безболезненного образования овальной формы с четкими контурами. Литературные данные указывают, что верхний наружный квадрант молочных желез — это наиболее распространенная локализация ФМЖ, при этом отсутствуют значимые различия в частоте поражения правой и левой молочных желез [5, 8]. В 10-25% случаев наблюдается билатеральное поражение молочных желез [10]. Важными компонентами клинической оценки состояния молочных желез является их визуальный осмотр и пальпаторное исследование, которое должно быть неотъемлемой частью физикального обследования девочек любого возраста [3, 8].
Основным методом визуализации патологии молочных желез у детей и подростков является ультразвуковое исследование, которое демонстрирует высокую информативность и безопасность при многократном применении [11]. Цветовое допплеровское картирование выявляет различную по степени выраженности интранодозную васкуляризацию. Стандартом для описания и разделения поражений молочных желез на категории, коррелирующие с вероятностью злокачественного новообразования, принята лексика системы отчетов и данных визуализации молочной железы — Breast Imaging Reporting and Data Systemlexicon (BI-RADS). Однако в настоящее время валидность этой системы у подростков остается предметом дискуссий [12].
Согласно позиции большинства авторов, опубликованные стратегии ведения юных пациенток с новообразованиями молочных желез демонстрируют сходство с алгоритмом ведения категории 3 BI-RADS для взрослых, но различаются с точки зрения включения размера опухоли в показания для хирургического лечения [13]. Следует отметить, что размеры узлов ФМЖ иногда затрудняют их клиническую и сонографическую оценку как дискретного образования. Повысить информативность дифференциации доброкачественного и злокачественного характера образований может использование соноэластографии, позволяющей не только визуализировать, но и измерить эластичности тканей опухоли.
Магнитно-резонансную томографию чаще применяют для уточнения результатов, полученных при ультрасонографии, дифференциации сосудистых поражений от нормальной ткани молочной железы, определения многодольчатых поражений [1, 14]. Вместе с тем возрастные особенности молочных желез, характеризующиеся преобладанием фиброгландулярной ткани по отношению к жировой, и потенциальное неблагоприятное действие на чувствительную маммарную ткань ионизирующего излучения ограничивают использование у детей и подростков маммографии — стандартного скринингового метода диагностики патологии молочных желез у взрослых [8, 14]. Компьютерная томография также не нашла широкого применения в педиатрической практике для первичной оценки новообразований молочных желез, но патологические изменения в маммарной ткани могут быть случайно обнаружены на томограммах, полученных по другим показаниям.
Важным моментом остается и тот факт, что схожие с фиброаденомами вариабельные пальпаторные и ультрасонографически выявляемые признаки имеют и другие новообразования молочных желез. Это, в свою очередь, ограничивает возможности до-морфологической верификации опухоли.
Подходы к тактике ведения девочек с новообразованиями молочных желез остаются проблематичными. В научной литературе представлена ограниченная информация о критериях мониторинга и показаниях к хирургическому вмешательству [8, 13]. Существует мнение о том, что с учетом редкости злокачественных морфологических вариантов новообразований молочных желез у юных пациенток, потенциальной хирургической травмы, наносимой развивающейся маммарной ткани и указаниям о возможном спонтанном регрессе опухолей, при типичных клинических и ультрасонографических признаках ФМЖ целесообразно выбрать тактику динамическо- го наблюдения [15], с одной стороны. С другой стороны, гарантированное исключение злокачественных форм до морфологической верификации невозможно. Кроме того, наличие патологии молочных желез — это тревожное событие как для юной пациентки, так и для семьи, провоцирующее психологические проблемы [16, 17]. Цитологическое исследование материала, полученного при тонкоигольной аспирации или биопсии стержневой иглой, может дать дополнительную информацию для характеристики образования (доброкачественного или злокачественного), но данный метод существенно уступает в информативности эксцизионной биопсии [18]. Наряду с этим, с точки зрения большинства исследователей, своевременно выполненное хирургическое вмешательство позволяет добиться более благоприятного эстетического эффекта и снижает психосоциальную коморбидность, тогда как наличие гигантских или многоузловых опухолей может потребовать проведения мастэктомии и последующей реконструктивно-пластической коррекции [4, 19].
Описание клинического случая . На публикацию представляемых данных из истории болезни получено добровольное информированное согласие пациентки.
Пациентка в возрасте 16 лет обратилась в клинику в плановом порядке с жалобами на случайно выявленное при самообследовании безболезненное уплотнение в левой молочной железе, которое за четыре месяца увеличилось в размере. Девочка-подросток с неотягощенным перинатальным анамнезом. В раннем детстве перенесла ветряную оспу, редкие респираторные заболевания. Страдает дискинезией желчевыводящих путей на фоне аномалии развития желчного пузыря и миопией слабой степени. Наследственность по патологии органов репродуктивной системы, эндокринопатиям, онкологическим заболеваниям по линии матери и отца не отягощена. По данным гинекологического анамнеза установлено физиологическое течение пубертата. В течение года после менархе (в возрасте 11 лет) установился менструальный цикл продолжительностью от 26 до 29 дней. Менструации до семи дней, субъективно оцениваемые как умеренные и безболезненные. Масталгию не отмечает. До настоящего обращения инструментального обследования органов репродуктивной системы не проходила. Состояние пациентки при поступлении в клинику удовлетворительное. По результатам соматоскопии отмечено среднее гармоничное физическое развитие (рост 168 см; SDS роста +0,76; масса тела 51 кг; ИМТ 18,11 кг/м2; SDS ИМТ –0,56). При осмотре на коже спины и верхних конечностей выявлены множественные пигментные невусы без визуальных признаков активности. Молочные железы визуально с умеренно выраженной асимметрией (sin>dex), кожа не изменена, но с более выраженной венозной сетью слева (рис. 1).
В правой молочной железе объемные образования не пальпируются. В левой молочной железе при пальпации обнаружено несколько плотных безболезненных образований округлой формы с четкими контурами, не спаянных с окружающими тканями — в верхневнутреннем квадранте размерами 5,0×4,0 см и 2,0×3,0 см, в верхненаружном квадранте — 5,0×3,0 см, в нижненаружном квадранте — 5,0×6,0 см и 7,0×4,0 см. С обеих сторон сосково-ареолярные комплексы не изменены, выделений из сосков нет. Надключичные, подключичные и ак-силлярные лимфатические узлы не определяются.
По данным наружного гинекологического осмотра: наружные половые органы изосексуального типа; большие половые губы сформированы правильно, не прикрывают малые половые губы, которые гипертрофированы, асимметричны (dex>sin); клитор нормальных размеров, топография наружного отверстия уретры не изменена; hymen типичной анатомической формы, имеет одно отверстие; слизистая преддверия влагалища розовая, без патологических элементов; выделения из влагалища физиологические.
Пациентке проведено лабораторно-инструментальное обследование в соответствии с действующими стандартами. По данным ультразвукового исследования (аппарат «Samsung Medison Accuvix XG», датчик 7,5 Мгц): в правой молочной железе эхоплотность железисто-стромального комплекса не изменена, млечные протоки диаметром 1,5 мм. В левой молочной железе лоцированы семь гипо-эхогенных образований с четкими контурами диаметром от 2,3 см до 5,7 см и одно многоузловое образование общим размером 7,9×3,2 см, содержащее гиперэхогенные включения диаметром 0,2– 0,3 см и анэхогенные участки диаметром до 0,4 см (рис. 2). При цветовом допплеровском картировании в образованиях зарегистрированы единичные сигналы по периферии.
При проведении трансабдоминального ультразвукового исследования визуализированы два тела мат-
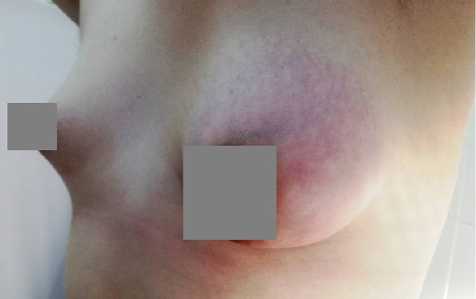
Рис. 1. Асимметрия молочных желез при первичном визуальном осмотре пациентки
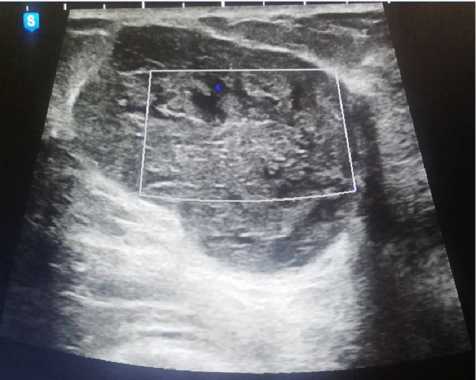
Рис. 2. Структура самого крупного очагового образования в левой молочной железе пациентки (ультрасонография, «Samsung Medison Accuvix XG»)
ки размерами 4,1×2,3×3,4 см и 4,2×2,3×3,8 см и одна шейка матки; структура миометрия не изменена, два М-эхо 0,6 см и 0,7 см на 8-й день менструального цикла; яичники в типичном месте, объем левого 6,7 см3, объем правого 7,1 см3, структура типичная. Вариант впервые диагностированного порока развития внутренних гениталий (двурогая матка) был уточнен данными магнитно-резонансной томографии, проведенной на 8-й день менструального цикла. На серии МР-томограмм, взвешенных по Т1 и Т2 в трех взаимно перпендикулярных плоскостях с подавлением МР-сигнала от жировой ткани с применением DWI ИП установлено: матка расположена в anteflexio , имеет два отклоненных по вертикальной оси рога: правый 5,4×3,0×2,7 см, левый 5,1×2,6×3,1 см, грушевидной формы, с четкими, ровными контурами, сохраненной зональной архитектоникой стенок, однородной структурой миометрия, эндометрий толщиной в правом роге до 1,1 см и до 0,8 см в левом роге, имеет однородный МР-сигнал, контуры на границе с миометрием четкие, ровные; шейка матки размерами 3,6×2,8 см, цервикальный канал не расширен, перегородок не определяется, толщина эндоцервикса 0,4см. Яичники: правый 7,6см3, левый 7,7см3 обычной формы, положения и структуры. Таким образом, получено подтверждение выявленного порока развития внутренних половых органов без нарушения оттока менструальной крови — двурогой матки.
По результатам лабораторного обследования клинически значимых отклонений не выявлено. Клинический анализ крови: WBC 6,89*109/л, RBC 4,05*1012/л, HGB 118 г/л, Ht 37,3%, MCH 29,1 пг, МСНС 316,0 г/л, MCV 92,2 фл, PLT 306 х 109/л, сегментоядерные нейтрофилы 58%, палочкоядерные нейтрофилы 1%, эозинофилы 2%, лимфоциты 34%, моноциты 5%, СОЭ 9 мм/час. Показатели биохимического анализа крови в пределах возрастной нормы: C-реактивный белок менее 6,0 мг/л, общий белок 76,8 г/л, креатинин 82,0 мкмоль/л, мочевина 4,16 ммоль/л, билирубин общий 10,8 мкмоль/л, холестерин 4,13 ммоль/л, HDL 1,3 ммоль/л, LDL 1,74 ммоль/л, триглицериды 1,32 ммоль/л, железо 31,7 мкмоль/л, ферритин 33,3 нг/мл, ЛДГ 342,0 U/l, щелочная фосфотаза 166,0 U/l, АлТ 11,1 U/l, АсТ 18,2 U/l, фосфор неорганический 1,5 ммоль/л. При исследовании системы гемостаза клинически значимых отклонений не выявлено: время свертывания крови по Ли — Уайту 11 мин 06 сек, протромбиновое время 14,7 сек, тромбиновое время 17,9 сек, МНО 1,02, фибринолитическая активность 4 мин 45 сек, РФМК 6,0 мг/%, фибриноген 2,95 г/л, АЧТВ 37,6 сек. Не выявлено повышения уровня фетальных
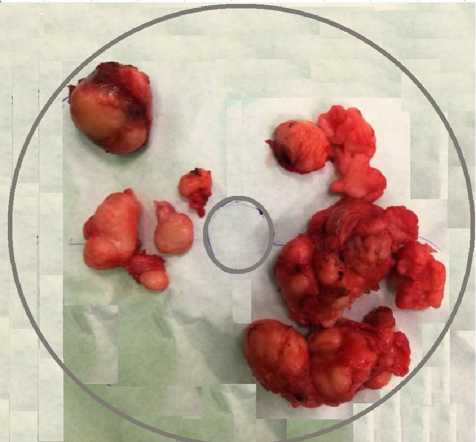
Рис. 3. Множественные узлы фиброаденомы молочной железы (макропрепарат)
онкомаркеров в сыворотке крови (АФП 0,01 МЕ/л; в—ХГЧ 0,01 МЕ/л). При исследовании уровня гормонов в сыворотке крови диагностирован эутиреоз (Т4 св. 12,6 пмоль/л, ТТГ 2,8 мкЕД/мл), функциональная гиперпролактинемия (750 мМЕ/л), нормогонадотро-пинемия и нормоэстрогенемия при исследовании на 5-й день менструального цикла (ФСГ 7,13 мМЕ/мл, ЛГ 5,3 мМЕ/мл, эстрадиол 76,0 пг/мл), нормальный уровень 17-ОН прогестерона (1,57 нг/мл), ДГЭА-С: (2,9 мкмоль/л), общего тестостерона (3,0 нмоль/л), кортизола (7:00 791,0 нмоль/л; 23:00114,0 нмоль/л) и АКТГ (37,7 пг/мл).
Учитывая наличие множественного очагового поражения левой молочной железы у девочки-подростка, в плановом порядке проведено оперативное лечение — энуклеация множественных узловых новообразований левой молочной железы из полуовального разреза, окаймляющего наружный край ареолы. Операция выполнена под интраоперационным ультразвуковым контролем, с интраоперационным экспресс-цитологическим исследованием удаленных тканей. Общая масса удаленных узлов составила 580 г (рис. 3).
Макроскопически узлы имели четкие контуры, на разрезе представлены тканью бледно-сероватого цвета, слегка дольчатого строения, местами с кистозными полостями диаметром 0,2–0,3 см, в одном из узлов — с мелкими кровоизлияниями (рис. 4).
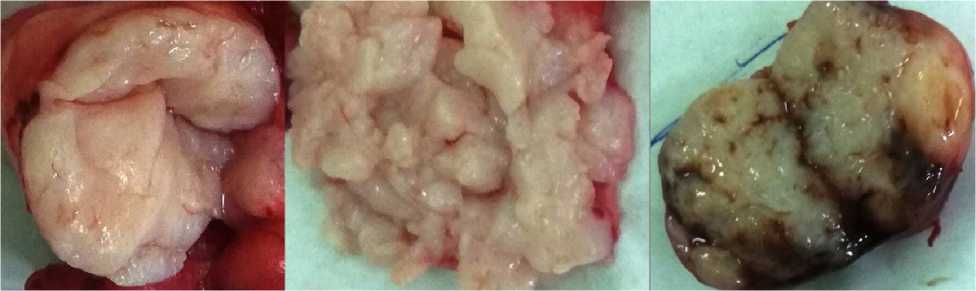
Рис. 4. Структура узлов фиброаденомы (макропрепараты)
При патоморфологическом исследовании во всех удаленных узлах верифицирована интраканалику-лярная форма фиброаденомы — на фоне преобладающей фиброзной ткани редкие щелевидные протоки с внутрипротоковой пролиферацией кубического эпителия. Течение послеоперационного периода — без осложнений. Заживление послеоперационных швов — первичным натяжением.
При катамнестическом наблюдении через три, шесть и девять месяцев после операции у девочки-подростка сохранялся клинически физиологический менструальный цикл, без проявлений дисменореи. Субъективно оцениваемая интенсивность менструальной кровопотери как физиологическая, подтверждена отсутствием гипохромных изменений в анализе крови. Асимметрия молочных желез не прогрессирует, масталгии нет. При динамическом ультрасонографическом контроле через три, шесть и девять месяцев после операции изменений в правой молочной железе не выявлено. В левой молочной железе через три месяца после операции в проекции ложа одного из удаленных узлов фиброаденомы лоцированы два участка средней эхогенности и гипоэхогенным ободком размерами 0,7×0,5 см и 0,9×0,7 см, аваску-лярные при цветовом допплеровском картировании; через шесть месяцев — при цветовом допплеровском картировании аваскулярный гипоэхогенный участок с четкими ровными контурами размерами 0,7×0,7 см; через девять месяцев — позади ареоляр-но-анэхогенные образования размерами 1,1×0,6 см; 0,7×0,5 см и 0,6×0,3 см. Динамическое наблюдение продолжено.
Обсуждение. Представленный клинический случай демонстрирует редкое сочетание множественной фиброаденомы молочной железы и порока развития внутренних половых органов у девочки-подростка. В доступной научной литературе мы не встретили аналогичного варианта коморбидности. Отметим, что у пациентки, несмотря на наличие двурогой матки, отсутствовали клинические проявления дисменореи и субъективные ощущения аномальной менструальной кровопотери. Именно этот факт, на наш взгляд, и стал причиной выявления порока развития половых органов при практически случайном обследовании. Согласно данным литературы, только у 12,2% девочек с ФМЖ имеется сопутствующая менструальная дисфункция и только в 7,3% наблюдений — масталгия [6], что подтверждается сведениями, представленными в нашем клиническом случае. Как известно, клинические проявления патологических изменений молочных желез у подростков разнообразны, среди них наиболее распространенные проявления — увеличение молочных желез, чаще — асимметричное пальпируемое образование имастал-гия [1, 8, 20]. Крайне редко при спонтанном кровоизлиянии в ткани узла возле протока или вовлечении в патологический процесс параареолярной области могут наблюдаться кровяные выделения из сосков. Во время пубертатного периода прогрессирующее увеличение размеров молочных желез часто связано с их естественным развитием, а не с наличием новообразования [8, 20]. Как одну из причин ювенильной агрегированной гипертрофии молочных желез у девочек-подростков рассматривают повышенную чувствительность органа-мишени к половым стероидным гормонам. В каждом третьем случае поводом для обращения за медицинской помощью становится пальпируемое в молочной железе образование [14, 17, 20]. Обстоятельства обнаружения объемных образований в маммарной ткани — важный фактор, который необходимо учитывать при оценке достоинств обучения девочек-подростков процедурам самообследования молочных желез. По данным исследований, до 80,0% новообразований молочных желез подростки обнаруживают самостоятельно [8]. В нашем случае пациентка также обнаружила уплотнение (наиболее крупный из имеющихся узлов) при самообследовании. В представленном нами клиническом случае показанием для хирургического лечения стало одностороннее многоузловое поражение ткани молочной железы, быстрый рост и большие размеры опухоли, что согласуется с существующими требованиями и мнением многих ученых.
Заключение . Представленный клинический случай акцентирует внимание на важном аспекте ювенильной маммологии. Знание основ возрастной маммологии и активная просветительская работа по обучению девочек-подростков навыкам самооб-следования молочных желез должны стать неотъемлемой составляющей врача — акушера-гинеколога и врачей смежных специальностей при работе в рамках амбулаторного приема независимо от причины обращения. Динамическое наблюдение за ростом и развитием молочных желез у девочек отвечает требованиям превентивной медицины, поскольку большинство заболеваний репродуктивной системы манифестируют у взрослых на неблагоприятном пре-морбидном фоне, сформировавшемся в детском и подростковом возрастах. Такой подход позволит своевременно заподозрить патологический процесс и определить маршрутизацию юных пациенток для проведения диагностических и лечебных мероприятий.
Список литературы Множественная фиброаденома молочной железы в сочетании с аномалией развития внутренних половых органов у девочки-подростка (клинический случай)
- Gao Y, Saksena MA, Brachtel EF, et al. How to approach breast lesions in children and adolescents. Eur J Radiol 2015; 84 (7): 1350-64.
- Травина М.Л., Попов А. Г., Попов С.А., Куликова Е.В. Клиническая классификация заболеваний и состояний молочных желез у детей и подростков. Вопросы современной педиатрии 2016; 15 (4): 385-90.
- Elsedfy Н. A clinical approach to benign breast lesions in female adolescents. Acta Biomed 2017; 88 (2): 214-21.
- Knell J, Koning JL, Grabowski JE. Analysis of surgically excised breast masses in 119 pediatric patients. Pediatr Surg Int 2016; 32(1): 93-6.
- Ciftci I, Sekmenli T, Ozbek S, et al. Inframammarial Giant Fibroadenoma Removing and a Nipple-sparing Breast Reconstruction in an Adolescent: A Case Report. Prague Med Rep 2015; 116(2): 161-6.
- Dogan G, Soyer T, Ekinci S, et al. Evaluation of surgically treated breast masses in children. Turk J Pediatr 2017; 59 (2): 177-83.
- Islam S, Saroop S, Bheem V, et al. Largest giant juvenile fibroadenoma of the breast. BMJ Case Rep 2019; 12 (1): e227277.
- Karaayvaz S. Clinical Evaluation of Breast in Childhood. Eur J Breast Health 2019; 15 (3): 137-40.
- Rafeek N, Rangasami R, Dhanraj K, et al. Multimodality approach in the diagnosis and management of bilateral giant juvenile breast fibroadenoma. BMJ Case Rep 2016; 2016: bcr2016217588.
- Laitano FF, Neto FL, Zerwes FP Bilateral giant juvenile fibroadenomas of the breasts-a rare indication for bilateral skin reducing mastectomy. Gland Surg 2016; 5 (4): 435-8.
- Valeur NS, Rahbar H, Chapman T. Ultrasound of pediatric breast masses: what to do with lumps and bumps. Pediatr Radiol 2015; 45 (11): 1584-99; quiz 1581-3.
- Cohen O, Avinadav E, Sharon E, et al. Pediatric and Adolescent Surgical Breast Clinic: Preliminary Experience. J Pediatr Adolesc Gynecol 2020; 33 (1): 23-6.
- Omar L, Gleason MK, Pfeifer CM, et al. Management of palpable pediatric breast masses with ultrasound characteristics of fibroadenoma: a more conservative approach. Am J Roentgenol 2019; 212 (2): 450-5.
- Durmaz E, Oztek MA, Arioz Habibi H, et al. Breast diseases in children: the spectrum of radiologic findings in a cohort study. Diagn Interv Radiol 2017; 23 (6): 407-13.
- McLaughlin CM, Gonzalez-Hernandez J, Bennett M, et al. Pediatric breast masses: an argument for observation. J Surg Res 2018; (228): 247-52.
- Brownstone ND, Celie KB, Spigland NA, et al. Pediatric Breast Fibroadenomas: A Systematic Review and Algorithm for Treatment. Ann Plast Surg 2019; 83 (5): 601-5.
- Michala L, Tsigginou A, Zacharakis D, et al. Breast disorders in girls and adolescents. Is there a need for a specialized service? J Pediatr Adolesc Gynecol 2015; 28 (2): 91-4.
- Shirian S, Daneshbod Y, Haghpanah S, et al. Spectrum of pediatric tumors diagnosed by fine-needle aspiration cytology. Medicine (Baltimore) 2017; 96 (6): e5480.
- Javed A, Jenkins SM, Labow B, et al. Intermediate and long-term outcomes of fibroadenoma excision in adolescent and young adult patients. Breast J 2019; 25 (1): 91-5.
- Harth S, Behrens C, Roller FC, et al. Breast Ultrasonography: Findings in Pediatric Patients. Ultraschall Med 2017; 38 (5): 500-7.


