Моделирование формирования электронного энергетического спектра оксида фосфора Р2O5 на линейных молекулярных моделях
Бесплатный доступ
На молекулярных моделях состава РnO3л+1Нn+2 и SinO3n+1H2n+2 прослежены сходства и различия в формировании электронного энергетического спектра неупорядоченных оксидов Р2O5 и SiO2.
Короткий адрес: https://sciup.org/147158548
IDR: 147158548 | УДК: 541.451-143
Текст научной статьи Моделирование формирования электронного энергетического спектра оксида фосфора Р2O5 на линейных молекулярных моделях
Б. С. Воронцов, И.А. Бабина ~
На молекулярных моделях состава Р„О3л+1Нл+2 и Si„O3„+1H2„+2 прослежены сходства и различия в формировании электронного энергетического спектра неупорядоченных оксидов Р2О5 и SiO2.
Специфика атомарного строения конденсированных веществ находит свое отражение в особенностях их электронной структуры [1]. Основу структуры силикатных и фосфатных стекол составляют тетраэдры SiO^” и РО4-, которые соединяясь через вершины образуют сетку Х-О-Х связей (X = Si,P ). Не смотря на это сходство структурообразования вопрос о возможности формировании совместной сетки из Si-О-Si и Р-О-Р и Si-О-Р-связей в стеклах системы SiO2 - Р2О5 является дискуссионным. Результаты различных исследований этих стекол и интерпретация результатов представлены, например, в работе [2]. В связи с этим представляют интерес вопросы о том, что является общим и что является специфичным для электронной структуры силикатных и фосфатных стекол и как формируется электронный спектр в силикофосфатных стеклах.
Одним из методов теоретического расчета электронной структуры является кластерный метод. В этом методе формирование электронного энергетического спектра прослеживается от минимального фрагмента структуры изучаемого вещества, с последующим его усложнением. Использование данного метода приобретает особое значение в связи с изучением нанообъектов [3], так как позволяет связать параметры электронной структуры с размером модели.
Расчет электронного энергетического спектра щелочно-фосфатных стекол в кластерном приближении был сделан в работе [4]. Полученные в ней количественные совпадения с экспериментом следует отнести к удачному подбору параметров. Собственно это утверждают и сами авторы. Подобное соответствие как систематический результат вряд ли было возможно, так как расчет проводился методом ППДП, в котором использовано наибольшее число дополнительных приближений квантовой химии [5, 6]. Кроме того, расчеты для отрицательно заряженных ионов, как правило, не проводятся, так как редко дают корректные результаты [7, 8]. Так, например, в работе [9], в которой проведены неэмпирические расчеты, использованы модели с граничными атомами водорода. Однако некоторые общие закономерности, связанные с формированием электронного энергетического спектра и состава МО, выявленные в работе [4], заслуживают внимания. По данным цитируемой работы все заполненные МО в моделях [РО4]3 и [Р2О7]4 можно разделить на несколько типов, определяемых разным составом АО. Первая группа наиболее низких по энергии орбиталей состоит преимущественно из s-AO кислорода и фосфора. Далее следуют МО, имеющие связывающий многоцентровый характер, состоящие в равной степени из АО фосфора и кислорода. Наиболее высокоэнергетические заполненные МО формируются в основном из 2рж -АО кислорода и имеют несвязывающий характер. По мере увеличения размеров анионов одноэлектронные МО образуют «квазизоны». При этом наблюдаемые изменения в ширине «квазизон» стремятся к насыщению. Последнее утверждение интересно, но вряд ли можно считать его доказанным в цитируемой статье, ведь наибольший по размеру кластер содержал лишь три атома фосфора.
В настоящее время имеется возможность проведения более систематичных расчетов и более строгими методами, что позволит проверить обоснованность ранее сделанных выводов.
Для проверки реализации выше указанных закономерностей нами изучен процесс формирования энергетического спектра для линейных моделей Р2О5 с граничными атомами водорода, состав которых выражается формулой РйО3й+]Ни+2. В наибольшей по размеру модели содержалось восемь атомов фосфора, при этом общее число атомов в модели равнялось 43, а ее размер достигал 1,2 нм. Расчеты проведены полуэмпирическим методом РМ-3.
По полученным нами данным в энергетическом спектре линейных моделей Р2О5 можно выделить четыре «квазизоны». Три из них заполненные электронами и одна вакантная. Первая заполненная зона лежит в области -38 ч- -34 эВ. Вторая заполненная зона простирается от -23 эВ до -17 эВ. Следующая заполненная зона отделена от предыдущей очень узкой щелью «1 эВ. Она занимает на оси энергий интервал -16ч--11 эВ. Вакантная зона простирается от -0,6 до 6 эВ и может быть поделена на области с низкой и высокой плотностью состояний. Граница областей соответствует ~ 3 эВ. В каждой из зон плотность состояний увеличивается от дна к потолку зоны. С удлинением цепочки плотность состояний увеличивается, при этом незначительно изменяется положение границ зон. Изменения плотности состояний для интервалов -23,1ч--11,1 эВ показаны на диаграммах на рис. 1.
Заголовок диаграммы
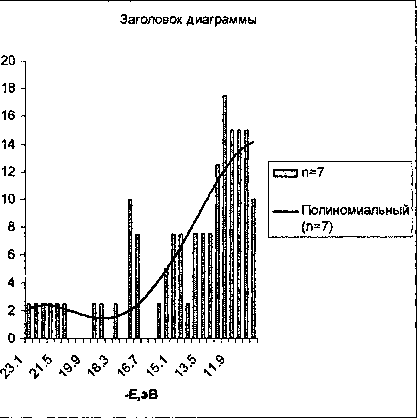
Рис. 1. Гистограммы плотности состояний в валентной квазизоне линейных фрагментов структуры Р2О5 с пятью и семью атомами фосфора (линия тренда - полином 4 степени)

Данные по изменению положения верхних границ заполненных зон приведены в таблице.
Положения верхних границ зон для моделей Р2 О5 разного размера
|
п |
Ер эВ |
Е2, эВ |
Е3,эВ |
Е4 , эВ |
|
2 |
-34,42 |
-17,14 |
-11,05 |
6,17 |
|
3 |
-34,31 |
-17,30 |
-11,03 |
6,12 |
|
4 |
-34,28 |
-17,30 |
-10,93 |
6,33 |
|
5 |
-34,09 |
-16,97 |
-10,85 |
6,37 |
|
6 |
-34,05 |
-16,92 |
-10,81 |
6,47 |
|
7 |
-33,99 |
-16,96 |
-10,74 |
6,52 |
|
8 |
-33,89 |
-16,93 |
-10,66 |
6,56 |
Состав и характер молекулярных орбиталей показаны на рис. 2.
Наиболее низкой заселенной зоне вблизи ее дна соответствуют МО, состоящие в основном из s-орбиталей концевых атомов кислорода, в меньшей степени из s-орбиталей мостиковых ато-
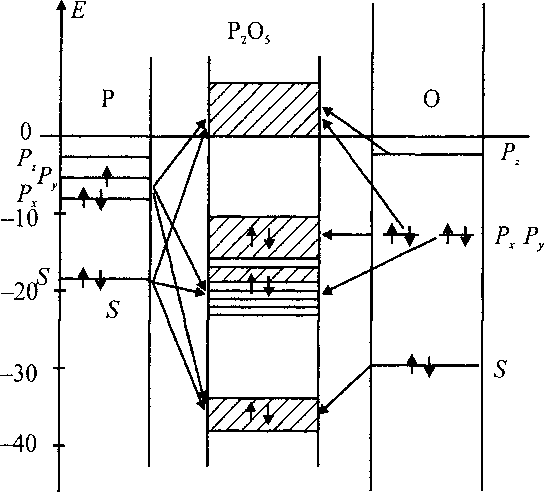
Рис. 2. Схема энергетических зон для моделей Р2О5
мов кислорода и в очень малых количествах из s-орбиталей атомов фосфора. Затем преобладающими становятся s-орбитали мостиковых атомов кислорода, а в самой верхней части s-орбитали атомов кислорода, связанных с фосфором двойной связью. Все эти молекулярные орбитали носят связывающий характер.
Орбитали второй заполненной зоны с низкой плотностью состояний также являются связывающими. У дна этой зоны орбитали состоят в основном из s-орбиталей атомов фосфора и s- и р-орбиталей мостиковых атомов кислорода. Эти многоцентровые орбитали и отвечают за формирование каркаса Р - О - Р -связей. Пример такой орбитали для линейной модели с семью атомами фосфора показана на рис. 3. Состав этой орбитали:
р24 = 0,13S (Р]) + 0,1 \РХ (Р3 ) + 0,1 5РХ (О4) - 0,12РГ (О4) + 0,26S(P5) - 0, 22РХ (О6) -
-0,12Pr(06)-0,24S(P7)-0, 2Рх^ 6) + 0,3S(P23) + 0,21P^(025)-0,21Pz(025)-
-0,32S,(P28) + 0,17Py(030) + 0,2Pz(030) + 0,19S'(P32)
(атомы кислорода с № 2, 4, 6, 16, 25, 30 являются мостиковыми).

Рис. 3. Пример связывающей МО для линейной молекулярной модели Р2О5 с семью атомами фосфора (c24 = -22,599 эВ)
Воронцов Б.С., Бабина И.А.
Далее по энергиям идут орбитали, соответствующие тетраэдрам на основе одного из атомов фосфора. Затем орбитали, ответственные за связь концевых атомов кислорода с каркасом Р - О - Р -связей.
Третья заполненная зона - зона несвязывающих орбиталей. У ее дна МО состоят из не перекрывающихся между собой р-орбиталей атомов кислорода всех типов: мостиковых, концевых, с двойной связью. Выше идут орбитали полностью состоящие из р-орбиталей атомов кислорода, ориентированных преимущественно перпендикулярно линиям связей (пример е12 =-12,84 эВ). У потолка валентной зоны определяющими в составе МО являются р-орбитали атомов кислорода с двойной связью и затем мостиковых атомов кислорода.
Вакантная зона начинается с МО, сформированных из p-АО атомов кислорода всех типов и sp-орбиталей атомов фосфора (в очень малых количествах). Эти орбитали не имеют какого-либо выраженного характера. Далее (область » 2,8 эВ) в составе МО преимущественно p-АО фосфора и sp-орбитали атомов кислорода различного типа. Эти орбитали охватывают отдельные фрагменты цепочки (локализованы в какой-либо области цепочки). Выше в вакантной зоне в составе МО начинают преобладать р-орбитали атомов фосфора. К ним примешаны орбитали концевого кислорода. В самом верху МО, относящиеся к отдельным фрагментам цепочки, состоящие из р-орбиталей атомов фосфора и связанных с ними двойной связью атомов кислорода.
Для оценки влияния оксида модификатора на характер энергетического спектра граничные атомы водорода были заменены на атомы лития. Для этих моделей получены те же закономерности в изменении спектра с размером цепочки. Установлено также, что замена граничных атомов водорода на атомы лития не меняет качественно зонную структуру. Количественные изменения сводятся к следующему. Все зоны сдвигаются вверх * на 2 эВ. Увеличивается ширина разрешенных зон на 0,54-2 эВ. По прежнему, у дна зоны связывающих орбиталей имеется МО соответствующая каркасу Р - О - Р -связей и состоящая, в основном, из 2з-орбиталей атомов фосфора и 2р-орбиталей мостиковых атомов кислорода.
Орбитали атомов лития мало заселены (средняя заселенность «0,12 эВ) и входят, в основном, в состав МО, соответствующих уровням у дна вакантной зоны.
Выше приведенные результаты по электронной структуре Р2О5 - получены полуэмпириче-ским методом РМ-3. С целью оценки их корректности был проведен неэмпирический расчет с базисом STO-3G для моделей с тремя и пятью атомами фосфора. Полученные в этих расчетах результаты в целом качественно согласуются с данными полуэмпирических расчетов.
Для выяснения закономерностей формирования энергетического спектра общих для сеткообразующих оксидов были проведены аналогичные расчеты для линейных моделей SiO2, содержащих от двух до восьми атомов кремния. В энергетическом спектре этих моделей также можно выделить три заполненных зоны, расположенные в интервалах -35,5 4--34 эВ, -17 4--15
эВ и -144--Ю эВ.
С изменением размера кластера (и = 24-8, где п - число атомов Si) качественный вид энергетического спектра не изменяется. Происходят лишь некоторые количественные изменения. Ширина зон вначале увеличивается с ростом п, а затем наступает отмеченное в работе [4] насыщение (рис. 4).
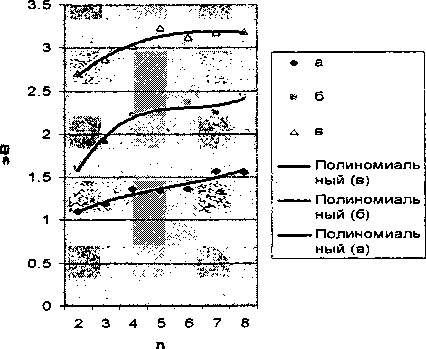
Рис. 4. Зависимость ширины зон от длины цепочки Si„O3n+1H2n+2
Зоны как бы нарастают вверх, что приводит, естественно, к соответствующему уменьшению ширин запрещенных зон.
Запрещенная зона, разделяющая заполненные зоны 2 и 3 очень мала. При усложнении модели внутрь этой зоны попадают отдельные уровни, причем не удается установить какой либо закономерности в их положениях. В связи с этим, при проведении линии тренда на диаграмме плотности состояний эти уровни разма- зывались по всей области, разделяющей зоны 2 и 3, что приводит как бы к слиянию этих зон (рис. 5).
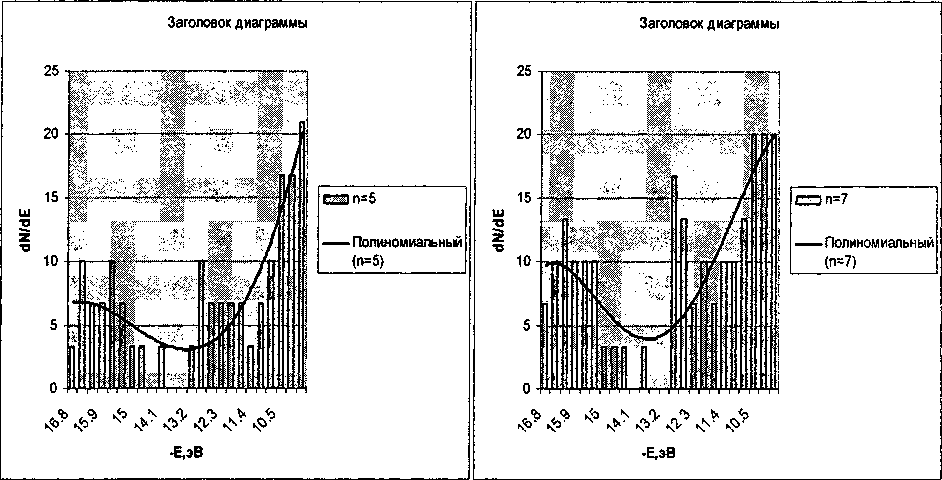
Рис. 5. Диаграммы плотности состояний для моделей Si„O3„+1H2„+2 сл=5ил=7
Из рис. 5 видно, что плотность состояний растет с увеличением длины цепочки. Распределение плотности состояний для SiO2 при малых п иное, чем для Р2О5. Однако уже при п = 1, как видно из сопоставления рис. 1 и 5, форма линия тренда становится сходной.
В составе и характере МО здесь также имеются сходство и отличие от МО моделей Р2О5. Нижняя зона связывающий МО образована в основном s-орбиталями атомов кислорода, атомов кремния и атомов водорода. Заселенность этих кислородных орбиталей составляет в среднем 1,79.
Орбитали в интервале -17 4--15 эВ (вторая заселенная зона) являются слабосвязывающими и состоят в основном из s-орбиталей атомов кремния и р-орбиталей атомов кислорода. По мере продвижения вверх по энергии в этой области вклад в МО от атомов кремния меняется от s к рАО. Однако величина этого вклада мала. Также как для моделей Р2О5 у дна этой зоны имеются орбитали каркаса Si-О-Si -связей. Пример такой орбитали показан на рис. 6. Это самая нижняя орбиталь второй заполненной зоны.

Рис. 6. Нижняя орбиталь связывающей зоны, соответствующая каркасу Si - О - Si -связей
Удовлетворительное соответствие с экспериментом параметров электронной структуры моделей SiO2, А12О3, В2О3 с граничными атомами H,Li,Na, полученных полуэмпирическими методами было показано в ряде работ по расчету рентгеновских спектров [10-12].
Вновь полученные методом РМ-3 результаты также удовлетворительно согласуются с экспериментальными данными по электронной структуре SiO2, которые приведены, например, в работе [13]. Так, по данным фотоэлектронной спектроскопии на пленках SiO2 обнаружены три пика, соответствующие энергиям -20,4; -17,1 и -13,7 эВ ниже уровня вакуума. Пик в районе -20 эВ отнесен к Os орбиталям. Как видно, по нашим расчетам зона этих орбиталей лежит значительно глубже. Два других значения хорошо согласуются с результатами наших расчетов.
Корректность полученных результатов подтверждается также специально проведенным тестовым неэмпирическим расчетом с базисом STO-3G для модели, содержащей три атома кремния. Положение внешних зон в интервалах (—35,8ч-—33 эВ); (—19,3-^-—15 эВ); (-13,1+ -9,2 эВ) хорошо согласуется с полуэмпирическими данными. Следует отметить, что для глубоких уровней расчетные данные при этом удовлетворительно согласуются с экспериментом [10, 13]. Для O1S расчетные и экспериментальные значения 54,7 эВ и 53,2 эВ соответственно; для Si25. 165 и 151 эВ и для Si2p 110 и 103 эВ.
При формировании комбинированной цепочки из тетраэдров Si(OH)4 и РО(ОН)3 число уровней, соответствующих оксиду фосфора в области от -23 до -18 эВ уменьшается и происходит формирование одной общей валентной зоны в области -17,7 +-10 эВ (рис. 7).
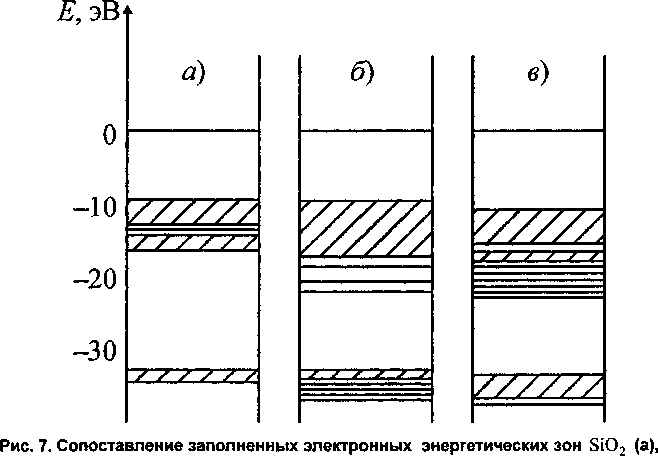
Р2О5 (в) и SiO2 - Р2О5 (6) на примере линейных моделей из шести тетраэдров
Однако при этом не образуется связывающих молекулярных орбиталей, общих для всей цепочки «каркасных» связей, сходных с приведенными на рис. 3 и рис. 6.
Заключение
Проведенные расчеты подтверждают формирование уже для сравнительно небольших фрагментов структуры оксидов сеткообразователей Р2О5 и SiO2 «квазизон» с достаточно очерченными границами. Положение этих «квазизон» для SiO2 удовлетворительно согласуется с экспериментальными данными по положению максимумов плотности электронных состояний. Состав и характер зон для Р2О5 качественно соответствуют данным работы [4].
Для Р2О5 и SiO2 области расположения валентных зон близки. Однако, заполненные зоны для Р2О5 более широкие, чем для SiO2. В зонном спектре SiO2 отсутствует характерная для мо- делей Р2О5 область с низкой плотностью состояний (-23 + -17 эВ). С увеличением размера модели распределения плотности электронных состояний в валентных зонах SiO2 и Р2О5 приобретают сходный характер. Вблизи дна валентных зон для этих моделей имеются связывающие молекулярные орбитали, отвечающие за формирование «каркаса» из Х-О-Х-связей.
При образовании совместных фрагментов структуры из тетраэдра Si(OH)4 и РО(ОН)3 происходит формирование общей валентной зоны, однако при этом не образуется связывающих молекулярных орбиталей, общих для всей цепочки Х-О-Х-связей.
Список литературы Моделирование формирования электронного энергетического спектра оксида фосфора Р2O5 на линейных молекулярных моделях
- Харрисон, У. Электронная структура и свойства твердых тел/У. Харрисон. -М.: Мир, 1983.-Т.2.-381 с.
- Колесов, В.А. Исследование двухкомпонентных силикофосфатных и германофосфатных стекол и кристаллов состава P2O5-SiO2, P2O5-GeO2 методом ИК спектроскопии/В.А. Колесов, А.Е. Мальшиков//ФХС. -1984. -Т. 10, № 6. -С. 641-648.
- Гусев, А.И. Нанокристаллические материалы/А.И. Гусев, А.А. Ремпель. -М.: Физматлит, 2001.-224 с.
- Моделирование электронной структуры щелочных фосфатных стекол/В.П. Палванов, В.К. Слепухин, Б.В. Шульгин и др.//ФХС, 1980. -Т. 6. -№ 6. -С. 658-662.
- Волков, С.В. Квантовая химия координационных конденсированных систем/С.В. Волков, В.А. Засуха. -Киев: Наукова Думка, 1985. -296 с.
- Минкин, В.И. Квантовая химия органических соединений. Механизмы реакций/В.И. Минкин, Б.Я. Симкин, P.M. Миняев. -М.: Химия, 1986. -248 с.
- Дункен, X. Квантовая химия адсорбции на поверхности твердых тел/X. Дункен, В.И. Лыгин. -М.: Мир, 1980. -288 с.
- Спектральное исследование и квантовохимический анализ поверхностных структур и адсорбционных комплексов борсодержащих кремнеземов/В.И. Лыгин, А.Д. Серазетдинов, З.Г. Хлопова и др.//В кн.: Катализ. -М.: Изд-во Московского университета, 1987. -С. 223-246.
- Okura, Т. Molecular orbital Study for short and medium range order of P2O5 glass/T. Okura, N. Aoki, T. J. Kanazava//Of Non-Crystalline Solids. -1987. -V. 95. -P. 427-432. 10.
- Особенности электронного строения силикатов/Ю.П. Диков, И.А. Брытов, Ю.Н. Ромащенко и др. -М.: Наука, 1979. -128 с.
- Бухтояров, О.И. Модельный и натурный рентгеноспектральный эксперимент в исследовании ближнего порядка структуры оксидов/О.И. Бухтояров, Б.С. Воронцов, С.Г. Комогорова//Пленарные доклады XVI Менделеевского съезда по общей и прикладной химии. -М., 1998. -Т. 1.-С. 53-54.
- Усанин, Ю.М. Математическое моделирование рентгеновских спектров в изучении структуры ближнего порядка многокомпонентных оксидов/Ю.М. Усанин, Б.С. Воронцов//Сб. научных трудов «Математическое и программное обеспечение научных исследований и обучения». -Курган, 1998. -С. 62-68.
- Лифшиц, В.Г. Электронная спектроскопия и атомные процессы на поверхности кремния/В.Г. Лифшиц. -М.: Наука, 1985. -200 с.


