Моделирование ишемически-реперфузионного повреждения печени и почек в эксперименте: отработка методики
Автор: Яремин Б.И., Аносова Е.Ю., Казымов Б.И., Алекберов К.Ф., Новрузбеков М.С., Зуйкова В.А., Гюльмагомедова Ф.Р.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Донорство и трансплантация органов и тканей
Статья в выпуске: 6 т.14, 2024 года.
Бесплатный доступ
Введение. Ощутимый дефицит качественных донорских органов по-прежнему остаётся одним из наиболее острых вызовов, особенно если речь идёт о донорах с расширенными критериями или об асистолических донорах. Решение этой проблемы возникает на стыке хирургического мастерства, продвинутых биомедицинских технологий и глубокого понимания механизмов ишемически-реперфузионного повреждения (ИРП).
Трансплантация печени, ишемически-реперфузионное повреждение, гипотермия, перфузия, трансплантация органов, периферическое сосудистое сопротивление, свиная модель
Короткий адрес: https://sciup.org/143184008
IDR: 143184008 | УДК: 617-089.6:615.847 | DOI: 10.20340/vmi-rvz.2024.6.TX.1
Текст научной статьи Моделирование ишемически-реперфузионного повреждения печени и почек в эксперименте: отработка методики
Ощутимый дефицит качественных донорских органов по-прежнему остаётся одним из наиболее острых вызовов, особенно если речь идёт о донорах с расширенными критериями или об асистоличе-ских донорах. Решение этой проблемы возникает на стыке хирургического мастерства, продвинутых биомедицинских технологий и глубокого понимания механизмов ишемически-реперфузионного повреждения (ИРП) [1].
Практика внедрения инновационных методов, таких как экстракорпоральная мембранная оксигенация (ECMO), гипотермическая оксигенированная перфузия (HOPE) и различные формы метаболической поддержки (к примеру, с применением дихлорацетата натрия), уже доказала свою эффективность, демонстрируя впечатляющие результаты в уменьшении повреждения тканей органов. Многочисленные эксперименты, проведённые как в доклинических условиях (на крысах, кроликах, свиных моделях), так и в клинических условиях, указывают на способность подобных вмешательств не только улучшать биохимические параметры, но и усиливать антиоксидантную защиту, что находит выражение в благоприятных морфологических картинах исследуемых образцов [2]. Параллельно наблюдается расширение клинического опыта трансплантаций от доноров с расширенными критериями, который подтверждает оправданность и дальнейшую перспективность подобных технологий.
Значительный интерес представляет эффективность различных температурных режимов при машинной перфузии органов: от глубокого охлаждения до субнормотермии и нормотермии, позволяющих сохранить тонкую архитектонику тканей и продлить жизнеспособность трансплантата [3]. Ряд объективных биохимических, морфологических и функциональных маркеров, полученных в ходе исследований, указывает на то, что систематическое внедрение этих подходов способно не только расширить круг доступных доноров, но и повысить общую результативность трансплантации, сократив риск осложнений и послеоперационного отторжения.
Впервые о машинной перфузии органов или ее прототипе говорят исследования 18 века, проведенные Максом фон Фреем и Максом Грубером [4]. Они соорудили закрытую систему с оксигенатором для перфузии органов, которая состояла из венозного резервуара, оксигенатора и перистальтического насоса. Сердце сохранялось в ней в течение нескольких часов. Эти эксперименты показали возможность поддержания жизнедеятельности отдельных органов вне организма и дали толчок для дальнейшего развития в этом направлении. Уже Алексис Каррель с опорой на имеющиеся представления разработал аппарат для перфузии органов совмест- но с Чарльзом Линдбергом в 1935 году [3]. Этот аппарат в контролируемых условиях поддерживал пульсирующую циркуляцию стерильной жидкости через орган (рис. 1).
Сравнивая с нынешними машинами, едва ли можно найти общие черты, но именно изобретение Линдберга и Карреля дало основу всем современным методам аппаратной перфузии. В настоящее время машинная перфузия рассматривается как способ увеличения пула доноров путем вовлечения доноров с «расширенными критериями отбора», то есть выходящих за рамки стандартных требований: возраст старше 50–60 лет, длительный анамнез гипертонической болезни, наличие сахарного диабета и других хронических заболеваний [5,6]. Риск трансплантации от таких доноров рассматривается как повышенный, в связи с чем подключение к аппаратной перфузии взамен стандартной статической холодовой перфузии имеет ряд преимуществ. Помимо маргинальных доноров, машинная перфузия может применяться для длительной транспортировки, например, из других регионов, что также увеличит охват трансплантаций [7].

Рисунок 1. Аппарат для перфузии целых органов, разработанный Алексисом Каррелем, Чарльзом Линдбергом и Отто Хопфом (1935). Орган помещен в герметичную камеру из выдувного стекла Pyrex и подключен к системе стеклянных трубок, имитирующих кровообращение. Фото: Луи Шмидт и Джозеф Б. Хау-ленбек, 1935. Цифровая коллекция Университета Рокфеллера Figure 1. A device for perfusion of whole organs, developed by Alexis Carrel, Charles Lindbergh and Otto Hopf (1935). The organ is placed in a sealed Pyrex blown glass chamber and connected to a system of glass tubes that simulate blood circulation. Photo: Louis Schmidt and Joseph B. Haulenbeck, 1935. Rockefeller University Digital Collection
В России с недавнего времени обширно развивается и расширяется применение перфузионных технологий в трансплантации. Первым подобным опытом обладают коллективы ММНКЦ им. С.П. Боткина (Москва), НМИЦ трансплантологии и искусственных органов имени В.И. Шумакова. Российским производителем (ООО «Трансбиотек», Санкт-Петербург, Россия, ООО «Биософт-М», Москва) разработан отечественный перфузионный аппарат для экстракорпоральной оксигенации “ExStream”, зарегистрированный для перфузии донорских органов. Вместе с тем отработка экспериментальной модели для изучения всех аспектов перфузии остается не до конца решенной, но важной задачей [8].
Цель исследования
Данное исследование выполнено с целью обоснования и отработки методики экстракорпоральной ex-vivo перфузии трансплантата печени на животной модели при помощи аппарата перфузионного для экстракорпоральной оксигенации “Ex-Stream” по ТУ 32.50.21-002-75538036-2020 (держатель РУ ООО «Трансбиотек», Санкт-Петербург, Россия, производитель ООО «Биософт-М», Москва, Россия). Исследование проводилось на мужских особях свиней массой 15–30 кг (n = 5). Исследование выполнено в соответствии с правилами лабораторной практики в Российской Федерации: приказ Минздрава СССР № 755 от 12.08.1977 г.; приказ МЗ РФ No 267 от 19.06.2003 г.; Закон «О защите животных от жестокого обращения» от 01.12.1999 г., на проведение данного исследования было получено разрешение Комитета по биомедицинской этике НИИ им. Н.В. Склифосовского № 4-22 от 12 апреля 2022 г.
Материалы и методы
В основу исследования включён анализ результатов гипотермической оксигенированной перфузии трансплантата печени в условиях вивария с использованием аппарата искусственного кровообращения. Исследование проводилось по следующему протоколу: у животного осуществлялось изъятие донорской печени с формированием временного вено-венозного обхода, производились фармакохолодовая консервация органа при помощи аппарата «Ex-Stream» и её последующая реплантация. Во время процедуры гипотермической перфузии ex vivo исследовались такие показатели как рН перфузата, а также данные электрохимического исследования при помощи потенциостата-гальваностата ИПС, предназначенного для электрохимических исследований жидкостных и твёрдотельных систем, исследовались биохимические параметры перфузата, крови лабораторного животного.
Процедура эксплантации донорской печени
Свинье (Sus scrofa domesticus) весом 15–30 кг вводили успокоительное с помощью инъекции пентобарбитала натрия в ягодичную мышцу (3 мг/кг), диазепама (0,4 мг/кг) и атропина (0,02 мг/кг). Животное укладывали на спину и фиксировали на операционном столе. Для обезболивания использовали внутривенную инъекцию суксаметония хлорида (1 мг/кг) с последующей эндотрахеальной интубацией. Для поддержания общей анестезии применяли севофлуран (2 %).
Перед разрезом свинье внутривенно вводили 25 000 единиц гепарина. Производили верхнюю срединную лапаротомию и рассекали связки, окружающие печень. Проводили диссекцию ворот печени с разделением общего желчного протока, собственной печёночной артерии (последнюю перевязывали), а также структур печёночно-двенадцатиперстной связки над поджелудочной железой. Воротную вену тупо выделяли до слияния селезеночной и верхней брыжеечной вен. Общую печёночную артерию выделяли проксимально, а левую желудочную артерию пересекали. Селезёнку и желудок смещали медиально. Селезёночную артерию пересекали, а чревный ствол и общую печёночную артерию полностью выделяли. Нижнюю полую вену выделяли в полости перикарда, после чего из заранее подготовленных кондуитов трупных вен человека (подвздошных) формировали вено-венозный шунт (by-pass), при помощи которого соединяли конец-в-бок над- и подпечёночный отделы нижней полой вены. После чего нижнюю полую вену пережимали под шунтом, отсекали.
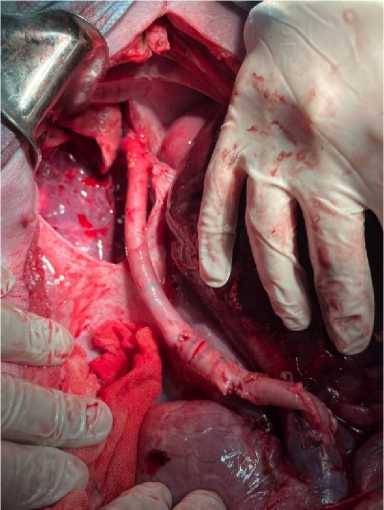
Рисунок 2. Каво-кавальный шунт
Figure 2. Cavo-caval shunt
Проводили быструю деваскуляризацию печёночной артерии, воротной вены, надпечёночной и подпечёночной полой вены, быстрое извлечение печени, подключение устройства Ex-Stream и начало перфузии раствором Belzer MPS® UW Machine Perfusion Solution (США) через воротную вену.
Определение показателей перфузии для эксперимента
Физиологические значения потока и давления определяются по-разному для печёночной артерии и воротной вены. Чтобы воспроизвести значения для воротной вены, равные 900 мл/мин (пульсирующий поток) и 5–7 мм рт. ст. соответственно, используется перистальтический насос, работающий при напряжении 5 В. В воротной вене скорость потока составляет 600–1200 мл/мин, а давление — 4–8 мм рт. ст. Для достижения этих значений потребовалось использовать гидростатический напор, создаваемый в резервуаре, заполненном жидкостью, с выходным соплом. Закон Стивено (закон гидростатического давления) гласит, что гидростатическое давление (P) в жидкости прямо пропорционально плотности жидкости (ρ), ускорению свободного падения (g) и высоте столба жидкости (h). Формула выглядит следующим образом:
P = ρ × g × h, где P – гидростатическое давление (Па); ρ – плотность жидкости (кг/м³); g – ускорение свободного падения (м/с²); h – высота столба жидкости (м).
Для расчёта высоты водяного столба, необходимой для создания желаемого гидростатического напора в АИК для перфузии свиной печени, нужно выразить высоту (h) из формулы:
h = P / (ρ × g).
Допустим, мы хотим создать гидростатическое давление в воротной вене, равное 6 мм рт. ст. (среднее значение из диапазона 4–8 мм рт. ст.). Переведём миллиметры ртутного столба в паскали: 6 мм рт. ст. = 6 × 133,322 Па = 799,932 Па ≈ 800 Па.
Плотность перфузионного раствора примем равной плотности воды при 4 °C (температура гипотермической перфузии): ρ = 1000 кг/м³; ускорение свободного падения: g = 9,81 м/с²:
h = 800 / (1000 × 9,81) = 0,0815 м = 8,15 см.
Закон Бернулли описывает зависимость между скоростью жидкости, давлением и высотой в потоке жидкости. Для расчёта скорости жидкости на выходе из АИК в воротную вену печени можно использовать упрощенную форму уравнения Бернулли, пренебрегая изменением высоты и считая плотность жидкости постоянной:
P1 + (ρ × v1²) / 2 = P2 + (ρ × v2²) / 2, где P1 и P2 – давление в двух точках потока (Па); ρ – плотность жидкости (кг/м³); v1 и v2 – скорость жидкости в двух точках потока (м/с).
Давление в АИК (P1) равно 20 мм рт. ст. (2666,44 Па), давление в воротной вене (P2) равно 6 мм рт. ст. (799,93 Па), а скорость жидкости в АИК (v1) равна 0,1 м/с. Плотность перфузионного раствора примем равной плотности воды при 4 °C: ρ = 1000 кг/м³.
v ≈ 1,93 м/с.
Для расчёта потребления кислорода во время перфузии печени использовалась формула
VO 2 = (П O 2 Sat – В O 2 Sat) × Hgb × 1,34 × (АИК + PV) / 100, где VO 2 – потребление кислорода (мл/мин); П O 2 Sat – насыщение кислородом перфузата на входе (%); В O 2 Sat – насыщение кислородом перфузата на выходе (%); Hgb – концентрация гемоглобина в перфузате (г/дл); 1,34 – константа, представляющая количество кислорода (в мл), связываемое 1 граммом гемоглобина; АИК – кровоток по аппарату (мл/мин); PV – портальный венозный кровоток (мл/мин).
Принимая П O 2 Sat = 98 %, В O 2 Sat = 75 %, Hgb = 10 г/дл, АИК = 200 мл/мин, PV = 800 мл/мин, тогда VO 2 = 3082 мл/мин.
Периферическое сосудистое сопротивление являлось расчётным показателем, вычисляемым по формуле:
R = P/V, где R – сопротивление; Р – давление в мм рт. ст.; V – объёмная скорость перфузии в мл/мин, и отображало податливость сосудистого русла трансплантата печени, что являлось предиктором восстановления печёночной функции после имплантации. С учётом специфики кровоснабжения печени у свиней перфузию артерии не проводили, при выполнении эксперимента было решено лигировать последнюю.
Методика перфузии печени в эксперименте
Для процедуры гипотермической перфузии донорской печени ex vivo предварительно выполняли сборку экстракорпорального контура. Перфузионный контур состоял из роликового насоса, блока инвазивного измерения давления, термодатчика, ёмкости для трансплантата печени, оксигенатора (использован неонатальный оксигенатор Maquet), перфузионных магистралей и перфузионной канюли.
Схематичное изображение экстракорпорального контура представлено на рисунке 3.
Перфузионный контур заполняли 100 мл раствора Бельзера (UW) при температуре 4 °С и добавляли гепарин 1000 ЕД. После проведённой фармакохолодовой консервации в воротную вену устанавливали внутривенный катетер, выполняли деаэрацию и коннекцию перфузионной магистрали к катетеру. Процедура гипотермической перфузии донорской печени ex vivo проводилась с регуляцией по давлению с ранее описанными параметрами перфузии.
Длительность процедуры составляла 30 минут, и по окончании гипотермической перфузии выполнялась реплантация.
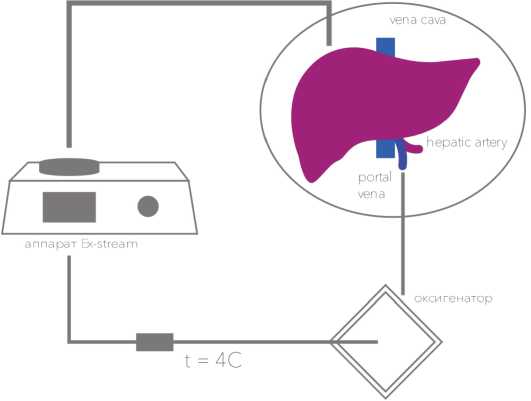
Рисунок 3. Контур перфузии печени в эксперименте
Figure 3. The contour of liver perfusion in the experiment
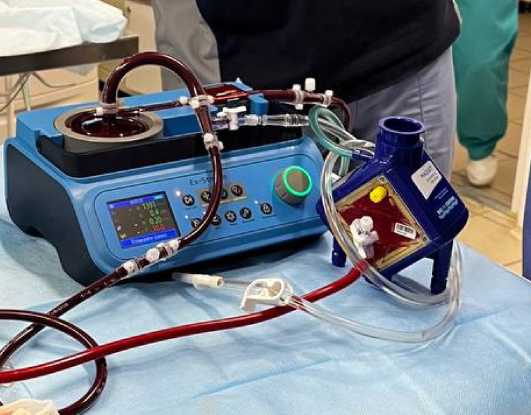
Рисунок 4. Подключенный контур перфузии печени в эксперименте с оксигенатором Maquet
Figure 4. Connected liver perfusion circuit in the experiment with the Maquet oxygenator
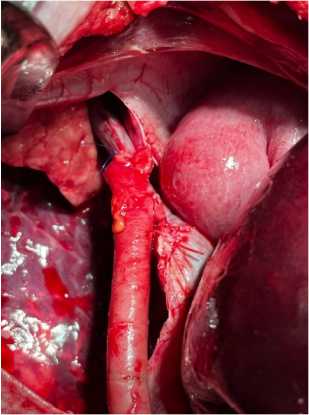
Рисунок 5. Методика реплантации и реперфузии в эксперименте Figure 5. Method of replantation and reperfusion in the experiment
Процедура моделирования реперфузии и ИРП
Трансплантат помещался в брюшную полость животного, формировался проксимальный кавокавальный анастомоз конец-в конец, а нижний конец воротной вены животного ушивался. Ранее сформированный каво-кавальный шунт функционировал до выведения животного из эксперимента. Далее формировали портальный анастомоз, выполняли реперфузию. Время наблюдения после реперфузии составило от 45 минут до 2 часов, после чего эксперимент прекращали.
Для оценки результатов эксперимента использовали следующие методики: биохимические анализы – оценка маркеров повреждения тканей (АСТ, АЛТ, ЛДГ, ГГТП), измерение уровня окислительного стресса (малоновый диальдегид, глутатион), опре- деление провоспалительных цитокинов (TNF-α, IL-6, IL-1β); выполняли гистологические исследования (микроскопическое в окраске гематоксилин-эозин, трихром по Масону, ультрамикроскопическое – просвечивающая электронная микроскопия), анализ потребления кислорода и продукции углекислого газа, потенциометрическое исследование перфузата при помощи потенциостата-гальваностата ИПС, исследование активности ферментов (супероксид-дисмутаза, каталаза) в ткани печени.
Результаты
В таблице 1 представлены сводные параметры – вес органа, температура в перфузате, давления в контуре, потока и сосудистого сопротивления в момент машинной перфузии и времени проведения.
Таблица 1. Результаты отработки методики перфузии в эксперименте
Table 1. Results of testing the perfusion technique in the experiment
|
№ наблюдения |
Вес, г |
Поток, мл/мин |
Давление, мм рт. ст. |
Сопротивление |
Температура, °С |
рН |
PСО 2 |
PaО 2 |
Лактат |
|
1 |
1400 |
90 |
5 |
0,05 |
4–6 |
6,88 |
6 |
125 |
8 |
|
2 |
1200 |
100 |
6 |
0,06 |
6–8 |
6,86 |
8 |
186 |
3 |
|
3 |
1600 |
89 |
7 |
0,07 |
6–9 |
6,83 |
6 |
201 |
5 |
|
4 |
1000 |
86 |
8 |
0,09 |
4–6 |
6,8 |
6 |
205 |
23 |
|
5 |
1200 |
90 |
5 |
0,05 |
4–6 |
6,89 |
9 |
164 |
16 |
В серии из 5 наблюдений были получены следующие результаты. Маркеры повреждения тканей (АСТ, АЛТ, ЛДГ, ГГТП) показали постепенное увеличение их уровня в перфузате с течением времени ишемии. Средние значения АСТ и АЛТ возросли в 2–3 раза, ЛДГ – в 1,5–2 раза, а ГГТП – в 1,2–1,5 раза по сравнению с исходными значениями. Уровень малонового диальдегида, отражающий окислительный стресс, повысился в среднем на 30–40 % к концу эксперимента, в то время как уровень глутатиона снизился на 20–25 %. Концентрации провоспали-тельных цитокинов (TNF- α , IL-6, IL-1 β ) в перфузате увеличились в 2–4 раза по сравнению с базовыми значениями, указывая на развитие воспалительного ответа.Микроскопическое исследование в окраске гематоксилин-эозин выявило признаки ишемического повреждения гепатоцитов, такие как вакуолизация цитоплазмы, пикноз ядер и нарушение балочной структуры. Степень повреждения нарастала с увеличением времени ишемии. Окраска по Масону показала умеренное увеличение соединительной ткани в портальных трактах и перицентральных зонах, свидетельствующее о начальных фибротиче-ских изменениях. Ультрамикроскопическое исследование (просвечивающая электронная микроскопия) выявило набухание митохондрий, нарушение целостности их крист, расширение эндоплазматического ретикулума и образование аутофагосом в гепатоцитах. Потребление кислорода тканью печени постепенно снижалось в ходе эксперимента, достигая 60–70 % от исходного уровня к концу наблюдения. Продукция углекислого газа также уменьшалась, но в меньшей степени, составляя 75–85 % от базовых значений. Анализ перфузата с помощью потенциостата-гальваностата ИПС показал постепенное снижение окислительно-восстановительного потенциала, указывающее на нарастание гипоксии и истощение антиоксидантных резервов. Активность суперок-сиддисмутазы и каталазы, ключевых антиоксидантных ферментов снизилась на 30–40 % и 20–30 % соответственно по сравнению с исходными значениями, свидетельствуя об ослаблении антиоксидантной защиты.
Полученные результаты демонстрируют развитие ишемически-реперфузионного повреждения печени в ходе эксперимента, характеризующегося нарастанием маркеров повреждения тканей, окис- лительного стресса, воспалительного ответа, гистологическими изменениями, нарушением энергетического метаболизма и ослаблением антиоксидантной защиты. Эти данные создают основу для дальнейшего изучения механизмов повреждения и разработки терапевтических стратегий.
В ходе проведения исследования интраоперационная летальность отсутствовала, и все животные успешно перенесли хирургическое вмешательство. Удалось поддерживать жизнеспособность моделей в течение периода от 45 минут до полутора часов, что позволило получить образцы желчи и крови для дальнейших исследований, а также провести морфологическую оценку тканей. Первые результаты полученных исследований на ограниченной серии в 5 наблюдений позволили получить воспроизводимые результаты.
Обсуждение
Машинная перфузия является многообещающим направлением в трансплантации печени, открывающим новые возможности для сохранения жизнеспособности органов вне человеческого тела [8]. Эта технология, привлекавшая внимание выдающихся учёных, таких как нобелевский лауреат Алексис Каррель, более ста лет назад, сегодня является альтернативой традиционному статическому холодовому хранению трансплантатов [9]. В последние десятилетия были разработаны различные методы машинной перфузии (МП), включая гипотермическую, нормотермическую, субнормотермическую и гипотермическую оксигенированную перфузию [10]. Исследования на животных моделях (свиньи, крысы, собаки) и различных типах трансплантатов (после сердечной смерти и смерти мозга) необходимы для изучения механизмов защиты, безопасности и осуществимости этих методов, а также новых устройств для их реализации [11].
В исследовании И.Ю. Цымбалюка, А.М. Мануйлова и К.А. Попова рассматривается метаболическая коррекция ишемически-реперфузионного повреждения печени с использованием дихлорацетата натрия (ДХА) при сосудистой эксклюзии, что моделирует такие условия, как маневр Прингла [12]. Эксперимент, проведённый на 105 самцах крыс, показал, что введение ДХА существенно снижает уровень маркеров повреждения печени, таких как лак- татдегидрогеназа (ЛДГ), аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (АСТ), а также повышает активность антиоксидантных ферментов, таких как супероксиддисмутаза (СОД) и каталаза (КАТ). Эти данные поддерживают идею о том, что метаболические вмешательства, такие как использование ДХА, могут значительно улучшить результаты трансплантации печени, минимизируя повреждения при ишемическом стрессе.
В статье О.Н. Резника, А.Е. Скворцова и В.С. Дайнеко [13] рассмотрены результаты трёхлетнего опыта трансплантации печени и почек от доноров, умерших вследствие внегоспитальной остановки сердца (OHCД), с использованием экстракорпоральной мембранной оксигенации (ECMO) для восстановления кровообращения и поддержания жизни органов потенциальных доноров. В период с 2017 по 2020 гг. в Санкт-Петербурге было проведено 67 случаев экстренной госпитализации пациентов с OHCД, из которых 4 случая реанимированы с помощью ECMO, что позволило восстановить кровообращение, а 11 доноров стали источником трансплантатов. В результате этого исследования были выполнены 22 трансплантации почки и 5 трансплантаций печени. Важными аспектами исследования являются точность и своевременность оценки состояния органов с помощью технологий, таких как КТ-анализ перфузии органов.
Работа А.В. Шабунина, М.Г. Мининой и П.В. Дроздова [14] фокусируется на применении машинной гипотермической оксигенированной перфузии (HOPE) для сохранения почечных трансплантатов от доноров с расширенными критериями. В исследовании, проведённом в Боткинской больнице с 2018 по 2021 гг., было выполнено 200 трансплантаций почки от посмертных доноров, включая 102 доноров с расширенными критериями. Использование HOPE в группе пациентов привело к снижению частоты отсроченной функции трансплантатов до 10 % по сравнению с 35,8 % в группе с традиционной холодовой консервацией. Эти данные подтверждают, что использование HOPE для сохранения почек от доноров с расширенными критериями является не только безопасным, но и эффективным методом для минимизации отсроченной функции трансплантатов.
В исследовании А.В. Шабунина, О.Б. Лорана и Д.Ю. Пушкаря [15] рассмотрена HOPE при трансплантации печени от доноров с расширенными критериями. Результаты показали, что применение HOPE значительно улучшает исходы трансплантации печени, снижая уровень ишемически- реперфузионного повреждения и улучшая восстановление функции печени. В группе с HOPE было зафиксировано статистически значимое снижение уровней АСТ и АЛТ в первую неделю после трансплантации, а также меньшее количество послеоперационных осложнений и короткий период нахождения реципиентов в интенсивной терапии. Морфологические исследования показали меньший уровень повреждения гепатоцитов по сравнению с традиционной холодовой консервацией.
В работе В.Г. Шестаковой, В.К. Богданова и Р.Д. Павлова [16] рассмотрено использование HOPE для почечных трансплантатов от асистолических доноров с применением раствора на основе декстрана-40. В эксперименте использовалась модель кролика, в которой доноры подвергались 30-минутной асистолии, после чего почки подвергались гипотермической перфузии с использованием раствора на основе декстрана-40. Результаты показали, что HOPE эффективно снижает периферическое сосудистое сопротивление, улучшает биохимические показатели, такие как уровень креатинина и мочевины, и способствует стабилизации этих показателей до физиологических значений к 12-му дню после трансплантации.
В работе M. Magbagbeola, Z.L. Rai, K. Doyle [17] описана низкозатратная система для гипотермической машинной перфузии печени с использованием свиных моделей. Эксперимент продемонстрировал успешную перфузию печени с использованием модульной системы, которая включает камеру для органа, насосы, кислородатор и датчики для мониторинга. Система показала долговечность и стабильные результаты при поддержании нормотермических условий для печени в течение 3 часов.
Заключение
Полученные результаты свидетельствуют о том, что разработанная модель с использованием аппарата Ex-Stream является воспроизводимой и позволяет эффективно изучать состояние ишемически-реперфузионного повреждения [18]. Это открывает возможности для проведения более масштабной и всесторонней серии экспериментов, результаты которой станут предметом наших дальнейших исследований. Успешное завершение данного этапа работы закладывает прочную основу для углубленного изучения механизмов ишемически-реперфузионного повреждения и разработки новых терапевтических стратегий, направленных на минимизацию повреждений трансплантируемых органов и улучшение результатов трансплантации [19].
Список литературы Моделирование ишемически-реперфузионного повреждения печени и почек в эксперименте: отработка методики
- Sánchez-Fructuoso AI, Prats D, Torrente J, et al. Renal transplantation from non-heart beating donors: a promising alternative to enlarge the donor pool. J Am Soc Nephrol. 2000;11:350-358.
- Reznik ON, Bagnenko SF, Skvortsov AE. Uncontrolled donors with controlled reperfusion after sixty minutes of asystole: a novel reliable resource for kidney transplantation. PloS One. 2013;8(5):e64209.
- Rudich SM, Kaplan B, Magee JC, et al. Renal transplants performed using non-heart-beating organ donors: going back to the future? Trans-plantation. 2002;74:1715-1720.
- Kokkinos C, Antcliffe D, Nanidis T, et al. Outcome of kidney transplantation from non-heart-beating versus heart-beating cadaveric donors. Transplantation. 2007;83:1193-1199.
- Borry P, van Reusel W, Roels L, Schotsmans P. Donation after Uncontrolled Cardiac Death (uDCD): a review of the debate from a European perspective. J Law Med Ethics. 2008;36:752-759.
- Blackstock MJ, Ray DC. Organ donation after circulatory death: an update. Eur J Emerg Med. 2014;21:324-329.
- Abrams D, et al. Extracorporeal membrane oxygenation in cardiopulmonary disease in adults. J Am Coll Cardiol. 2014;63(25 Pt A):2769-2778.
- Carroll BJ, et al. Clinical features and outcomes in adults with cardiogenic shock supported by extracorporeal membrane oxygenation. Am J Cardiol. 2015;116(10):1624-1630.
- Lee HS, Kang M, Kim B, Park Y. Outcomes of kidney transplantation over a 16-year period in Korea: An analysis of the National Health Infor-mation Database. PLoS One. 2021;16(2):e0247449.
- Wang Z, Durai P, Tiong HY. Expanded criteria donors in deceased donor kidney transplantation – An Asian perspective. Indian J Urol. 2020;36(2):89.
- Gondos A, Döhler B, Brenner H, Opelz G. Kidney graft survival in Europe and the United States: strikingly different long-term outcomes. Transplantation. 2013;95(2):267-274.
- Saat TC, van den Akker EK, IJzermans JN, Dor FJ, de Bruin RW. Improving the outcome of kidney transplantation by ameliorating renal is-chemia reperfusion injury: lost in translation? J Transl Med. 2016;14(1):1-9.
- Kaminski J, Delpech PO, Kaaki-Hosni S, Promeyrat X, Hauet T, Hannaert P. Oxygen consumption by warm ischemia-injured porcine kidneys in hypothermic static and machine preservation. J Surg Res. 2019;242:78-86.
- Cannon RM, Franklin GA. Machine perfusion for improving outcomes following renal transplant: current perspectives. Transpl Res Risk Manag. 2016;8:1-7.
- Lomero M, Gardiner D, Coll E, Haase-Kromwijk B, Procaccio F, Immer F, et al. Donation after circulatory death today: an updated overview of the European landscape. Transplant Int. 2020;33(1):76-88. doi:10.1111/tri.13506.
- Domínguez-Gil B, Duranteau J, Mateos A, Núñez JR, Cheisson G, Corral E, et al. Uncontrolled donation after circulatory death: European practices and recommendations for the development and optimization of an effective programme. Transplant Int. 2016;29(8):42-859. doi:10.1111/tri.12734.
- Miranda-Utrera N, Medina-Polo J, Pamplona M, de la Rosa F, Rodríguez A, Duarte JM, et al. Donation after cardiac death: results of the SUMMA 112 – Hospital 12 de Octubre Program. Clin Transplant. 2013;27:283. doi:10.1111/ctr.12071.
- Hoogland ER, van Smaalen TC, Christiaans MH, van Heurn LW. Kidneys from uncontrolled donors after cardiac death: which kidneys do worse? Transpl Int. 2013;26:477-484. doi:10.1111/tri.12067.
- Hanf W, Codas R, Meas-Yedid V, Berthiller J, Buron F, Chauvet C, et al. Kidney graft outcome and quality (after transplantation) from uncon-trolled deceased donors after cardiac arrest. Am J Transplant. 2012;12:1541-1550. doi:10.1111/j.1600-6143.2011.03983.x.
- Fondevila C, Hessheimer AJ, Flores E, Ruiz A, Mestres N, Calatayud D, et al. Applicability and results of Maastricht type 2 donation after cardiac death liver transplantation. Am J Transplant. 2012;12:162-170. doi:10.1111/j.1600-6143.2011.03834.x.
- Kron P, Schlegel A, de Rougemont O, Oberkofler CE, Clavien PA, Dutkowski P, et al. Short, cool, and well oxygenated – HOPE for kidney transplantation in a rodent model. Ann Surg. 2016;264(5):815-822. doi:10.1097/SLA.0000000000001766.
- Gautier SV, Khomyakov SM. Donorstvo i transplantatsiya organov v Rossiyskoy Federatsii v 2020 godu. XIII soobshchenie registra Ros-siyskogo transplantologicheskogo obshchestva. Vestnik transplantologii i iskusstvennykh organov. 2021;23(3):8-34. doi:10.15825/1995-1191-2021-3-8-34.
- Shabunin AV, Parfenov IP, Minina MG, Drozdov PA, Nesterenko IV, Makeev DA, et al. Botkin Hospital Transplant Program: 100 solid organ transplantations. Russian Journal of Transplantology and Artificial Organs. 2020;22(1):55-58. doi:10.15825/1995-1191-2020-1-55-58.
- Urbanellis P, Mazilescu L, Kollmann D, Linares-Cervantes I, Kaths JM, Ganesh S, et al. Prolonged warm ischemia time leads to severe renal dysfunction of donation-after-cardiac death kidney grafts. Sci Rep. 2021;11(1):1-11. doi:10.1038/s41598-021-97078-w.
- Eurotransplant Annual Report 2022. Available from: https://www.eurotransplant.org/statistics/annual-report/.
- Moysyuk YaG, Poptsov VN, Sushkov AI, et al. Early liver allograft dysfunction: risk factors, clinical course and outcomes. Transplantologiya. 2016;(2):16-28.
- Olthoff KM, Kulik L, Samstein B, et al. Validation of a current definition of early allograft dysfunction in liver transplant recipients and analysis of risk factors. Liver Transpl. 2010;16(8):943-949. doi:10.1002/lt.22091.
- Lee DD, Croome KP, Shalev JA, et al. Early allograft dysfunction after liver transplantation: an intermediate outcome measure for targeted improvements. Ann Hepatol. 2016;15(1):53-60. doi:10.5604/16652681.1184212.
- Hartog H, Hann A, Perera MTPR. Primary Nonfunction of the Liver Allograft. Transplantation. 2022;106(1):117-128. doi:10.1097/TP.0000000000003682.
- Fedoruk DA, Kirkovsky LV, Sadovsky DN, et al. Influence of hypothermic oxygenated machine perfusion on the degree of ischemic damage of ecd liver grafts. Military medicine. 2020;(2):68-75.
- Czigany Z, Pratschke J, Froněk J, et al. Hypothermic Oxygenated Machine Perfusion Reduces Early Allograft Injury and Improves Post-transplant Outcomes in Extended Criteria Donation Liver Transplantation From Donation After Brain Death: Results From a Multicenter Ran-domized Controlled Trial (HOPE ECD-DBD). Ann Surg. 2021;274(5):705-712. doi:10.1097/SLA.0000000000005110.
- Mugaanyi J, Dai L, Lu C, et al. A Meta-Analysis and Systematic Review of Normothermic and Hypothermic Machine Perfusion in Liver Trans-plantation. J Clin Med. 2022;12(1):235. doi:10.3390/jcm12010235.
- Shabunin AV, Minina MG, Drozdov PA, et al. Early experiments with hypothermic oxygenated machine perfusion of kidney grafts from ex-tended criteria donors. Russian Journal of Transplantology and Artificial Organs. 2022;24(1):143-150. doi:10.15825/1995-1191-2022-1-143-150.
- Shabunin AV, Minina MG, Drozdov PA, et al. Asystole kidney donation using automated chest compression system and hypothermic oxy-genated machine perfusion (first experience in the Russian Federation). Russian Journal of Transplantology and Artificial Organs. 2022;24(2):102-107. doi:10.15825/1995-1191-2022-2-102-107.
- Shabunin AV, Minina MG, Drozdov PA, et al. Complex use of perfusion techniques in kidney transplantation from a donor with out-of-hospital cardiac arrest (clinical case). Russian Journal of Transplantology and Artificial Organs. 2023;25(3):113-121. doi:10.15825/1995-1191-2023-3-113-121.
- Guarrera JV, Henry SD, Samstein B, et al. Hypothermic machine preservation in human liver transplantation: the first clinical series. Am J Transplant. 2010;10(2):372-381. doi:10.1111/j.1600-6143.2009.02932.x.
- Dutkowski P, Schlegel A, de Oliveira M, et al. HOPE for human liver grafts obtained from donors after cardiac death. J Hepatol. 2014;60:765-772. doi:10.1016/j.jhep.2013.11.023.
- Muller X, Schlegel A, Kron P, et al. Novel Real-time Prediction of Liver Graft Function During Hypothermic Oxygenated Machine Perfusion Before Liver Transplantation. Ann Surg. 2019;270(5):783-790. doi:10.1097/sla.0000000000003513.
- De Vries Y, Brüggenwirth IMA, Karangwa SA, et al. Dual Versus Single Oxygenated Hypothermic Machine Perfusion of Porcine Livers: Impact on Hepatobiliary and Endothelial Cell Injury. Transplant Direct. 2021;7(9):e741. doi:10.1097/TXD.0000000000001184.
- Brat A, de Vries KM, van Heurn EWE, Huurman VAL, de Jongh W, Leuvenink HGD, et al. Hypothermic Machine Perfusion as a National Stand-ard Preservation Method for Deceased Donor Kidneys. Transplantation. 2022;106(5):1043–1050. doi:10.1097/TP.0000000000003845.
- Peng P, Ding Z, He Y, Zhang J, Wang X, Yang Z. Hypothermic Machine Perfusion Versus Static Cold Storage in Deceased Donor Kidney Transplantation: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Artif Organs. 2019;43(5):478–489. doi:10.1111/aor.13364.
- Simona MS, Alessandra V, Emanuela C, Elena T, Michela M, Fulvia G, et al. Evaluation of Oxidative Stress and Metabolic Profile in a Preclinical Kidney Transplantation Model According to Different Preservation Modalities. Int J Mol Sci. 2023;24(2):1029. doi:10.3390/ijms24021029.
- Zulpaite R, Miknevicius P, Leber B, Strupas K, Stiegler P, Schemmer P. Ex-vivo Kidney Machine Perfusion: Therapeutic Potential. Front Med (Lausanne). 2021;8:808719. doi:10.3389/fmed.2021.808719.
- Lindell SL, Compagnon P, Mangino MJ, Southard JH. UW Solution for Hypothermic Machine Perfusion of Warm Ischemic Kidneys. Transplantation. 2005;79(10):1358–1361. doi:10.1097/01.TP.0000159143.45022.F6.
- Elliott TR, Nicholson ML, Hosgood SA. Normothermic kidney perfusion: An overview of protocols and strategies. Am J Transplant. 2021;21(4):1382–1390. doi:10.1111/ajt.16307.
- Campos Pamplona C, Moers C, Leuvenink HGD, van Leeuwen LL. Expanding the Horizons of Pre-Transplant Renal Vascular Assessment Using Ex Vivo Perfusion. Curr Issues Mol Biol. 2023;45(7):5437–5459. doi:10.3390/cimb45070345.
- Abramowicz D, Oberbauer R, Heemann U, Viklicky O, Peruzzi L, Mariat C, Crespo M, Budde K, Oniscu GC. Recent advances in kidney trans-plantation: a viewpoint from the Descartes advisory board. Nephrol Dial Transpl. 2018;33(10):1699–1707.
- Ceresa CDL, Nasralla D, Pollok JM, Friend PJ. Machine perfusion of the liver: applications in transplantation and beyond. Nat Rev Gastroenterol Hepatol. 2022;19(3):199–209.
- Nasralla D, Coussios CC, Mergental H, Akhtar MZ, Butler AJ, Ceresa CDL, Chiocchia V, Dutton SJ, García-Valdecasas JC, Heaton N, Imber C, Jassem W, Jochmans I, Karani J, Knight SR, Kocabayoglu P, Malagò M, Mirza D, Morris PJ, Pallan A, Paul A, Pavel M, Perera MTPR, Pirenne J, Ravikumar R, Russell L, Upponi S, Watson CJE, Weissenbacher A, Ploeg RJ, Friend PJ. A randomized trial of normothermic preservation in liver transplantation. Nature. 2018;557(7703):50–56.
- Excellence, NIoH. OrganOx Metra for liver transplant Medtech innovation briefing. September, 2011.
- Obara H, Matsuno N, Shigeta T, Enosawa S, Hirano T, Mizunuma H. Rewarming machine perfusion system for liver transplantation. J Med Devices. 2013;7(4):1–7.
- Riveros S, Marino C, Ochoa G, Morales E, Soto D, Alegría L, Zenteno MJ, Brañes A, Achurra P, Rebolledo RA. Implementation and design of customized ex vivo machine perfusion. Analysis of its first results. Artif Organs. 2022;46(2):210–218.
- Eshmuminov D, Becker D, Bautista Borrego L, Hefti M, Schuler MJ, Hagedorn C, Muller X, Mueller M, Onder C, Graf R, Weber A, Dutkowski P, Rudolf von Rohr P, Clavien PA. An integrated perfusion machine preserves injured human livers for 1 week. Nat Biotechnol. 2020;38(2):189–198.
- Van der Plaats A, Maathuis M, Hart N A t, Bellekom A A, Hofker H S, Houwen V D, Verkerke G J, Leuvenink H G D, Verdonck P, Ploeg R J, Rakhorst G. The Groningen hypothermic liver perfusion pump: functional evaluation of a new machine perfusion system. Ann Biomed Eng. 2006;34(12):1924–1934.
- Campos-Delgado DU, Bonilla I, Rodriguez-Martinez M, Sanchez-Briones M, Ruiz-Hernandez E. Closed-loop control of renal perfusion pres-sure in physiological experiments. IEEE Trans Biomed Eng. 2013;60(7):1776–1784.
- Post ICJH, Dirkes MC, Heger M, Bezemer R, van ’t Leven J, van Gulik TM. Optimal flow and pressure management in machine perfusion systems for organ preservation. Ann Biomed Eng. 2012;40(12):2698–2707.
- Mazzantini L, Dimitri M, Staderini F, Cianchi F, Corvi A. Design and realization of a normothermic perfusion system for laboratory tests on pig liver. The International Journal of Artificial Organs. 2020;43(1):3-9. doi:10.1177/0391398819865744
- Vogel T, Brockmann J, Peter J. Ex-vivo normothermic liver perfusion: an update. Curr Opin Organ Transplant. 2010;15:167–172.
- Tolboom H, Pouw R, Izamis M, et al. Recovery of warm ischemic rat liver grafts by normothermic extracorporeal perfusion. Transplantation. 2009;87:170–177.
- Strasberg S, Howard T, Molmenti E, et al. Selecting the donor liver: risk factors for poor function after orthotopic liver transplantation. Hepa-tology. 1994;20:829–838.
- Moers C, Leuvenink H, Ploeg R. Non-heart beating organ donation: overview and future perspectives. Transp Int. 2007;20:567–575.
- Abt P, Crawford M, Desai N, et al. Liver transplantation from controlled non-heart-beating donors: an increased incidence of biliary complica-tions. Transplantation. 2003;75:1659–1663.
- Chan E, Olson L, Kisthard J, et al. Ischemic cholangiopathy following liver transplantation from donation after cardiac death donors. Liver Transplant. 2008;14:604–610.
- Merion R, Pelletier S, Goodrich N, et al. Donation after cardiac death as a strategy to increase deceased donor liver availability. Ann Surg. 2006;244:555–560.
- Reich D, Hong J. Current status of donation after cardiac death liver transplantation. Curr Opin Organ Transplant. 2010;15:316–321.
- Fukumori T, Kato T, Levi D, et al. Use of older controlled non-heart-beating donors for liver transplantation. Transplantation. 2003;75:1171–1174.
- Brockmann J, Reddy S, Coussios C, et al. Normothermic perfusion: a new paradigm for organ preservation. Ann Surg. 2009;250:1–6.
- Watson CJ, Kosmoliaptsis V, Randle LV, et al. Normothermic perfusion in the assessment and preservation of declined livers before trans-plantation: hyperoxia and vasoplegia—important lessons from the first 12 cases. Orig Clin Sci. 2017;101:1084–1098.
- Ravikumar R, Jassem W, Mergental H, et al. Liver transplantation after ex vivo normothermic machine preservation: a phase 1 (first-in-man) clinical trial. Am J Transplant. 2016;16:1779–1787.
- Boehnert M, Yeung J, Bazerbachi F, et al. Normothermic acellular ex vivo liver perfusion reduces liver and bile duct injury of pig livers re-trieved after cardiac death. Am J Transplant. 2013;13:1441–1449.
- Wertheim JA, Petrowsky H, Saab S, Kupiec-Weglinski JW, Busuttil RW. Major challenges limiting liver transplantation in the United States. Am J Transplant. 2011;11(9):1773–1784.
- Orma ES, Barritt S IV, Wheeler SB, Hayashi PH. Declining liver utilization for transplantation in the United States and the impact of donation after cardiac death. Liver Transpl. 2013;19(1):59–68.
- Foley DP, Fernandez LA, Leverson G, et al. Donation after cardiac death: The University of Wisconsin experience with liver transplantation. Ann Surg. 2005;242(5):724–731.
- Jay C, Ladner D, Wang E, et al. A comprehensive risk assessment of mortality following donation after cardiac death liver transplant—An analysis of the national registry. J Hepatol. 2011;55(4):808–813.
- Guarrera JV, Henry SD, Samstein B, et al. Hypothermic machine preservation in human liver transplantation: The first clinical series. Am J Transplant. 2010;10(2):372–381.
- Vogel T, Brockmann JG, Coussios CC, Friend PJ. The role of normothermic extracorporeal perfusion in minimizing ischemia reperfusion injury. Transplant Rev. 2012;26(3):156–162.
- Dutkowski P, Schlegel A, de Oliveira M, Müllhaupt B, Clavien PA. HOPE for human liver grafts obtained from donors after cardiac death. J Hepatol. 2013;58(4):765–772.
- van der Plaats A, ’t Hart NA, Verkerke GJ, Leuvenink HG, Ploeg RJ, Rakhorst G. Hypothermic machine preservation in liver transplantation revisited: Concepts and criteria in the new millennium. Ann Biomed Eng. 2004;32(5):623–631.
- Jahr JS, Mackenzie C, Pearce LB, Pitman A, Greenburg AG. HBOC-201 as an alternative to blood transfusion: Efficacy and safety evaluation in a multicenter phase III trial in elective orthopedic surgery. J Trauma. 2008;64(6):1484–1497.
- Jahr JS, Walker V, Manoochehri K. Blood substitutes as pharmacotherapies in clinical practice. Curr Opin Anesthesiol. 2007;20(3):325–330.
- Schafer DF, Shaw BW Jr. Fulminant hepatic failure and orthotopic liver transplantation. Semin Liver Dis. 1989;9(3):189.
- McGuire BM, Sielaff TD, Nyberg SL, et al. Review of support systems used in the management of fulminant hepatic failure. Dig Dis. 1995;13(6):379.
- Hammer GB, So SK, Al-Uzri A, et al. Continuous venovenous hemofiltration with dialysis in combination with total hepatectomy and porto-caval shunting. Bridge to liver transplantation. Transplantation. 1996;62(1):130.
- Redeker AG, Yamahiro HS. Controlled trial of exchange-transfusion therapy in fulminant hepatitis. Lancet. 1973;1(7793):3.
- Chen SC, Hewitt WR, Watanabe FD, et al. Clinical experience with a porcine hepatocyte-based liver support system. Int J Artif Organs. 1996;19(11):664.
- Fox IJ, Langnas AN, Fristoe LW, et al. Successful application of extracorporeal liver perfusion: a technology whose time has come. Am J Gastroenterol. 1993;88(11):1876.
- Eiseman B, Liem DS, Raffucci F. Heterologous liver perfusion in treatment of hepatic failure. Ann Surg. 1965;162(3):329.
- Parbhoo SP, Chalstrey LJ, Adjukiewicz AB, et al. Extracorporeal perfusion of pig liver in the treatment of acute liver failure. Br J Surg. 1971;58(10):746P.
- Whitson BA, Black SM. Organ Assessment and Repair Centers: The Future of Transplantation Is Near. World J Transplant. 2014;4(1):40-43.
- van Beekum CJ, Vilz TO, Glowka TR, et al. Normothermic Machine Perfusion (NMP) of the Liver—Current Status and Future Perspectives. Ann Transplant. 2021;26:e931664-1–e931664-8.


