Моделирование направленного транспорта лекарственных веществ. Часть I. Однократное введение
Автор: Заборовский Андрей Владимирович, Гуревич Константин Георгиевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.16, 2017 года.
Бесплатный доступ
В онкологической практике, несмотря на развитие методов ранней диагностики, хирургии, лучевой терапии и др., химиотерапия вряд ли потеряет свою актуальность в ближайшее время. В этой связи разработка новых противоопухолевых препаратов является одной из актуальных задач современной онкологии. При всей значимости поиска новых соединений с противоопухолевой активностью воз-можности «старых» средств полностью не исчерпаны. Направленный транспорт противоопухолевых средств может подарить им «вторую жизнь» в клинике. При разработке направленного транспорта лекарственных средств и их дальнейшем внедрении в практику особое значение имеет изменение их фармакодинамики и фармакокинетики. В работе описана формальная фармакокинетическая модель направленного транспорта лекарственных веществ. Сформулированы условия, при которых для ис-ходного действующего вещества имеет смысл искать средство доставки. Исходя из основных предпо-ложений модели проведен первичный скрининг противовопухолевых средств с целью их модификации для направленного транспорта.
Лекарственные вещества, направленный транспорт, ткани-мишени, противоопухолевые препараты
Короткий адрес: https://sciup.org/140254095
IDR: 140254095 | УДК: 615.277.3 | DOI: 10.21294/1814-4861-2017-16-1-59-65
Текст научной статьи Моделирование направленного транспорта лекарственных веществ. Часть I. Однократное введение
Направленный транспорт лекарственных веществ – способ модификации для улучшения их поступления в ткани-мишени [1]. Кроме того, стоимость разработки направленного транспорта известных антибактериальных и противоопухолевых препаратов в разы уступает стоимости разработки новых лекарственных средств. Это объясняется двумя причинами: во-первых, тем, что обычно в качестве носителей используются мицеллы (липосомы) [2], наночастицы [3], биополимеры [4, 5], для большинства которых вопросы биобезопасности хорошо изучены [6]; во-вторых, «старые» препараты имеют мощное доклиническое и клиническое досье. Именно поэтому для модифицированного лекарственного средства («старый» препарат плюс носитель) чаще всего достаточно проведения ограниченного изучения токсичности и эффективности [7–9].
При этом достаточно часто за рамками исследований остаются вопросы изучения фармакокинетики модифицированных лекарственных средств [10]. Хотя именно показатели фармакокинетики осново-полагающи в подборе режимов дозирования [11].
Кроме того, с нашей точки зрения, имеются фармакокинетические ограничения в выборе исходных веществ, которые имеет смысл модифицировать для целей направленного транспорта. Подобный вопрос практически не изучался; есть лишь описательная (но не аналитическая) модель направленного транспорта антибиотиков [12, 13]. Все это обосновывает необходимость создания аналитической фармакокинетической модели направленного транспорта, в первую очередь, с целью изучения модифицированных противоопухолевых препаратов. Это и определило актуальность настоящего исследования.
Материал и методы
Моделирование изменения концентрации лекарственного вещества (ЛВ) в крови и тканях осуществляли, используя описанные линейные фармакокинетические модели [14]. Основные предположения модели:
-
1. Введение ЛВ в кровь осуществляется одномоментно, в конъюгированном виде.
-
2. ЛВ может находиться в крови в свободном и конъюгированном виде. Конъюгированное
-
3. Из крови почками (печенью) элиминируется только неконъюгированная форма ЛВ. Константа элиминации меньше любой константы поступления ЛВ в ткани.
-
4. Константа поступления неконъюгированной формы ЛВ в ткани одинакова.
-
5. Константа поступления конъюгированной формы ЛВ в ткань 1 существенно превосходит все остальные ткани организма (ткань 2). Поступление конъюгированной формы ЛВ в ткань 2 осуществляется не быстрее, чем свободной.
-
6. Поступление конъюгированной формы ЛВ в ткань по сути означает сочетание 2 процессов: взаимодействия носителя ЛВ и высвобождения ЛВ. Таким образом, в ткани всегда оказывается неконъюгированная форма ЛВ.
-
7. Скорость выведения ЛВ из ткани не зависит от типа ткани.
-
8. Скорость любого процесса пропорциональна концентрации ЛВ.
-
9. Объем крови (тканей) неизменен.
вещество может только распадаться и не может синтезироваться de novo .
При построении модели были использованы следующие основные обозначения:
Ск – концентрация конъюгированной формы ЛВ; к
Ссв – концентрация свободной формы ЛВ в крови;
С1 и С2 – концентрации ЛВ в камерах 1 и 2 соответственно;
kд – константа деструкции конъюгированной формы ЛВ;
kэл – константа экскреции ЛВ печенью или почками;
-
k1 – константа поступления свободной формы ЛВ в ткани из крови;
-
k1’ – константа поступления конъюгированной формы ЛВ в ткань 1;
-
k1” – константа поступления конъюгированной формы ЛВ в ткань 2;
-
k2 – константа поступления ЛВ из ткани в кровь.
Соотношение между константами, следующее из постулатов модели:
-
k 1 ’ > k 1 ≥ k 1 ”.
Исходя из представленных предположений, концентрация ЛВ описывается следующей системой линейных дифференциальных уравнений:
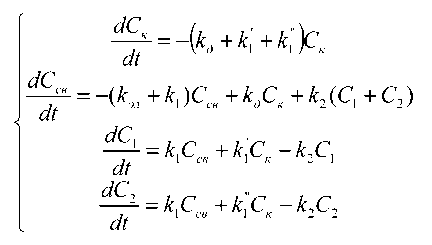
Теоретически данная система уравнений методом преобразований Лапласа может быть на комплексной плоскости сведена к системе линейных алгебраических уравнений, что позволит ее решить в аналитическом виде. Однако получаемое решение является громоздким. Поэтому в работе использовали численное решение методом Рунге-Куты. Решение проводили в программе Excel на основании написанного алгоритма. Шаг по времени - 0,01 ч. Исходную концентрацию конъюгированного препарата предполагали 1 ммоль/мл, свободного - 0 ммоль/мл. к 1 =0,1 ч-1; к 1 ’=0,5 ч-1; к 1 ”=0,01 ч-1; кд =0,005 ч-1; к эл =0,4 ч-1; к 2 =0,2 ч-1. Выбор констант основан на литературных данных для доксорубицина [15] и цисплатины [16, 17]. В дальнейшем осуществляли вариацию констант.
Результаты исследования
Ск – концентрация конъюгированной формы ЛВ; Ссв – концентрация свободной формы ЛВ в крови; С1 и С2 – концентрации ЛВ в камерах 1 и 2 соответственно. Динамика изменений концентраций ЛВ в крови (свободная и конъюгированная формы), таргетной ткани (ткань 1) и других тканях (ткань 2) представлена на рис. 1. Выбранные
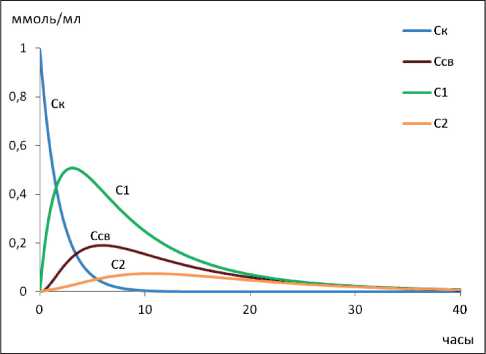
Рис. 1. Динамика изменений концентраций ЛВ
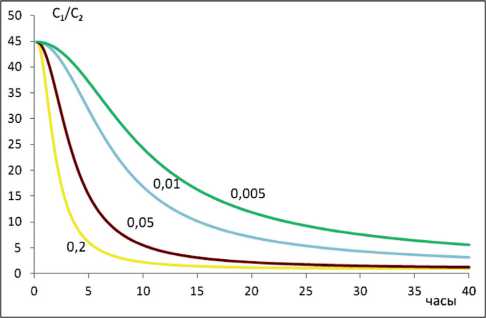
Рис. 2. Изменение соотношения концентраций ЛВ в камерах 1 и 2 в зависимости от времени таблица
Фармакокинетические параметры противоопухолевых средств [18–22]
|
ЛВ |
Время полувыведения |
Связывание |
Выведение |
Способность |
|
(быстрая; медленная фаза) |
с белками крови |
с мочой |
накапливаться в тканях |
|
|
Абраксан |
27 ч |
95 % |
0 % |
Да |
|
Азацитидин* |
41 мин |
Нет данных |
50–85 % |
Да |
|
Актиномицин Д |
36 ч |
Нет данных |
10 % |
Да |
|
Амифостин* |
10 мин для исходного вещества |
Нет данных |
100 % |
Да |
|
Анастразол |
50 ч |
40 % |
0 % |
Нет |
|
Апротитин* |
150 мин; 7–10 ч |
Нет данных |
100 % |
Да |
|
Бендамустин* |
28,3 мин |
95 % |
20 % |
Да |
|
Блеомицин |
2-3 ч |
5 % |
60–70 % |
Нет |
|
Бусульфан* |
2,5 ч |
Нет данных |
40–60 % |
В больших дозах – да |
|
Винбластин |
25 ч |
99 % |
Менее 5 % |
Да |
|
Винкристин |
85 ч |
75 % |
0 % |
Да |
|
Винорелбин |
35 ч |
80 % |
0 % |
Да |
|
Гексаметилметианин |
0,5–3 ч; 4,7–10,2 ч |
50 % |
Порядка 99 % |
Нет данных |
|
Гемцитабин* |
1–7 ч |
5 % |
10–60 % |
Да |
|
Гефитиниб |
35 ч |
90 % |
0 % |
Да |
|
50 % исходное |
||||
|
Гидроксимочевина* |
3–4 ч |
Нет данных |
вещество; 80 % |
Да |
|
метаболиты |
||||
|
10–36 ч для исходного веще- |
97 % исходное веще- |
|||
|
Идарубицин |
ства; 33–60 ч для активного |
ство; 94 % активный |
До 50 % |
Да |
|
метаболита |
метаболит |
|||
|
Имидазол* |
19 мин; 5 ч |
5 % |
40 % |
Частично |
|
Иринотекан |
9 ч |
45 % |
Не более 10 % |
Да |
|
Ирнатиниб |
18 ч |
95 % |
До 20 % |
Да |
|
Ифосфармид |
7 ч |
20 % |
Около 100 % |
Нет |
|
Дакабазин |
5 ч |
20 % |
Около 10 % |
нет |
|
Даунорубицин* |
35–45 мин; 46–54 ч |
Нет данных |
10–25 % |
Да |
|
Доксорубицин* |
1 ч; 20–48 ч |
74–76 % |
40 % |
Да |
|
Доцетаксел* |
4 мин; 11,4 ч |
95 % |
6 % |
Да |
|
Иринотекан |
12 мин |
65 % |
20–25 % |
Нет данных |
|
Капецитабин |
0,6–0,9 ч |
54 % |
84–96 % |
Нет |
|
Карбоплатин |
144 ч |
0 % |
Около 100 % |
Нет |
|
Кармустин* |
0,33 ч |
80 % |
Около 100 % |
Да |
|
Лизомустин |
12 ч |
Нет данных |
40 % |
Нет данных |
|
Ломустин |
16–48 ч; 72 ч |
50 % |
50 % |
Да |
|
Мелфотан |
90 мин |
50–60 % |
50 % |
Нет данных |
|
6–меркаптопурин* |
45 мин; 2,5 ч; 10 ч |
Нет данных |
7–40 % |
Да |
|
Метотрексат |
3–17 ч |
50 % |
80–95 % |
Нет |
|
Митоксантрон |
75 ч |
80 % |
0 % |
Да |
|
Митомицин С |
17 мин |
Нет данных |
10 % |
Нет |
|
Нимустин* |
1 ч |
Нет данных |
Нет данных |
Да |
|
Нитромедазолмоче-вина* |
6–7 мин; у части больных – 17 мин |
Нет данных |
Нет данных |
У части больных – да |
|
Оксалиплатин* |
0,28 ч |
98 % |
58 % |
Да |
|
Ормустин* |
3,5 мин; 109,4 ч |
Нет данных |
Около 100 % |
Да |
|
Паклитаксел* |
3 мин; 52,7 ч |
89–98 % |
10 % |
Да |
|
Пеметрексед* |
20 мин–3,5 ч |
80 % |
Около 100 % |
Да |
|
Пралатрексед |
12–18 ч |
67 % |
30–40 % |
Нет |
|
Прокарбазин |
1 ч |
Нет данных |
100 % |
Нет данных |
|
Ралтитрексед |
32–99 мин |
Мало |
80–95 % |
Нет (при неизмененной функции почек) |
|
Стрептозоцин |
6 мин; 40 мин |
Нет данных |
20 % |
Нет |
Продолжение таблицы
|
ЛВ |
Время полувыведения (быстрая; медленная фаза) |
Связывание с белками крови |
Выведение с мочой |
Способность накапливаться в тканях |
|
Сунитиб |
50 ч |
95 % |
0 % |
Да |
|
Тамоксифен |
240 ч |
99 % |
Менее 5 % |
Да |
|
Тегафур* |
10–25 мин |
Нет данных |
25 % |
Да |
|
Темозоломид* |
2 ч |
15 % |
100 % |
Да |
|
Тиогуанин |
80 мин |
Нет данных |
Более 90 % |
Нет |
|
Тиофосфамид |
20 ч |
Нет данных |
85 % |
Нет данных |
|
Топотекан* |
3 ч |
25 % |
90 % |
Да |
|
Трабектедин* |
175 мин |
97 % |
До 10 % |
Да |
|
1,5 ч для исходного вещества, |
||||
|
Хлорамбуцил |
2,5 ч для активного метабо- |
99 % |
Менее 1 % |
Нет |
|
лита |
||||
|
Циклофосфамид |
2-3 ч для исходного препарата, 65 ч для метаболитов |
12-14 %; ряд метабо-литов до 60 % |
Около 100 % |
Нет |
|
Цисплатин* |
25–49 мин; 58–73 ч |
90–95 % |
27–43 % |
Да |
|
Цитозин* |
10 мин; 1–3 ч |
15 % |
80 % |
Да |
|
Флударабин фосфат* |
30 мин для исходного препарата; 2 ч и более для актив- |
0 % |
40–80 % |
Да |
|
ных метаболитов |
||||
|
Фотомустин* |
7 мин |
25–30 % |
50–60 % |
Да |
|
5–фторурацил |
8–22 мин |
10 % |
20 % |
Нет |
|
Эверолимус |
30 ч |
75 % |
Менее 5 % |
Нет данных |
|
Эксеместран |
24 ч |
90 % |
Менее 10 % |
Нет |
|
Эстрамустин |
20 ч |
Нет данных |
Менее 10 % |
Нет данных |
|
Эпирубицин |
35 ч |
80 % |
0 % |
Да |
|
Эрлотиниб |
36,2 ч |
95 % |
10 % |
Да |
|
Этопозид |
1,5–7 ч |
90–95 % |
40–60 % |
Нет |
Примечание. * – ЛВ, которые по фармакокинетическим параметрам являются перспективными для разработки средств направленного транспорта.
константы позволяют достичь в камере 1 более высокой концентрации ЛВ по сравнению с камерой 2 и сохранять ее таковой в течение некоторого времени. Полученный результат соответствует целям направленного транспорта, так как позволяет повысить доставку ЛВ в ткань-мишень и уменьшить в других тканях, что увеличивает эффективность терапии и снижает вероятность развития побочных эффектов.
Так как через некоторое время после введения концентрации ЛВ в камерах 1 и 2 выравниваются, то для целей направленного транспорта имеет смысл оценить соотношение концентраций ЛВ в этих камерах ( C 1 / C 2 ). Изменение этого соотношения в зависимости от времени при вариации констант представлено на рис. 2. С нашей точки зрения, направленный транспорт ЛВ имеет смысл тогда и только тогда, когда соотношение C 1 / C 2 больше единицы.
Из приведенных рисунков можно сделать следующий вывод. Разница C 1 / C 2 тем дольше сохраняется по времени, чем больше значения kэл , меньше значения кд , к 1 , к 2 и больше отношение к 1 ’ к к 1 ”. То есть ЛВ должно обладать следующими свойствами для того, чтобы имело смысл разрабатывать его направленные формы:
-
- Медленное выведение из тканей (т.е. способность накапливаться в них).
– Быстрое выведение из организма (хотя бы одна из фаз выведения). Заметим, что при построении системы уравнений (1) мы предполагали, что выведение ЛВ - простой процесс, пропорциональный его концентрации. На самом деле из-за поступления и накопления ЛВ в ткани динамика убывания Ссв будет описываться, как минимум, двумя экспонентами. Как показывает численный эксперимент, для целей увеличения соотношения C 1 / C 2 достаточно, чтобы кэл первой фазы было достаточно велико. Это эквивалентно требованию малой величины времени полувыведения первой фазы ЛВ из крови (не более нескольких часов).
-
– Медленное поступление в ткани свободной формы.
– Стабильность получаемого конъюгата ЛВ с носителем. Не имеет смысла использовать для таргетной терапии нестабильные конъюгаты. Увеличение kд приводит к снижению соотношения C/C 2.
В соответствии с приведенными фармакокинетическими параметрами нами был проведен скрининг противоопухолевых ЛВ, чтобы выявить, для каких из них имеет смысл разрабатывать средства направленной доставки (таблица). Как следует из данных, приведенных в таблице, таковыми могут быть азацитидин, амифостин, апротинин, бендаму-стин, бусульфан, гентацабин, гидроксимочевина, даунорубицин, имидазол, доксорубицин, доцетаксел, кармустин, 6-меркаптопурин, ормустин, оксиплатин, паклитаксел, пеметрексед, нимустин, нитромедазолмочевина, тегафур, темозоломид, топотекан, трабектидин, цисплатин, цитозин, флу-дарабин фосфат, фотомустин.
Заключение
Разработка средств направленного транспорта ЛВ – задача медицины будущего. Она позволяет снизить затраты на разработку новых лекарственных препаратов; уменьшить время, необходимое для их разработки; повысить ценовую доступность лекарственной терапии для потребителя и, наконец (что самое главное), повысить эффективность проводимой терапии при снижении потенциального риска развития ее осложнений [23].
В онкологической практике, несмотря на развитие методов ранней диагностики, хирургии, радиотерапии, лазерной терапии, таргетной терапии и т. д., химиотерапия вряд ли потеряет свою актуальность в ближайшее время. В этой связи разработка новых противоопухолевых препаратов является одной из актуальных задач современной консерва- тивной онкологии. При всей значимости процесса поиска новых соединений с противоопухолевой активностью возможности «старых» средств исчерпаны далеко не полностью. Направленный транспорт противоопухолевых средств может подарить им «вторую жизнь» в клинике [24].
Список литературы Моделирование направленного транспорта лекарственных веществ. Часть I. Однократное введение
- Ивонин А.Г., Пименов Е.В., Оборин В.А., Девришов Д.А., Копылов С.Н. Направленный транспорт лекарственных препаратов: современное состояние вопроса и перспективы. Известия Коми научного центра УрО РАН. 2012; 9: 46-55.
- Березов Т.Т., Яглова Н.В., Дмитриева Т.Б., Жирков Ю.А., Чехонин В.П. Направленный транспорт лекарственных средств с помощью липосом. Вестник Российской академии медицинских наук. 2004; 5: 42-47.
- Санжаков М.А., Игнатов Д.В., Кострюкова Л.В., Дружиловская О.С., Медведева Н.В., Прозоровский В.Н., Ипатова О.М. Изучение свойств лекарственных композиций доксорубицина в составе коллоидных наночастиц с адресным фрагментом в экспериментах in vivo. Биомедицинская химия. 2016; 62 (2): 150-153.
- Яббаров Н.Г., Посыпанова Г.А., Воронцов Е.А., Попова О.Н., Северин Е.С. Направленный транспорт доксорубицина: система доставки на основе pamam дендримеров. Биохимия. 2013; 78 (8): 1128-1140.
- Пятаев Н.А., Гуревич К.Г., Заборовский А.В., Кокорев А.В., Минаева О.В., Зырняева Н.А., Кладиев А.А., Бычковский П.П., Ревмтович М.Ю. Эффективность комбинации свободной и полимерсвязанной форм проспидина с доксорубицином у крыс с асцидной гепатомой Зайдела. Химико-фармацевтический журнал. 2014; 48 (11): С.18-22


