Моделирование систем созревания ооцитов свиней in vitro
Автор: Кузьмина Т.И., Новичкова Д.А., Волкова Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Технологии получения трансгенных животных
Статья в выпуске: 2 т.48, 2013 года.
Бесплатный доступ
На основе исследования роли структурных элементов фолликулов свиней в формировании зрелой яйцеклетки и превентивной оценки функционального статуса ооцита (ВСВ-тест) разработана система экстракорпорального дозревания свиных ооцитов, завершивших фазу роста in vivo или in vitro, которая позволяет получать до 45 % эмбрионов на стадиях поздней морулы и бластоцисты.
Клеточные технологии репродукции, свинья, ооциты, эмбрионы, оплодотворение in vitro, всв-тест
Короткий адрес: https://sciup.org/142133393
IDR: 142133393 | УДК: 636.4:591.465.12:576.3/.7.086.83
Текст научной статьи Моделирование систем созревания ооцитов свиней in vitro
Возможность получения необходимого количества биологически полноценных нативных или реконструированных эмбрионов свиней in vitro позволит решить ряд важнейших проблем внедрения инновационных клеточных репродуктивных технологий (трансплантация эмбрионов, трансгенез, клонирование, получение эмбриональных стволовых клеток) в свиноводство, биомедицину, фармакологию (1-3). Несмотря на то, что основные подходы к методу разработаны и о рождении потомства из ооцитов, созревших in vitro, сообщается в научных публикациях, выход ооцитов на стадии метафазы II продолжает оставаться низким по сравнению с результатами, полученными in vivo (4). При оплодотворении свиных ооцитов, созревших in vitro, наблюдается высокая доля полиспермии, нарушений процесса формирования мужского пронуклеуса (5). Недостаточное число эмбрионов на стадии бластоцисты значительно лимитирует эксперименты по созданию линий эмбриональных стволовых клеток. Все это свидетельствует об актуальности разработки эффективных систем дозревания in vitro, позволяющих повышать выход зрелых яйцеклеток свиней.
Цель настоящего исследования — на основе использования маркеров ядерно-цитоплазматического созревания ооцитов (статуса хроматина и митохондриальной активности) in vitro смоделировать систему дозревания свиных ооцитов, завершивших фазу роста in vivo или in vitro, для их использования в клеточных репродуктивных технологиях.
Методика . Объектом исследования служили ооцит-кумулюсные комплексы (ОКК), выделенные от свиней породы ландрас (6-8 мес), соматические клетки овариальных фолликулов, доимплантационные эмбрионы. Ооцит-кумулюсные комплексы аспирировали из фолликулов диаметром 35 мм. Для получения оболочек фолликулов их оценивали по степени васкуляризации и тургору. Фолликулярную жидкость аспирировали из фолликулов диаметром 3-5 мм с высоким тургором и обширной сетью капилляров. Отбор ОКК для экспериментов, оценку качества фолликулов, получение стенок фолликулов и фолликулярной жидкости, определение интенсивности флуоресценции MitoTracker Orange CMTMRos (M 7510; Molecular Probes, «Eugene, OR», США) в ооцитах проводили методами, описанными нами ранее (6, 7). Интенсивность флуоресценции (мкА/ооцит)
измеряли с помощью флуориметра (Nikon Photometry System P 100, «Nikon», Dusseldorf, Германия). Режимы культивирования и оплодотворения ооцитов свиней in vitro, а также культивирования доимплантационных эмбрионов соответствовали разработанным рекомендациям (6). Оценку функционального состояния исходной популяции ооцитов с помощью ВСВ-теста осуществляли согласно описанной нами ранее процедуре для ВСВ-теста ооцитов коров, модифицированной за счет уменьшения рабочей концентрации раствора бриллиантового кристаллического голубого — ВСВ (brilliant cresyl blue) (B-5388, «Sigma», США) до 13 мМ и времени обработки до 60 мин (8). По истечении периода воздействия ВСВ ооциты с голубой окраской цитоплазмы учитывались как завершившие фазу роста (ВСВ + ), неокрашенные — как растущие (ВСВ - ). Статус хроматина ооцитов и эмбрионов оценивали по методу A. Tarkowski (9). Сравнивали три системы культивирования: в I использовали синтетическую питательную среду NCSU 23 (North Carolina State University), которую готовили по прописи R.M. Petters и K.D. Wells (1993), изложенной нами ранее в методических рекомендациях (6), с добавлением хорионического гонадотропина человека и хорионического гонадотропина лошади (по 10 МЕ) (основная модель — ОМ, контроль); к составу ОМ во II системе добавляли 10 % фолликулярной жидкости (ФЖ, диаметр фолликулов 3-5 мм), в III — стенки фолликулов (СФ, диаметр фолликулов 3-5 мм), в IV — 10 % ФЖ и СФ.
Для сравнения результатов, полученных в опытных и контрольных группах, использовали критерий х 2 или t -критерий Стьюдента (статистическая программа Sigma Stat). Достоверность различия средних значений оценивали при трех уровнях значимости — P < 0,05; P < 0,01 и P < 0,001 для 3-5 независимых экспериментов.
Результаты . Общая схема опытов приведена на рисунке.
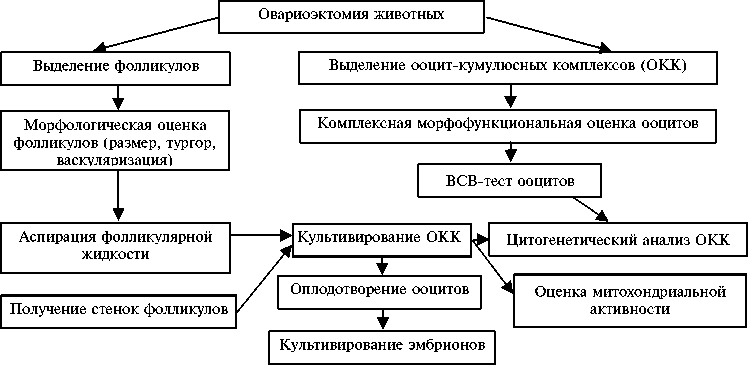
Моделирование систем дозревания ооцита — важная составляющая эмбриотехнологий. Развитие эмбрионов вне организма прямо зависит от того, насколько условия культивирования in vitro адекватны физиологическому процессу (10, 11). Популяция ооцитов, выделяемых из яичников свиней-доноров, гетерогенна. Прижизненное тестирование ооцитов с применением красителя BCB в качестве индикатора активности глюкозо-6-фос-фатдегидрогеназы (G6PDH) позволяет использовать отобранные клетки для последующего культивирования, оплодотворения и получения эмбрионов. ВСВ выявляет интрацеллюлярную активность G6PDH — ключевого фер- мента пентозофосфатного цикла, играющего важную роль в клеточном росте. В растущем ооците активность фермента повышается, к завершению роста — снижается. Нетоксичность указанного красителя при определении активности G6PDH была показана для овечьих ооцитов, независимо от их размера, а также при определении компетенции ооцитов к мейо-тическому дозреванию (12). Ранее обнаружено, что у свиней в фолликулах диаметром 3-5 мм содержится 71 % завершивших рост ооцитов (ВСВ+) и 29 % — растущих (ВСВ-) (7). In vivo ооциты созревают в фолликуле, функциональная активность его структурных элементов (клетки теки, гранулезы) и ФЖ обеспечивают завершение мейотического созревание и формирование зрелой яйцеклетки. В связи с этим для моделирования системы дозревания ооцитов свиней мы использовали стенки фолликула и фолликулярную жидкость, вводя эти компоненты в состав сред для культивирования. В экспериментах использовали клетки, которые по предварительной оценке в тесте с ВСВ были отнесены к группам завершивших рост и растущих ооцитов.
1. Показатели, характеризующие созревание ооцитов свиней при 44-часовом культивировании в разных системах
|
Система культивирования |
ВСВ-диа-гностика |
Число ооцитов (доля, %) |
|||
|
всего |
мейоз |
на стадии |
дегенери- |
||
|
не реинициирован| реинициирован |
метафазы II |
рованных |
|||
В таблице 1 отражены данные экспериментов по культивированию растущих и завершивших рост ооцитов в различных системах. Через 44 ч дозревания основная часть ооцитов во всех группах реинициировала мейоз (91-93 %), лишь 7-10 % клеток оставались на стадии диплотены. Проявились достоверные различия по числу вступивших в стадию метафазы II ооцитов между контрольным вариантом, когда ВСВ-тест не проводили, и всеми исследуемыми группами при использовании клеток, завершивших рост до начала культивирования (ВСВ+). В 78-88 % этих ооцитов (независимо от системы культивирования) произошло мейотическое созревание. Из яйцеклеток, отнесенных перед культивированием к категории растущих, через 44 ч окончательной стадии мейоза достигли 48-58 %. Кроме того, во всех исследуемых группах мы не обнаружили достоверных различий по числу ооцитов с дегенерированным хроматином. То есть в целом была показана возможность достижения ооцитами, не завершившими фазу роста, стадии метафазы II in vitro.
Формирование зрелой яйцеклетки, готовой к оплодотворению и последующему развитию эмбрионов, представляет собой комплексный процесс преобразований хроматина (ядерное созревание) и компартментов ооплазмы. Все события в клетке, так или иначе связанные с энергетиче- ским обменом, зависят от клеточного дыхания, важная составляющая которого — окислительное фосфорилирование. Функциональная активность митохондрий детерминирует цитоплазматическое созревание ооцита (13). Ее определение позволят разработать высокоинформативные метаболические тесты биологической полноценности яйцеклеток. Использование прижизненных красителей, в частности MitoTracker Orange CMTMRos M 7510, специфически связывающегося с активными митохондриями, позволяет оценивать функциональный статус ооцита.
2. Интенсивность флуоресценции в ооцитах свиней при 44-часовом культивировании в разных системах (MitoTracker Orange CMTMRos, мкА/ооцит)
|
Система культивирования | |
ВСВ-диагностика |
n |
| Интенсивность флуоресценции |
|
NCSU 23 + гормоны (контроль) |
Б.д. |
47 |
178,0±17,9a |
|
+ |
44 |
169,4±21,3b |
|
|
- |
39 |
390,3±17,2c |
|
|
NCSU 23 + гормоны + 10 % ФЖ |
Б.д. |
45 |
181,3±18.6d |
|
+ |
41 |
151,1±17,1e |
|
|
- |
38 |
395,4±21,2f |
|
|
NCSU 23 + гормоны + СФ |
Б.д. |
45 |
168,9±18,1j |
|
+ |
41 |
142,0±22,8k |
|
|
- |
37 |
376,2±15,3l |
|
|
NCSU 23 + гормоны + 10 % ФЖ + СФ |
Б.д. |
45 |
158,4±15,1m |
|
+ |
44 |
118,9±17,4n |
|
|
- |
37 |
281,0±15,7o |
Примечание. Б.д. — без диагностики, «+»/« - » — результаты теста; NCSU 23 — синтетическая питательная среда; гормоны — 10 МЕ хорионического гонадотропина человека + 10 МЕ хорионического гонадотропина лошади; ФЖ — фолликулярная жидкость (диаметр фолликулов 3-5 мм); СФ — стенки фолликулов (диаметр фолликулов 3-5 мм). Достоверность различия сравниваемых значений ( t -критерий Стьюдента) для b:c; a:c; d:f; e:f; j:l; k:l; m:o; n:o — p < 0,001, для c:o; f:o; l:o; b:n; e:n; m:n — p < 0,01.
При сравнении интенсивности флуоресценции MitoTracker Orange CMTMRos M 7510 в растущих и завершивших рост ооцитах свиньи после их дозревания в различных системах мы выявили достоверные различия во всех исследуемых группах (табл. 2). К завершению культивирования (44 ч) у ВСВ - ооцитов отмечались высокие значения флуоресценции независимо от модели культивирования (см. табл. 2). Для ВСВ - ооцитов после культивирования в среде с гормонами, фолликулярной жидкостью и стенками фолликулов показатели были ниже, чем у той же категории клеток, дозревавших в остальных системах. Обнаружились достоверные различия в интенсивности флуоресценции между ВСВ+ ооцитами, созревавшими в присутствии гормонов, структурных элементов фолликулов и фолликулярной жидкости, и ВСВ+ клетками в вариантах, когда в состав среды входили гормоны и фолликулярная жидкость. Факт снижение интенсивности флуоресценции использованного прижизненного красителя после культивирования можно оценивать как свидетельство завершения цитоплазматического созревания формирующейся яйцеклетки и подготовки к блоку мейоза на стадии метафазы II.
При изучении эффективности оплодотворения ооцитов и культивирования полученных свиных эмбрионов (табл. 3) на основе анализа частоты дробления и развития до стадий поздних морул и бластоцист была выявлена система, обеспечивающая дозревание ооцитов, завершивших фазу роста как in vitro (ВСВ - ), так и in vivo (ВСВ+). Система обеспечивала высокий выход эмбрионов на стадиях поздних морул и бластоцист (соответственно 12 и 45 %) по сравнению с другим экспериментальными группами (в них этот показатель составил от 3 до 21 %).
Таким образом, было показано, что созревание завершивших фазу роста ооцитов свиней in vivo или in vitro в системе с фолликулярной жидкостью и стенками фолликулов благоприятно сказывается на формировании зрелой яйцеклетки in vitro и дальнейшем развитии эмбрионов. Оче- видно, ввиду того, что основная роль клеток гранулезы — стероидогенез и эстрадиол активно вовлекается в процесс созревания яйцеклетки, при наличии соматических фолликулярных клеток (стенки фолликула) в средах для культивирования может дополнительно увеличиваться продукция эстрадиола, способствующего приобретению ооцитами компетенции к завершению мейотического созревания и формированию зрелой яйцеклетки.
-
3. Показатели развития у доимплантационных свиных эмбрионов из ооцитов, завершивших фазу роста in vivo и in vitro, в разных системах культивирования
Итак, на основе превентивной оценки функционального статуса ооцита (ВСВ-тест) с учетом маркеров ядерно-цитоплазматического созревания (состояние хроматина и митохондриальная активность) разработана система экстракорпорального дозревания ооцитов, завершивших фазу роста in vivo или in vitro. Компонентами используемой при этом среды служат стенки фолликула и его жидкость. При использовании системы выход свиных эмбрионов на стадиях поздней морулы и бластоцисты достигает 45 %.


