Моделирование влияния формы кровеносного капилляра на фильтрационно-реабсорбционные процессы
Автор: Шабрыкина Н.С., Висталин Н.Н., Глачаев А.Г.
Журнал: Российский журнал биомеханики @journal-biomech
Статья в выпуске: 1 (23) т.8, 2004 года.
Бесплатный доступ
В данной работе представлен ряд усовершенствований известной модели фильтрационно-реабсорбционных процессов в кровеносном капилляре, позволяющих учитывать геометрию и особенности строения реального капилляра. Рассмотрены случаи капилляра с переменным радиусом пор в его стенке, конического капилляра и капилляра с локальным сужением стенок.
Фильтрационно-реабсорбционные процессы, форма кровеносного капилляра, математическое моделирование
Короткий адрес: https://sciup.org/146215787
IDR: 146215787 | УДК: 531/534:57+612.7
Текст научной статьи Моделирование влияния формы кровеносного капилляра на фильтрационно-реабсорбционные процессы
Обмен веществ между кровью и клетками ткани происходит на уровне микроциркуляторного русла, где жидкость и растворенные в ней вещества, а также частично макромолекулы переходят сквозь полупроницаемую стенку кровеносного капилляра в интерстициальное пространство, где происходит обмен веществ с клетками ткани. После чего жидкость частично всасывается обратно в кровеносное русло, частично – в лимфатические капилляры.
Среди многообразных механизмов переноса жидкости и макромолекул через полупроницаемую мембрану сосудистой стенки наибольшего внимания заслуживают фильтрация (вызывается гидростатическим градиентом давлений внутри и вне сосуда), диффузия (обеспечивается концентрационным градиентом давлений) и везикулярный транспорт (поддерживается физиологической активностью клеточных структур) [7, 8]. Последний механизм в данной работе не рассматривается.
Первым исследователем, предположившим, что переход жидкости из крови в межклеточное пространство обусловлен не только фильтрацией, но и диффузией, был Э. Старлинг [5]. Согласно его гипотезе объемная скорость движения жидкости через капиллярную стенку J определяется соотношением гидростатического и коллоидноосмотического давления в капилляре и межклеточной жидкости:
J = C [( Р ГК — Р ГТ )- ( P OK - P OT )] , (1) где PГК – гидростатическое давление в капилляре, PГТ – гидростатическое давление в тканевой жидкости, PОТ – онкотическое давление тканевой жидкости, PОК – онкотическое давление плазмы в капилляре, C – коэффициент гидравлической
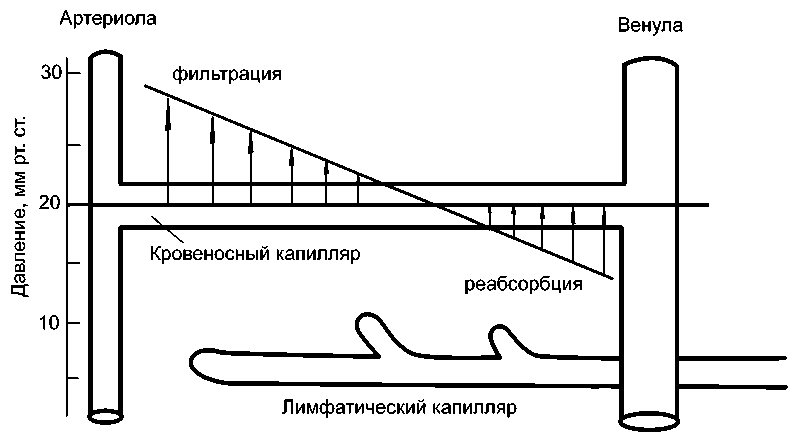
Рис. 1. Схема типичного капилляра, иллюстрирующая фильтрационно-реабсорбционную гипотезу Старлинга [5]
проницаемости капиллярной стенки. Данное уравнение носит название закона Старлинга. Когда величина J положительна, происходит фильтрация жидкости из капилляра, когда отрицательна – жидкость переходит из межклеточного пространства в капилляры – происходит реабсорбция.
По предположению Старлинга в межклеточном пространстве гидростатическое давление PГТ и онкотическое давление PОТ одинаковы. Поэтому он считал, что на артериальном конце капилляра, где велико гидростатическое давление, происходит фильтрация жидкости из сосуда, а на венозном – гидростатическое давление падает и в результате происходит реабсорбция (рис. 1). В некоторой точке капилляра отсутствует как фильтрация, так и реабсорбция, поскольку здесь давления, вызывающие фильтрацию и реабсорбцию, равны. Кроме того, Старлинг полагал, что в нормальных условиях фильтрация жидкости несколько превышает ее реабсорбцию, так что часть жидкости остается в межклеточном пространстве, откуда впоследствии поступает в лимфатическую систему.
Следует отметить, что гипотеза Старлинга была подтверждена экспериментами [4, 5] и до сих пор является основой представлений о транскапиллярном обмене веществ.
Математическая модель фильтрационно-реабсорбционных процессов в кровеносном капилляре
Рассмотрим математическую модель процессов, происходящих в микроциркуляторном русле. Данные процессы можно разделить на три этапа: движение жидкости в кровеносном капилляре параллельно с ее фильтрацией и реабсорбцией в межклеточное пространство; движение жидкости в межклеточном пространстве; абсорбция и движение в лимфатическом капилляре [8].
Будем рассматривать течение плазмы крови, которую можно считать ньютоновской (линейно-вязкой) жидкостью. Влияние форменных элементов крови (эритроцитов, лимфоцитов и т.д.) не учитывается. Течение считается ламинарным и стационарным. Кровеносный капилляр моделируется жесткой трубкой с порами в стенке.
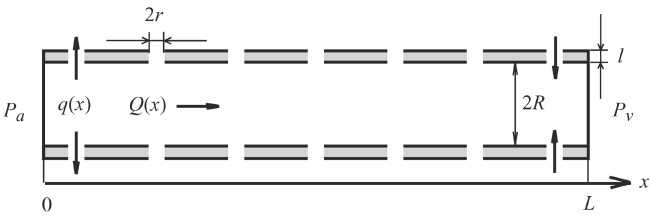
Рис. 2. Модель кровеносного капилляра: r – радиус поры в стенке капилляра, R – радиус капилляра, L – его длина, l – толщина стенки, Pa – давление на артериальном конце, Pv – на венозном, Q ( x ) – объемная скорость течения жидкости вдоль капилляра, q ( x ) – объемная скорость течения жидкости через все поры на поверхности капилляра единичной длины [6]
Проанализируем течение жидкости в кровеносном капилляре. Рассмотрим два одновременно протекающих процесса: движение жидкости вдоль капилляра и поперек через поры в его стенке (рис. 2). Для описания течения вдоль капилляра используется закон Пуазейля, для описания движения жидкости через поры в стенке капилляра – закон Старлинга. Такой подход описан в работе [6].
Перейдем к построению модели. Объемная скорость течения воды через поры равна уменьшению объемной скорости ее течения по капилляру на длине dx :
dQ ( x ) = - q ( x ) dx .
По закону Пуазейля для "продольного" течения по капилляру
Q(x) = - 1 dP(x) W dx
.
Величина P ( x ) = PГК ( x ) - PГТ – результирующее гидростатическое давление (разность между гидростатическим давлением в капилляре и ткани). При этом считается, что гидростатическое давление в ткани неизменно. Удельное гидравлическое сопротивление капилляра единичной длины имеет вид:
W = 8 η ,
π R 4
где η – коэффициент вязкости жидкости.
Для «поперечного» течения через поры в стенке капилляра применим закон Старлинга:
q ( x ) = P ( x ) - P o , w
где результирующее онкотическое давление Po = PОК - PОТ считается постоянным.
Величина
8 η l 4 η l
w= =
πr4N2πR π2r4NR представляет собой гидравлическое сопротивление всех пор на поверхности капилляра единичной длины. Обозначая λ = w и подставляя (3) и (4) в (2), получим W дифференциальное уравнение второго порядка:
d 2P(x) P(x)
- =- dx 2 λ2
Решение данного уравнения имеет вид:
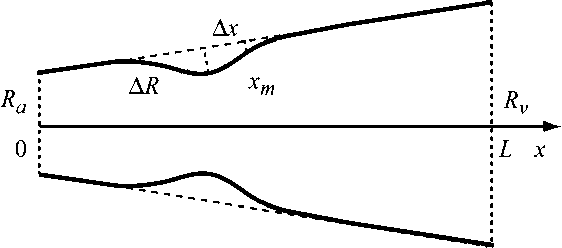
Рис. 3. Схематическое изображение конического капилляра с локальным сужением xx
— --
P ( x ) = Ae х + Be х + P o .
Коэффициенты A и B определяются из граничных условий на величины гидростатического давления на артериальном (x = 0) и венозном (x = L) концах капилляра:
P (0) = P a , P ( L ) = P v .
Описанная выше модель хорошо известна и применяется в учебной литературе для качественного описания обменных процессов, происходящих в идеализированном кровеносном капилляре. Далее рассмотрим несколько усовершенствований данной модели, позволяющих учесть некоторые особенности реальных капилляров.
Реальные капилляры часто имеют вид конических трубочек, обычно расширяющихся к венозному концу [7,8]. Радиус пор также непостоянен и увеличивается к венозному концу капилляра [7, 8].
Первым усовершенствованием модели является учет изменяющегося радиуса пор в стенке капилляра. Был рассмотрен случай линейного изменения радиуса пор. В этом случае радиус зависит от продольной координаты по формуле:
r ( x ) = M x + r a , (8)
где ra и rv - радиус пор на артериальном и венозном концах капилляра, соответственно. В этом случае коэффициенты w и λ будут зависеть от x , и уравнение (5) не будет иметь очевидного аналитического решения. Поэтому в этом и последующих случаях решение граничной задачи осуществлялось численно с помощью метода отложенных поправок [2].
Рассмотрим теперь случай конического капилляра (рис. 3). Радиус капилляра считается линейно зависящим от x :
R -R
R ( x ) = R a + л , (9)
где R a и R v - радиусы капилляра на артериальном и венозном концах. В этом случае гидравлическое сопротивление капилляра W также будет зависеть от продольной координаты x .
Для капилляра с измененной геометрией объемная скорость течения жидкости через поры в его стенке направлена по нормали к стенке в данной точке и считается пропорциональной разности результирующих давлений в капилляре и ткани в этом направлении. Таким образом, и для капилляра с сужением считается справедливым уравнение (4).
Еще один интересный случай - локальные изменения радиуса капилляра, например, отложения на стенках капилляра (рис. 3). Зависимость радиуса от продольной координаты задавалась в следующем виде:
R ( x ) = R a + R v R a x - ae bx + cx 2 ,
x m 2 x 1
где a =-AR • e2 A x , b = —- и c =---. Здесь A R - максимальная величина
A x 2 2 A x 2
сужения, x m - координата центра сужения (точка максимального сужения), A x -расстояние от точки перегиба функции y = aebx + cx 2 до центра сужения - характеризует протяженность сужения (рис. 3).
Результаты
На рис. 4 представлены зависимости от координаты x давления (а) и объемной скорости продольного (б) течения, полученные с помощью описанной модели для цилиндрического капилляра с постоянным радиусом пор. Для небольшого радиуса пор графики давления показывают хорошее соответствие с результатами, предсказанными Старлингом, и экспериментальными данными [3, 4]. При больших радиусах пор проявляется нелинейность изменения гемодинамических параметров вдоль капилляра.
При увеличении радиуса пор область равновесия становится более протяженной. Тот же эффект получается при увеличении количества пор в стенке капилляра.
На рис. 5 представлено изменение распределения давления при повышении артериального или венозного давления. Видно, что эти изменения приводят к нарушению равновесия: фильтрация преобладает над реабсорбцией и в ткани остается избыточная жидкость. Тот же эффект достигается при уменьшении результирующего онкотического давления. Данные результаты согласуются с экспериментальными данными [3, 4]. Избыточная жидкость, остающаяся в ткани при превышении фильтрации над реабсорбцией, поступает в лимфатический капилляр.
Ситуация, когда реабсорбция преобладает над фильтрацией, возникает либо при уменьшении артериального или венозного давления, либо при увеличении результирующего онкотического давления.
На рис. 6 представлен профиль давления при линейно увеличивающемся радиусе пор в стенке капилляра. Видно, что он совмещает в себе черты графиков для малого (ближе к артериальному концу) и большого (ближе к венозному концу) радиуса пор. Сначала давление понижается почти линейно, но на этапе реабсорбции линейный характер распределения нарушается. Кроме того, фильтрация будет превышать реабсорбцию тем больше, чем сильнее увеличивается радиус пор в стенке капилляра.
Профили давления для конического капилляра показаны на рис. 7. В этом случае даже для небольшого радиуса пор наблюдается нелинейное распределение давления по длине капилляра. Расширение капилляра к венозному концу приводит к более быстрому падению давления в капилляре и, как следствие, к увеличению участка реабсорбции. При этом преобладание реабсорбции над фильтрацией увеличивается с увеличением угла раствора а .
Рис. 8 показывает распределение давления для конического капилляра с увеличивающимся радиусом пор. Видно, что увеличивающийся радиус пор несколько компенсирует преобладание реабсорбции, вызванное увеличением радиуса капилляра.
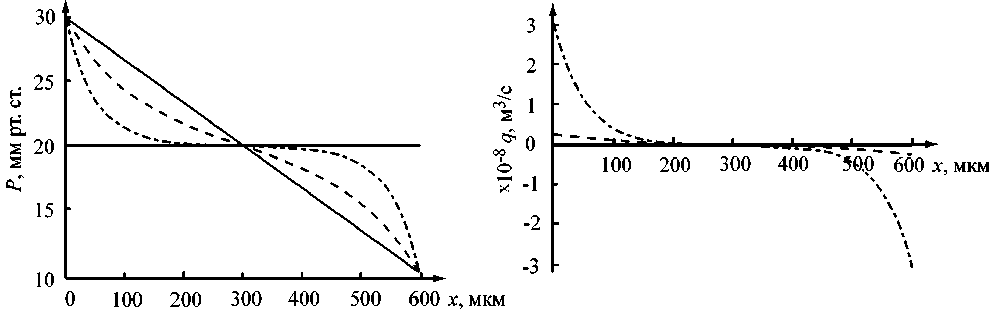
а
б
Рис. 4. Распределение гемодинамических величин вдоль кровеносного капилляра для различных радиусов пор: r = 20 нм (сплошная линия), r = 100 нм (пунктирная линия), r = 200 нм (штрих-пунктирная линия). Расчетные данные: P a = 30 мм рт.ст., P v = 10 мм рт.ст., P o = 20 мм рт.ст., R = 3,5 мкм, l = 0,9 мкм, п = 0,001 Па^с, N = 1,5 • 1012 1/м2 [6, 7]
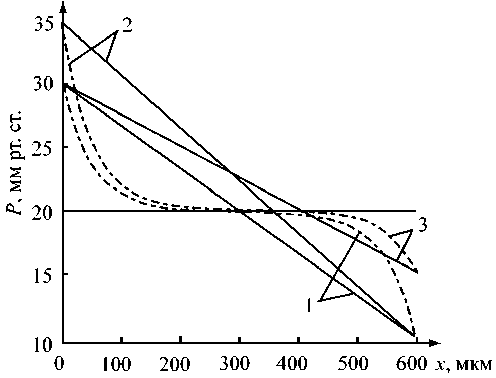
Рис. 5. Влияние повышения венозного давления P v = 15 мм рт.ст. (2) и артериального давления P a = 35 мм рт.ст. (3) на распределение гемодинамических величин вдоль кровеносного капилляра для различных радиусов пор: r = 20 нм (сплошная линия), r = 200 нм (штрих-пунктирная линия). 1 - распределение в норме: P a = 30 мм рт.ст., P v = 10 мм рт.ст., Po = 20 мм рт.ст.
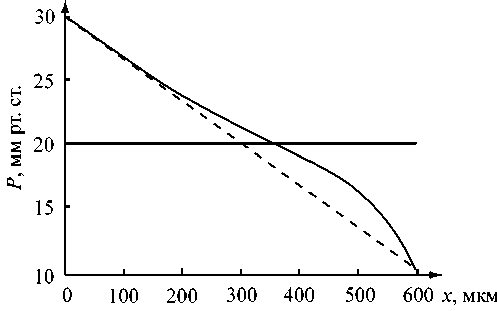
Рис. 6. Влияние линейного увеличения радиуса пор в капилляре: r a = 50 нм, r v = 150 нм (сплошная линия), r = const = 50 нм (пунктирная линия)
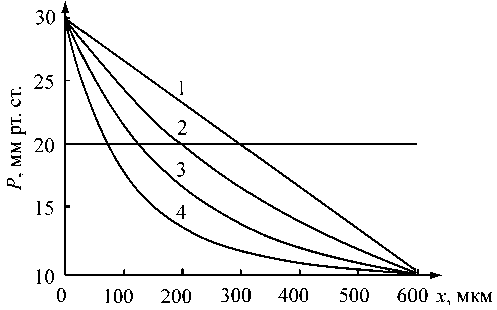
Рис. 7. Распределение давления в коническом капилляре с различным углом раствора: Ra = 3,5 мкм, R v = 3,5 мкм (1), Rv = 5 мкм (2), Rv = 7 мкм (3), Rv = 10,5 мкм (4)
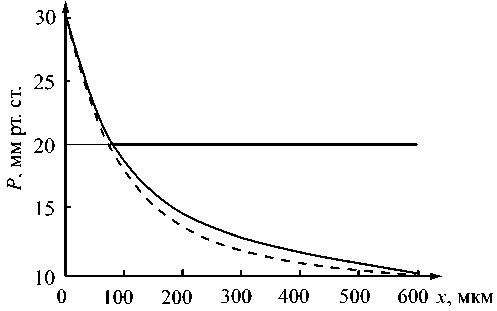
Рис. 8. Распределение давления в коническом капилляре с увеличивающимся радиусом пор: Ra = 3,5 мкм, Rv = 10,5 мкм, ra = 50 нм, rv = 150 нм (сплошная линия); r = const = 50 нм (пунктирная линия)
На рис. 9 представлены профили давления для конического сосуда с локальным сужением. Наличие дефекта, как и следовало ожидать, сильно изменяет характер распределения давления. Сужение капилляра приводит к увеличению давления в районе начала дефекта, вызывая как следствие усиление фильтрации. Затем, в наиболее узкой части капилляра, происходит падение давления, величина которого тем больше, чем более выражен дефект. В результате давление опускается до величины меньшей, чем давление в соответствующей точке нормального конического капилляра, что приводит к усилению реабсорбции на оставшемся участке капилляра. Таким образом, наличие сужения капилляра приводит к усилению как фильтрационных, так и реабсорбционных процессов и существенно влияет на обмен жидкости между капилляром и тканью.
Изменение профиля давления для капилляра с дефектом зависит от расположения, величины и протяженности этого дефекта (рис. 9). Чем больше величина и протяженность дефекта, тем сильнее он влияет на фильтрационно-реабсорбционные процессы в капилляре. Расположение сужения у артериального конца капилляра изменяет распределение давления практически на всей длине капилляра (рис. 9б). Если же дефект расположен у венозного конца, то на значительной части капилляра существенных изменений давления не наблюдается (рис. 9а).
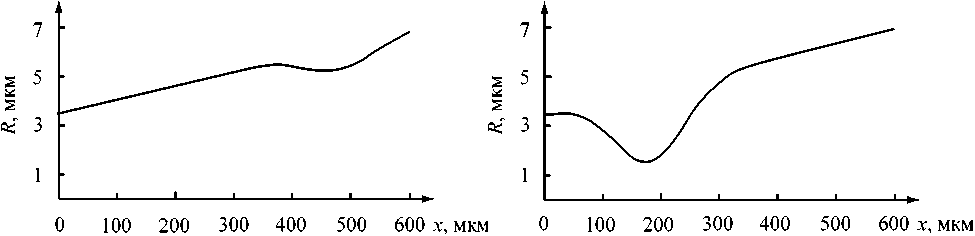
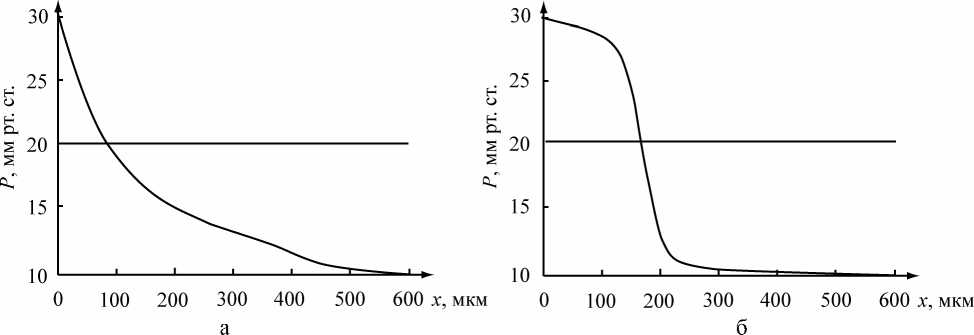
Рис. 9. Зависимость радиуса капилляра от координаты и распределение давления в коническом капилляре с локальным сужением стенок: (а) слабый дефект у венозного конца: R ( x ) = 3,5 + 0,583 - 10 2 x - 0,127 - 10 - 13 e 0,133 x - 0 , 139 - 10 x мкм, A R = 1 мкм, x m = 480 мкм,
A x = 60 мкм; (б) сильный дефект у артериального конца капилляра: A R = 3 мкм, x m = 180 мкм, A x = 60 мкм, R ( x ) = 3,5 + 0,583 - 10 2 x - 0,033 e0,050 x - 0 , 139 - 10 x мкм
Выводы
В работе рассмотрена простейшая модель фильтрации и реабсорбции жидкости в кровеносном капилляре. Эта модель позволяет качественно оценить зависимость гидростатического давления, объемной скорости течения жидкости вдоль капилляра и сквозь поры в его стенке от продольной координаты. Представлен ряд усовершенствований известной модели, позволяющие учитывать геометрию реального кровеносного капилляра и особенности его строения. Полученные зависимости качественно совпадают с данными экспериментальных наблюдений [3, 4] и результатами, полученными с помощью других моделей [1].


