Модифицированная пластика дистального сегмента дуги аорты с использованием тканей левой общей сонной артерии у новорожденного с предуктальной коарктацией аорты и гипоплазией дистальной дуги аорты в сочетании с атипичным течением мышечного дефекта межжелудочковой перегородки (клинический случай)
Автор: Грехов Е.В., Морозов А.А., Латыпов А.К., Мирончук Р.Р., Котин Н.А., Никифоров В.Г., Ляпунова А.А., Татаринова Т.Н., Васичкина Е.С., Первунина Т.М.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Случаи из клинической практики
Статья в выпуске: 1 т.23, 2019 года.
Бесплатный доступ
Лечение коарктации аорты в сочетании с гипоплазией дистального сегмента дуги аорты в периоде новорожденности является сложной и актуальной задачей. Возможное сочетание обструктивного поражения аорты с внутрисердечными дефектами требует комплексного подхода к ведению данной группы пациентов. Коррекция сочетанного порока может быть достигнута одномоментным устранением патологии аорты с коррекцией внутрисердечных дефектов, а также путем этапного хирургического лечения. Отсутствие гемодинамической значимости септальных дефектов при первичной оценке гемодинамического статуса пациента позволяет воздержаться от необходимости традиционного суживания легочной артерии на первом этапе оперативного лечения и не требует дополнительных вмешательств в дальнейшем. Мы представляем клинический случай устранения коарктации аорты в сочетании с гипоплазией дистальной дуги аорты у новорожденного пациента с использованием модифицированной пластики тканями левой общей сонной артерии в сочетании с атипичным течением мышечного дефекта межжелудочковой перегородки, осложнившегося выраженными нарушениями трахеобронхиальной проходимости, что потребовало проведения этапного хирургического лечения, в том числе направленного на нормализацию пространственных взаимоотношений органов средостения. Клинический случай будет полезен детским кардиологам и кардиохирургам при ведении данной группы пациентов.
Гипоплазия дуги аорты, дефект межжелудочковой перегородки, клинический случай, коарктация аорты
Короткий адрес: https://sciup.org/142230683
IDR: 142230683 | DOI: 10.21688/1681-3472-2019-1-71-77
Текст научной статьи Модифицированная пластика дистального сегмента дуги аорты с использованием тканей левой общей сонной артерии у новорожденного с предуктальной коарктацией аорты и гипоплазией дистальной дуги аорты в сочетании с атипичным течением мышечного дефекта межжелудочковой перегородки (клинический случай)
Сочетание коарктации аорты с дефектом межжелудочковой перегородки — достаточно частое явление, встречающееся, по данным M.D. Plunkett и соавт., в 25,7% случаев [1]. У пациентов неонатального возраста ассоциированная с коарктацией гипоплазия дуги аорты выявляется от 65 [2] до 81% случаев [3], при этом в более 80% случаев определяется гипоплазия дистальной дуги, включающая сегмент между левой общей сонной артерией (ЛОСА) и левой подключичной артерией (ЛПклА) [4].
В литературе представлен широкий спектр хирургических методов, используемых для устранения обструкции дуги аорты как при этапной, так и одномоментной коррекции порока. Одним из таких методов является модифицированная пластика дистального сегмента аорты тканями левых общей сонной и подключичной артерий [ 5 ]. Однако протяженность

Статья доступна по лицензии Creative Commons Attribution 4.0.
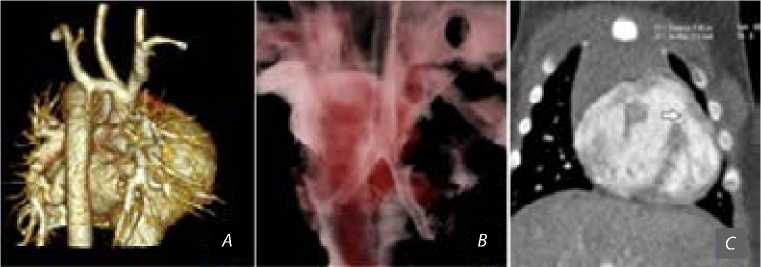
Рис. 1. Дооперационное состояние аорты, бронхов и межжелудочковой перегородки исходная анатомия дуги аорты и коарктация аорты ( A ); проходимость трахеобронхиального дерева ( B ); дефект межжелудочковой перегородки, отмечен стрелкой ( C )
дистального сегмента дуги может варьировать, а диаметр левой подключичной артерии, как правило, имеет меньший диаметр, по сравнению с левой общей сонной артерией, что может привести к субоптимальному гемодинамическому результату.
В настоящей работе мы приводим описание коррекции у новорожденного коарктации аорты в сочетании с гипоплазией дистальной дуги и дефектом межжелудочковой перегородки с помощью модифицированной пластики дистального сегмента аорты с использованием тканей левой общей сонной артерии с сохранением ее непрерывности, а также описываем атипичное течение мышечного дефекта межжелудочковой перегородки.
Клинический случай
Новорожденная девочка, массой тела 4 кг, осмотрена кардиологом на первые сутки жизни в связи с выявлением систолического шума. По данным эхокардиографического исследования выявлена предук-тальная коарктация аорты с гипоплазией дистального отдела дуги аорты в сочетании с гемодинамически незначимым мышечным дефектом межжелудочковой перегородки. Для уточнения анатомических особенностей дуги аорты проведена мультиспиральная компьютерная томография (МСКТ) (рис. 1, А ), по данным которой диаметр аорты на уровне синотубулярного соединения составил 7,5×7 мм, восходящий отдел аорты — 7×8 мм (Z-score –1,33; здесь и далее при расчетах использован калькулятор Boston Children’s Hospital; zscore.chboston.org ), проксимальнее отхождения брахиоцефального ствола (БЦС) — 6×7 мм, между БЦС и ЛОСА — 5×6 мм, дистальнее ЛОСА — 3,5×4,0 мм (Z-score –3,34), дистальнее отхождения
ЛПклА — 2 мм (Z-score –3,7), ЛОСА — 3,5×4,0 мм, ЛПклА — 3,5 мм, протяженность дистального сегмента дуги аорты между ЛОСА и ЛПклА — 12 мм, нисходящий отдел аорты — 7,0×8,5 мм, открытый артериальный проток — 6 мм. Ствол ЛА — 15 мм (Z-score 4,45), правая ЛА — 7 мм (Z-score 1,2), левая ЛА — 7,5 мм (Z-score 1,79). Патологических изменений трахеобронхиального дерева не выявлено (рис. 1, B ). На рис. 1, C представлены аорта, трахеобронхиальное дерево и внутрисердечная анатомия.
С учетом предуктальной коарктации аорты, небольшого мышечного (4,0–4,5 мм) гемодинамически незначимого дефекта межжелудочковой перегородки на 5-е сут. жизни выполнено изолированное устранение коарктации аорты из бокового доступа без суживания ствола легочной артерии. После выделения дуги аорты, перешейка и проксимального отдела нисходящей аорты открытый артериальный проток лигирован. С помощью сосудистых зажимов пережата дуга аорты с ЛПклА и ЛОСА с сохранением кровотока по БЦС, нисходящая аорта дистальнее коарктации. Участок аорты с зоной коарктации и дуктальными тканями иссечен. Выполнено формирование косого анастомоза по типу «конец-в-конец» с заходом на дугу аорты и устье ЛПклА, во время формирования анастомоза отмечалось прорезывание тканей в проекции дистального сегмента дуги аорты, потребовавшее наложения дополнительных швов. После снятия зажимов выявлено значимое сужение дуги аорты между ЛОСА и ЛПклА.
Повторно пережат приводящий и отводящий сегменты аорты, пережаты ЛПклА и ЛОСА. Дуга аорты по наружному радиусу на участке между ЛОСА и ЛПклА
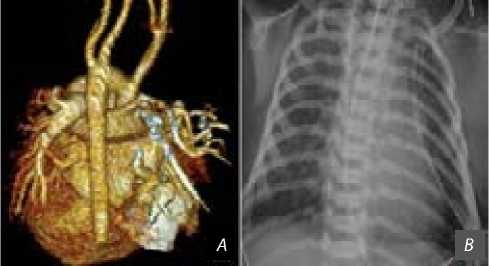
Рис. 2. Состояние дуги аорты и легочной паренхимы после реконструкции: дуга аорты и нисходящий сегмент аорты ( A ); рентгенограмма грудной клетки ( B )
рассечена с заходом на ЛОСА (в большей степени) и ЛПклА (в меньшей степени) по обращенным друг к другу поверхностям. Выполнена пластика дистального сегмента дуги аорты с использованием тканей ЛОСА (преимущественно) и ЛПклА с сохранением непрерывности с увеличением внутреннего диаметра дуги на этом уровне до 8–9 мм. Длительность пережатия аорты при создании анастомоза составила 23 мин, при реконструкции дистального отдела дуги аорты — 15 мин. После снятия зажимов дрожания в области анастомоза нет, пульсация нисходящей аорты хорошая, градиент давления руки/ноги не определяется.
Послеоперационный период протекал без особенностей (искусственная вентиляция легких — 18 ч, нахождение в палате реанимации — 2 сут., выписка из стационара на 19-е сут. после операции). На контрольной МСКТ визуализирована адекватная реконструкция зоны гипоплазии дистальной дуги и устранения коарктации аорты (рис. 2, А), диаметр дистального отдела дуги аорты (между ЛОСА и ЛПклА) составил 8,7 мм (Z-score 1,56), дистальнее ЛПклА — 6 мм (Z-score –0,02). Ствол ЛА — 15 мм (Z-score 4,45), правая ЛА — 7 мм (Z-score 1,2), левая ЛА — 7,5 мм (Z-score 1,79). Легкие расправлены, признаков экстрабронхи-альной компрессии и нарушений проходимости трахеобронхиального дерева нет (рис. 2, B).
По данным эхокардиографии, выполненной перед выпиской ребенка из стационара, размеры предсердий одинаковые, конечный диастолический размер правого желудочка — 15 мм, левого — 18 мм, конечный диастолический объем левого желудочка — 9,71 мл, индекс конечного диастолического объема левого желудочка — 38,8 мл/м2, фракция выброса — 65%. V max на нисходящей аорте 1,67 м/с. Трикуспидальный клапан — 16 мм, регургитация на клапане минимальная, V max — 0,5 м/с, митральный клапан — 14 мм, регургитация на клапане минимальная, V мах — 0,7 м/с, аортальный клапан — трехстворчатый, V max — 1,0 м/с, регургитации нет, V max на стволе ЛА — 1,0 м/с. Дефекты межжелудочковой перегородки (ДМЖП) мышечные: межтрабекулярный 4 мм + апикальный 1 мм, с транссептальным градиентом давления 68 мм рт. ст. При контрольной непрямой манометрии артериального давления между правой и левой верхними конечностями, а также между правой рукой и ногой градиента не выявлено: артериальное давление на правой верхней конечности составило 92/44 (среднее — 64), на правой нижней конечности — 93/47 (среднее — 65) мм рт. ст.
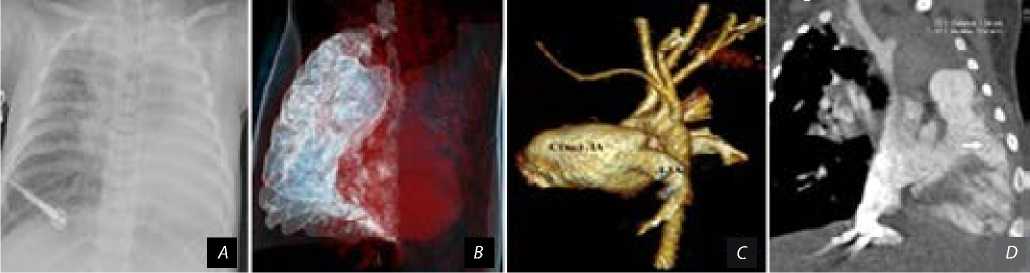
Рис. 3. Состояние легочной паренхимы и магистральных артерий при повторном поступлении: тотальный ателектаз левого легкого ( A ), наружная компрессия левого главного бронха ( B ), состояние дуги аорты после реконструкции ( C ), дефект межжелудочковой перегородки, отмечен стрелкой ( D )
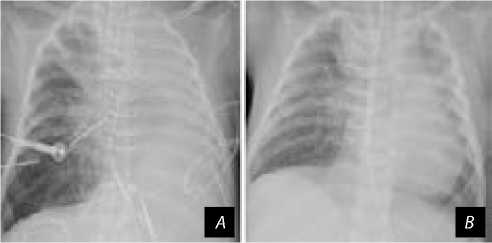
Рис. 4. Рентгенограмма грудной клетки до ( А ) и после ( B ) аортопексии
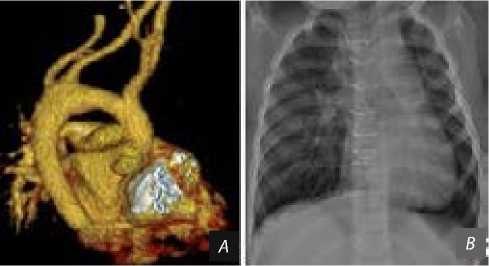
Рис. 5. Результаты контрольного обследования пациента через год: контроль области реконструкции аорты ( A ); рентгенограмма грудной клетки ( B )
Через 2 мес. после выписки ребенок экстренно госпитализирован в крайне тяжелом состоянии с явлениями выраженной дыхательной недостаточности, потребовавшей помещения в отделение реанимации и интенсивной терапии и перевода на искусственную вентиляцию легких. По данным рентгенографии органов грудной клетки выявлен тотальный ателектаз левого легкого с признаками смещения средостения влево (рис. 3, А ). Жидкость и воздух в плевральной полости не определяются. При фибробронхоскопии визуализировано щелевидное сужение левого главного бронха за счет внешней компрессии. Проведена МСКТ органов средостения, определяется тотальный ателектаз левого легкого, левый главный бронх расположен между нижней поверхностью дуги аорты и резко расширенной левой легочной артерией, проходимость сохранена только в проксимальном отделе (рис. 3, B ).
Диаметр восходящей аорты — 8,5 мм (Z-score –1,09), после отхождения БЦС — 8,0×7,5 мм, между устьями ЛОСА и ЛПклА — 10×9 мм (Z-score 1,53), дистальнее ЛПклА — 9×10 мм (Z-score 2,48). Локальных сужений не выявлено (рис. 3, C). БЦС — 5,5 мм, ЛОСА — 5 мм, ЛПклА — 4,5 мм. Ствол ЛА — 20 мм (Z-score 7,42), правая ЛА — 12 мм (Z-score 5,59), левая ЛА — 12 мм (Z-score 5,56). По данным эхокардиографии, конечный диастолический размер правого желудочка 16 мм, левого — 24 мм, конечный диастолический объем левого желудочка — 20,1 мл, индекс конечного диастолического объема левого желудочка — 69,5 мл/м2, определяются множественные межтрабекулярные ДМЖП от 3 до 11 мм (рис. 3, D). Фиброзное кольцо аортального клапана — 8 мм, регургитации нет, V max — 1,2 м/с. V max на стволе ЛА — 1,8 м/с, регургитация до 2 ст., диастолическое давление в ЛА — 53 мм рт. ст. Отмечается значительное снижение транссептального градиента давления левого желудочка к правому до 14 мм рт. ст.
С учетом гемодинамической значимости сброса на уровне межжелудочковой перегородки, а также компрессии левого главного бронха между резко расширенной (и дистопированной ввиду значительной кардиомегалии) левой ветвью легочной артерии и нисходящей аортой ребенок взят в операционную для хирургической коррекции. При интраоперационной ревизии выявлен большой мышечный ДМЖП в трабекулярной части межжелудочковой перегородки 12×13 мм, несколько мышечных дефектов в трабекулярной части перегородки и ближе к верхушке размером от 4 до 6 мм, большинство из них — с широким сообщением между собой. Выполнено закрытие мышечных дефектов межжелудочковой перегородки тремя заплатами из ксеноперикарда, закрытие дефекта межпредсердной перегородки заплатой из ксеноперикарда с оставлением разгрузочной фистулы, редукционная пластика ствола и левой легочной артерии, пластика трикуспидального клапана в условиях искусственного кровообращения и кардиоплегии. После основного этапа выполнена интраоперационная эхокардиография: большой мышечный дефект МЖП закрыт герметично, нельзя исключать минимальный верхушечный дефект МЖП. При контрольной интраоперационной манометрии системное давление — 75/45, в легочной артерии — 40/20 мм рт. ст.
В послеоперационном периоде при контроле, по данным МСКТ, сохраняется значимая компрессия ле- вого главного бронха за счет сдавления между левой легочной артерией и нисходящей аортой, подтвержденная данными фибробронхоскопии, с сохранением тотального ателектаза левого легкого по данным рентгенографии (рис. 4, А). С учетом сохраняющихся нарушений проходимости левого главного бронха пациенту проведена аортопексия из левого торакотом-ного доступа. Для выполнения аортопексии нисходящая аорта, зона анастомоза, дуга с брахиоцефальными сосудами выделены из спаек, аорта мобилизована, к адвентиции заднебоковой поверхности нисходящей аорты дистальнее зоны ранее сформированного анастомоза в проекции расположения левого главного бронха фиксирована ксеноперикардиальная заплата 4×18 мм. Тремя отдельными П-образными швами за ксеноперикардиальную заплату на встречных синтетических прокладках выполнена аортопексия к надкостнице соответствующих ребер. При контроле после аортопексии по данным фибробронхоскопии определяется незначительное остаточное сужение просвета левого главного бронха за счет минимальной наружной компрессии, с положительной рентгенологической динамикой (рис. 4, B).
После нормализации проходимости трахеобронхиального дерева ребенок экстубирован через 7 сут., восстановлено энтеральное питание в полном объеме. После 18 сут. нахождения в реанимационном отделении ребенок переведен в кардиохирургическое отделение. В дальнейшем пациентка в удовлетворительном состоянии выписана из стационара через 28 сут. При контрольном обследовании через год признаков рекоарктации не выявлено (рис. 5, А ). ЛОСА и ЛПклА без признаков стеноза и деформации, патологических сбросов на уровне межжелудочковой перегородки не обнаружено. Ход и проходимость трахеи, главных, долевых, сегментарных и субсегментарных бронхов не нарушены; легкие расправлены (рис. 5, B ).
Обсуждение
Устранение коарктации аорты путем резекции суженного участка с анастомозированием аорты по типу «конец-в-конец» известно с 1945 г., когда C. Crafoord и G. Nylin [6] опубликовали результаты использования данной техники у 2 пациентов. Развитию хирургического лечения порока способствовало появление эффективных методик коррекции коарктации аорты, в том числе ассоциированной с гипоплазией дуги, среди которых различные варианты пластики аорты левой подключичной артерией, в том числе свободным лоскутом [7] и путем реверсивной аортопластики [8], резекция суженного участка аорты с наложением расширенного анастомоза по типу «конец-в-конец» [9, 10], наложение анастомоза между нисходящей аортой и проксимальной частью дуги по типу «конец-в-бок» [11] и ряд других. Однако недостатки, такие как отсутствие магистрального кровотока в левой руке при изолированном использовании левой подключичной артерии, риск рестеноза сосудов при подключично-каротидном анастомозе по типу «конец-в-бок», изменение геометрии дуги аорты, возможность экзогенной компрессии левого главного бронха, способствовали поиску оптимального пути устранения обструкции, в особенности у новорожденных с коарктацией, ассоциированной с гипоплазией дуги аорты.
Кроме того, существенно расширились подходы к ведению пациентов с коарктацией аорты в сочетании с ДМЖП. Традиционное двухэтапное хирургическое лечение с устранением коарктации аорты и суживанием легочной артерии из торакотомии с последующим закрытием ДМЖП из срединного доступа [ 12 ] дополнилось одномоментной коррекцией обеих мальформаций из срединной стернотомии [ 13 ]. Каждая из данных хирургических стратегий имеет преимущества и недостатки и дает возможность выбора в каждом конкретном случае. В представленном клиническом наблюдении одноэтапное устранение коарктации аорты и закрытие ДМЖП не проводилось ввиду гемодинамической незначимости дефекта межжелудочковой перегородки при первичной оценке пациента.
Кроме того, в литературе представлены данные о высокой частоте (от 43 до 58%) спонтанного закрытия мышечного межжелудочкового сообщения после устранения коарктации аорты, в том числе без суживания легочной артерии [14, 15]. Использование модифицированной пластики дистального сегмента аорты с использованием левой общей сонной и подключичной артерий позволило эффективно устранить коарктацию аорты с ассоциированной гипоплазией дуги аорты у новорожденного с сохранением геометрии и нормальной анатомии магистральных сосудов дуги аорты. Однако сердечная недостаточность и нарушение проходимости трахеобронхиального дерева, обусловленные значительным лево-правым сбросом и формированием выраженной кардиомегалии с изменением простран- ственных взаимоотношений органов средостения, потребовали закрытия дефекта межжелудочковой перегородки и аортопексии в кратчайший срок.
Отсутствие предикторов спонтанного закрытия мышечных ДМЖП требует особого внимания при выборе двухэтапной коррекции порока у данной категории пациентов, а также более пристального динамического контроля за состоянием пациента при сохраняющемся дефекте межжелудочковой перегородки.
Заключение
Использование тканей ЛОСА и ЛПклА с сохранением непрерывности является эффективным методом расширения дистального сегмента дуги аорты при гипоплазии, который позволяет избежать применения искусственного кровообращения и чужеродных материалов при устранении коарктации аорты.
В редких случаях мышечный дефект межжелудочковой перегородки может прогрессировать в размерах и приводить к существенным отклонениям гемодинамики в короткий срок, а также к изменению пространственных взаимоотношений органов средостения, вызывая значительные нарушения трахеобронхиальной проходимости. Нормализация гемодинамики при закрытии дефектов не всегда способствует нормализации пространственных взаимоотношений, что может потребовать аортопексии для восстановления нарушенной анатомии.
Аортопексия может быть эффективным методом устранения нарушенной проходимости бронхолегочного дерева даже при контралатеральной компрессии со стороны значительно дилатированной легочной артерии.
Финансирование
Исследование не имело спонсорской поддержки.
Список литературы Модифицированная пластика дистального сегмента дуги аорты с использованием тканей левой общей сонной артерии у новорожденного с предуктальной коарктацией аорты и гипоплазией дистальной дуги аорты в сочетании с атипичным течением мышечного дефекта межжелудочковой перегородки (клинический случай)
- Plunkett M.D., Harvey B.A., Kochilas L.K., Menk J.S., St Louis J.D. Management of an associated ventricular septal defect at the time of coarctation repair. Ann Thorac Surg. 2014;98(4):1412-8. PMID: 25149056, PMCID: PMC5701891. http://dx.doi. org/ DOI: 10.1016/i.athoracsur.2014.05.076
- Vouhe P, Trinquet F., Lecompte Y., Vernant F., Roux P.M., Touati G., Pome G., Leca F., Neveux J.Y. Aortic coarctation with hypoplastic aortic arch. J Thorac Cardiovasc Surg. 1988;96(4):557-63. PMID: 3172802.
- Conte S., Lacour-Gayet F., Serraf A., Sousa-Uva M., Bruniaux J., Touchot A., Planché C. Surgical management of neonatal coarctation. J Thorac Cardiovasc Surg. 1995;109(4):663-75. PMID: 7715213. 10.1016/S0022- 5223(95)70347-0 DOI: 10.1016/S0022-5223(95)70347-0
- Lacour-Gayet F., Bruniaux J., Serraf A., Chambran P., Blaysat G., Losay J., Petit J., Kachaner J., Planché C. Hypoplastic transverse arch and coarctation in neonates. J Thorac Cardiovasc Surg. 1990;100:808-16. PMID: 2246903.
- Amato J.J., Rheinlander H.F., Cleveland R.J. A method of enlarging the distal transverse arch in infants with hypoplasia and coarctation of the aorta. Ann Thorac Surg. 1977;23(3):261-3. PMID: 849035.


