Модификации кинетического метода определения тиоцианат-иона по реакции Ландольта метилоранжа с броматом калия
Автор: Данилина Елена Ивановна, Абдулзалилова Римма Рауфовна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Аналитическая химия
Статья в выпуске: 3 т.5, 2013 года.
Бесплатный доступ
Были исследованы различные модификации кинетического метода для оптимизации условий проведения реакции Ландольта метилоранжа с броматом калия, применяемой с целью определения тиоцианат-иона в водном растворе (метод остановленного времени, метод измерения индукционного периода, метод тангенсов, дифференциальные кривые двух видов). Преимущество имеет метод тангенсов. Оптимальные условия определения: 0,28 М HCl, рН 1,02, 8•10 -5 М KBrO 3, 10 мг/л метилоранжа. Градуировочный график линеен в интервале концентраций (0,2-7)-10 -5 М, повторяемость составила 4,0%, погрешность определения 4,1 %.
Кинетический анализ, тиоцианат, реакция ландольта, метилоранж, индукционный период, метод фиксированного времени, метод тангенсов, дифференциальная кривая
Короткий адрес: https://sciup.org/147160266
IDR: 147160266 | УДК: 543.422.7
Текст научной статьи Модификации кинетического метода определения тиоцианат-иона по реакции Ландольта метилоранжа с броматом калия
Тиоцианат (роданид) SCN– привлекает внимание исследователей из различных областей науки, в частности, медицины, пищевой химии и химии окружающей среды. Тиоцианаты обычно присутствуют в биологических жидкостях в низких концентрациях, но появляются в них (например, слюне) в высокой концентрации после курения. Он является основным продуктом метаболической трансформации цианида с аналогичным, хотя и более слабо выраженным, механизмом токсического действия, встречается в сточных водах и почве после обработки пестицидами и контролируется наряду с другими загрязнителями [1]. Предельно допустимая концентрация роданида калия KSCN в воде составляет 0,1 мг/л [2].
Применяются различные методы определения тиоцианата: хроматографические, в частности, ионная хроматография [3], электрохимические [4], флуориметрия [5], УФ-спектрометрия [6], фотометрия в видимой области спектра [7]. Помимо прочего, тиоцианат обладает специфическим свойством, которое возможно использовать в кинетическом анализе, а именно способностью ингибировать реакции окисления различных красителей бромат-ионом, что дает возможность значительно улучшить селективность определения. Предложен ряд фотометрических методик, основанных на ингибировании окисления метилового красного [8], метилового оранжевого [9], метиленового синего [10], мета-крезолового пурпурного [11], кристаллического фиолетового [12], януса зеленого [13].
Красители обесцвечиваются броматом, но в присутствии тиоцианата – не мгновенно, причем время индукционного периода реакции зависит от концентрации тиоцианата. Предложена следующая схема многостадийного процесса (на примере метилового оранжевого) [9].
Реакция бромат-иона с HCl происходит в кислой среде с образованием Cl2 и Br2:
2BrO 3 – + 10 Cl– + 12 H+ → Br 2 + 5 Cl 2 + 6 H 2 O.
Образующиеся хлор или бром реагируют с метилоранжем и обесцвечивают его:
-
O 3 S NN N(CH 3 ) 2 +x2 + H 2O ►
HO N(CH3)2 + X so3H + N2+ X- где X = Cl; Br.
Тиоцианат является реагентом Ландольта в реакции с КBrO 3 ; его присутствие в растворе приводит к расходу образующихся Cl 2 и Br 2 , так как они взаимодействуют с тиоцианатом значительно быстрее, чем с метиловым оранжевым:
SCN– + 4 Br 2 (Cl 2 ) + 4 H 2 O → H 2 SO 4 + CNBr (CNCl) + 4 HBr (HCl).
Реакции Ландольта – это медленные химические реакции, в которых образование окрашенного продукта реакции задерживается подходящим реагентом, специально добавленным для этой цели. В процессах Ландольта медленная реакция связана с быстрой реакцией вследствие участия в ней продукта первой реакции. Эффект Ландольта может быть выражен следующим образом:
-
1) медленная реакция: А + В → Р,
-
2) быстрая реакция: Р + L → Y.
Поскольку вторая реакция идет быстрее, чем первая, ее продукт (Р) может быть обнаружен только тогда, когда «реагент Ландольта» (L) полностью расходуется в результате второй реакции. Метод, основанный на эффекте Ландольта, в ряде случаев обеспечивает более высокую воспроизводимость результатов анализа, чем обычный метод фиксированной концентрации, разновидностью которого он является. Концентрацию катализатора можно определять по длительности индукционного периода, по истечении которого скорость реакции становится заметной [14].
Однако измерение абсолютной длительности индукционного периода – не единственная возможность получить информацию о зависимости скорости реакции от концентрации реагента, если имеется полноценная кинетическая кривая. Широко используется метод фиксированного времени, достоинство которого – простота и отсутствие специальных расчетов, однако требуется точно выдерживать время измерения. Наклон кинетической кривой позволяет найти тангенс угла наклона при ее близости к линейному виду (или соответствующей аппроксимации); метод тангенсов превосходит по точности определения все остальные варианты кинетических методов, с успехом применяется даже для многостадийных реакций (в том числе с индукционным периодом). Наконец, возможно дифференцирование самой тангенциальной зависимости, по аналогии с тем, как ведут измерение в методе производной спектрофотометрии. Последние два метода требуют соответствующей математической обработки экспериментальных результатов, но существенно повышают точность и позволяют усилить малозаметные эффекты, что важно при характеристике условий, влияющих на реакцию.
Целью дальнейшей работы стала оптимизация условий проведения реакции Ландольта для определения тиоцианат-иона, с применением различных модификаций кинетического метода.
Экспериментальная часть
Стандартный раствор тиоцианата калия KSCN 0,0172 М: 0,1673 г препарата («ч.д.а.») растворяли в дистиллированной воде в мерной колбе вместимостью 100 мл.
Рабочие растворы тиоцианата калия готовили соответствующим разбавлением в день употребления.
Раствор бромата калия KBrO 3 0,1059 М: 1,7700 г соли («ч.д.а.») растворяли в дистиллированной воде и разбавляли водой до 100 мл в мерной колбе.
Метиловый оранжевый 100 мг/л: 0,010 г препарата метилового оранжевого («ч») растворяли в воде и разбавляли водой до метки в мерной колбе вместимостью 100 мл.
Соляная кислота 2,8 М: готовили соответствующим разбавлением концентрированной кислоты ( ρ = 1,19 г/мл).
Методика проведения эксперимента состояла в следующем: аликвотные порции рабочего раствора, содержащего тиоцианат, помещали в мерные колбы вместимостью 100 мл, добавляли по 10 мл 2,8 М раствора HCl и 10 мл раствора метилоранжа, разбавляли дистиллированной водой примерно до 90 мл. Затем добавляли 0,75 мл раствора бромата калия КBrO 3 и разбавляли дистиллированной водой до метки, тщательно перемешивали. Раствор переносили в кювету с толщиной поглощающего слоя 1 см и измеряли оптическую плотность во времени относительно дистиллированной воды, регистрируя изменения при длине волны 490 нм на фотоэлектроколориметре КФК-2МП через каждые 20 секунд, считая за нулевой отсчет момент разбавления водой до метки. В дальнейшем кинетические кривые обрабатывали для получения зависимости скорости химической реакции от различных параметров.
Результаты и их обсуждение
Как показано в литературе, одним из наиболее существенных факторов, влияющих на процесс обесцвечивания красителей в присутствии бромат-иона, является кислотность среды. Однако при изучении его влияния на реакцию Ландольта метилоранжа с бромат-ионом авторы работы [9] упростили задачу, рассмотрев только зависимость разности оптической плотности растворов, содержащих тиоцианат и без него, через выбранный интервал времени (t = 60 с). По нашим данным, индукционный период до начала обесцвечивания, скорость обесцвечивания и кислотность находятся в сложной зависимости между собой.
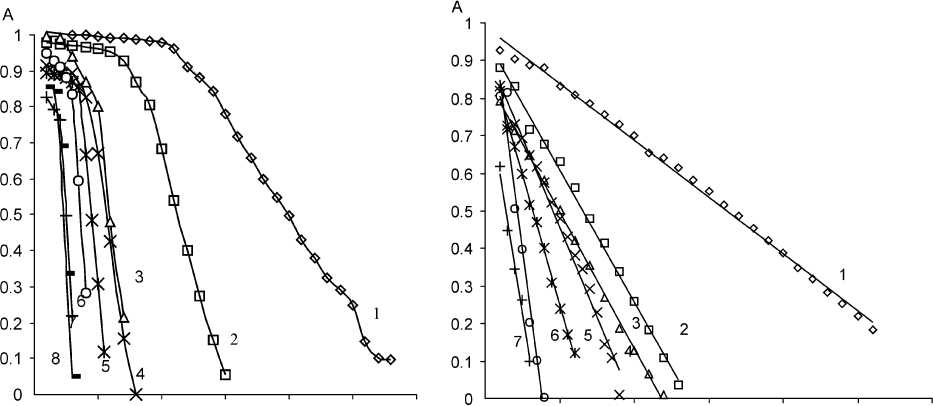
Сравним обесцвечивание метилоранжа в холостом опыте, не содержащем тиоцианата, и в растворах с добавлением 3,4 ⋅ 10–5 М KSCN, при различной концентрации соляной кислоты. Данные приведены на рис. 1 (а, б).
О 100 200 300 400 500 600 о 100 200 300 400 500 600
t, с t, с
а) б)
Рис. 1. Зависимость оптической плотности растворов от времени при различной концентрации соляной кислоты C MO = 10 мг/л, С KВrO3 = 7,4·10–4 M, λ = 490 нм, l = 1 см ):
а) С HCl 1 – 0, 20 М; 2 – 0,25 М; 3 – 0,27 М; 4 – 0,28 М; 5 – 0,29 М; 6 – 0,30 М; 7 – 0,35 М, б) C KSCN = 3,4 ⋅ 10–5 M; C HCl 1 – 0,15 M; 2 – 0,20 M; 3 – 0,25 М; 4 – 0,27 М; 5 – 0,28 М; 6 – 0,29 М, 7 – 0,30 М; 8 – 0,35 М
Таким образом, можно видеть, что присутствие тиоцианат-иона в системе действительно приводит к появлению индукционного периода у реакции, в течение которого обесцвечивание не происходит ввиду расходования окислителя на реагент Ландольта.
Для нахождения количественных значений на полученных кинетических кривых (рис. 1, б) выделяли по два прямолинейных участка. Их экстраполяция дает точку пересечения. Ее абсциссу
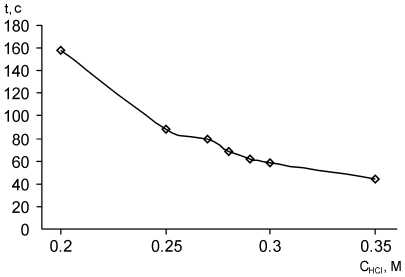
Рис. 2. Зависимость индукционного периода реакции Ландольта от концентрации соляной кислоты; С КSCN = 3,4 ⋅ 10–5 M, C MO = 10 мг/л, СKВrO 3 = 7,4·10–4 M, λ = 490 нм, l = 1 см
мы и принимали за величину индукционного периода («псевдоиндукционный период»), в соответствии с [14].
На рис. 2 видно, что с увеличением кислотности индукционный период уменьшается, вплоть до того, что при концентрации соляной кислоты 0,15 М он практически приближается к нулю (прямолинейный участок очень узок или вырождается в точку).
Вид полученной зависимости достаточно монотонный, хоть и не является линейным. Вряд ли можно выделить на подобной плавной кривой участок, который соответствует оптимальным условиям определения.
Картина меняется, если прибегнуть к аналитическому дифференцированию наблюдаемой монотонной зависимости. Мы использовали отношение разности времени индукционного периода к разности концентрации соляной кислоты, считая с начальной точки С HCl = 0,2 М. В этом случае соседние значения различаются уже весьма резко (для концентраций 0,25; 0,27 и 0,28 М это величины 400; 1100 и 700 соответственно). Обработанная зависимость приведена на рис. 3.
Максимум на данной кривой соответствует концентрации соляной кислоты 0,27 М, что, видимо, и следует считать оптимальной кислотностью для данного метода определения тиоцианат-иона.
Была сделана попытка определить оптимум кислотности методом фиксированного времени. В работе [9] находили разность оптических плотностей растворов, содержащих тиоцианат-ион и с нулевой концентрацией SCN– при t = 60 с (авторы исходили из того, что с увеличением концентрации соляной кислоты индукционный период сохраняется).
На системе кинетических кривых, представленных на рис. 1, были проведены соответствующие сечения (отдельно для частей а и б), найдены разности; полученные результаты приведены на рис. 4.
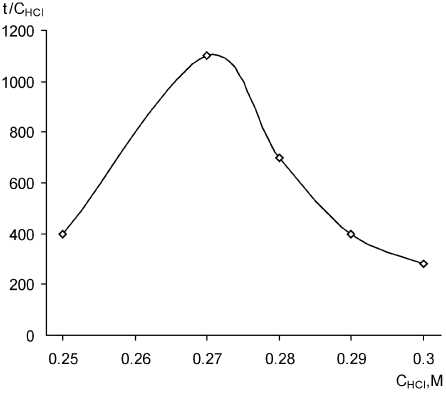
Рис. 3. Дифференциальная кривая зависимости индукционного периода реакции Ландольта от концентрации соляной кислоты; С КSCN = 3,4 ⋅ 10–5 M, C MO = 10 мг/л, СKВrO3 = 7,4·10–4 M, λ = 490 нм, l = 1 см
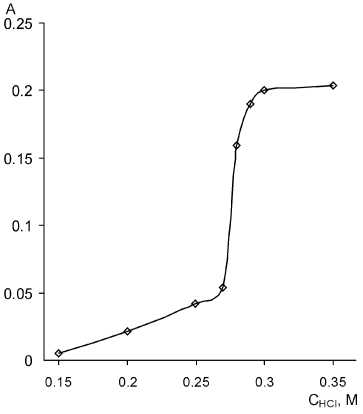
Рис. 4. Зависимость разности оптических плотностей исследуемых и холостых растворов от концентрации соляной кислоты С КSCN = 3,4 ⋅ 10–5 M, C MO = 10 мг/л, СKВrO3 = 7,4·10–4M, λ = 490 нм, l = 1 см, t = 60 c
Как мы и предполагали, взаимовлияние медленного процесса (обесцвечивания метилоранжа под воздействием бромат-иона) и быстрого процесса (расходования бромата за счет реакции с тиоцианат-ионом) слишком сложно, чтобы можно было пользоваться одномерным экспериментом, по крайней мере, пока не полностью оптимизированы условия многостадийной реакции.
Рассмотрим снова зависимости оптической плотности от времени при различной концентрации соляной кислоты (рис. 1). При их сравнении заметно, что с увеличением концентрации соляной кислоты увеличивается и угол наклона второго участка кинетических кривых, соответствующего обесцвечиванию метилоранжа.
Эти части кинетических кривых, хорошо аппроксимирующиеся линейными уравнениями, можно применять в методе тангенсов. Под тангенсом угла наклона кинетической кривой мы понимали угловой коэффициент b прямолинейной зависимости вида Y = a + bX, полученной путем обработки экспериментальных данных методом наименьших квадратов.
Данные по зависимости тангенса угла наклона нисходящих ветвей кинетических кривых от концентрации соляной кислоты можно видеть на рис. 5.
Обработка привела к неочевидным результатам. Оказалось, что не только индукционный период реакции зависит от концентрации тиоцианат-иона (что прямо следует из определения реак-
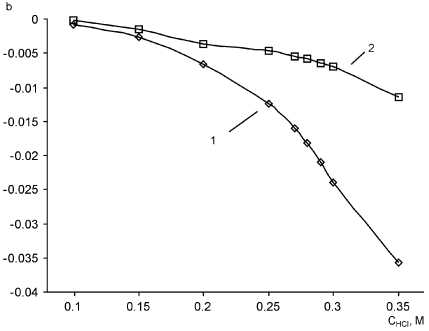
Рис. 5. Зависимость тангенса угла наклона нисходящей ветви кинетической кривой от концентрации соляной кислоты C MO = 10 мг/л, С KBrO = 7,4·10–4 M, λ = 490 нм, l = 1 см; 1 – С КSCN = 3,4 ⋅ 10–5 M; 2 – C KSCN = 0
ции Ландольта), но и скорость обесцвечивания метилоранжа также зависит от наличия в системе тиоцианат-иона, и, предположительно, количественно. На рис. 5 видно, что при одних и тех же концентрациях HCl угловые коэффициенты различны в присутствии KSCN (кривая 1) и в холостом опыте (кривая 2).
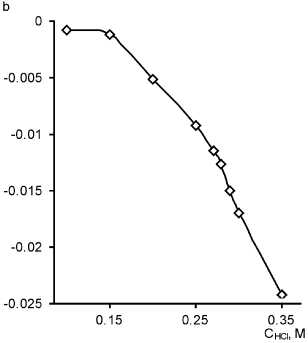
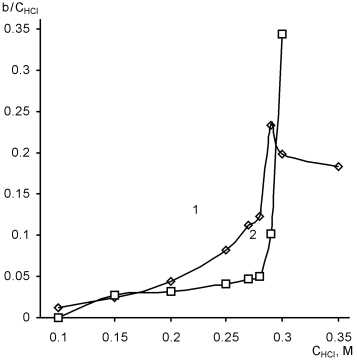
Что касается подбора оптимальных условий определения, мы воспользовались тем же приемом, что и при исследовании влияния кислотности на индукционный период реакции Ландольта, а именно сравнили интегральную и дифференциальную зависимости (рис. 6).
Аналогично зависимостям индукционного периода реакции Ландольта, интегральная разностная кривая является монотонной, в то время как на дифференциальной кривой в присутствии тиоцианат-иона наблюдается ярко выраженный максимум. Он расположен при концентрации соляной кислоты, равной 0,28 М.
а)
б)
Рис. 6. Разностная (а) и дифференциальная (б) зависимости тангенса угла наклона нисходящей ветви кинетической кривой от концентрации соляной кислоты (C MO = 10 мг/л, СKВrO3 = 7,4·10–4 M, λ = 490 нм, l = 1 см). 1 – С КSCN = 3,4 ⋅ 10–5 M; 2 – C KSCN = 0
Небольшое несовпадение значений оптимальной кислотности, полученное разными методами, может объясняться погрешностью эксперимента: так, при концентрации соляной кислоты, равной 0,27 М, фотометрируемый раствор имеет рН 1,04; а измеренное значение рН раствора при концентрации HCl = 0,28 М составляет 1,02 – вполне в пределах погрешности измерения лабораторного рН-метра. Однако не исключено, что на разные аналитические сигналы действительно по-разному влияют условия определения; следовательно, их выбор будет обуславливаться тем, какая именно модификация кинетического метода выбрана как наиболее подходящая.
При оптимизации других условий проведения реакции Ландольта повторяли описанный выше подход.
Так, потребовалось изучение влияния концентрации окислителя (бромата калия); поскольку ранее был отмечен сам факт его влияния, но не были исследованы ни интервал, ни область максимального воздействия.
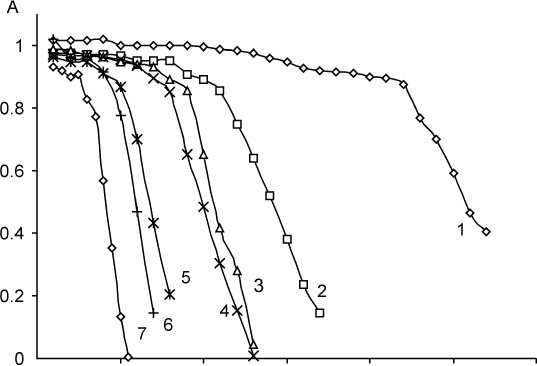
Мы изучали скорость реакции и индукционный период в интервале концентраций KBrO 3 (2∙10–4 – 12∙10–4) M. Кинетические кривые приведены на рис. 7, а на рис. 8 – дифференциальные зависимости ∆b/∆CKBrO3 от концентрации KBrO 3 в присутствии тиоцианат-иона (кривая 1) и в холостом опыте (кривая 2).
О 100 200 300 400 500 600
t, с
Рис. 7. Зависимость оптической плотности растворов от времени при различной концентрации бромата калия С КSCN = 3,4 ⋅ 10–5 M, C MO = 10 мг/л, рН 1,02; λ = 490 нм, l = 1 см, СKВrO3: 1 – 2 ⋅ 10–4 M; 2 – 3 ⋅ 10–4 M; 3 – 4 ⋅ 10–4 M; 4 – 5 ⋅ 10–4 M; 5 – 6 ⋅ 10–4 M; 6 – 8 ⋅ 10–4 M; 7 – 11 ⋅ 10–4 M
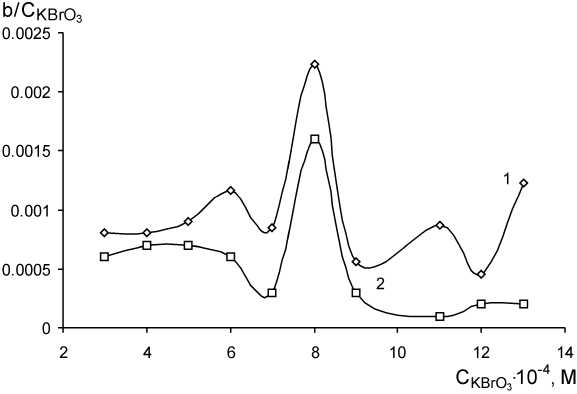
Рис. 8. Дифференциальная зависимость тангенса угла наклона прямолинейного участка кинетической кривой от концентрации бромата калия; C MO = 10 мг/л, С HCl = 0,28 М; λ = 490 нм, l = 1 см; 1 – С КSCN = 3,4 ⋅ 10–5 M; 2 – С КSCN = 0
Как видно из кинетических кривых, показанных на рис. 7, с увеличением концентрации бромата одновременно сокращается индукционный период и возрастает скорость индикаторной реакции.
Таким образом, по аналогии представляется неизбежным использование для оптимизации условий проведения реакции Ландольта дифференциальных зависимостей. В частности, из рис. 8 видно, что максимальная скорость достигается при концентрации KBrO 3 = 8 ⋅ 10–4 M в обоих случаях, но, тем не менее, различие остается довольно значительным. Максимум соответствует более чем 20-кратному избытку бромата калия по отношению к тиоцианат-иону.
В дальнейшем использовали именно эту концентрацию бромата калия, что соответствует добавлению 0,75 мл 0,1059 М раствора KBrO 3 .
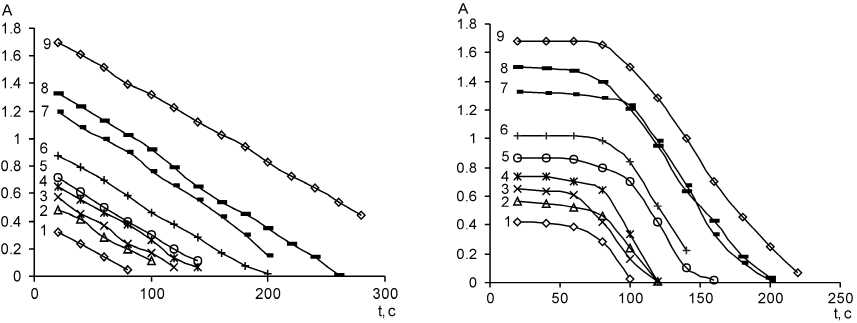
В отличие от исследованных выше факторов, концентрация метилоранжа (по крайней мере, в изученном интервале 4–17 мг/л) не влияет на скорость обесцвечивания и практически не влияет на индукционный период, как можно видеть на рис. 9.
а)
б)
Рис. 9. Зависимость оптической плотности растворов от времени при различной концентрации метилоранжа; C HCl = 0,28 М, СKВrO3 = 8·10–4 M, λ = 490 нм, l = 1 см; С МО 1 – 4 мг/л; 2 – 6 мг/л; 3 – 6,5 мг/л; 4 – 7 мг/л; 5 – 8 мг/л;
6 – 10 мг/л; 7 – 13 мг/л; 8 – 15 мг/л; 9 – 17 мг/л. а – C KSCN = 0; б – C KSCN = 3,4 ⋅ 10–5 M
Математическая обработка кривых была проведена, но заметного влияния этого фактора на скорость реакции ни в отсутствии, ни в присутствии тиоцианата замечено не было; таким образом, мы не стали менять выбранную из соображений удобства концентрацию 10 мг/л.
При найденных оптимальных условиях построили градуировочные графики для определения тиоцианата. В качестве аналитического сигнала, как показано ранее, возможно использование и индукционного периода реакции Ландольта, и тангенса угла наклона части кинетической кривой, соответствующей обесцвечиванию метилоранжа и, как показал эксперимент, также зависящего от концентрации тиоцианата. Полученные данные можно сравнить на рис. 10.
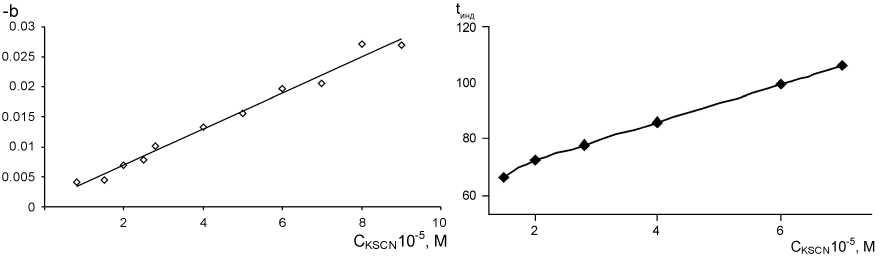
а) б)
Рис. 10. Зависимость тангенса угла наклона нисходящей ветви кинетической кривой (а) и времени индукционного периода (б) от концентрации тиоцианата; C MO = 10 мг/л, СKВrO3 = 8·10–4 M, С HCl = 0,28 М, рН = 1,02; λ = 490 нм, l = 1 см
Оба графика линейны до 7 ⋅ 10–5 М, коэффициенты корреляции, соответственно, 0,985 (а) и 0,995 (б); однако использование индукционного периода возможно лишь с оговорками. Обычный фотометрический метод не позволяет получить достоверную (не менее 3 точек) прямолинейную зависимость, поэтому область низких концентраций недоступна для измерения, что накладывает ограничения на чувствительность метода. Вероятно, применение регистрирующего спектрофотометра позволило бы достоверно измерять и меньшие по величине индукционные периоды, но и здесь наблюдается методологическое затруднение. Экстраполяция прямой линии пересечет ось ординат в точке, отличной от нуля, приводя к противоречию: существованию индукционного периода реакции в отсутствие реагента Ландольта (тиоцианат-иона).
Для определения тиоцианат-иона при фотометрическом наблюдении за ходом реакции Лан-дольта больше подходит метод тангенсов. Мы оценили метрологические характеристики методики, проведя 6 параллельных измерений растворов с одинаковым введенным содержанием тиоцианата калия. Результаты приведены в таблице.
Оценка метрологических характеристик определения тиоцианат-иона (Р = 0,95)
|
b(tg a ) - 102 |
X i , М - 105 |
X, М - 105 |
S r ,% |
А С |
( А С/С)100% |
5 ,% |
|
введено KSCN 4,13 - 10-5 М |
||||||
|
–1,56; –1,48; –1,48; – 1,41; –1,65; –1,64 |
3,85; 3,90; 3,95; 3,75; 4,15; 4,15 |
3,96 |
3,78 |
0,16 |
4,0 |
4,1 |
Как видно из таблицы, повторяемость результатов определения тиоцианат-иона составила 4,0 %, в то время как погрешность определения оказалась на уровне 4,1 %. Относительное стандартное отклонение составило 3,78 %, что хуже, чем данные, полученные в работе [6] для той же реакции Ландольта с использованием регистрирующего спектрофотометра (при измерении из 10 параллелей S r = 0,19 %), однако не превышает средних значений фотометрических методов.
Заключение
Кинетический метод анализа основывается на измерении скорости химической реакции, однако он может реализоваться в различных модификациях, таких как метод фиксированного времени, метод фиксированной концентрации, метод тангенсов, а для ряда реакций – еще и путем измерения индукционного периода. Реакции Ландольта выделяются как отдельный тип, используемый в кинетическом анализе: благодаря тому, что исследуемое вещество быстро реагирует с компонентом более медленной индикаторной реакции, она не может дать продукт (по которому измеряется аналитический сигнал), пока реагент Ландольта не будет полностью израсходован. Именно к таким реакциям относится обесцвечивание метилоранжа за счет его окисления броматом калия, где в качестве реагента Ландольта выступает тиоцианат-ион SCN–.
Исследование различных модификаций кинетического метода при переменных условиях определения показало сложное взаимовлияние индукционного периода и скорости индикаторной реакции обесцвечивания под воздействием тех или иных факторов. Метод остановленного времени, предложенный ранее в литературе, не позволяет однозначно интерпретировать результаты. Концентрация тиоцианата влияет и на индукционный период, и на тангенс угла наклона нисходящей ветви кинетической кривой (скорость обесцвечивания), однако первый из методов, несмотря на простоту, требует быстрой регистрации аналитического сигнала (например, использование регистрирующего спектрофотометра). В то время как метод тангенсов может применяться на обычном лабораторном оборудовании при фотометрическом наблюдении за ходом реакции Ландольта и дает вполне приемлемые результаты: градуировочный график линеен в интервале (0,2-7) - 10-5 М тиоцианат-иона; повторяемость составила 4,0 %, погрешность определения введенного количества 4,1 %.
Кроме этого, при оптимизации условий определения использовали кинетический метод в модификации дифференциальных кривых, которые лучше позволяют выделить аналитический сигнал. Ее использовали и для измерения индукционного периода, и для метода тангенсов. Оптимальные условия определения, по нашим данным, составили: 0,28 М HCl, рН 1,02, 8 - 10-5 М KBrO3, 10 мг/л метилоранжа. За исключением метилоранжа, влияние которого в интервале (4–17) мг/л практически не проявляется, концентрацию других компонентов лучше поддерживать достаточно точно.
Список литературы Модификации кинетического метода определения тиоцианат-иона по реакции Ландольта метилоранжа с броматом калия
- Lavorante, A.F. Multicommutation in Flow Analysis: a Versatile Tool for the Development of the Automatic Analytical Procedure Focused on the Reduction of Reagent Consumption/A.F. Lavorante, M.A. Feres, B.F. Reis//Spectroscopy Letters. 2006. V. 39, No. 6. P. 631-650.
- Беспамятнов, Г.П. Предельно допустимые концентрации химических веществ в окружающей среде: справочник/Г.П. Беспамятнов, Ю.А. Кротов. Л.: Химия, 1985. 528 с.
- Saussereau, E. Determination of Thiocyanate in Plasma by Ion Chromatography and Ultraviolet Detection/E. Saussereau, J.-P. Goulle, C. Lacroix//Journal of Analytical Toxicology. 2007. V. 31, No. 7. P. 383-387.
- Determination of Trace Thiocyanate with Glassy Graphite Electrode Modified with Nanosize Silver/M. Li, G. Wang, Y. Gao, B. Fang//Physical Testing and Chemical Analysis. 2005. V. 41, No.5. P. 305.
- Gong, B. Fluorimetric Method for the Determination of Thiocyanate with 2',7'-Dichlorofluorescein and Iodine/B. Gong, G. Gong//Analytica Chimica Acta. 1999. V. 394, No. 2-3. -P. 171-175.
- Karimi, H. Simultaneous Determination of Thiocyanate and Salycilate by a Combined UV-Spectrophotometric Detection Principal Component Artificial Neural Network//H. Karimi, M. Ghaedi. Annali di Chimica. 2006. V. 96, No. 11-12. P. 657-667.
- РД 52.24.519-2011 Массовая концентрация цианидов и тиоцианатов в водах. Методика выполнения измерений фотометрическим методом с барбитуровой (тиобарбитуровой) кислотой. -М.: Изд-во стандартов, 2011. 17 с.
- Ghasemi, J. Kinetic Spectrophotometric Determination of Thiocyanate Based on Its Inhibitory Effect on the Oxidation of Methyl Red by Bromate/J. Ghasemi, R. Amini, A. Afkhami//Analytical Sciences. 2001. V. 17, No.3. P.435-437.
- Мадракиан, Т. Кинетико-спектрофотометрическое определение следовых количеств тиоцианата, основанное на эффекте Ландольта в реакции бромата с соляной кислотой/Т. Мадракиан, А. Эсмаэили, А. Абдолмалеки//Журн. аналит. химии. 2004. Т. 59, вып. 1. С.35-39.
- Shishehbore, M.R. Kinetic Determination of Thiocyanate on the Basis of Its Catalytic Effect on the Oxidation of Methylene Blue with Potassium Bromate/M.R. Shishehbore, N. Nasirizadeh, A.A. Kerdegari//Analytical Sciences. 2005. V. 21, No. 10. P. 1213-1216.
- Chamjangali, M.A. Determination of Trace Amounts of Thiocyanate by a New Kinetic Procedure Based on an Induction Period/M.A. Chamjangali, G. Bagherian, N. Salek-Gilani//Spectrochimica Acta. Part A: Molecular and Biomolecular Spectroscopy. 2007. V. 67, No. 5. P. 1252-1256.
- Bagherian, G. Kinetic Spectrophotometric Determination of Trace Amounts of Thiocyanate Basen on Its Catalytic Effect on the Bromate-Crystal Violet Reaction in Biological Samples/G. Bagherian, M.A. Chamjangali, Z. Berenji//Eurasian Journal of Analytical Chemistry. 2008. V. 3, No. 3. -P. 307-317.
- Keyvanfard, M. Determination of Thiocyanate by Kinetic Spectrophotometric Flow Injection Analysis/M. Keyvanfard, K. Alizad, P. Elahian//Journal of Chemistry. 2013. Article ID 147364, 5 pages DOI: 10.1155/2013/147364
- Перес-Бендито, Д. Кинетические методы в аналитической химии/Д. Перес-Бендито, М. Сильва. М.: Мир, 1991. 395 с.


