Модификация противоопухолевой химиотерапии антиоксидантными препаратами в эксперименте
Автор: Зорькина А.В., Скопин П.И.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 (43), 2011 года.
Бесплатный доступ
Комбинированное применение препаратов антиоксидантного действия - эмоксипина и α-токоферола ацетата - с про- тивоопухолевыми лекарственными средствами (циклофосфан, 5-фторурацил, рубомицин) на модели перевиваемого рака крыс РС-1 выявило снижение показателей интоксикации в организме опухоленосителей, ограничение лейкопении и актив- ности процессов перекисного окисления липидов в тканях печени и почек. В опухолевой ткани в этих условиях наблюдался рост содержания малонового диальдегида и угнетение антиокислительной активности. Эмоксипин (17 мг/кг, 25 мг/кг) повысил индекс торможения роста опухоли циклофосфаном, 5-фторурацилом и рубомицином при комбинированном при- менении в условиях роста холангиоцеллюлярного рака РС-1 в эксперименте в большей степени, чем α-токоферола ацетат в изомолярных дозах.
Противоопухолевая химиотерапия, перекисное окисление липидов, эмоксипин, перевиваемый холангиоцеллюлярный рак рс-1
Короткий адрес: https://sciup.org/14055878
IDR: 14055878 | УДК: 615.277.3+577.115]-092.9
Текст научной статьи Модификация противоопухолевой химиотерапии антиоксидантными препаратами в эксперименте
Современная интенсивная противоопухолевая химиотерапия сопровождается многочисленными побочными эффектами. Образующиеся на фоне противоопухолевой химиотерапии, в организме больного свободные радикалы и инактивация ферментов антиоксидантной защиты усиливают интоксикацию, вызывают токсическое повреждение клеток внутренних органов и зачастую оказываются лимитирующим фактором для продолжения лечения [9, 13]. Также важно учитывать, что химиотерапия проводится у больных в условиях уже активированных злокачественной опухолью процессов перекисного окисления липидов (ПОЛ) [8, 11, 15].
Относительно взаимодействия противоопухолевых препаратов и веществ с антиоксидантной активностью в литературе имеются многочисленные, но довольно противоречивые сведения. Большинство авторов указывают на способность антиоксидантов улучшать переносимость химиотерапии и отдаленные результаты лечения [7, 12, 14, 16], сторонники иной точки зрения считают, что антиоксиданты ингибируют противоопухолевый эффект химиопрепаратов [10]. Однако все эти исследования касаются применения нутрицевтиков с мягким антиоксидантным действием (β-каротин; витамины А, С, Е; селен; мелатонин, цистеин; витамины группы В; витамин D3; витамин K3; глютатион, коэнзим Q10).
Целью исследования явилось изучение воздействия отечественного синтетического производного 3-оксипиридина с мощным антиоксидантным действием – эмоксипина – на эффективность и токсичность некоторых противоопухолевых препаратов в условиях роста холангиоцеллюлярного рака РС-1.
Материал и методы
На 228 белых нелинейных крысах мужского пола с перевиваемой опухолью – холангиоцел-люлярным раком крыс РС-1 (НИИ экспериментальной диагностики и терапии опухолей РОНЦ им. Н.Н. Блохина РАМН) проведено изучение возможности применения синтетических препаратов антиоксидантного действия на фоне противоопухолевой химиотерапии. Для проведения эксперимента использованы следующие фармакологические препараты: эмоксипин (ФГУП «Московский эндокринный завод») в ампулах по 1 мл 1 % раствора, α-токоферола ацетат – 10 % масляный раствор в ампулах (АО «АЙ СИ ЭН ОКТЯБРЬ», г. Санкт-Петербург). В качестве препарата сравнения при исследовании корригирующего влияния антиоксидантов на процессы ПОЛ в организме опухоленосителя нами применялся α-токоферола ацетат, так как он обладает доказанным наибольшим антиоксидантным действием из всех веществ природного происхождения [1].
Для моделирования курса противоопухолевой химиотерапии использованы препараты, наиболее широко применяемые в клинической практике, с разным механизмом противоопухолевого действия: циклофосфан – противоопухолевый препарат из группы алкилирующих цитостатиков (ОАО «Биохимик», г. Саранск) во флаконах по 200 мг сухого вещества (растворялся в стерильном 0,9 % растворе натрия хлорида), в дозе 20 мг/кг, внутримышечно (в/м), через день № 5; 5-фторурацил – цитостатик из группы антиметаболитов нуклеинового обмена, по 10 мг/кг внутримышечно через день № 5; рубо-мицин – противоопухолевый антрациклиновый антибиотик (ЗАО «Брынцалов-А», г. Москва) во флаконах по 20 мг сухого вещества (растворялся в стерильном 0,9 % растворе натрия хлорида) в дозе 4 мг/кг, внутрибрюшинно через день № 4.
Эмоксипин вводился внутримышечно в дозах 3,4, 6,8, 17, 25 мг/кг – условно соответствующих 1 % от LD50, 2, 5 и 8 % от LD50; α-токоферола ацетат применялся в/м в дозах 9,5, 19, 47,5 мг/кг, изомолярно соответствующих изучаемым дозам эмоксипина (3,4; 6,8 и 17 мг/кг). У трех групп моделировалась противоопухолевая химиотерапия циклофосфаном, 5-фторурацилом и рубо-мицином, а также изучались комбинации этих цитостатиков с α-токоферола ацетатом в дозе 47,5 мг/кг и эмоксипином 17 и 25 мг/кг. Корригирующие препараты вводились с 21 по 35-е сут роста опухоли ежедневно; интактную группу составили 12 животных, животным контрольной группы вводился физиологический раствор в/м. Животных всех опытных серий забивали путем декапитации под эфирным наркозом на 35-е сут после перевивки опухолевого штамма.
В плазме крови, эритроцитах, гомогенатах печени, почек, ткани сердца и кишечника, а также ткани опухоли определяли содержание вторичного продукта перекисного окисления липидов – малонового диальдегида (МДА) и железом индуцированного МДА (Fe-МДА) (Конюхова С.Г., 1989), рассчитывали антиокислительную активность (АОА) (Клебанов Г.И., 1999), определяли активность ферментов антиокислительной защиты – каталазы (Королюк М.А., 1988) и супероксиддисму-тазы (СОД) по методу С. Чевари (1981) [3–6]. Для оценки изменений в метаболическом звене гомеостаза определяли уровень креатинина, мочевины, активность АлТ и АсТ, содержание глюкозы, молекул средней массы (МСМ), общую (ОКА) и эффективную (ЭКА) концентрации альбумина. По полученным значениям ЭКА, ОКА и МСМ рассчитывали: резерв связанного альбумина (РСА), индекс токсичности (ИТ) и критерии интоксикации (КИ) [2]. Производили общий анализ крови, рассчитывали индекс лейкоцитарной интоксикации (ИЛИ). Оценивали массу животных-опухоленосителей, массу и индекс массы опухоли (ИМО), рассчитанный как отношение массы опухоли к массе животного. Противоопухолевый эффект оценивали по индексу торможения роста опухоли (ИТРО): ИТРО = 100 – (средняя mконтр/mопыт×100), где средняя mконтр – средняя масса опухоли в контрольной группе, mопыт – масса опухоли в опытной группе.
Статистическую обработку проводили с использованием критерия Стьюдента (t). Изменения считали статистически значимыми при р<0,05.
Результаты и обсуждение
Рост холангиоцеллюлярного рака РС-1 в организме животных сопровождался резким усилением процессов ПОЛ на фоне выраженного истощения антиоксидантной защиты организма-опухоленосителя по сравнению с интактными животными. Это проявлялось повышением содержания вторичных продуктов ПОЛ – МДА и Fe-МДА в плазме крови, тканях печени и почек, угнетением активности каталазы и СОД в плазме крови и ткани печени. На фоне роста опухоли отмечено снижение ЭКА на 75 % (р<0,001), снижение РСА – на 64 % (р<0,001) и увеличение индекса токсичности в 5 раз (р<0,001). Увеличение СОЭ произошло в 4,6 раза (р<0,001) по сравнению с уровнем интактных животных. В плазме крови происходило значительное увеличение содержания молекул средней массы, мочевины и креатинина, развивались гипогликемия, анемия и лейкопения.
Полученные результаты полностью согласуются с литературными данными, по которым на фоне роста опухоли в организме происходит смещение прооксидантно-оксидантного равновесия, развивается дефицит антиоксидантных ферментов первой линии защиты – СОД, глутатионпероксидазы и каталазы [11, 15]. Подобное состояние объясняют развивающимся гипогликемическим давлением опухоли на метаболизм нормальных тканей, что, в свою очередь, приводит к мобилизации тканями в качестве энергетических ресурсов жирных кислот. Данное обстоятельство плюс развивающаяся на фоне роста опухоли тканевая гипоксия приводят к выраженному усилению процессов ПОЛ в организме.
При противоопухолевом лечении дефицит антиоксидантных ферментов усугубляется, в ряде случаев отмечается истощение механизмов антиоксидантной защиты, что приводит к снижению резистентности организма и к повреждению жизненно важных органов и систем. В нашем эксперименте применение химиопрепаратов вызывало торможение роста опухоли, так, при введении циклофосфана ИТРО составил 40,2 %, при использовании рубомицина ИТРО – 33,5 ± 7,05 %. В условиях применения 5-фторурацила ИМО уменьшился на 45 % (р<0,05). В связи с уменьшением опухолевой массы под влиянием цитостатиков в организме опухоленосителей несколько ограничивались показатели эндотоксикоза – наблюдалось снижение содержания МДА во внутренних органах, повышение РСА, снижался уровень гипогликемии, однако происходило усиление лейкопении, сохранялось угнетение АОА в крови и внутренних органах. Отрицательные эффекты специфического противоопухолевого лечения диктуют необходимость поиска и разработки новых подходов для получения оптимального лечебного эффекта при уменьшении токсических эффектов цитостатической терапии.
При комбинированном применении противоопухолевых химиопрепаратов и α-токоферола ацетата не происходило изменений весовых показателей опухоли по сравнению с таковыми у животных, получавших только цитостатик, и сохранялись изменения процессов ПОЛ, вызванные введением противоопухолевых препаратов. Кроме того, в крови животных и в тканях внутренних органов происходило усиление активности каталазы, повышение АОА по сравнению с уровнем этих показателей у животных, получавших монотерапию цитостатиками. В ткани опухоли применение циклофосфана с α-токоферола ацетатом проявилось ростом уровня МДА на 36 % (р<0,05) по сравнению с этим показателем у животных, получавших монотерапию циклофосфаном. Кроме того, происходило снижение содержания в плазме крови МСМ, увеличение количества лейкоцитов и содержания гемоглобина по сравнению с показателями у животных, получавших монотерапию цитостатиками. Таким образом, комбинация α-токоферола ацетата в максимальной из изученных доз – 47,5 мг/кг, не уменьшая противоопухолевую эффективность цитостатиков, несколько ограничивала показатели эндотоксикоза в организме исследуемых животных.
При комбинированном использовании противоопухолевых препаратов и эмоксипина отмечено усиление противоопухолевого эффекта цитостатиков. Это наблюдалось при введении эмоксипина в дозах 17 и 25 мг/кг (табл. 1). Так, у животных, получавших комбинацию циклофос-фана и эмоксипина в дозе 17 мг/кг, масса опухоли уменьшилась на 44 % (р<0,01) по сравнению с животными, получавшими только циклофосфан.
Индекс массы опухоли в этой группе был на 73 % (р<0,001) ниже контрольного уровня, а индекс торможения роста опухоли составил 66,3 %. Введение эмоксипина в дозе 17 мг/кг на фоне применения рубомицина способствовало снижению массы опухоли на 39 % и на 55 % – при использовании эмоксипина в дозе 34 мг/кг, при этом индекс массы опухоли уменьшился на 50 % и 63 % соответственно в сравнении с группой животных, получавшей рубомицин.
Применение эмоксипина на фоне моделирования химиотерапии холангиоцеллюлярного рака оказывало выраженное дезинтоксикаци-онное действие на организм опухоленосителей: наблюдалось увеличение ОКА и ЭКА, снижение концентрации МСМ в плазме крови, уменьшение критериев интоксикации, нормализация активности АлТ и АсТ, снижение содержания креатинина, а также увеличение содержания лейкоцитов и концентрации гемоглобина по отношению к уровню показателей у животных, получавших цитостатик в режиме монотерапии (рис. 1). Комбинация циклофосфана с эмоксипи-ном в дозах – 3,4 и 6,8 мг/кг вызывала умеренное ограничение процессов ПОЛ в организме опу-холеносителя, с увеличением дозы эмоксипина до 17 мг/кг выраженность эффектов нарастала, и при использовании максимальной из изученных доз (25 мг/кг), наблюдался наибольший корригирующий эффект.
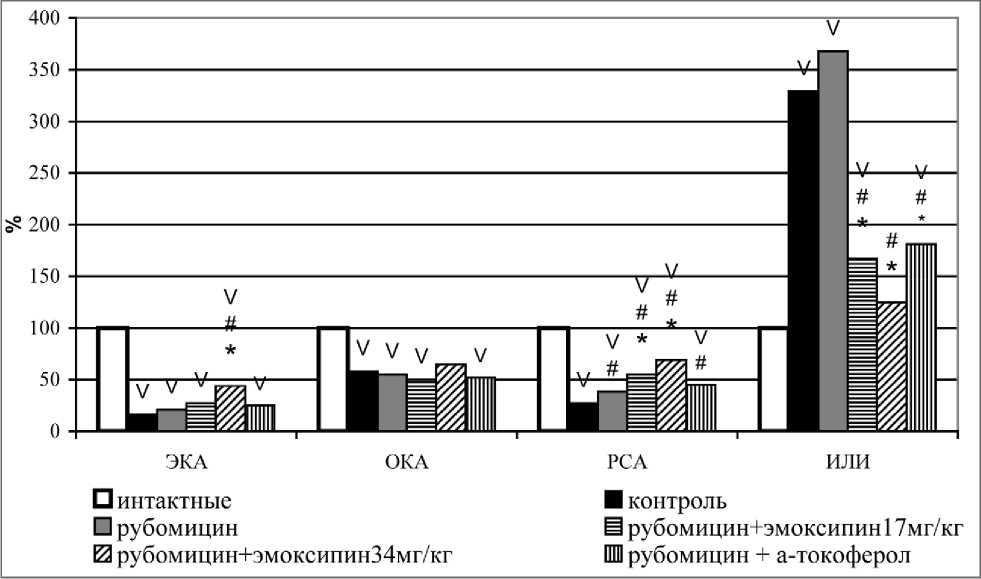
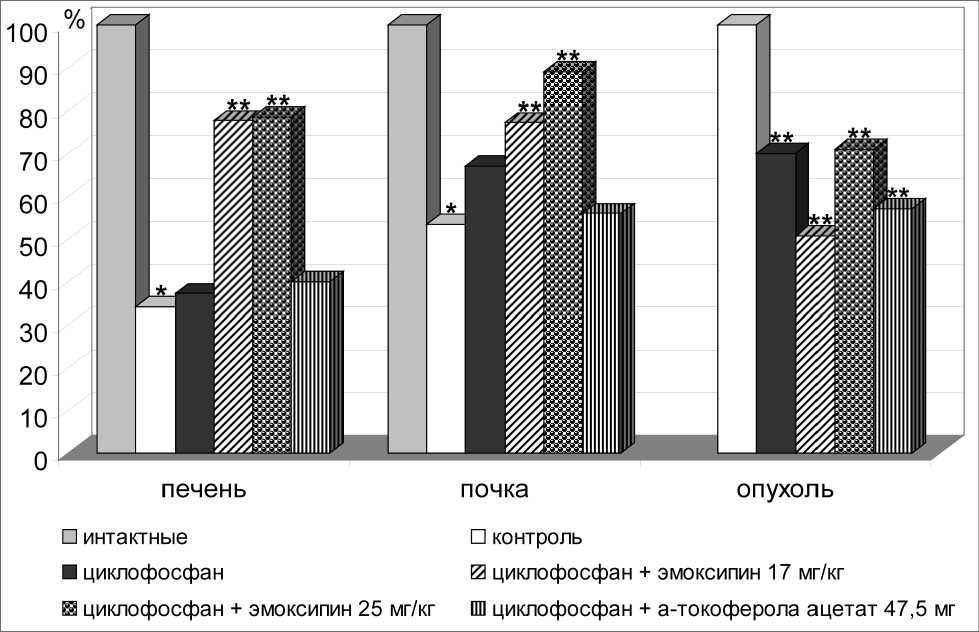
Рис. 1. Влияние комбинированного применения рубомицина с эмоксипином и α-токоферолом на некоторые показатели эндогенной интоксикации (в % к данным интактной группы животных, v – достоверность различия р<0,05 с данными интактной группы, # – достоверность различия р<0,05 с данными контрольной группы, * – достоверность различия р<0,05 с данными группы, получавшей рубомицин)
Рис. 2. Влияние эмоксипина и α-токоферола ацетата на антиокислитель-ную активность (в %) в органах экспериментальных животных и ткани холан-гиоцеллюлярного рака РС-1 в условиях моделирования химиотерапии циклофос-фаном в дозе 20 мг/кг. * – достоверность отличия с данными интактной группы, р<0,05; ** – достоверность отличия с данными контрольной группы, р<0,05
Таблица 1
Влияние α-токоферола ацетата и эмоксипина в комбинации с циклофосфаном на весовые характеристики холангиоцеллюлярного рака РС-1 (М±m)
|
Группы животных |
Масса крысы с опухолью, г |
Масса крысы без опухоли, г |
Масса опухоли, г |
Индекс массы опухоли |
ИТРО |
|
Контроль |
140,0 ± 16,41 |
105,3 ± 12,67 |
37,54 ± 7,05 |
30,85 ± 1,54 % |
- |
|
Циклофосфан 20 мг/кг |
188,3 ± 21,04 р>0,05 |
155,6 ± 12,35 р<0,05 |
22,47 ± 2,61 р>0,05 |
9,42 ± 1,25 % р<0,001 |
40,24 ± 4,73 % |
|
Циклофосфан + эмоксипин 17 мг/кг |
129,2 ± 14,44 р>0,05; р’<0,05 |
114,8 ± 6,79 р>0,05; р’<0,05 |
12,56 ± 1,78 р<0,01; р’<0,01 |
8,47 ± 2,11 % р<0,001; р’>0,05 |
66,31 ± 3,36 % р’<0,001 |
|
Циклофосфан + эмоксипин 25 мг/кг |
138 ± 6,63 р>0,05; р’<0,05 |
125,3 ± 9,72 р>0,05; р’>0,05 |
14,54 ± 1,22 р<0,01; р’>0,05 |
10,27 ± 1,73 % р<0,001; р’>0,05 |
61,13 ± 2,51 % р’<0,01 |
|
Циклофосфан + α-токоферола ацетат 47,5 мг/кг |
172 ± 11,94 р>0,05; р’>0,05 |
152,1 ± 9,41 р<0,05; р’>0,05 |
17,9 ± 2,59 р<0,05; р’>0,05 |
10,5 ± 1,18 % р<0,001; р’>0,05 |
52,46 ± 4,04 % р’>0,05 |
Примечание: р – уровень значимости различий с данными контрольной группы; р’– уровень значимости различий с данными группы «Циклофосфан».
Таблица 2
Влияние применения эмоксипина и α-токоферола ацетата на показатели перекисного окисления липидов в ткани холангиоцеллюлярного рака РС-1 при моделировании химиотерапии циклофосфаном в дозе 20 мг/кг (М±m)
|
Группы животных |
Каталаза, мКат/ с х л |
Fe-MДA, ммоль/л |
MДA, ммоль/л |
AOA, ммоль/л |
СОД, усл. ед. |
|
Контроль |
0,65 ± 0,07 |
5,381 ± 0,269 |
0,963 ± 0,062 |
4,419 ± 0,267 |
53,759 ± 1,574 |
|
Циклофосфан 20 мг/кг |
0,29 ± 0,04 р<0,001 |
5,53 ± 0,276 р>0,05 |
1,898 ± 0,22 р<0,01 |
3,093 ± 0,301 р<0,01 |
38,814 ± 1,178 р<0,001 |
|
Циклофосфан + эмок-сипин 17 мг/кг |
0,36 ± 0,037 р<0,01; р*>0,05 |
4,46 ± 0,194 р<0,05; р*<0,05 |
2,221 ± 0,209 р<0,001; р*>0,05 |
2,239 ± 0,386 р<0,001; р*>0,05 |
18,019 ± 2,333 р<0,001; р*<0,001 |
|
Циклофосфан + эмок-сипин 25 мг/кг |
0,357 ± 0,075 р<0,05; р*>0,05 |
6,789 ± 0,184 р<0,001; р*<0,001 |
3,646 ± 0,109 р<0,001; р*<0,001 |
3,143 ± 0,247 р<0,01; р*>0,05 |
21,793 ± 2,893 р<0,001; р*<0,001 |
|
Циклофосфан + α-токоферол 47,5 мг/кг |
0,407 ± 0,04 р<0,05; р*>0,05 |
5,108 ± 0,215 р>0,05; р*>0,05 |
2,577 ± 0,142 р<0,001; р*<0,05 |
2,531 ± 0,229 р<0,001; р*>0,05 |
32,825 ± 2,233 р<0,001; р*<0,05 |
Примечание: р – уровень значимости различий с данными контрольной группы; р* – уровень значимости различий с данными группы «циклофосфан».
Так, при использовании эмоксипина в дозе 25 мг/кг на фоне применения циклофосфана в плазме крови содержание МДА уменьшилось на 44 % (р<0,001), АОА увеличилась на 166 % (р<0,001), активность каталазы выросла на 45 % (р<0,001) (рис. 2). В ткани печени на 41 % (р<0,001) уменьшилась концентрация МДА, АОА увеличилась на 111 % (р<0,001). Активность СОД снизилась на 26 % (р<0,05), а активность каталазы выросла на 45 % (р<0,05) по сравнению с уровнем показателей у животных, получавших монотерапию циклофосфаном. Сходные изменения наблюдались и в других внутренних органах, при комбинированном применении 5-фторурацила и эмоксипина 17 мг/кг
МДА в почках снижался на 43 % (р<0,001) по сравнению с данными у животных, получавших только 5-фторурацил, а АОА возросла на 31 % (р<0,01).
В ткани опухоли комбинация противоопухолевых препаратов и эмоксипина, напротив, приводила к активации процессов ПОЛ. Дополнительное применение эмоксипина в дозе 25 мг/кг на фоне терапии 5-фторурацилом вызвало бóльшую активацию процессов ПОЛ в опухолевой ткани, чем 5-фторурацил в виде монотерапии, что проявилось повышением концентрации МДА в ткани опухоли на 35 % (р<0,01). При комбинированном применении эмоксипина в дозе 25 мг/кг и циклофосфана активность СОД в ткани опухоли уменьшилась на 44 % (р<0,001), а содержание МДА выросло на 92 % (р<0,001) (табл. 2). Аналогичный эффект наблюдался при применении рубомицина с эмоксипином. Так, комбинированное применение рубомицина и эмоксипина в дозе 17 мг/кг в опухолевой ткани вызывало угнетение активности каталазы и СОД на 56 % (р<0,005) и 76 % (р<0,05) соответственно (р<0,05). Повышение дозы эмоксипина до 25 мг/кг приводило к еще большему угнетению активности ферментов антиоксидантной защиты, при этом содержание МДА увеличилось на 79 % (р<0,05), а АОА снизилась на 33 % (р<0,01) в сравнении с группой, получавшей только рубомицин.
Таким образом, применение эмоксипина (17 мг/кг, 25 мг/кг) на фоне моделирования химиотерапии холангиоцеллюлярного рака РС-1, во-первых, повысило противоопухолевую эффективность циклофосфана, 5-фторурацила и рубомицина. Во-вторых, эмоксипин в большей степени, чем токоферола ацетат в изомолярных дозах, снижал выраженность нежелательных побочных эффектов противоопухолевых препаратов в условиях роста РС-1, что проявлялось корригирующим воздействием на процессы ПОЛ в тканях печени и почек опухоленосите-лей, ограничением лейкопении. Следует особо отметить, что на фоне применения эмоксипина в ткани опухоли развивалась противоположная картина – усиление окислительных процессов, на фоне снижения активности антиокислитель-ных ферментов. Раскрытие механизма этого феномена требует дальнейших исследований.


